7.4: Mashtaka rasmi na Resonance
- Page ID
- 176646
- Compute mashtaka rasmi kwa atomi katika muundo wowote Lewis
- Matumizi mashtaka rasmi kutambua busara zaidi Lewis muundo kwa molekuli kutokana
- Eleza dhana ya resonance na kuteka miundo Lewis anayewakilisha aina resonance kwa molekuli fulani
Hapo awali, tulijadili jinsi ya kuandika miundo ya Lewis kwa molekuli na ions polyatomic. Katika baadhi ya matukio, hata hivyo, kuna inaonekana zaidi ya muundo mmoja halali kwa molekuli. Tunaweza kutumia dhana ya mashtaka rasmi kutusaidia kutabiri sahihi zaidi muundo Lewis wakati zaidi ya moja ni busara.
Kuhesabu Malipo rasmi
Malipo rasmi ya atomu katika molekuli ni malipo ya nadharia ambayo atomu ingekuwa nayo kama tungeweza kugawa tena elektroni katika vifungo sawasawa kati ya atomi. Njia nyingine ya kusema hii ni kwamba matokeo rasmi ya malipo wakati sisi kuchukua idadi ya elektroni valence ya atomi neutral, Ondoa elektroni nonbonding, na kisha Ondoa idadi ya vifungo kushikamana na kwamba atomi katika muundo Lewis.
Hivyo, tunahesabu malipo rasmi kama ifuatavyo:
\[\textrm{formal charge = # valence shell electrons (free atom) − # lone pair electrons − }\dfrac{1}{2}\textrm{ # bonding electrons} \nonumber \]
Tunaweza kuangalia mara mbili mahesabu rasmi ya malipo kwa kuamua jumla ya mashtaka rasmi kwa muundo mzima. Jumla ya mashtaka rasmi ya atomi zote katika molekuli lazima iwe sifuri; jumla ya mashtaka rasmi katika ioni yanapaswa kuwa sawa na malipo ya ioni.
Lazima tukumbuke kwamba malipo rasmi yaliyohesabiwa kwa atomu sio malipo halisi ya atomu katika molekuli. Malipo rasmi ni utaratibu muhimu tu wa kuweka vitabu; haionyeshi kuwepo kwa mashtaka halisi.
Weka mashtaka rasmi kwa kila atomi katika ioni ya interhalogen\(\ce{ICl4-}\).
Suluhisho la S
Tunagawanya jozi za elektroni za kuunganisha sawa kwa\(\ce{I–Cl}\) vifungo vyote:
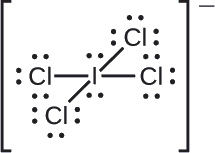
Tunawapa jozi moja za elektroni kwenye atomi zao. Kila atomu ya Cl sasa ina elektroni saba zinazopewa, na atomi ya I ina nane.
Ondoa nambari hii kutoka kwa idadi ya elektroni za valence kwa atomi ya neutral:
- I: 7 — 8 = -1
- Cl: 7 — 7 = 0
Jumla ya mashtaka rasmi ya atomi zote ni sawa na -1, ambayo ni sawa na chaji ya ioni (—1).
Tumia malipo rasmi kwa kila atomi katika molekuli ya monoxide ya kaboni:

- Jibu
-
C -1, O +1
Weka mashtaka rasmi kwa kila atomi katika molekuli ya interhalogen\(\ce{BrCl3}\).
Suluhisho
Weka moja ya elektroni katika kila dhamana Br—Cl kwa atomi ya Br na moja kwa atomi ya Cl katika dhamana hiyo:
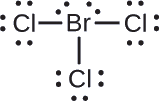
Hawawajui jozi lone kwa atomi zao. Sasa kila atomu ya Cl ina elektroni saba na atomu ya Br ina elektroni saba.
Ondoa nambari hii kutoka kwa idadi ya elektroni za valence kwa atomi ya neutral. Hii inatoa malipo rasmi:
- Br: 7 — 7 = 0
- Cl: 7 — 7 = 0
Atomi zote katika\(\ce{BrCl3}\) kuwa na malipo rasmi ya sifuri, na jumla ya mashtaka rasmi jumla sifuri, kama ni lazima katika molekuli neutral.
Kuamua malipo rasmi kwa kila atomi katika\(\ce{NCl3}\).
- Jibu
-
N: 0; atomi zote tatu za Cl: 0
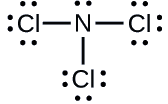
Kutumia Charge Rasmi Kutabiri Masi Muundo
Mpangilio wa atomi katika molekuli au ioni huitwa muundo wake wa masi. Mara nyingi, kufuata hatua kwa ajili ya kuandika miundo Lewis inaweza kusababisha zaidi ya moja inawezekana Masi muundo-tofauti nyingi dhamana na lone-jozi elektroni uwekaji au mipango tofauti ya atomi, kwa mfano. Miongozo michache inayohusisha malipo rasmi inaweza kuwa na manufaa katika kuamua ni ipi ya miundo iwezekanavyo ni uwezekano mkubwa kwa molekuli fulani au ion.
- Muundo wa Masi ambayo mashtaka yote rasmi ni sifuri ni vyema kwa moja ambayo baadhi ya mashtaka rasmi si sifuri.
- Ikiwa muundo wa Lewis lazima uwe na mashtaka yasiyo ya sifuri rasmi, utaratibu na mashtaka madogo yasiyo ya zero rasmi ni bora.
- Miundo ya Lewis ni vyema wakati mashtaka ya karibu rasmi ni sifuri au ya ishara tofauti.
- Wakati tunapaswa kuchagua miongoni mwa miundo kadhaa Lewis na mgawanyo sawa wa mashtaka rasmi, muundo na mashtaka hasi rasmi juu ya atomi zaidi electronegative ni vyema.
Kuona jinsi miongozo hii inatumika, hebu fikiria baadhi ya miundo iwezekanavyo kwa dioksidi kaboni,\(\ce{CO2}\). Tunajua kutokana na majadiliano yetu ya awali kwamba atomu ndogo ya electronegative kawaida inachukua nafasi kuu, lakini mashtaka rasmi yanatuwezesha kuelewa kwa nini hii inatokea. Tunaweza kuteka uwezekano wa tatu kwa muundo: kaboni katikati na vifungo viwili, kaboni katikati na dhamana moja na tatu, na oksijeni katikati na vifungo viwili:
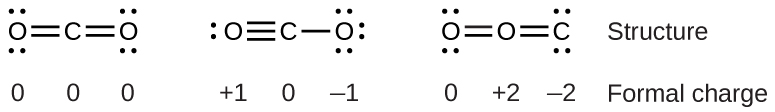
Kulinganisha mashtaka matatu rasmi, tunaweza dhahiri kutambua muundo upande wa kushoto kama vyema kwa sababu ina tu mashtaka rasmi ya sifuri (Mwongozo 1).
Kama mfano mwingine, ioni ya thiocyanate, ioni inayotokana na atomi ya kaboni, atomi ya nitrojeni, na atomi ya sulfuri, inaweza kuwa na miundo mitatu tofauti ya Masi:\(\ce{CNS^{–}}\)\(\ce{NCS^{–}}\),, au\(\ce{CSN^{–}}\). Mashtaka rasmi yaliyopo katika kila moja ya miundo hii ya Masi yanaweza kutusaidia kuchukua utaratibu wa uwezekano mkubwa wa atomi. Miundo inayowezekana ya Lewis na mashtaka rasmi kwa kila moja ya miundo mitatu inayowezekana kwa ioni ya thiocyanate huonyeshwa hapa:
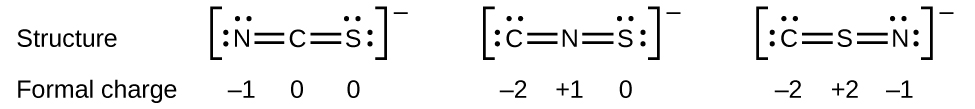
Kumbuka kwamba jumla ya mashtaka rasmi katika kila kesi ni sawa na malipo ya ion (-1). Hata hivyo, mpangilio wa kwanza wa atomi hupendelewa kwa sababu ina idadi ya chini kabisa ya atomi yenye mashtaka rasmi yasiyo ya sifuri (Mwongozo 2). Pia, inaweka angalau electronegative atomi katikati, na malipo hasi juu ya kipengele zaidi electronegative (Mwongozo 4).
Oxydi ya nitrous, N 2 O, inayojulikana kama gesi ya kucheka, hutumiwa kama anesthetic katika upasuaji mdogo, kama vile uchimbaji wa kawaida wa meno ya hekima. Je, ni muundo gani wa uwezekano wa oksidi ya nitrous?

Solution Kuamua malipo rasmi mavuno yafuatayo:
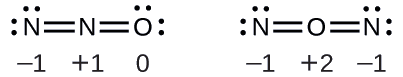
Muundo na atomi ya oksijeni ya mwisho hutimiza vigezo vya usambazaji imara zaidi wa malipo rasmi:
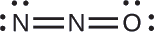
Idadi ya atomi na mashtaka rasmi ni kupunguzwa (Mwongozo 2), na hakuna malipo rasmi kubwa kuliko moja (Mwongozo 2). Hii ni tena sambamba na upendeleo wa kuwa na atomi chini ya electronegative katika nafasi ya kati.
Ambayo ni muundo mkubwa wa Masi kwa ioni ya nitriti (\(\ce{NO2-}\))?
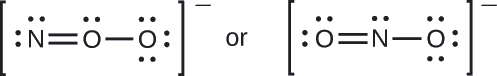
- Jibu
-
\(\ce{ONO^{–}}\)
Resonance
Huenda umeona kwamba anioni ya nitriti katika Mfano\(\PageIndex{3}\) inaweza kuwa na miundo miwili iwezekanavyo na atomi katika nafasi sawa. Elektroni zinazohusika katika dhamana ya N—O mara mbili, hata hivyo, ziko katika nafasi tofauti:
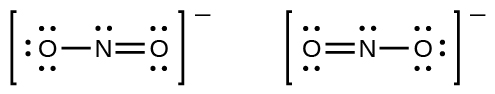
Kama nitriti ions kufanya kweli vyenye moja na mara mbili dhamana, tunataka kutarajia kwa mbili urefu dhamana kuwa tofauti. Dhamana mara mbili kati ya atomi mbili ni mfupi (na nguvu) kuliko dhamana moja kati ya atomi hizo mbili. Majaribio yanaonyesha, hata hivyo, kwamba vifungo vya N - O\(\ce{NO2-}\) vina nguvu sawa na urefu, na vinafanana katika mali nyingine zote.
Haiwezekani kuandika muundo mmoja wa Lewis ambao nitrojeni ina octet na vifungo vyote ni sawa.\(\ce{NO2-}\) Badala yake, tunatumia dhana ya resonance: ikiwa miundo miwili au zaidi ya Lewis yenye mpangilio huo wa atomi inaweza kuandikwa kwa molekuli au ion, usambazaji halisi wa elektroni ni wastani wa ule unaoonyeshwa na miundo mbalimbali ya Lewis. Usambazaji halisi wa elektroni katika kila moja ya vifungo vya nitrojeni na oksijeni ndani\(\ce{NO2-}\) ni wastani wa dhamana mbili na dhamana moja. Sisi wito mtu binafsi Lewis miundo resonance aina. Mfumo halisi wa umeme wa molekuli (wastani wa fomu za resonance) huitwa mseto wa resonance wa aina za resonance za mtu binafsi. Mshale unaoongozwa mara mbili kati ya miundo ya Lewis unaonyesha kuwa ni aina za resonance. Hivyo, muundo wa elektroniki wa\(\ce{NO2-}\) ion unaonyeshwa kama:
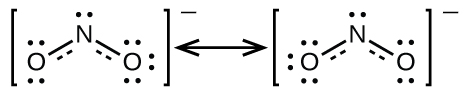
Tunapaswa kukumbuka kwamba molekuli iliyoelezwa kama mseto wa resonance haijawahi kuwa na muundo wa elektroniki ulioelezwa na fomu ama ya resonance. Haibadilishana kati ya fomu za resonance; badala yake, muundo halisi wa elektroniki daima ni wastani wa ile iliyoonyeshwa na aina zote za resonance. George Wheland, mmoja wa waanzilishi wa nadharia ya resonance, alitumia mfano wa kihistoria kuelezea uhusiano kati ya fomu za resonance na mahuluti ya resonance. Msafiri wa medieval, baada ya kamwe kuona vifaru, aliielezea kama mseto wa joka na nyati kwa sababu ilikuwa na mali nyingi sawa na wote wawili. Kama vile vifaru sio joka wakati mwingine wala nyati wakati mwingine, mseto wa resonance sio aina zake za resonance wakati wowote. Kama vifaru, ni chombo halisi ambacho ushahidi wa majaribio umeonyesha kuwepo. Ina sifa fulani zinazofanana na fomu zake za resonance, lakini fomu za resonance wenyewe ni rahisi, picha za kufikiri (kama nyati na joka).
Anion carbonate\(\ce{CO3^2-}\), hutoa mfano wa pili wa resonance:
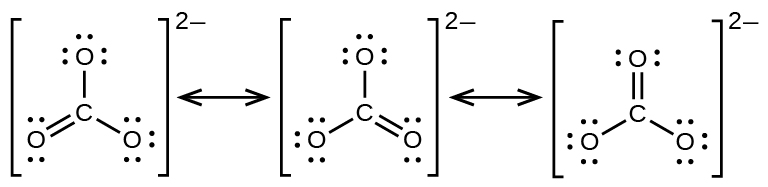
Atomu moja ya oksijeni lazima iwe na dhamana mbili kwa kaboni ili kukamilisha octet kwenye atomu ya kati. Atomi zote oksijeni, hata hivyo, ni sawa, na dhamana mara mbili inaweza kuunda kutoka yoyote moja ya atomi tatu. Hii inatoa aina tatu za resonance za ion carbonate. Kwa sababu tunaweza kuandika miundo mitatu ya resonance inayofanana, tunajua kwamba mpangilio halisi wa elektroni katika ion ya carbonate ni wastani wa miundo mitatu. Tena, majaribio yanaonyesha kwamba vifungo vyote vya C - O ni sawa.
Muhtasari
Katika muundo wa Lewis, mashtaka rasmi yanaweza kupewa kila atomu kwa kutibu kila dhamana kana kwamba nusu moja ya elektroni hupewa kila atomu. Hizi nadharia mashtaka rasmi ni mwongozo wa kuamua sahihi zaidi Lewis muundo. Mfumo ambao mashtaka rasmi ni karibu na sifuri iwezekanavyo hupendekezwa. Resonance hutokea katika hali ambapo miundo miwili au zaidi ya Lewis yenye mipangilio inayofanana ya atomi lakini mgawanyo tofauti wa elektroni unaweza kuandikwa. Usambazaji halisi wa elektroni (mseto wa resonance) ni wastani wa usambazaji unaoonyeshwa na miundo ya mtu binafsi ya Lewis (fomu za resonance).
Mlinganyo muhimu
- \(\textrm{formal charge = # valence shell electrons (free atom) − # one pair electrons − }\dfrac{1}{2}\textrm{ # bonding electrons}\)
faharasa
- malipo rasmi
- malipo ambayo ingeweza kusababisha atomi kwa kuchukua idadi ya elektroni valence juu ya atomi neutral na kutoa elektroni nonbonding na idadi ya vifungo (nusu moja ya elektroni bonding)
- muundo wa molekuli
- utaratibu wa atomi katika molekuli au ion
- udukiziwimbi
- hali ambayo muundo mmoja wa Lewis haitoshi kuelezea kuunganisha katika molekuli na wastani wa miundo mingi huzingatiwa
- aina za resonance
- miundo miwili au zaidi ya Lewis ambayo ina mpangilio sawa wa atomi lakini mipango tofauti ya elektroni
- mseto resonance
- wastani wa aina resonance inavyoonekana na miundo ya mtu binafsi Lewis


