4.4: Mazao ya Majibu
- Page ID
- 176930
- Eleza dhana za mavuno ya kinadharia na kupunguza vitendanisho/vitendanishi.
- Kupata mavuno ya kinadharia kwa mmenyuko chini ya hali maalum.
- Tumia mavuno ya asilimia kwa mmenyuko.
Kiasi cha jamaa cha reactants na bidhaa zinazowakilishwa katika usawa wa kemikali ya usawa mara nyingi hujulikana kama kiasi cha stoichiometric. Mazoezi yote ya moduli iliyotangulia yalihusisha kiasi cha stoichiometric cha reactants. Kwa mfano, wakati wa kuhesabu kiasi cha bidhaa zinazozalishwa kutoka kiasi fulani cha reactant, ilikuwa kudhani kuwa reactants nyingine yoyote required walikuwa inapatikana kwa kiasi stoichiometric (au zaidi). Katika moduli hii, hali ya kweli zaidi inachukuliwa, ambayo majibu haipo katika kiasi cha stoichiometric.
Kupunguza Reactant
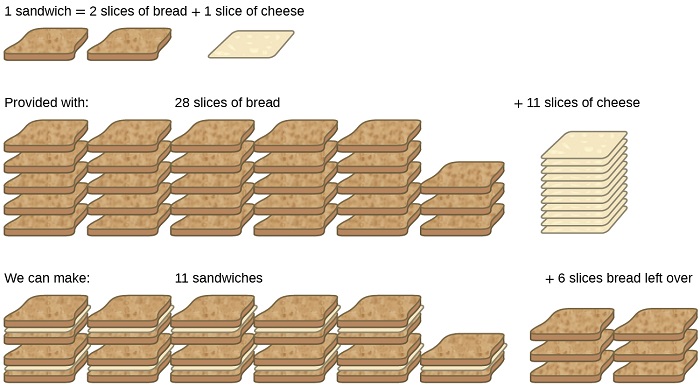
Fikiria mlinganisho mwingine wa chakula, ukifanya sandwiches ya jibini iliyohifadhiwa (Kielelezo\(\PageIndex{1}\)):
\[\text{1 slice of cheese} + \text{2 slices of bread} \rightarrow \text{1 sandwich} \label{4.5.A} \]
Kiasi cha stoichiometric cha viungo vya sandwich kwa mapishi hii ni vipande vya mkate na jibini katika uwiano wa 2:1. Kutokana na vipande 28 vya mkate na vipande 11 vya jibini, mtu anaweza kuandaa sandwiches 11 kwa mapishi yaliyotolewa, kwa kutumia jibini yote iliyotolewa na kuwa na vipande sita vya mkate vilivyoachwa. Katika hali hii, idadi ya sandwiches iliyoandaliwa imepunguzwa na idadi ya vipande vya jibini, na vipande vya mkate vimetolewa kwa ziada.
Fikiria dhana hii sasa kuhusiana na mchakato wa kemikali, mmenyuko wa hidrojeni na klorini ili kuzalisha kloridi hidrojeni:
\[\ce{H2}(g) + \ce{Cl2}(g)\rightarrow \ce{2HCl}(g) \nonumber \]
Equation uwiano inaonyesha hidrojeni na klorini kuguswa katika uwiano wa stoichiometric 1:1. Kama reactants hizi hutolewa kwa kiasi kingine chochote, moja ya reactants itakuwa karibu kila mara kabisa zinazotumiwa, hivyo kupunguza kiasi cha bidhaa ambayo inaweza kuzalishwa. Dutu hii ni reactant kikwazo, na dutu nyingine ni reactant ziada. Kutambua kikwazo na reactants ziada kwa hali fulani inahitaji kompyuta kiasi molar ya kila reactant zinazotolewa na kulinganisha yao kwa kiasi stoichiometric kuwakilishwa katika uwiano kemikali equation.
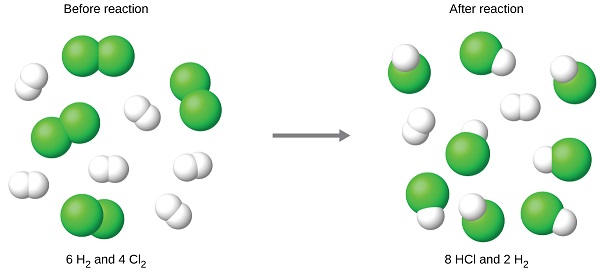
Kwa mfano, fikiria kuchanganya moles 6 ya H 2 na 4 moles ya Cl 2. Kutambua reactant kikwazo inahusisha kulinganisha kiasi cha bidhaa inatarajiwa kwa majibu kamili ya kila reactant. Kila kiasi kinachotumiwa kinatumiwa kuhesabu tofauti kiasi cha bidhaa ambacho kitaundwa kwa stoichiometry ya mmenyuko. Mtazamo wa kutoa kiasi kidogo cha bidhaa ni reactant kikwazo.
Kwa mfano katika aya iliyotangulia, majibu kamili ya hidrojeni bila mavuno
\[\mathrm{mol\: HCl\: produced=6\: mol\:H_2\times \dfrac{2\: mol\: HCl}{1\: mol\:H_2}=12\: mol\: HCl} \nonumber \]
Majibu kamili ya klorini zinazotolewa bila kuzalisha
\[\mathrm{mol\: HCl\: produced=4\: mol\:Cl_2\times \dfrac{2\: mol\: HCl}{1\: mol\:Cl_2}=8\: mol\: HCl} \nonumber \]
Klorini itatumiwa kabisa mara moja 8 moles ya HCl zimezalishwa. Kwa kuwa hidrojeni ya kutosha ilitolewa ili kuzalisha moles 12 za HCl, kutakuwa na hidrojeni isiyojitokeza iliyobaki mara mmenyuko huu ukamilifu. Kwa hiyo, klorini ni reactant kikwazo na hidrojeni ni reactant ziada (Kielelezo\(\PageIndex{2}\)). Kuamua kiasi cha reactant ya ziada iliyobaki, kiasi cha hidrojeni kinachotumiwa katika mmenyuko kinaweza kuondolewa kutoka kwa kiasi cha kuanzia cha hidrojeni.
Kiasi cha hidrojeni zinazotumiwa ni
\[\mathrm{mol\: H_2\: produced=8\: mol\:HCl\times \dfrac{1\: mol\: H_2}{2\: mol\:HCl}=4\: mol\: H_2} \nonumber \]
Ondoa hidrojeni inayotumiwa kutoka kwa kiasi cha kuanzia
\[\mathrm{mole\: of\: excess\:H_{2}=6\:mol\:H_{2}\:starting\:-\:4\:mol\:H_{2}\:consumed\:=\:2\:mol\:H_{2}\; excess} \nonumber \]
Nitridi ya silicon ni kauri ngumu sana, ya juu-joto-sugu kutumika kama sehemu ya vile turbine katika inji za ndege. Imeandaliwa kulingana na equation ifuatayo:
\[\ce{3Si}(s)+\ce{2N2}(g)\rightarrow \ce{Si3N4}(s) \nonumber \]
Ambayo ni reactant kikwazo wakati 2.00 g ya Si na 1.50 g ya N 2 kuguswa?
Suluhisho
Compute zinazotolewa kiasi molar ya reactants, na kisha kulinganisha kiasi hiki kwa equation uwiano kutambua reactant kikwazo.
\[\mathrm{mol\: Si=2.00\:\cancel{g\: Si}\times \dfrac{1\: mol\: Si}{28.09\:\cancel{g\: Si}}=0.0712\: mol\: Si} \nonumber \]
\[\mathrm{mol\:N_2=1.50\:\cancel{g\:N_2}\times \dfrac{1\: mol\:N_2}{28.02\:\cancel{g\:N_2}}=0.0535\: mol\:N_2} \nonumber \]
Uwiano wa Si:N 2 molar uliotolewa ni:
\[\mathrm{\dfrac{0.0712\: mol\: Si}{0.0535\: mol\:N_2}=\dfrac{1.33\: mol\: Si}{1\: mol\:N_2}} \nonumber \]
Uwiano wa stoichiometric Si:N 2 ni:
\[\mathrm{\dfrac{3\: mol\: Si}{2\: mol\:N_2}=\dfrac{1.5\: mol\: Si}{1\: mol\:N_2}} \nonumber \]
Kulinganisha uwiano huu unaonyesha kwamba Si hutolewa kwa kiasi chini-kuliko stoichiometric, na hivyo ni reactant kikwazo.
Vinginevyo, compute kiasi cha bidhaa inatarajiwa kwa majibu kamili ya kila moja ya reactants zinazotolewa. Moles 0.0712 ya silicon ingekuwa mavuno
\[\mathrm{mol\:Si_3N_4\:produced=0.0712\: mol\: Si\times \dfrac{1\:mol\:Si_3N_4}{3\: mol\: Si}=0.0237\: mol\:Si_3N_4} \nonumber \]
wakati moles 0.0535 ya nitrojeni bila kuzalisha
\[\mathrm{mol\:Si_3N_4\:produced=0.0535\: mol\:N_2\times \dfrac{1\: mol\:Si_3N_4}{2\: mol\:N_2}=0.0268\: mol\:Si_3N_4} \nonumber \]
Kwa kuwa silicon hutoa kiasi kidogo cha bidhaa, ni reactant kikwazo.
Ambayo ni reactant kikwazo wakati 5.00 g ya H 2 na 10.0 g ya O 2 kuguswa na kuunda maji?
- Jibu
-
O 2
Asilimia mavuno
Kiasi cha bidhaa ambacho kinaweza kuzalishwa na mmenyuko chini ya hali maalum, kama ilivyohesabiwa kwa stoichiometry ya usawa sahihi wa kemikali, inaitwa mavuno ya kinadharia ya mmenyuko. Katika mazoezi, kiasi cha bidhaa zilizopatikana huitwa mavuno halisi, na mara nyingi ni chini ya mavuno ya kinadharia kwa sababu kadhaa. Baadhi ya athari ni asili isiyo na ufanisi, ikifuatana na athari za upande zinazozalisha bidhaa nyingine. Wengine, kwa asili, hawajakamilika (fikiria athari za sehemu za asidi dhaifu na besi zilizojadiliwa mapema katika maandiko haya). Bidhaa zingine ni vigumu kukusanya bila kupoteza, na hivyo chini ya kupona kamili itapunguza mavuno halisi. Kiwango ambacho mavuno ya kinadharia ya mmenyuko yanapatikana kwa kawaida huelezwa kama mavuno yake ya asilimia:
\[\mathrm{percent\: yield=\dfrac{actual\: yield}{theoretical\: yield}\times 100\%} \nonumber \]
Mazao halisi na ya kinadharia yanaweza kuonyeshwa kama raia au kiasi cha molar (au mali nyingine yoyote inayofaa; kwa mfano, kiasi, kama bidhaa ni gesi). Mradi mavuno yote ni walionyesha kwa kutumia vitengo sawa, vitengo hivi kufuta wakati asilimia mavuno ni mahesabu.
Baada ya mmenyuko wa 1.274 g ya sulfate ya shaba na chuma cha ziada cha zinki, 0.392 g chuma cha shaba kilipatikana kulingana na equation:
\[\ce{CuSO4}(aq)+\ce{Zn}(s)\rightarrow \ce{Cu}(s)+\ce{ZnSO4}(aq) \nonumber \]
Mavuno ya asilimia ni nini?
Suluhisho
Taarifa iliyotolewa inatambua sulfate ya shaba kama reactant ya kikwazo, na hivyo mavuno ya kinadharia hupatikana kwa njia iliyoonyeshwa katika moduli ya awali, kama inavyoonekana hapa:
\[\mathrm{1.274\:\cancel{g\:Cu_SO_4}\times \dfrac{1\:\cancel{mol\:CuSO_4}}{159.62\:\cancel{g\:CuSO_4}}\times \dfrac{1\:\cancel{mol\: Cu}}{1\:\cancel{mol\:CuSO_4}}\times \dfrac{63.55\:g\: Cu}{1\:\cancel{mol\: Cu}}=0.5072\: g\: Cu} \nonumber \]
Kutumia mavuno haya ya kinadharia na thamani iliyotolewa kwa mavuno halisi, mavuno ya asilimia yanahesabiwa kuwa
\[\mathrm{percent\: yield=\left(\dfrac{actual\: yield}{theoretical\: yield}\right)\times 100} \nonumber \]
\ [kuanza {align*}
\ hesabu {asilimia\: mavuno} &=\ hesabu {\ kushoto (\ dfrac {0.392\: g\: Cu} {0.5072\: g\: g\: Cu}\ haki)\ mara 100}\\
&=77.3\
\ mwisho {align*}\ nonumber\]
Je, ni asilimia mavuno ya mmenyuko inayozalisha 12.5 g ya gesi Freon CF 2 Cl 2 kutoka 32.9 g ya cCl 4 na HF ya ziada?
\[\ce{CCl4 + 2HF \rightarrow CF2Cl2 + 2HCl} \nonumber \]
- Jibu
-
48.3%
Mpangilio wa makusudi wa bidhaa za kemikali na michakato ambayo hupunguza matumizi ya vitu vya hatari ya mazingira na kizazi cha taka hujulikana kama kemia ya kijani. Kemia ya kijani ni mbinu ya falsafa ambayo inatumika kwa maeneo mengi ya sayansi na teknolojia, na mazoezi yake yanafupishwa kwa miongozo inayojulikana kama “Kanuni Kumi na mbili za Kemia ya Kijani”. Moja ya kanuni 12 inalenga hasa kuongeza ufanisi wa michakato ya kuunganisha bidhaa za kemikali. Uchumi wa atomu wa mchakato ni kipimo cha ufanisi huu, hufafanuliwa kama asilimia kwa wingi wa bidhaa ya mwisho ya jamaa ya awali na raia wa majibu yote yaliyotumiwa:
\[\mathrm{atom\: economy=\dfrac{mass\: of\: product}{mass\: of\: reactants}\times 100\%} \nonumber \]
Ingawa ufafanuzi wa uchumi wa atomu kwa mtazamo wa kwanza unaonekana sawa na ule kwa mavuno ya asilimia, fahamu kwamba mali hii inawakilisha tofauti katika ufanisi wa kinadharia wa michakato mbalimbali ya kemikali. Mavuno ya asilimia ya mchakato wa kemikali iliyotolewa, kwa upande mwingine, hutathmini ufanisi wa mchakato kwa kulinganisha mavuno ya bidhaa kwa kweli yaliyopatikana kwa mavuno ya kiwango cha juu yaliyotabiriwa na stoichiometry.
Awali ya dawa za kawaida zisizo za kawaida za maumivu, ibuprofen, zinaonyesha vizuri mafanikio ya mbinu ya kemia ya kijani (Kielelezo\(\PageIndex{3}\)). Kwanza kuuzwa mwanzoni mwa miaka ya 1960, ibuprofen ilitengenezwa kwa kutumia awali ya hatua sita ambayo ilihitaji 514 g ya reactants kuzalisha kila mole (206 g) ya ibuprofen, uchumi wa atomu wa 40%. Katika miaka ya 1990, mchakato mbadala ulianzishwa na Kampuni ya BHC (sasa BASF Corporation) ambayo inahitaji hatua tatu tu na ina uchumi wa atomi wa ~ 80%, karibu mara mbili ya mchakato wa awali. Mchakato wa BHC huzalisha taka ndogo ya kemikali; hutumia vifaa visivyo na madhara na vya kurekebishwa; na hutoa akiba kubwa ya gharama kwa mtengenezaji (na, hatimaye, walaji). Kwa kutambua athari nzuri ya mazingira ya mchakato wa BHC, kampuni hiyo ilipokea tuzo ya Greener Synthetic pathways ya Shirika la Ulinzi wa Mazingira mwaka 1997.

Muhtasari
Wakati athari zinafanywa kwa kutumia kiasi chini-stoichiometric ya reactants, kiasi cha bidhaa zinazozalishwa kitatambuliwa na reactant kikwazo. Kiasi cha bidhaa zinazozalishwa na mmenyuko wa kemikali ni mavuno yake halisi. Mavuno haya mara nyingi ni chini ya kiasi cha bidhaa kilichotabiriwa na stoichiometry ya usawa wa kemikali unaowakilisha mmenyuko (mavuno yake ya kinadharia). Kiwango ambacho mmenyuko huzalisha kiasi cha kinadharia cha bidhaa kinaonyeshwa kama mavuno yake ya asilimia.
Mlinganyo muhimu
- \(\mathrm{percent\: yield=\left(\dfrac{actual\: yield}{theoretical\: yield}\right)\times 100}\)
faharasa
- mavuno halisi
- kiasi cha bidhaa kilichoundwa katika mmenyuko
- reactant kupita kiasi
- reactant sasa katika kiasi kikubwa zaidi kuliko inavyotakiwa na stoichiometry mmenyuko
- kikwazo reactant
- reactant sasa katika kiasi cha chini kuliko inavyotakiwa na stoichiometry mmenyuko, hivyo kupunguza kiasi cha bidhaa yanayotokana
- asilimia mavuno
- kipimo cha ufanisi wa mmenyuko, walionyesha kama asilimia ya mavuno ya kinadharia
- mavuno ya nadharia
- kiasi cha bidhaa ambayo inaweza kutolewa kutoka kiasi fulani cha reactant (s) kulingana na stoichiometry mmenyuko


