3.2: Kuamua Fomu za Masi na za Masi
- Page ID
- 175834
- Compute muundo wa asilimia ya kiwanja
- Kuamua formula ya maandishi ya kiwanja
- Kuamua formula ya Masi ya kiwanja
Katika sehemu iliyotangulia, tulijadili uhusiano kati ya wingi wa dutu na idadi ya atomi au molekuli iliyo nayo (moles). Kutokana na formula ya kemikali ya dutu hii, tuliweza kuamua kiasi cha dutu (moles) kutoka kwa wingi wake, na kinyume chake. Lakini vipi ikiwa formula ya kemikali ya dutu haijulikani? Katika sehemu hii, tutazingatia jinsi ya kutumia kanuni hizi sawa ili kupata fomu za kemikali za vitu visivyojulikana kutoka kwa vipimo vya majaribio ya majaribio.
Asilimia Muundo
Maumbo ya msingi ya kiwanja hufafanua utambulisho wake wa kemikali, na kanuni za kemikali ni njia inayofaa zaidi ya kuwakilisha babies hii ya msingi. Wakati formula ya kiwanja haijulikani, kupima wingi wa kila moja ya vipengele vyake vya kawaida ni mara nyingi hatua ya kwanza katika mchakato wa kuamua formula kwa majaribio. Matokeo ya vipimo hivi huruhusu hesabu ya muundo wa asilimia ya kiwanja, hufafanuliwa kama asilimia kwa wingi wa kila kipengele katika kiwanja. Kwa mfano, fikiria kiwanja cha gesi kilichojumuisha kaboni na hidrojeni tu. Utungaji wa asilimia ya kiwanja hiki unaweza kuwakilishwa kama ifuatavyo:
\[\mathrm{\%H=\dfrac{mass\: H}{mass\: compound}\times100\%} \nonumber \]
\[\mathrm{\%C=\dfrac{mass\: C}{mass\: compound}\times100\%} \nonumber \]
Ikiwa uchambuzi wa sampuli ya 10.0-g ya gesi hii ilionyesha kuwa na 2.5 g H na 7.5 g C, muundo wa asilimia utahesabiwa kuwa 25% H na 75% C:
\[\mathrm{\%H=\dfrac{2.5\:g\: H}{10.0\:g\: compound}\times100\%=25\%} \nonumber \]
\[\mathrm{\%C=\dfrac{7.5\:g\: C}{10.0\:g\: compound}\times100\%=75\%} \nonumber \]
Uchambuzi wa sampuli ya 12.04-g ya kiwanja kioevu kilichoundwa na kaboni, hidrojeni, na nitrojeni ilionyesha kuwa na 7.34 g C, 1.85 g H, na 2.85 g N. ni muundo wa asilimia gani ya kiwanja hiki?
Suluhisho
Ili kuhesabu utungaji wa asilimia, tunagawanya molekuli inayotokana na majaribio ya kila kipengele kwa wingi wa jumla wa kiwanja, na kisha kubadilisha kwa asilimia:
\[\mathrm{\%C=\dfrac{7.34\:g\: C}{12.04\:g\: compound}\times100\%=61.0\%} \nonumber \]
\[\mathrm{\%H=\dfrac{1.85\:g\: H}{12.04\:g\: compound}\times100\%=15.4\%} \nonumber \]
\[\mathrm{\%N=\dfrac{2.85\:g\: N}{12.04\:g\: compound}\times100\%=23.7\%} \nonumber \]
Matokeo ya uchambuzi yanaonyesha kwamba kiwanja ni 61.0% C, 15.4% H, na 23.7% N kwa wingi.
Sampuli ya 24.81-g ya kiwanja cha gesi kilicho na kaboni tu, oksijeni, na klorini imedhamiriwa kuwa na 3.01 g C, 4.00 g O, na 17.81 g Cl. Ni nini kiwanja hiki cha asilimia utungaji?
- Jibu
-
12.1% C, 16.1% O, 71.8% Cl
Kuamua Asilimia Muundo kutoka Mfumo wa Mfumo
Utungaji wa asilimia pia ni muhimu kwa kutathmini wingi wa jamaa wa kipengele kilichopewa katika misombo tofauti ya fomu zinazojulikana. Kwa mfano mmoja, fikiria mbolea za kawaida za nitrojeni (NH 3), nitrati ya amonia (NH 4 NO 3), na urea (CH 4 N 2 O). Kipengele cha nitrojeni ni kiungo cha kazi kwa madhumuni ya kilimo, hivyo asilimia kubwa ya nitrojeni katika kiwanja ni wasiwasi wa vitendo na kiuchumi kwa watumiaji wanaochagua kati ya mbolea hizi. Kwa aina hizi za maombi, muundo wa asilimia ya kiwanja hutolewa kwa urahisi kutoka kwa molekuli yake ya formula na raia wa atomiki wa vipengele vyake vya sehemu. Molekuli ya NH 3 ina atomi moja ya N yenye uzito 14.01 amu na atomi tatu H yenye uzito wa jumla ya (3 × 1.008 amu) = 3.024 amu. Masi ya formula ya amonia ni kwa hiyo (14.01 amu + 3.024 amu) = 17.03 amu, na muundo wake wa asilimia ni:
\[\mathrm{\%N=\dfrac{14.01\:amu\: N}{17.03\:amu\:NH_3}\times100\%=82.27\%} \nonumber \]
\[\mathrm{\%H=\dfrac{3.024\:amu\: N}{17.03\:amu\:NH_3}\times100\%=17.76\%} \nonumber \]
Mbinu hii inaweza kuchukuliwa kwa kuzingatia jozi ya molekuli, molekuli kadhaa, au mole ya molekuli, nk kiasi cha mwisho ni rahisi zaidi na ingekuwa tu kuhusisha matumizi ya raia molar badala ya raia atomiki na formula, kama alionyesha Mfano\(\PageIndex{2}\). Muda mrefu kama tunajua formula ya kemikali ya dutu katika swali, tunaweza kupata urahisi asilimia utungaji kutoka formula molekuli au molekuli molar.
Aspirini ni kiwanja na formula ya Masi C 9 H 8 O 4. Asilimia yake ni muundo gani?
Suluhisho
Ili kuhesabu muundo wa asilimia, tunahitaji kujua raia wa C, H, na O katika molekuli inayojulikana ya C 9 H 8 O 4. Ni rahisi kuzingatia 1 mol ya C 9 H 8 O 4 na kutumia molekuli yake ya molar (180.159 g/mole, kuamua kutoka formula ya kemikali) kuhesabu asilimia ya kila moja ya vipengele vyake:
\ [kuanza {align*}
\%\ ce C&=\ mathrm {\ dfrac {9\: mol\: C\ mara molar\: Misa\: C} {molar\: molekuli\:\ ce {C9H18O4}}\ mara 100=\ dfrac {9\ times12.01\: g/mol}\ nonumber {180.159\: g/mol l}\ mara 100 =\ dfrac {108.09\: g/mol} {180.159\: g/mol}\ mara 100}\ hakuna idadi
\\%\ ce C&=\ m =\ m {60.00\,\%\, C}\ hakuna idadi
\ mwisho {align*}\ nonumber\]
\ [kuanza {align*}
\%\ ce H&=\ mathrm {\ dfrac {8\: mol\: H\ mara molar\: H} {molar\: molekuli\:\ ce {C9H18O4}}\ mara 100=\ dfrac {8\ mara 1.008\ :g/mol}\ hakuna idadi {180.159\ g/mol}\ mara 100 =\ dfrac {8.064\: g/mol} {180.159\: g/mol}\ mara 100}\ hakuna idadi
\\%\ ce H & = 4.476\,\%\,\ ce H\ hakuna idadi
\ mwisho {align*}\ nonumber\]
\ [kuanza {align*}
\%\ ce O&=\ hesabu {\ dfrac {4\: mol\: O\ mara molar\: Misa\: O} {molar\: molekuli\:\ ce {C9H18O4}}\ mara 100=\ dfrac {4\ mara 16.00\ :g/mol}\ nonumber {180.159\ :g/mol l}\ mara 100 =\ dfrac {64.00\: g/mol} {180.159\: g/mol}\ mara 100}\ hakuna idadi
\\%\ ce O & = 35.52\%\ hakuna idadi
\ mwisho {align*}\ nonumber\]
Kumbuka kuwa asilimia hizi ni sawa na 100.00% wakati ipasavyo mviringo.
Kwa tarakimu tatu muhimu, ni asilimia gani ya chuma katika kiwanja\(Fe_2O_3\)?
- Jibu
-
69.9% Fe
Uamuzi wa Fomu za kimapenzi
Kama ilivyoelezwa hapo awali, mbinu ya kawaida ya kuamua formula ya kemikali ya kiwanja ni kupima kwanza raia wa vipengele vyake vya sehemu. Hata hivyo, ni lazima kukumbuka kwamba kemikali formula kuwakilisha idadi jamaa, si raia, ya atomi katika dutu hii. Kwa hiyo, data yoyote inayotokana na majaribio inayohusisha wingi lazima itumike kupata idadi sambamba ya atomi katika kiwanja. Ili kukamilisha hili, tunaweza kutumia raia wa molar kubadili masi ya kila elementi kwa idadi ya moles. Kisha tunazingatia moles ya kila kipengele jamaa kwa kila mmoja, kugeuza namba hizi kuwa uwiano wa nambari nzima ambayo inaweza kutumika kupata formula ya empirical ya dutu hii. Fikiria sampuli ya kiwanja kuamua kuwa na 1.71 g C na 0.287 g H. idadi sambamba ya atomi (katika moles) ni:
\[\mathrm{1.71\:g\: C\times \dfrac{1\:mol\: C}{12.01\:g\: C}=0.142\:mol\: C} \nonumber \]
\[\mathrm{0.287\:g\: H\times \dfrac{1\:mol\: H}{1.008\:g\: H}=0.284\:mol\: H} \nonumber \]
Hivyo, tunaweza kuwakilisha kwa usahihi kiwanja hiki na formula C 0.142 H 0.284. Bila shaka, kwa mkataba uliokubaliwa, formula zina vyenye nambari nzima, ambayo inaweza kupatikana kwa kugawa kila subscript na subscript ndogo:
\[\ce C_{\Large{\frac{0.142}{0.142}}}\:\ce H_{\Large{\frac{0.284}{0.142}}}\ce{\:or\:CH2} \nonumber \]
(Kumbuka kwamba subscripts ya “1” si imeandikwa, lakini badala ya kudhani kama hakuna idadi nyingine ni sasa.)
Fomu ya maandishi ya kiwanja hiki ni hivyo CH 2. Hii inaweza au si kuwa kiwanja ya molekuli formula pia; hata hivyo, tunataka haja maelezo ya ziada kufanya uamuzi huo (kama kujadiliwa baadaye katika sehemu hii).
Fikiria kama mfano mwingine sampuli ya kiwanja kuamua kuwa na 5.31 g Cl na 8.40 g O. kufuatia mbinu hiyo hutoa tentative empirical formula ya:
\[\mathrm{Cl_{0.150}O_{0.525}=Cl_{\Large{\frac{0.150}{0.150}}}\: O_{\Large{\frac{0.525}{0.150}}}=ClO_{3.5}} \nonumber \]
Katika kesi hii, kugawanywa na usajili mdogo bado unatuacha na usajili wa decimal katika formula ya upimaji. Ili kubadilisha hii kuwa idadi nzima, tunapaswa kuzidisha kila scripts kwa mbili, kubakiza uwiano sawa wa atomi na kutoa Cl 2 O 7 kama formula ya mwisho ya upimaji.
Kwa muhtasari, kanuni za upimaji zinatokana na raia wa kipengele kilichopimwa kwa majaribio na:
- Kupata idadi ya moles ya kila kipengele kutoka kwa wingi wake
- Kugawanya kiasi cha kila kipengele cha molar kwa kiasi kidogo cha molar ili kuzalisha michango kwa formula ya upimaji
- Kuzidisha coefficients zote kwa integer, ikiwa ni lazima, ili kuhakikisha kuwa uwiano mdogo kabisa wa idadi ya usajili unapatikana
Kielelezo\(\PageIndex{1}\) muhtasari utaratibu huu katika mtiririko chati mtindo kwa dutu zenye vipengele A na X.
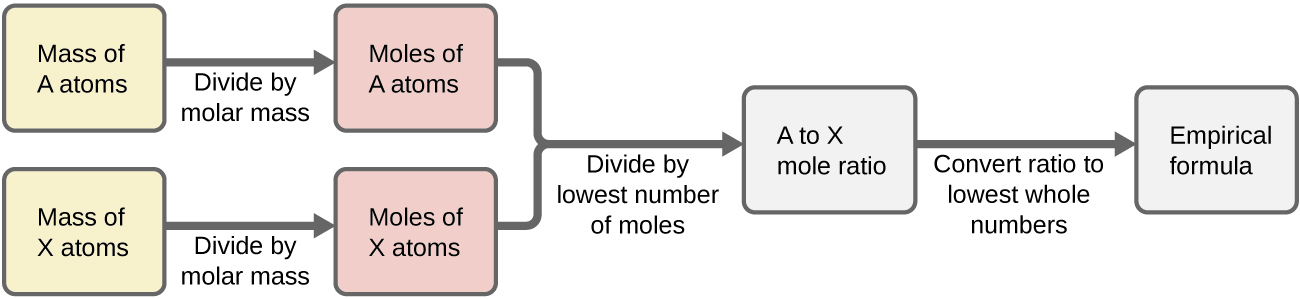
Sampuli ya hematite nyeusi ya madini (Kielelezo\(\PageIndex{2}\)), oksidi ya chuma iliyopatikana katika ores nyingi za chuma, ina 34.97 g ya chuma na 15.03 g ya oksijeni. Nini formula ya empirical ya hematite?

Suluhisho
Kwa tatizo hili, tunapewa wingi kwa gramu za kila kipengele. Anza kwa kutafuta moles ya kila mmoja:
\ [kuanza {align*}
\ hesabu {34.97\ g:\: Fe\ kushoto (\ drac {mol\: Fe} {55.85\ g}\ haki)} &=\ hesabu {0.6261\ :mol\: Fe}\\ hakuna idadi\\\ hesabu {15.03
\: g\\: O\ kushoto (\ dfrac {mol\: O} {16.00\: g}\ haki)} &=\ hesabu {0.9394\: mol\: O}\ nonumber
\ mwisho {align*}\ nonumber\]
Kisha, hupata uwiano wa chuma-kwa-oksijeni molar kwa kugawa na idadi ndogo ya moles:
\[\mathrm{\dfrac{0.6261}{0.6261}=1.000\:mol\: Fe} \nonumber \]
\[\mathrm{\dfrac{0.9394}{0.6261}=1.500\:mol\: O} \nonumber \]
Uwiano ni 1.000 mol ya chuma hadi 1.500 mol ya oksijeni (Fe 1 O 1.5). Hatimaye, kuzidisha uwiano na mbili kupata ndogo iwezekanavyo idadi nzima subscripts wakati bado kudumisha sahihi chuma-kwa-oksijeni uwiano:
\[\mathrm{2(Fe_1O_{1.5})=Fe_2O_3} \nonumber \]
Fomu ya upimaji ni\(Fe_2O_3\).
Je, ni formula ya maandishi ya kiwanja ikiwa sampuli ina 0.130 g ya nitrojeni na 0.370 g ya oksijeni?
- Jibu
-
\(N_2O_5\)
Video\(\PageIndex{1}\): Mifano ya ziada ya kazi inayoonyesha ufuatiliaji wa formula za upimaji hutolewa katika kipande cha video fupi.
Kupata Fomula za kimapenzi kutoka kwa Asilimia ya
Hatimaye, kuhusiana na deriving formula empirical, fikiria matukio ambayo kiwanja cha asilimia utungaji inapatikana badala ya raia kamili ya vipengele Constituent kiwanja. Katika hali hiyo, utungaji wa asilimia unaweza kutumika kuhesabu raia wa vipengele vilivyopo katika molekuli yoyote rahisi ya kiwanja; raia hizi zinaweza kutumiwa kupata formula ya upimaji kwa mtindo wa kawaida.
Fermentation ya bakteria ya nafaka kuzalisha ethanol huunda gesi yenye muundo wa asilimia 27.29% C na 72.71% O (Kielelezo\(\PageIndex{3}\)). Nini formula empirical kwa gesi hii?

Suluhisho
Kwa kuwa kiwango cha asilimia ni 100, ni rahisi zaidi kuhesabu wingi wa vipengele vilivyopo katika sampuli yenye uzito wa 100 g. hesabu ni “rahisi zaidi” kwa sababu, kwa ufafanuzi wa muundo wa asilimia, wingi wa kipengele kilichopewa katika gramu ni numerically sawa na wingi wa kipengele asilimia. Ulinganifu huu wa namba unatokana na ufafanuzi wa kitengo cha “asilimia”, jina lake linatokana na maneno ya Kilatini kwa sentimita inayomaanisha “kwa mia.” Kuzingatia ufafanuzi huu, asilimia kubwa zinazotolewa zinaweza kuelezwa kwa urahisi zaidi kama sehemu ndogo:
\ [kuanza {align*}
27.29\,\%\,\ ce C&=\ hesabu {\ drac {27.29\ g\: C} {100\: g\: kiwanja}}\ nonumber\\ nonumber\\
72.71\,\%\,\ ce O&=\ hesabu {\ drac {72.71\ g:\\ O} {100\ :g\: kiwanja}}\ nonumber
\ mwisho {align*}\ nonumber\]
Kiasi cha molar cha kaboni na hidrojeni katika sampuli ya 100-g huhesabiwa kwa kugawa molekuli ya kila elementi kwa masi yake ya molar:
\ [kuanza {align*}
\ hesabu {27.29\:\ g\: C\ kushoto (\ drac {mol\: C} {12.01\ g}\ haki)} & =\ hesabu {2.272\: mol\: C}\ hakuna idadi\\\ hesabu {72.71
\:\ g\: O\ kushoto (\ drac {mol\: O} {16.00\: g}\ haki)} &=\ hesabu {4.544\: mol\: O}\ hakuna nambari
\ mwisho {align*}\ nonumber\]
Coefficients kwa formula ya majaribio ya majaribio yanatokana na kugawanya kila kiasi cha molar kwa mdogo wa mbili:
\[\mathrm{\dfrac{2.272\:mol\: C}{2.272}=1} \nonumber \]
\[\mathrm{\dfrac{4.544\:mol\: O}{2.272}=2} \nonumber \]
Kwa kuwa uwiano unaosababishwa ni kaboni moja hadi atomi mbili za oksijeni, formula ya empirical ni CO 2.
Je, ni formula ya maandishi ya kiwanja kilicho na 40.0% C, 6.71% H, na 53.28% O?
- Jibu
-
\(CH_2O\)
Utoaji wa Fomu za Masi
Kumbuka kwamba formula empirical ni alama anayewakilisha idadi jamaa ya mambo ya kiwanja. Kuamua idadi kamili ya atomi ambazo hutunga molekuli moja ya kiwanja cha covalent inahitaji ujuzi wa formula yake ya kimapenzi na molekuli yake ya Masi au molekuli ya molar. Kiasi hiki kinaweza kuamua majaribio na mbinu mbalimbali za kupima. Masi ya molekuli, kwa mfano, mara nyingi hutokana na wigo wa wingi wa kiwanja (tazama majadiliano ya mbinu hii katika sura ya awali juu ya atomi na molekuli). Masi ya molar inaweza kupimwa na mbinu kadhaa za majaribio, ambazo nyingi zitaanzishwa katika sura za baadaye za maandiko haya.
Fomula za molekuli zinatokana na kulinganisha kiwanja cha molekuli au molekuli ya molekuli kwa molekuli yake ya kimapenzi Kama jina linavyoonyesha, molekuli ya formula ya kimapenzi ni jumla ya raia wa atomia wastani wa atomi zote zinazowakilishwa katika formula ya kimapenzi. Ikiwa tunajua molekuli (au molar) ya dutu hii, tunaweza kugawanya hii kwa wingi wa formula ya kimapenzi ili kutambua idadi ya vitengo vya formula za kimapenzi kwa molekuli, ambayo tunaweka kama n:
\[\mathrm{\dfrac{molecular\: or\: molar\: mass\left(amu\: or\:\dfrac{g}{mol}\right)}{empirical\: formula\: mass\left(amu\: or\:\dfrac{g}{mol}\right)}= \mathit n\: formula\: units/molecule} \nonumber \]
Fomu ya Masi ni kisha kupatikana kwa kuzidisha kila subscript katika formula empirical na n, kama inavyoonekana na generic empirical formula A x B y:
\[\mathrm{(A_xB_y)_n=A_{nx}B_{nx}} \nonumber \]
Kwa mfano, fikiria kiwanja covalent ambao empirical formula imedhamiria kuwa CH 2 O. empirical formula molekuli kwa kiwanja hiki ni takriban 30 amu (jumla ya 12 amu kwa moja C atomi, 2 amu kwa atomi mbili H, na 16 amu kwa moja O atomi). Ikiwa masi ya molekuli ya kiwanja imedhamiriwa kuwa 180 amu, hii inaonyesha kwamba molekuli za kiwanja hiki zina mara sita idadi ya atomi zinazowakilishwa katika formula ya kimapenzi:
\[\mathrm{\dfrac{180\:amu/molecule}{30\:\dfrac{amu}{formula\: unit}}=6\:formula\: units/molecule} \nonumber \]
Molekuli ya kiwanja hiki ni kisha kuwakilishwa na formula Masi ambao subscripts ni mara sita zaidi kuliko wale katika formula empirical:
\[\ce{(CH2O)6}=\ce{C6H12O6} \nonumber \]
Kumbuka kuwa mbinu hiyo hiyo inaweza kutumika wakati molekuli ya molar (g/mol) badala ya molekuli ya Masi (amu) inatumiwa. Katika kesi hii, sisi ni tu kuzingatia mole moja ya vitengo empirical formula na molekuli, kinyume na vitengo moja na molekuli.
Nikotini, alkaloid katika nightshade familia ya mimea ambayo ni hasa wajibu wa asili addictive ya sigara, ina 74.02% C, 8.710% H, na 17.27% N. Kama 40.57 g ya nikotini ina 0.2500 mol nikotini, ni nini formula Masi?
Suluhisho
Kuamua formula ya Masi kutoka kwa data iliyotolewa itahitaji kulinganisha kwa wingi wa formula ya kiwanja kwa wingi wake wa molar. Kama hatua ya kwanza, tumia utungaji wa asilimia ili upate fomu ya kiwanja cha maandishi. Kutokana na urahisi, sampuli ya 100-g ya nikotini hutoa kiasi cha molar zifuatazo cha vipengele vyake:
\ [kuanza {alignat} {2}
&\ mathrm {(74.02\ g\: C)\ kushoto (\ dfrac {1\: mol\: C} {12.01\ g\: C}\ haki)} &&=\:\ hesabu {6.163\: mol\: C}\\
&\ hisabati {(8.710\ g\: H)\ kushoto (\ dfrac {1\: mol\: H} {1.01\ g\: H}\ haki)} &&=\:\ hesabu {8.624\: mol\: H}\\
&\ mathrm {(17.27\ g:\ : N)\ kushoto (\ dfrac {1\: mol\: N} {14.01\: g\: N}\ haki)} &&=\:\ hesabu {1.233\: mol\: N}
\ mwisho {alignat}\ hakuna idadi\]
Kisha, tunahesabu uwiano wa molar wa vipengele hivi kuhusiana na kipengele kidogo zaidi,\(\ce{N}\).
\(6.163 \: \text{mol} \: \ce{C}\)/\(1.233 \: \text{mol} \: \ce{N}\)= 5
\(8.264 \: \text{mol} \: \ce{H}\)/\(1.233 \: \text{mol} \: \ce{N}\)= 7
\(1.233 \: \text{mol} \: \ce{N}\)/\(1.233\: \text{mol} \: \ce{N}\)= 1
1.233/1.233 =\(1.000 \: \text{mol} \: \ce{N}\)
6.163/1.233 =\(4.998 \: \text{mol} \: \ce{C}\)
8.624/1.233 =\(6.994 \: \text{mol} \: \ce{H}\)
C-to-N na H -n uwiano wa kutosha karibu na idadi nzima, na hivyo formula empirical ni C 5 H 7 N. empirical formula molekuli kwa kiwanja hiki ni kwa hiyo 81.13 amu/formula kitengo, au 81.13 g/mol formula kitengo.
Tunahesabu molekuli ya molar kwa nikotini kutoka kwa wingi uliopewa na kiasi cha molar cha kiwanja:
\[\mathrm{\dfrac{40.57\:g\: nicotine}{0.2500\:mol\: nicotine}=\dfrac{162.3\:g}{mol}} \nonumber \]
Kulinganisha molekuli ya molar na molekuli ya formula ya empirical inaonyesha kwamba kila molekuli ya nikotini ina
\[\mathrm{\dfrac{162.3\:g/mol}{81.13\:\dfrac{g}{formula\: unit}}=2\:formula\: units/molecule} \nonumber \]
Hivyo, tunaweza kupata formula ya Masi ya nikotini kutoka kwa formula ya maandishi kwa kuzidisha kila usajili na mbili:
\[\ce{(C5H7N)2}=\ce{C10H14N2} \nonumber \]
Je, ni formula ya Masi ya kiwanja yenye muundo wa asilimia 49.47% C, 5.201% H, 28.84% N, na 16.48% O, na molekuli ya molekuli ya 194.2 amu?
- Jibu
-
C 8 H 10 N 4 O 2
Muhtasari
Utambulisho wa kemikali wa dutu hufafanuliwa na aina na namba za jamaa za atomi zinazounda vyombo vyake vya msingi (molekuli katika kesi ya misombo ya covalent, ions katika kesi ya misombo ya ionic). kiwanja ya asilimia utungaji hutoa asilimia wingi wa kila kipengele katika kiwanja, na ni mara nyingi majaribio kuamua na kutumika hupata kiwanja ya empirical formula. Masi ya formula ya kiwanja cha covalent inaweza kulinganishwa na molekuli ya kiwanja au molekuli ya molekuli ili kupata formula ya Masi.
Mlinganyo muhimu
- \(\mathrm{\%X=\dfrac{mass\: X}{mass\: compound}\times100\%}\)
- \(\mathrm{\dfrac{molecular\: or\: molar\: mass\left(amu\: or\:\dfrac{g}{mol}\right)}{empirical\: formula\: mass\left(amu\: or\:\dfrac{g}{mol}\right)}=\mathit n\: formula\: units/molecule}\)
- (A x B y) n = A nx B ny
faharasa
- muundo wa asilimia
- asilimia kwa wingi wa mambo mbalimbali katika kiwanja
- empirical formula habari
- jumla ya raia wastani wa atomiki kwa atomi zote kuwakilishwa katika formula empirical


