9.4: Kuunganisha katika Vyombo vya fuwele
- Page ID
- 175264
Mwishoni mwa sehemu hii, utaweza:
- Eleza miundo ya kufunga ya yabisi ya kawaida
- Eleza tofauti kati ya kuunganisha katika imara na katika molekuli
- Kuamua umbali wa mgawanyo wa usawa uliotolewa mali za kioo
- Kuamua nishati ya dissociation ya chumvi iliyotolewa mali ya kioo
Kuanzia katika sehemu hii, tunasoma yabisi ya fuwele, ambayo yanajumuisha atomi zilizopangwa katika muundo ulioongezwa mara kwa mara unaoitwa kimiani. Zabisi ambazo hazifanyi au haziwezi kuunda fuwele huainishwa kama yabisi ya amofasi. Ingawa yabisi ya amofasi (kama kioo) yana maombi mbalimbali ya teknolojia ya kuvutia, lengo la sura hii litakuwa juu ya yabisi ya fuwele.
Atomi hujipanga wenyewe katika bandia ili kuunda kioo kwa sababu ya nguvu ya kuvutia ya wavu kati ya elektroni zao za majimbo na nuclei ya atomiki. Fuwele zinazoundwa na kuunganishwa kwa atomi ni moja ya makundi matatu, yaliyowekwa na kuunganishwa kwao: ionic, covalent, na metali. Molekuli zinaweza pia kushikamana pamoja ili kuunda fuwele; vifungo hivi, ambavyo havijadiliwa hapa, vinaainishwa kama Masi. Mapema katika karne ya ishirini, mfano wa atomiki wa imara ulikuwa wa mapema. Sasa tuna ushahidi wa moja kwa moja wa atomi katika yabisi (Kielelezo\(\PageIndex{1}\)).
Ionic bonding katika yabisi
Yabisi wengi huunda na bonding ionic. Mfano wa prototypical ni kioo cha kloridi ya sodiamu, kama tulivyojadili mapema. Uhamisho wa elektroni kutoka atomi za sodiamu hadi atomi za klorini zilizo karibu, tangu elektroni za valence katika sodiamu zimefungwa na klorini ina uhusiano mkubwa wa elektroni. Ions za sodiamu zilizopigwa vyema na ions za klorini (kloridi) zilizosababishwa vibaya huandaa kwenye safu ya kawaida ya atomi (Kielelezo\(\PageIndex{2}\)).
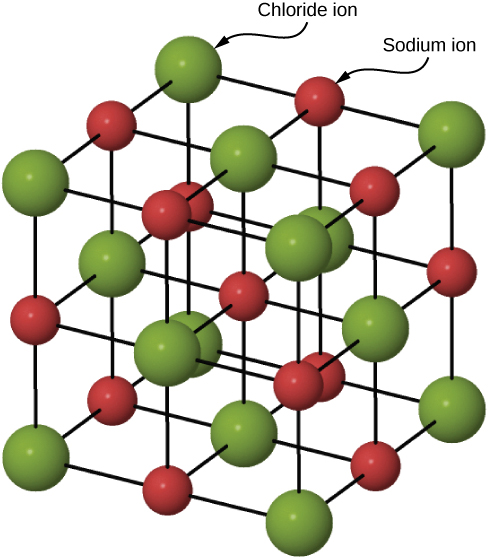
Mgawanyiko wa malipo ya ioni za sodiamu na kloridi ni spherically ulinganifu, na ion ya kloridi ni karibu mara mbili ukubwa wa ion ya sodiamu. Mpangilio wa chini wa nishati ya ions hizi huitwa muundo wa cubic (FCC) unaozingatia uso. Katika muundo huu, kila ion iko karibu na ions sita za aina nyingine. Kiini cha kitengo ni mchemraba—atomu inachukua kituo na pembe za kila “uso” wa mchemraba. Nishati ya kuvutia ya\(Na^+\) ion kutokana na mashamba ya\(Cl^-\) ions hizi sita imeandikwa
\[U_1 = -6\frac{e^2}{4\pi \epsilon_0 r} \nonumber \]
ambapo ishara ndogo inaonyesha uwezo wa kuvutia (na tunatambua\(k = 1/4 \pi \epsilon_0\)). Kwa mbali\(\sqrt{2r}\) ni majirani zake za karibu:\(Na^+\) ions kumi na mbili za malipo sawa. Jumla ya nishati ya kutosha inayohusishwa na ions hizi ni
\[U_2 = 12\frac{e^2}{4\pi \epsilon_0\sqrt{2}r}. \nonumber \]
Ifuatayo karibu ni\(Cl^-\) ions nane umbali 3√r3r kutoka\(Na^+\) ion. Nishati ya uwezo wa\(Na^+\) ion katika uwanja wa ions hizi nane ni
\[U_3 = -8\frac{e^2}{4\pi \epsilon_0 \sqrt{3}r}. \nonumber \]
Kuendelea kwa namna ile ile na seti mbadala\(Na^+\) za ions, tunaona kwamba nishati ya kuvutia\(U_A\) ya nishati ya\(Na^+\) ion moja inaweza kuandikwa kama\(Cl^-\)
\[U_{coul} = - \alpha \frac{e^2}{4\pi \epsilon_0 r} \nonumber \]
ambapo\(\alpha\) ni mara kwa mara Madelung, ilianzisha mapema. Kutokana na uchambuzi huu, tunaweza kuona kwamba hii mara kwa mara ni usio converging jumla
\[\alpha = 6 - \frac{12}{sqrt{2}} + \frac{8}{\sqrt{3}} + . . . \nonumber \]
Ioni za mbali hufanya mchango mkubwa kwa jumla hii, hivyo hujiunga polepole, na maneno mengi yanapaswa kutumiwa kuhesabu αα kwa usahihi. Kwa yabisi zote za ioniki za FCC, αα ni takriban 1.75.
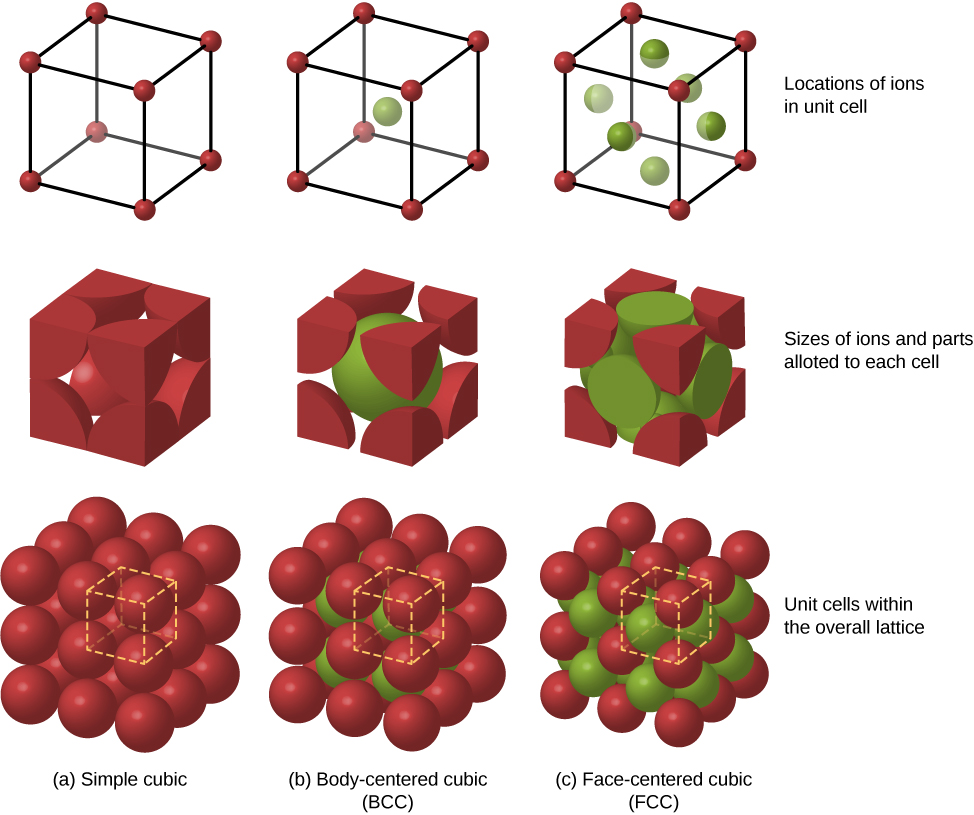
Mipango mingine inayowezekana ya kufunga ya atomi katika yabisi ni pamoja na ujazo rahisi na unaozingatia mwili (BCC). Hizi tatu tofauti kufunga miundo ya yabisi ni ikilinganishwa katika Kielelezo\(\PageIndex{3}\). Mstari wa kwanza unawakilisha eneo, lakini si ukubwa, wa ions; mstari wa pili unaonyesha seli za kitengo cha kila muundo au safu; na mstari wa tatu unawakilisha eneo na ukubwa wa ions. Muundo wa BCC una majirani nane wa karibu, na mara kwa mara ya Madelung ya takriban 1.76—tofauti kidogo tu na ile kwa muundo wa FCC. Kuamua mara kwa mara Madelung kwa yabisi maalum ni kazi ngumu na somo la utafiti wa sasa.
Nishati ya ions ya sodiamu sio kabisa kutokana na vikosi vya kuvutia kati ya ions za kushtakiwa kinyume. Ikiwa ions zinunuliwa karibu sana, kazi za wimbi za elektroni za msingi za ions huingiliana, na elektroni hurudia kutokana na kanuni ya kutengwa. Nishati ya jumla ya uwezo wa\(Na^+\) ion ni kwa hiyo jumla ya uwezo wa kuvutia wa Coulomb (\(U_{coul}\)) na uwezo wa kukataa unaohusishwa na kanuni ya kutengwa (\(U_{ex}\)). Kuhesabu uwezo huu wa kukataa unahitaji kompyuta zenye nguvu. Kwa bahati nzuri, hata hivyo, nishati hii inaweza kuelezwa kwa usahihi na formula rahisi ambayo ina vigezo vinavyoweza kubadilishwa:
\[U_{ex} = \frac{A}{r^n} \nonumber \]
ambapo vigezo A na n huchaguliwa kutoa utabiri kulingana na data ya majaribio. Kwa tatizo mwishoni mwa sura hii, parameter n inajulikana kama mara kwa mara ya kupinduliwa. Nishati ya jumla ya uwezo wa\(Na^+\) ion ni kwa hiyo
\[U = -\alpha\frac{e^2}{4\pi \epsilon_0 r} + \frac{A}{r^n}. \nonumber \]
Katika usawa, hakuna nguvu ya wavu juu ya ion, hivyo umbali kati ya jirani\(Na^+\) na\(Cl^-\) ions lazima iwe thamani\(r_0\) ambayo U ni kiwango cha chini. Kuweka\(\frac{dU}{dr} = 0\), tuna
\[0 = \frac{\alpha e^2}{4\pi \epsilon_0 r_0^2} - \frac{nA}{r_0^{n+1}}. \nonumber \]
Hivyo,
\[A = \frac{\alpha e^2 r_0^{n-1}}{4\pi \epsilon_0 n}. \nonumber \]
Kuingiza maneno haya katika kujieleza kwa nishati ya jumla ya uwezo, tuna
\[U = - \frac{\alpha e^2}{4\pi \epsilon_0 r_0} \left[\frac{r_0}{r} - \frac{1}{n}\left(\frac{r_0}{r}\right)^n \right]. \nonumber \]Angalia kwamba jumla ya nishati uwezo sasa ina parameter moja tu adjustable, n. Kipimo A kimebadilishwa na kazi inayohusisha r0r0, umbali wa kujitenga usawa, ambayo inaweza kupimwa na jaribio la diffraction (ulijifunza kuhusu diffraction katika sura iliyopita). Nishati ya jumla ya uwezo imepangwa katika Kielelezo\(\PageIndex{4}\) kwa\(n = 0\), thamani ya takriban ya n kwa NaCl.
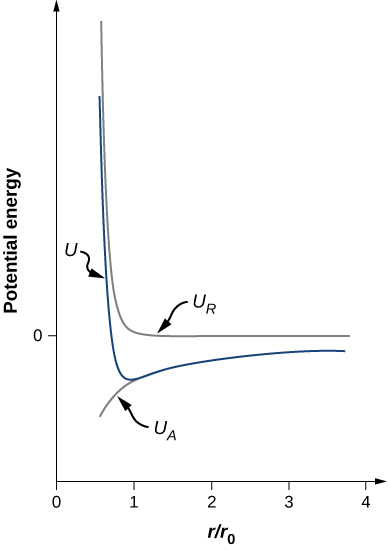
Muda mrefu kama\(n > 1\), Curve kwa U ina sura sawa ya jumla: U inakaribia infinity kama\(r \rightarrow 0\) na U inakaribia sifuri kama\(r \rightarrow \infty\). Thamani ya chini ya nishati inayoweza kutolewa hutolewa na
\[U_{min} (r = r_0) = -\alpha \frac{fe^2}{r_0}\left( 1 - \frac{1}{n}\right). \nonumber \]
Nishati kwa jozi ion zinahitajika kutenganisha kioo ndani ya ions ni kwa hiyo
\[U_{diss} = \alpha \frac{ke^2}{r_0}\left(1 - \frac{1}{n}\right). \nonumber \]
Hii ni nishati ya dissociation ya imara. Nishati ya kujitenga pia inaweza kutumika kuelezea nishati ya jumla inayohitajika kuvunja mole ya imara ndani ya ions zake zilizojitokeza, mara nyingi zinaelezwa katika KJ/mole. Nishati ya kujitenga inaweza kuamua majaribio kwa kutumia joto la latent la mvuke. Maadili ya sampuli hutolewa katika meza ifuatayo.
| \(F^-\) | \(Cl^-\) | \(Br^-\) | \(I^-\) | |
|---|---|---|---|---|
| \(Li^+\) | \ (F^-\)” style="Nakala-align:center;” class="lt-phys-4543">1036 | \ (Cl^-\)” style="Nakala-align:center;” class="lt-phys-4543">853 | \ (Br^-\)” style="Nakala-align:center;” class="lt-phys-4543">807 | \ (I^-\)” style="Nakala-align:center;” class="lt-phys-4543">757 |
| \(Na^+\) | \ (F^-\)” style="Nakala-align:center;” class="lt-phys-4543">923 | \ (Cl^-\)” style="text-align:center;” class="lt-phys-4543">787 | \ (Br^-\)” style="text-align:center;” class="lt-phys-4543">747 | \ (I^-\)” style="Nakala-align:center;” class="lt-phys-4543">704 |
| \(K^+\) | \ (F^-\)” style="Nakala-align:center;” class="lt-phys-4543">821 | \ (Cl^-\)” style="text-align:center;” class="lt-phys-4543">715 | \ (Br^-\)” style="text-align:center;” class="lt-phys-4543">682 | \ (I^-\)” style="Nakala-align:center;” class="lt-phys-4543">649 |
| \(Rb^+\) | \ (F^-\)” style="Nakala-align:center;” class="lt-phys-4543">785 | \ (Cl^-\)” style="text-align:center;” class="lt-phys-4543">689 | \ (Br^-\)” style="text-align:center;” class="lt-phys-4543">660 | \ (I^-\)” style="Nakala-align:center;” class="lt-phys-4543">630 |
| \(Cs^+\) | \ (F^-\)” style="Nakala-align:center;” class="lt-phys-4543">740 | \ (Cl^-\)” style="text-align:center;” class="lt-phys-4543">659 | \ (Br^-\)” style="text-align:center;” class="lt-phys-4543">631 | \ (I^-\)” style="Nakala-align:center;” class="lt-phys-4543">604 |
Hivyo, tunaweza kuamua mara kwa mara Madelung kutoka muundo wa kioo na n kutoka nishati ya bandia. Kwa NaCl, tuna\(r_0 = 2.81 A\),\(n \approx 8\), na\(U_{diss} = 7.84 \, eV/ion \, pair\). Nishati hii ya kujitenga ni kubwa. Photon yenye nguvu zaidi kutoka kwa wigo unaoonekana, kwa mfano, ina nishati ya takriban
\[hf = (4.14 \times 10^{-15} eV \cdot s)(7.5 \times 10^{14} Hz) = 3.1 \, eV. \nonumber \]
Kwa sababu ions katika fuwele zimefungwa sana, fuwele za ionic zina sifa zifuatazo:
- Wao ni ngumu sana na imara.
- Wao hupuka kwa joto la juu (1000 hadi 2000 K).
- Wao ni wazi kwa mionzi inayoonekana, kwa sababu photoni katika sehemu inayoonekana ya wigo sio nguvu ya kutosha kusisimua elektroni kutoka hali yake ya ardhi hadi hali ya msisimko.
- Wao ni wasimamizi wa umeme maskini, kwa sababu hawana elektroni za bure kwa ufanisi.
- Mara nyingi hupumzika katika maji, kwa sababu molekuli ya maji ina muda mkubwa wa dipole ambao uwanja wa umeme una nguvu ya kutosha kuvunja vifungo vya umeme kati ya ions.
Kuamua nishati ya dissociation ya kloridi ya sodiamu (NaCl) katika KJ/mol. (Dokezo: repulsion mara kwa mara n ya NaCl ni takriban 8.)
Mkakati
Kioo cha kloridi ya sodiamu kina mgawanyiko wa usawa wa 0.282 nm. (Linganisha thamani hii na 0.236 nm kwa kitengo cha bure cha diatomic cha NaCl.) Nishati ya kujitenga inategemea umbali wa kujitenga, mara kwa mara ya kukataa, na Madelung mara kwa mara kwa muundo wa FCC. Umbali wa kujitenga unategemea mzunguko wa molar na wiani wa kipimo. Tunaweza kuamua umbali wa kujitenga, na kisha kutumia thamani hii kuamua nishati ya dissociation kwa mole moja ya imara.
Suluhisho
Misa ya atomiki ya Na na Cl ni 23.0 u na 58.4 u, hivyo molekuli ya molar ya NaCl ni 58.4 g/mol. Uzito wa NaCl ni\(2.16 \, g/cm^3\). Uhusiano kati ya kiasi hiki ni
\[\rho = \frac{M}{V} = \frac{M}{2N_A r_0^3}, \nonumber \]
ambapo M ni wingi wa mole moja ya chumvi, NANA ni namba ya Avogadro, na r0r0 ni umbali wa kujitenga usawa. Sababu ya 2 inahitajika kwa kuwa ions zote za sodiamu na kloridi zinawakilisha kiasi cha ujazo\(r_0^3\). Kutatua kwa umbali, tunapata
\[r_0^3 = \frac{M}{2N_A \rho} = \frac{58.4 \, g/mol}{2(6.03 \times 10^{23})(2.160 \, g/cm^3)} = 2.23 \times 10^{-23} \, cm^3, \nonumber \]au
\[r_0 = 2.80 \times 10^{-8} cm = 0.280 \, nm. \nonumber \]
Nishati ya uwezo wa jozi moja ya ion (\(Na^+ Cl^-\)) ni
\[U = -\alpha \frac{ke^2}{r_0} \left(1 - \frac{1}{n}\right), \nonumber \]
wapi\(\alpha\) Madelung mara kwa mara,\(r_0\) ni umbali wa kujitenga usawa, na n ni mara kwa mara repulsion. NaCl ni FCC, hivyo mara kwa mara Madelung ni\(\alpha = 1.7476\). Kubadilisha maadili haya, tunapata
\[U = -1.75 \frac{1.44 \, eV \cdot nm}{0.280 \, nm} \left(1 - \frac{1}{8}\right) = - 7.88 \frac{eV}{ion \, pair}. \nonumber \]
Nishati ya dissociation ya mole moja ya kloridi ya sodiamu ni hivyo
\[D = \left(\frac{7.88 \, eV}{ion \, pair}\right)\left( \frac{\frac{23.052 \, kcal}{1 \, mol}}{\frac{1 \, eV}{ion \, pair}}\right) = 182 \, kcal/mol = 760 \, kJ/mol. \nonumber \]
Umuhimu
Thamani hii ya kinadharia ya nishati ya dissociation ya 766 kJ/mol iko karibu na thamani ya majaribio ya kukubalika ya 787 kJ/mol. Kumbuka kwamba kwa wiani mkubwa, umbali wa mgawanyo wa usawa kati ya jozi za ion ni ndogo, kama inavyotarajiwa. Umbali huu mdogo wa kujitenga huendesha nguvu kati ya ions na hivyo nishati ya dissociation. Uongofu mwishoni mwa equation ulitumia faida ya sababu ya uongofu\(1 \, kJ = 0.239 \, kcal\).
Kama dissociation nishati walikuwa kubwa, ingekuwa kwamba iwe rahisi au vigumu zaidi kuvunja imara mbali?
- Jibu
-
ngumu zaidi
Covalent Bonding katika yabisi
Fuwele pia inaweza kuundwa na kuunganisha covalent. Kwa mfano, vifungo vya covalent vinahusika na kushikilia atomi za kaboni pamoja katika fuwele za almasi. Configuration ya elektroni ya atomi ya kaboni ni\(1s^22s^22p^2\) - msingi Yeye pamoja na elektroni nne za valence. Configuration hii ya elektroni ni elektroni nne fupi ya ganda kamili, hivyo kwa kugawana elektroni hizi nne na atomi nyingine za kaboni katika dhamana ya covalent, maganda ya atomi zote za kaboni hujazwa. Diamond ina muundo ngumu zaidi kuliko fuwele nyingi za ionic (Kielelezo\(\PageIndex{5}\)). Kila atomu ya kaboni ni kitovu cha tetrahedroni ya kawaida, na pembe kati ya vifungo ni 110°.110°. Pembe hii ni matokeo ya moja kwa moja ya uongozi wa orbitals p ya atomi za kaboni.
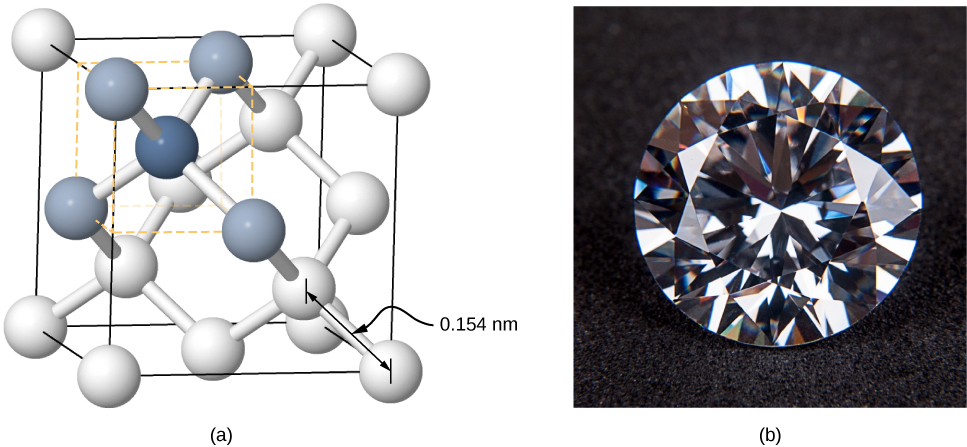
Fuwele zilizofungwa kwa ushirikiano sio sare kama fuwele za ioniki lakini ni vigumu sana, vigumu kuyeyuka, na hazina maji. Kwa mfano, almasi ina joto la juu sana la kiwango (4000 K) na ni wazi kwa mwanga unaoonekana. Kwa kulinganisha, bati iliyounganishwa kwa covalently (pia inajulikana kama alpha-tin, ambayo ni nonmetallic) ni laini kiasi, hutengana saa 600 K, na huonyesha mwanga unaoonekana. Mifano mingine miwili muhimu ya fuwele zilizounganishwa kwa covalently ni silicon na germanium. Wote wa yabisi haya hutumiwa sana katika utengenezaji wa diodes, transistors, na nyaya jumuishi. Tutarudi kwenye vifaa hivi baadaye katika majadiliano yetu ya semiconductors.
Metali Bonding katika Yabisi
Kama jina linamaanisha, kuunganisha metali ni wajibu wa kuundwa kwa fuwele za metali. Electroni za valence kimsingi hazina atomi na zina uwezo wa kusonga kwa urahisi katika kioo cha metali. Bonding ni kutokana na vikosi vya kuvutia kati ya ions chanya na elektroni conduction. Vifungo vya metali ni dhaifu kuliko vifungo vya ionic au covalent, na nguvu za kujitenga katika upeo\(1 - 3 \, eV\).


