9.3: Masi Spectra
- Page ID
- 175233
Mwishoni mwa sehemu hii, utaweza:
- Tumia dhana za nishati ya vibrational na ya mzunguko kuelezea mabadiliko ya nishati katika molekuli ya diatomic.
- Eleza vipengele muhimu vya wigo wa nishati ya vibrational-mzunguko wa molekuli ya diatomic
- Tathmini nguvu za kuruhusiwa za molekuli inayozunguka
- Kuamua umbali wa kujitenga usawa kati ya atomi katika molekuli ya diatomic kutoka kwa wigo wa ngozi ya vibrational-rotational
Viwango vya nishati ya molekuli ni ngumu zaidi kuliko viwango vya nishati atomia kwa sababu molekuli zinaweza pia kutetemeka na kuzunguka. Nguvu zinazohusiana na mwendo huo ziko katika safu tofauti na zinaweza kujifunza tofauti. Mabadiliko ya umeme ni ya utaratibu 1 eV, mabadiliko ya vibrational ni ya utaratibu\(10^{-2}eV\), na mabadiliko ya mzunguko ni ya utaratibu\(10^{-3}eV\). Kwa molekuli tata, mabadiliko haya ya nishati ni vigumu kuifanya, kwa hiyo tunaanza na kesi rahisi ya molekuli ya diatomic.
Quantum mzunguko
Kulingana na mechanics classical, nishati ya mzunguko wa molekuli diatomic hutolewa na
\[E_r = \dfrac{L^2}{2I}, \nonumber \]
ambapo mimi ni wakati wa inertia na L ni kasi ya angular. Kwa mujibu wa mechanics quantum, kasi ya mzunguko wa angular ni quantized:
\[L = \sqrt{l(l + 1)} \hbar (l = 0,1,2,3,...), \nonumber \]
ambapo l ni nambari ya quantum ya angular ya orbital. Kiwango cha nishati ya mzunguko wa kuruhusiwa ya molekuli ya diatomic ni kwa hiyo
\[E_r = l(l + 1) \dfrac{\hbar^2}{2I} = l(l + 1) \, E_{0r} \, \, (l = 0,1,2,3,...), \nonumber \]
ambapo nishati ya mzunguko wa tabia ya molekuli hufafanuliwa kama
\[E_{0r} = \dfrac{\hbar^2}{2I}. \nonumber \]
Kwa molekuli ya diatomic, wakati wa inertia na molekuli iliyopunguzwa\(μ\) ni
\[I = \mu r_0^2, \nonumber \]
ambapo\(r_0\) ni umbali wa jumla kati ya atomi. Tofauti ya nishati kati ya viwango vya mzunguko ni hivyo
\[\Delta E_r = E_{l+1} - E_l = 2(l + 1) \, E_{0r}. \nonumber \]
Utafiti wa kina wa mabadiliko kati ya viwango vya nishati vya mzunguko vinavyoletwa na ngozi au uchafu wa mionzi (kinachojulikana kama mpito wa umeme wa dipole) inahitaji kwamba
\[\Delta l = \pm1. \label{delta l} \]
Sheria hii, inayojulikana kama utawala wa uteuzi, inapunguza mabadiliko iwezekanavyo kutoka hali moja ya quantum hadi nyingine. Equation\ ref {delta l} ni utawala wa uteuzi kwa mabadiliko ya nishati ya mzunguko. Inatumika tu kwa molekuli za diatomic zilizo na wakati wa umeme wa dipole. Kwa sababu hii, molekuli za ulinganifu kama vile\(H_2\) na\(N_2\) hazipati mabadiliko ya nishati ya mzunguko kutokana na ngozi au chafu ya mionzi ya umeme.
Kuamua viwango vya chini vya nishati ya mzunguko wa hidrojeni hidrojeni ((\(\ce{HCl}\))) molekuli.
Mkakati
Kloridi ya hidrojeni (\(\ce{HCl}\)) ni molekuli ya diatomiki yenye umbali wa mgawanyo wa usawa wa 0.127 nm. Viwango vya nishati ya mzunguko hutegemea tu kasi ya inertia I na namba ya kasi ya angular ya orbital\(l\) (katika kesi hii\(l = 0\), 1, na 2). Kasi ya inertia inategemea, kwa upande wake, umbali wa mgawanyo wa usawa (unaotolewa) na molekuli iliyopunguzwa, ambayo inategemea raia wa atomi za H na Cl.
Suluhisho
Kwanza, tunahesabu molekuli iliyopunguzwa. Kama Chembe 1 ni hidrojeni na Chembe 2 ni kloridi, tuna
\[\begin{align*} \mu &= \dfrac{m_1m_2}{m_1 + m_2} = \dfrac{(1.0 \, u)(35.4 \, u)}{1.0 \, u + 35.4 \, u} \\[4pt] &= 0.97 \, u = 0.97 \, u \left(\dfrac{931.5 \dfrac{MeV}{c^2}}{1 \, u}\right) \\[4pt] &= 906 \dfrac{MeV}{c^2}. \end{align*} \nonumber \]
Sambamba mapumziko molekuli nishati ni hiyo
\[\mu c^2 = 9.06 \times 10^8 \, eV \nonumber \]
Hii inaruhusu sisi kuhesabu nishati ya tabia:
\[ \begin{align*} E_{0r} &= \dfrac{\hbar^2}{2(\mu r_0^2)} = \dfrac{(\hbar c)^2}{2(\mu c^2)r_0^2} \nonumber \\[4pt] &= \dfrac{(197.3 \, eV \cdot nm)^2}{2(9.06 \times 10^8 eV)(0.127 \, nm)^2} \nonumber \\[4pt] &= 1.33 \times 10^{-3} eV. \nonumber \end{align*} \nonumber \]
(Angalia jinsi maneno haya yameandikwa kwa suala la nishati ya molekuli. Mbinu hii ni ya kawaida katika mahesabu ya kisasa ya fizikia.) Viwango vya nishati ya mzunguko hutolewa na
\[E_r = l(l + 1) \dfrac{\hbar^2}{2I} = l(l + 1) E_{0r}, \nonumber \]
wapi\(l\) nambari ya quantum ya orbital. Viwango vitatu vya chini vya nishati ya mzunguko wa molekuli ya HCl ni kwa hiyo
\[\begin{align*} l &= 0:\quad E_r &&= 0 \, eV \, \text{(no rotation)} \\[4pt] l &= 1: \quad E_r &&= 2 \, E_{0r} = 2.66 \times 10^{-3}eV, \\[4pt] l &= 2:\quad E_r &&= 6 \, E_{0r} = 7.99 \times 10^{-3} eV. \end{align*} \nonumber \]
Umuhimu
Wigo wa mzunguko unahusishwa na mabadiliko dhaifu (1/1000 hadi 1/100 ya eV). Kwa kulinganisha, nishati ya elektroni katika hali ya chini ya hidrojeni ni\(- 13.6 \, eV\).
Je, kujitenga kwa nishati kati ya mistari ya ngozi katika wigo wa mzunguko wa molekuli ya diatomic inakuambia nini?
- Jibu
-
wakati wa inertia
quantum vibration
Kiwango cha nishati ya vibrational, ambayo ni kiwango cha nishati kinachohusiana na nishati ya vibrational ya molekuli, ni vigumu zaidi kukadiria kuliko kiwango cha nishati ya mzunguko. Hata hivyo, tunaweza kukadiria viwango hivi kwa kudhani kwamba atomi mbili katika molekuli diatomiki ni kushikamana na spring bora ya spring mara kwa mara k. Nishati ya uwezo wa mfumo huu wa spring ni
\[U_{osc} = \dfrac{1}{2}k \Delta r^2, \nonumber \]
Ambapo\(\Delta r\) ni mabadiliko katika “urefu asilia” wa molekuli kando ya mstari unaounganisha atomi. Kutatua equation Schrödinger kwa uwezo huu anatoa
\[E_n = \left(n + \dfrac{1}{2}\right) \hbar \omega \, (n = 0,1,2,. . .), \nonumber \]
Ambapo\(\omega\) ni mzunguko wa angular wa asili wa vibration na n ni nambari ya quantum ya vibrational. Utabiri kwamba viwango vya nishati vibrational ni sawasawa spaced (\(\Delta E = \hbar \omega\)) zinageuka kuwa nzuri katika nguvu za chini.
Utafiti wa kina wa mabadiliko kati ya viwango vya nishati vibrational ikiwa na ngozi au chafu ya mionzi (na hasa kinachojulikana umeme dipole mpito) inahitaji kwamba
\[\Delta n = \pm 1. \label{delta n} \]
Equation\ ref {delta n} inawakilisha utawala wa uteuzi kwa mabadiliko ya nishati ya vibrational. Kama ilivyoelezwa hapo awali, sheria hii inatumika tu kwa molekuli za diatomic zilizo na wakati wa umeme wa dipole. Molekuli za ulinganifu hazipati mabadiliko hayo.
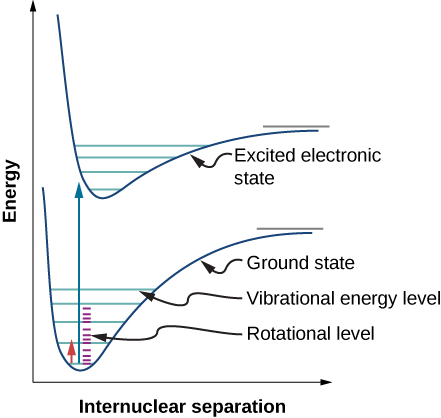
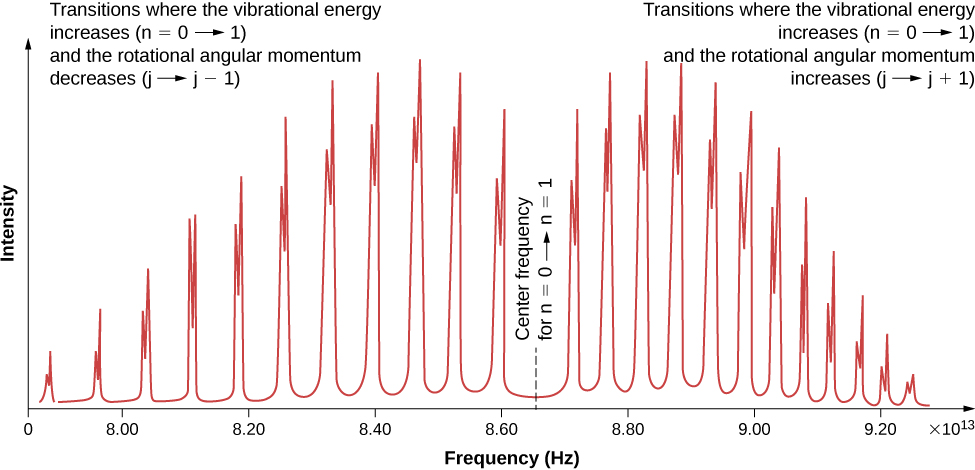
Kutokana na sheria za uteuzi, ngozi au uchafu wa mionzi na molekuli ya diatomic inahusisha mpito katika majimbo ya vibrational na ya mzunguko. Hasa, ikiwa nambari ya quantum ya vibrational (n) inabadilika kwa kitengo kimoja, basi nambari ya quantum ya mzunguko (l) inabadilika kwa kitengo kimoja. Mchoro wa ngazi ya nishati ya mpito iwezekanavyo hutolewa katika Kielelezo\(\PageIndex{1}\). Wigo wa ngozi kwa mabadiliko hayo katika kloridi ya hidrojeni (HCl) inavyoonekana kwenye Mchoro (\ PageIndex {2}\). Vipande vya ngozi vinatokana na mabadiliko kutoka\(n = 0\) kwa nchi za\(n = 1\) vibrational. Tofauti za nishati kwa bendi ya kilele upande wa kushoto na kulia ni, kwa mtiririko huo:
(bendi ya kulia)
\[ \Delta E_{l \rightarrow l+1} = \hbar \omega + 2(l + 1)E_{0r} = \hbar \omega + 2E_{0r}, \, \hbar \omega + 4E_{0r}, \, \hbar \omega + 6E_{0r}, ... \nonumber \]
(bendi ya kushoto)
\[ \Delta E_{l \rightarrow l-1} = \hbar \omega - 2l E_{0r} = \hbar \omega - 2E_{0r}, \, \hbar \omega - 4E_{0r}, \, \hbar \omega - 6E_{0r}, .... \nonumber \]
Wakati wa inertia unaweza kuamua kutoka nafasi ya nishati kati ya kilele cha mtu binafsi (\(2E_{0r}\)) au kutoka pengo kati ya bendi za kushoto na za kulia (\(4E_{0r}\)). Mzunguko katikati ya pengo hili ni mzunguko wa vibration.