9.2: Aina ya vifungo vya Masi
- Page ID
- 175243
Mwishoni mwa sehemu hii, utaweza:
- Tofautisha kati ya aina tofauti za vifungo vya Masi
- Kuamua nishati ya dissociation ya molekuli kwa kutumia dhana ionization nishati, ushirika wa elektroni, na nguvu ya Coulomb
- Eleza bonding covalent katika suala la ulinganifu kubadilishana
- Eleza muundo wa kimwili wa molekuli kwa suala la dhana ya hybridization
Quantum mechanics imekuwa extraordinarily mafanikio katika kueleza muundo na bonding katika molekuli, na hivyo ni msingi kwa ajili ya wote wa kemia. Kemia ya quantum, kama inavyoitwa wakati mwingine, inaelezea maswali ya msingi kama kwa nini\(H_2O\) molekuli zipo, kwa nini angle ya kuunganisha kati ya atomi za hidrojeni katika molekuli hii ni sawa 104.5°, na kwa nini molekuli hizi hufunga pamoja ili kuunda maji ya kioevu kwenye joto la kawaida. Kutumia mechanics ya quantum kwa molekuli inaweza kuwa vigumu sana hesabu, hivyo majadiliano yetu yatakuwa ya ubora tu.
Tunapojifunza molekuli na kisha yabisi, tutatumia mifano mbalimbali ya kisayansi. Katika baadhi ya matukio, tunaangalia molekuli au kioo kama seti ya viini vya uhakika na elektroni zinazunguka nje katika trajectories zilizoelezwa vizuri, kama ilivyo katika mfano wa Bohr. Katika hali nyingine, sisi kuajiri maarifa yetu kamili ya quantum mechanics kujifunza mifumo hii kwa kutumia kazi wimbi na dhana ya elektroni spin. Ni muhimu kukumbuka kwamba tunasoma fizikia ya kisasa na mifano, na kwamba mifano tofauti ni muhimu kwa madhumuni tofauti. Hatutumii daima mfano wenye nguvu zaidi, wakati mfano wa chini, rahisi kutumia utafanya kazi.
Aina ya vifungo
Vitengo vya kemikali vinaunda na aina nyingi za vifungo vya kemikali. Dhamana ya ioniki inaunda wakati elektroni inapohamisha kutoka atomi moja hadi nyingine. Dhamana ya covalent hutokea wakati atomi mbili au zaidi zinashiriki elektroni. dhamana van der Waals hutokea kutokana na mvuto wa molekuli malipo-polarized na ni dhaifu mno kuliko dhamana ionic au covalent. Aina nyingine nyingi za kuunganisha zipo pia. Mara nyingi, kuunganisha hutokea kupitia njia zaidi ya moja. Lengo la sehemu hii ni ionic na covalent bonding.
Ionic vifungo
dhamana ionic labda ni aina rahisi ya bonding kuelewa. Inaelezea malezi ya misombo ya chumvi, kama vile kloridi ya sodiamu,\(\ce{NaCl}\). Atomu ya sodiamu (ishara Na) ina mpangilio sawa wa elektroni kama atomu ya neon pamoja na elektroni moja ya 3 s. 5.14 eV tu ya nishati ya ionization inahitajika ili kuondoa hii elektroni moja kutoka atomi ya sodiamu. Kwa hiyo, Na anaweza kutoa kwa urahisi au kuchangia elektroni hii kwa atomi iliyo karibu (karibu), kufikia mpangilio thabiti zaidi wa elektroni. Klorini (alama Cl) inahitaji elektroni moja tu ili kukamilisha ganda lake la valence, hivyo inakubali kwa urahisi elektroni hii ikiwa iko karibu na atomu ya sodiamu. Kwa hiyo tunasema kwamba klorini ina mshikamano mkubwa wa elektroni, ambayo ni nishati inayohusishwa na elektroni iliyokubaliwa. Nishati iliyotolewa na atomi ya klorini katika mchakato huu ni 3.62 eV. Baada ya uhamisho wa elektroni kutoka atomi ya sodiamu hadi atomi ya klorini, atomi ya sodiamu inakuwa ion chanya na atomi ya klorini inakuwa ioni hasi.
Tabia hii inaonekana kama hii
\[\ce{Na(g) + Cl(g) -> Na^{+}(g) + Cl^{-}(g)} \label{rx1} \]
na nishati ya jumla zinazohitajika kwa ajili ya uhamisho huu ni iliyotolewa na
\[E_{transfer} = 5.14 \,\text{eV} - 3.62 \,\text{eV} = 1.52 \,\text{eV}. \label{9.1} \]
Ioni nzuri ya sodiamu na ioni hasi ya kloridi hupata nguvu ya kuvutia ya Coulomb. Nishati inayohusishwa na nguvu hii inatolewa na
\[U_{coul} = -\dfrac{ke^2}{r_0}, \nonumber \]
wapi\(ke^2 = 1.440\, \text{eV-nm}\) na\(r_0\) ni umbali kati ya ions.
Kama ions ya sodiamu na kloridi huenda pamoja (“kushuka kilima cha nishati”), nguvu ya mvuto kati ya ions inakuwa imara. Hata hivyo, kama ions kuwa karibu sana, msingi wa elektroni wimbi kazi katika ions mbili kuanza kuingiliana. Kutokana na kanuni ya kutengwa, hatua hii inakuza msingi elektroni-na kwa hiyo molekuli nzima-katika hali ya juu ya nishati.
\[\ce{ Na^{+}(g) + Cl^{-}(g) -> NaCl(g)} \label{rx2} \]
Umbali wa mgawanyo wa usawa (au urefu wa dhamana) kati ya ions hutokea wakati molekuli iko katika hali yake ya chini ya nishati. Kwa diatomic\(\ce{NaCl}\), umbali huu ni 0.236 nm. Kielelezo\(\PageIndex{1}\) inaonyesha nishati ya jumla ya\(\ce{NaCl}\) kama kazi ya umbali wa kujitenga kati ya ions.
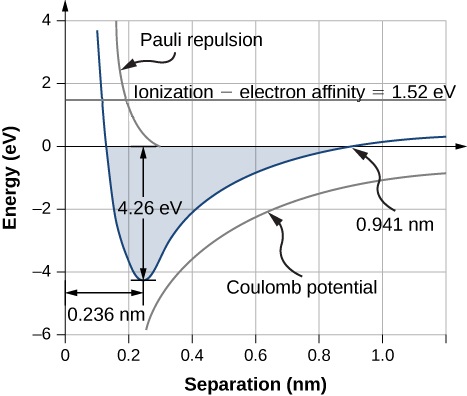
Nishati ya jumla inayotakiwa kuunda kitengo kimoja cha chumvi kutoka upande wowote\(\ce{Na}\) na\(\ce{Cl}\) atomi ni jumla ya nguvu zinazohusishwa na uhamisho wa elektroni (Equation\ ref {rx1}) na mchanganyiko wa ioni (Equation\ ref {rx2}):
\[U_{form} = E_{transfer} + U_{coul} + U_{ex}, \nonumber \]
wapi nishati\(U_{ex}\) inayohusishwa na kupinduliwa kati ya elektroni za msingi kutokana na kanuni ya kutengwa kwa Pauli. Thamani ya\(U_{form}\) lazima iwe hasi kwa dhamana kuunda kwa hiari (vinginevyo, ni chini katika nishati ya kutenganishwa aina). Nishati ya kujitenga hufafanuliwa kama nishati inahitajika kutenganisha kitengo ndani ya ions zake zilizojumuisha, zilizoandikwa
\[U_{diss} = -U_{form} \nonumber \]
Kila kitengo cha formula ya diatomic kina tabia yake ya kujitenga nishati na urefu wa mgawanyo wa usawa. Maadili ya sampuli hutolewa katika Jedwali\(\PageIndex{1}\).
Vifungo vinaweza kuvunjika kwa usawa au asymmetrically. Ya zamani inaitwa homolysis na ni msingi wa kawaida (homolytic) dhamana dissociation nishati. Kwa kitengo cha formula ya chumvi (\(\ce{NaCl}\)), mmenyuko wa homolytic unaohusishwa utakuwa
\[\ce{NaCl(g) -> Na (g) + Cl(g)} \label{homo} \]
Scission isiyo ya kawaida ya dhamana inaitwa heterolysis (yaani, heterolytic dhamana dissociation nishati). Kuhusishwa heterolytic mmenyuko kwa\(\ce{ NaCl}\) itakuwa
\[\ce{NaCl(g) -> Na^{+} (g) + Cl^{-}(g)} \label{hetero} \]
Tofauti katika nguvu za kujitenga dhamana ya homolytic na heterolytic\(E_{transfer}\) hutolewa tu na Equation\ ref {9.1}.
| Molekuli | Nishati ya kujitenga (eV) | Ugawanyiko wa usawa (nm) (urefu wa dhamana) |
|---|---|---|
| NaCl | 4.26 | 0.236 |
| NaF | 4.99 | 0.193 |
| NaBr | 3.8 | 0.250 |
| NaI | 3.1 | 0.271 |
| NaH | 2.08 | 0.189 |
| LiCl | 4.86 | 0.202 |
| LiH | 2.47 | 0.239 |
| LII | 3.67 | 0.238 |
| KCl | 4.43 | 0.267 |
| KBr | 3.97 | 0.282 |
| RBf | 5.12 | 0.227 |
| rBcl | 4.64 | 0.279 |
| CSI | 3.57 | 0.337 |
| H-H | 4.5 | 0.075 |
| N-N | 9.8 | 0.11 |
| O-O | 5.2 | 0.12 |
| F-F | 1.6 | 0.14 |
| Cl-Cl | 2.5 | 0.20 |
Nishati ya dissociation ya kitengo cha formula ya chumvi (NaCl) ni nini?
Mkakati
Kloridi ya sodiamu (\(\ce{NaCl}\)) ni chumvi iliyoundwa na vifungo vya ionic. Mabadiliko ya nishati yanayohusiana na dhamana hii inategemea michakato mitatu kuu:
- ionization ya Na na kukubalika kwa elektroni kutoka atomi Na kwa atomi ya Cl; na
- Coulomb kivutio cha ions kusababisha (\(\ce{Na^{+}}\)na\(\ce{Cl^{-}}\)).
- Ikiwa ions hupata karibu sana, hurudia kwa sababu ya kanuni ya kutengwa (0.32 eV).
Umbali wa mgawanyo wa usawa ni\(r_0 = 0.236 \text{nm}\).
Suluhisho
Mabadiliko ya nishati yanayohusiana na uhamisho wa elektroni kutoka Na hadi Cl ni 1.52 eV (Equation\ ref {9.1}). Katika mgawanyo wa usawa, atomi ni\(r_0 = 0.236 \text{nm}\) mbali. Nishati ya umeme ya uwezo wa atomi ni
\[\begin{align*} U_{could} &= -\dfrac{ke^2}{r_0} \\[5pt] &= - \dfrac{1.44 \, \text{eV} \cdot nm}{0.236 \,nm} \\[5pt] &= - 6.10 \, \text{eV} . \end{align*} \nonumber \]
Tofauti ya nishati ya jumla inayohusishwa na malezi ya kitengo cha formula ya NaCl ni
\[\begin{align*}E_{form} &= E_{transfer} + U_{coul} + U_{ex} \\[5pt] &= 1.52 \, \text{eV} + (−6.10 eV) + 0.32\, \text{eV} \\[5pt] &= -4.26 eV \end{align*} \nonumber \]
Kwa hiyo, nishati ya dissociation ya homolytic\(\ce{NaCl}\) ni 4.26 eV.
Umuhimu
Kuundwa kwa kitengo cha formula ya NaCl na kuunganisha ionic ni nguvu nzuri. nishati dissociation, au nishati required kutenganisha NaCl kitengo ndani\(Na\) na\(Cl\) atomi ni 4.26 eV, sambamba na Kielelezo\(\PageIndex{1}\).
Kwa nini nishati inayohusishwa na kanuni ya kutengwa chanya katika Mfano\(\PageIndex{1}\)?
- Jibu
-
Inalingana na nguvu ya kutisha kati ya elektroni za msingi katika ions.
Kwa nini\(\ce{Na}\) -\(\ce{Cl}\) umbali ni nguvu nzuri kwa mmenyuko huu kutokea?
\[\ce{Na(g) + Cl(g) -> Na^{+}(g) + Cl^{-}(g)} \nonumber \]
- Jibu
-
Hii hutokea wakati umeme uwezo nishati (\(U_{coul}\)) na Pauli repulsion nishati (\(U_{ex}\)) equation nishati kwa ajili ya uhamisho elektroni (\(E_{transfer}\)), ambayo ni 0.941 nm kama kulingana na Kielelezo\(\PageIndex{1}\). Kumbuka kuwa\(U_{ex} \approx 0\) kwa umbali huu.
Kwa ioni ya sodiamu katika kioo cha ionic cha NaCl, usemi wa nishati ya uwezo wa Coulomb\(U_{could}\) lazima ubadilishwe na sababu inayojulikana kama mara kwa mara ya Madelung. Sababu hii inachukua kuzingatia mwingiliano wa ion ya sodiamu na kloridi zote za karibu na ions za sodiamu. Mara kwa mara ya Madelung kwa kioo cha NaCl ni karibu 1.75. Thamani hii inamaanisha umbali wa mgawanyo wa usawa kati\(Na^+\) na\(Cl^-\) ioni za 0.280 nm—kubwa kidogo kuliko kwa NaCl ya diatomiki. Tutarudi kwenye hatua hii tena baadaye.
Covalent vifungo
Katika dhamana ya ionic, elektroni huhamisha kutoka atomi moja hadi nyingine. Hata hivyo, katika dhamana ya covalent, elektroni inashirikiwa kati ya atomi mbili. Utaratibu wa kuunganisha ionic hauwezi kueleza kuwepo kwa molekuli kama vile\(H_2\)\(O_2\), na CO, kwa kuwa hakuna umbali wa kujitenga uliopo ambao nishati hasi ya uwezo wa kivutio ni kubwa zaidi kuliko nishati zinazohitajika kuunda ions. Kuelewa kwa usahihi jinsi molekuli hizo zinaunganishwa kwa covalently hutegemea uelewa wa kina wa mechanics ya quantum ambayo inakwenda zaidi ya chanjo ya kitabu hiki, lakini tutaelezea kwa usahihi utaratibu katika sehemu ifuatayo.
Vifungo vyema vinaweza kueleweka kwa kutumia mfano rahisi wa\(\ce{H_2^{+}}\) molekuli, ambayo ina elektroni moja katika uwanja wa umeme wa protoni mbili. Mfumo huu unaweza kuonyeshwa na elektroni katika vizuri mraba mbili (Kielelezo\(\PageIndex{2}\)). Electroni ni sawa uwezekano wa kupatikana katika kila kisima, hivyo kazi ya wimbi ni ama linganifu au antisymmetric kuhusu hatua katikati ya visima.
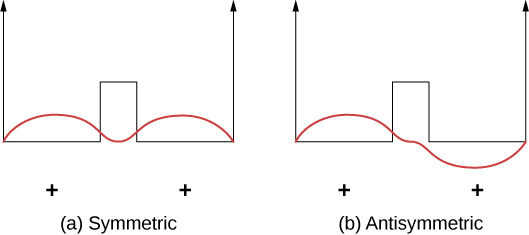
Sasa fikiria kwamba visima viwili vinatenganishwa na umbali mkubwa. Katika hali ya ardhi, kazi ya wimbi ipo katika moja ya majimbo mawili iwezekanavyo: ama kilele chanya (sine wimbi kama “hump”) katika visima vyote (kesi ya ulinganifu), au kilele chanya katika kisima kimoja na kilele hasi kwa upande mwingine (kesi ya antisymmetric). Mataifa haya yana nishati sawa. Hata hivyo, wakati visima vinapoletwa pamoja, kazi ya wimbi la ulinganifu huwa hali ya ardhi na hali ya antisymmetric inakuwa hali ya kwanza ya msisimko —kwa maneno mengine, kiwango cha nishati cha elektroni kinagawanyika. Angalia, hali ya nafasi ya ulinganifu inakuwa hali nzuri sana (chini ya nishati).
Uchambuzi huo unafaa kwa elektroni iliyofungwa na atomi mbili za hidrojeni. Hapa, maumbo ya kazi za wimbi la hali ya ardhi zina fomu\(e^{-r/a_0}\) au\(e^{(-|x|/a_0)}\) kwa mwelekeo mmoja. Hali yenye nguvu nzuri, nafasi-symmetric inamaanisha wiani mkubwa wa malipo katikati ya protoni ambapo elektroni zinaweza kuvuta protoni zenye kushtakiwa pamoja.
Ikiwa elektroni ya pili inaongezwa kwenye mfumo huu ili kuunda\(H_2\) molekuli, kazi ya wimbi lazima ieleze chembe zote mbili, ikiwa ni pamoja na uhusiano wao wa anga na spins jamaa. Kazi hii ya wimbi lazima pia iheshimu kutofautishwa kwa elektroni. (“Kama umeona elektroni moja, umewaona wote.”) Hasa, kubadili au kubadilishana elektroni haipaswi kuzalisha athari inayoonekana, mali inayoitwa ulinganifu wa kubadilishana. Ubadilishaji wa ulinganifu unaweza kuwa ulinganifu, huzalisha hakuna mabadiliko katika kazi ya wimbi, au antisymmetric, huzalisha mabadiliko ya jumla katika ishara ya kazi ya wimbi-wala ambayo inaonekana.
Kama sisi kujadili baadaye, jumla wimbi kazi ya elektroni mbili lazima antisymmetric juu ya kubadilishana. Kwa mfano, elektroni mbili zinazofungwa na molekuli ya hidrojeni zinaweza kuwa katika hali ya msama-ulinganifu na spins antiparallel (↓) au hali ya nafasi ya antisymmetric na spins sambamba (↑). Hali na spins antiparallel ni nguvu nzuri na kwa hiyo kutumika katika bonding covalent. Ikiwa protoni zinavutwa kwa karibu sana, hata hivyo, kupinduliwa kati ya protoni kunakuwa muhimu. (Katika molekuli nyingine, athari hii hutolewa na kanuni ya kutengwa.) Matokeo yake,\(H_2\) hufikia mgawanyo wa usawa wa karibu 0.074 nm na nishati ya kumfunga ni 4.52 eV.
Ziara hii PBS Learning Media mafunzo na simulation maingiliano kuchunguza kuvutia na repulsive vikosi kwamba hatua juu ya chembe atomiki na covalent bonding katika\(H_2\) molekuli.
Mechanics Quantum hujumuisha aina nyingi za molekuli. Kwa mfano, molekuli\(H_3\) haina sumu, kwa sababu kama atomi ya tatu H inakaribia hidrojeni diatomiki, kazi ya wimbi ya elektroni katika atomi hii inaingilia elektroni katika atomi nyingine mbili. Ikiwa elektroni zote tatu ziko katika majimbo ya ardhi ya atomi zao, jozi moja ya elektroni hushiriki namba zote za quantum, ambazo hazizuiliwi na kanuni ya kutengwa. Badala yake, moja ya elektroni inalazimishwa katika hali ya juu ya nishati. Hakuna kujitenga kati ya protoni tatu zilizopo ambazo mabadiliko ya jumla ya nishati ya mchakato huu ni hasi-yaani, ambapo bonding hutokea kwa hiari. Vile vile,\(He_2\) si covalently bonded chini ya hali ya kawaida, kwa sababu atomi hizi hawana elektroni valence kushiriki. Kama atomi zinaletwa pamoja, kazi za wimbi za elektroni za msingi huingiliana, na kwa sababu ya kanuni ya kutengwa, elektroni zinalazimishwa kuwa hali ya juu ya nishati. Hakuna kujitenga kwa ambayo molekuli hiyo ni nzuri sana.
Kuunganisha katika Molekuli za Polyatomiki
Molekuli ya polyatomiki ni molekuli iliyofanywa kwa atomi zaidi ya mbili. Mifano huanzia molekuli rahisi ya maji hadi molekuli tata ya protini. Miundo ya molekuli hizi mara nyingi inaweza kueleweka kwa suala la kuunganisha covalent na hybridization. Hybridization ni mabadiliko katika muundo wa nishati ya atomu ambayo majimbo mchanganyiko (majimbo ambayo yanaweza kuandikwa kama superposition linear ya wengine) kushiriki katika bonding.
Ili kuonyesha mahuluti, fikiria kuunganisha katika molekuli rahisi ya maji,\(H_2O\). Configuration elektroni ya oksijeni ni\(1s^22s^22p^4\). Electroni za 1 na 2 s ziko katika “shells zilizofungwa” na hazishiriki katika kuunganisha. Elektroni nne zilizobaki ni elektroni za valence. Electroni hizi zinaweza kujaza majimbo sita iwezekanavyo (\(l = 1, m = 0, \pm 1\), pamoja na spin juu na chini). Nguvu za majimbo haya ni sawa, hivyo atomi ya oksijeni inaweza kutumia mchanganyiko wowote wa mstari wa majimbo haya kwa kuunganishwa na atomi za hidrojeni. Mchanganyiko huu wa mstari (uliyojifunza juu ya sura ya muundo wa atomiki) huitwa orbitals ya atomiki, na huashiria\(p_x\),\(p_y\), na\(p_z\). Mgawanyo wa malipo ya elektroni kwa orbitals hizi hutolewa katika Kielelezo\(\PageIndex{3}\).
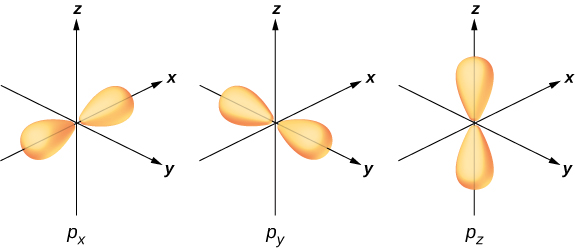
Mabadiliko ya kazi ya wimbi la elektroni ya oksijeni kwa\(p_x, p_y\), na\(p_z\) orbitals mbele ya atomi za hidrojeni ni mfano wa mahuluti. Elektroni mbili zinapatikana katika\(p_z\) orbital na mizunguko ya paired (↓). Elektroni moja inapatikana katika kila moja ya\(p_x\) na\(p_y\) orbitals, na spins unpaired. Orbitals mwisho kushiriki katika bonding na atomi hidrojeni. Kulingana na Kielelezo\(\PageIndex{3}\), tunatarajia angle ya kuunganisha kwa H—O—H kuwa 90°. Hata hivyo, ikiwa tunajumuisha madhara ya kupinduliwa kati ya atomi, angle ya dhamana ni 104.5°. Hoja hizo zinaweza kutumika kuelewa umbo la tetrahedral la methane (\(CH_4\)) na molekuli nyingine.


