8.5: Kanuni ya Kutengwa na Jedwali la Mara kwa mara
- Page ID
- 175602
Mwishoni mwa sehemu hii, utaweza:
- Eleza umuhimu wa kanuni ya kutengwa kwa Pauli kwa uelewa wa muundo wa atomiki na bonding ya Masi
- Eleza muundo wa meza ya mara kwa mara kulingana na nishati ya jumla, kasi ya angular ya orbital, na spin ya elektroni ya mtu binafsi katika atomi
- Eleza usanidi wa elektroni wa atomi katika meza ya mara kwa mara
Hadi sasa, tumejifunza hidrojeni tu, kipengele cha kemikali rahisi zaidi. Tumegundua kwamba elektroni katika atomi ya hidrojeni inaweza kutajwa kabisa na namba tano za quantum:
- \(n\):nambari kuu ya quantum
- \(l\): angular kasi quantum idadi
- \(m\): angular kasi makadirio quantum idadi
- \(s\): spin idadi quantum
- \(m_s\): spin makadirio quantum idadi
Ili kujenga hali ya ardhi ya atomi ya elektroni mbalimbali ya neutral, fikiria kuanzia na kiini cha chaji Ze (yaani kiini cha namba atomia Z) halafu uongeze elektroni Z moja kwa moja. Fikiria kwamba kila elektroni huenda katika uwanja wa umeme wa spherically symmetrical zinazozalishwa na kiini na elektroni nyingine zote za atomu. Dhana ni halali kwa sababu elektroni ni kusambazwa nasibu kuzunguka kiini na kuzalisha wastani umeme shamba (na uwezo) kwamba ni spherically symmetrical. Uwezo wa umeme U (r) kwa kila elektroni haufuati\(-1/r\) fomu rahisi kwa sababu ya mwingiliano kati ya elektroni, lakini inageuka kuwa bado tunaweza kuandika kila hali ya elektroni binafsi kwa namba za quantum, (\(n,l,m,s,m_s\)). (Nambari ya quantum ya spin\(s\) ni sawa kwa elektroni zote, hivyo haitumiwi katika sehemu hii.)
Muundo na tabia za kemikali za atomi zinaelezewa kwa sehemu na kanuni ya kutengwa kwa Pauli: Hakuna elektroni mbili katika atomu zinaweza kuwa na maadili sawa kwa namba zote nne za quantum (\(n,l,m,m_s\)). Kanuni hii inahusiana na mali mbili za elektroni: elektroni zote zinafanana (“wakati umeona elektroni moja, umewaona wote”) na zina nusu-muhimu spin (\(s = 1/2\)). Seti za sampuli za namba za quantum kwa elektroni katika atomu zinatolewa katika Jedwali\(\PageIndex{1}\). Sambamba na kanuni ya kutengwa kwa Pauli, hakuna safu mbili za meza zilizo na seti sawa ya namba za quantum.
| \(n\) | \(l\) | \(m\) | \(m_s\) | Ishara ndogo | Idadi ya elektroni: subshell | Idadi ya elektroni: shell |
|---|---|---|---|---|---|---|
| \ (n\)” style="wima align:katikati; "> 1 | \ (l\)” style="wima align:katikati; "> 0 | \ (m\)” style="wima align:katikati; "> 0 | \ (m_s\)” style="wima align:katikati; "> ½ | 1 s | 2 | 2 |
| \ (n\)” style="wima align:katikati; "> 1 | \ (l\)” style="wima align:katikati; "> 0 | \ (m\)” style="wima align:katikati; "> 0 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 2 | \ (l\)” style="wima align:katikati; "> 0 | \ (m\)” style="wima align:katikati; "> 0 | \ (m_s\)” style="wima align:katikati; "> ½ | 2 s | 2 | 8 |
| \ (n\)” style="wima align:katikati; "> 2 | \ (l\)” style="wima align:katikati; "> 0 | \ (m\)” style="wima align:katikati; "> 0 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 2 | \ (l\)” style="wima align:katikati; "> 1 | \ (m\)” style="wima align:katikati; ">—1 | \ (m_s\)” style="wima align:katikati; "> ½ | 2 p | 6 | |
| \ (n\)” style="wima align:katikati; "> 2 | \ (l\)” style="wima align:katikati; "> 1 | \ (m\)” style="wima align:katikati; ">—1 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 2 | \ (l\)” style="wima align:katikati; "> 1 | \ (m\)” style="wima align:katikati; "> 0 | \ (m_s\)” style="wima align:katikati; "> ½ | |||
| \ (n\)” style="wima align:katikati; "> 2 | \ (l\)” style="wima align:katikati; "> 1 | \ (m\)” style="wima align:katikati; "> 0 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 2 | \ (l\)” style="wima align:katikati; "> 1 | \ (m\)” style="wima align:katikati; "> 1 | \ (m_s\)” style="wima align:katikati; "> ½ | |||
| \ (n\)” style="wima align:katikati; "> 2 | \ (l\)” style="wima align:katikati; "> 1 | \ (m\)” style="wima align:katikati; "> 1 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 0 | \ (m\)” style="wima align:katikati; "> 0 | \ (m_s\)” style="wima align:katikati; "> ½ | 3 s | 2 | 18 |
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 0 | \ (m\)” style="wima align:katikati; "> 0 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 1 | \ (m\)” style="wima align:katikati; ">—1 | \ (m_s\)” style="wima align:katikati; "> ½ | 3 p | 6 | |
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 1 | \ (m\)” style="wima align:katikati; ">—1 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 1 | \ (m\)” style="wima align:katikati; "> 0 | \ (m_s\)” style="wima align:katikati; "> ½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 1 | \ (m\)” style="wima align:katikati; "> 0 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 1 | \ (m\)” style="wima align:katikati; "> 1 | \ (m_s\)” style="wima align:katikati; "> ½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 1 | \ (m\)” style="wima align:katikati; "> 1 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 2 | \ (m\)” style="wima align:katikati; ">—2 | \ (m_s\)” style="wima align:katikati; "> ½ | 3 d | 10 | |
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 2 | \ (m\)” style="wima align:katikati; ">—2 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 2 | \ (m\)” style="wima align:katikati; ">—1 | \ (m_s\)” style="wima align:katikati; "> ½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 2 | \ (m\)” style="wima align:katikati; ">—1 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 2 | \ (m\)” style="wima align:katikati; "> 0 | \ (m_s\)” style="wima align:katikati; "> ½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 2 | \ (m\)” style="wima align:katikati; "> 0 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 2 | \ (m\)” style="wima align:katikati; "> 1 | \ (m_s\)” style="wima align:katikati; "> ½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 2 | \ (m\)” style="wima align:katikati; "> 1 | \ (m_s\)” style="wima align:katikati; ">—½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 2 | \ (m\)” style="wima align:katikati; "> 2 | \ (m_s\)” style="wima align:katikati; "> ½ | |||
| \ (n\)” style="wima align:katikati; "> 3 | \ (l\)” style="wima align:katikati; "> 2 | \ (m\)” style="wima align:katikati; "> 2 | \ (m_s\)” style="wima align:katikati; ">—½ |
Electroni zilizo na idadi sawa ya quantum n zinasemekana kuwa katika shell moja, na wale ambao wana thamani sawa ya l wanasemekana kuchukua subshell sawa. Electron katika\(n = 1\) hali ya atomi ya hidrojeni inaashiria 1 s, ambapo tarakimu ya kwanza inaonyesha shell (\(n = 1\)) na barua inaonyesha subshell (\(s,p,d,f,...\)inafanana na\(l = 0,1,2,3,...\)). Electroni mbili katika\(n = 1\) hali zinaashiria kama\(1s^2\), ambapo superscript inaonyesha idadi ya elektroni. Electron katika\(n = 2\) hali na\(l = 1\) inaashiria 2 p. Mchanganyiko wa elektroni mbili katika\(n = 2\) na\(l = 0\) hali, na elektroni tatu katika\(n = 2\) na\(l = 1\) hali imeandikwa kama\(2s^22p^3\), na kadhalika. Uwakilishi huu wa hali ya elektroni huitwa usanidi wa elektroni wa atomi. Maandamano ya elektroni kwa atomi kadhaa yanatolewa katika Jedwali\(\PageIndex{2}\). Electroni katika ganda la nje la atomu huitwa elektroni za valence. Uunganisho wa kemikali kati ya atomi katika molekuli huelezewa na uhamisho na ugawaji wa elektroni za valence.
| Element | Usanidi wa Electron | spin alignment |
|---|---|---|
| H | \(1s^1\) | (↑) |
| Yeye | \(1s^2\) | (↓) |
| Li | \(1s^22s^1\) | (↑) |
| Kuwa | \(1s^22s^2\) | (↓) |
| B | \(1s^22s^22p^1\) | (↓) (↑) |
| C | \(1s^22s^22p^2\) | (↓) (↑) (↑) |
| N | \(1s^22s^22p^3\) | (↓) (↑) (↑) (↑) |
| O | \(1s^22s^22p^4\) | (↓) (↓) (↑) (↑) |
| F | \(1s^22s^22p^5\) | (↓) (↓) (↓) (↑) (↑) |
| Ne | \(1s^22s^22p^6\) | (↓) (↓) (↓) (↓) (↓) |
| Na | \(1s^22s^22p^63s^1\) | (↑) |
| Mg | \(1s^22s^22p^63s^2\) | (↓) |
| Al | \(1s^22s^22p^63s^13p^1\) | (↓) (↑) |
Idadi ya juu ya elektroni katika subshell inategemea thamani ya idadi ya kasi ya angular quantum, l. Kwa kupewa thamani l, kuna\(2l + 1\) orbital angular kasi majimbo. Hata hivyo, kila moja ya majimbo haya yanaweza kujazwa na elektroni mbili (spin up na chini, ↓). Hivyo, idadi kubwa ya elektroni katika subshell ni
\[N = 2(2l + 1) = 4l + 2. \nonumber \]
Katika subshell 2 s (\(l = 0\)), idadi kubwa ya elektroni ni 2. Katika subshell 2 p (\(l = 1\)), idadi kubwa ya elektroni ni 6. Kwa hiyo, idadi ya juu ya elektroni katika\(n = 2\) shell (ikiwa ni pamoja\(l = 0\) na subshells zote mbili na 1) ni\(2 + 6\) au 8. Kwa ujumla, idadi kubwa ya elektroni katika n shell ni\(2n^2\).
Je! Subshells ngapi ziko kwenye\(n = 3\) shell? Tambua kila subshell na uhesabu idadi kubwa ya elektroni ambayo itajaza kila mmoja. Onyesha kwamba idadi kubwa ya elektroni inayojaza atomu ni\(2n^2\).
Mkakati
Subshells imedhamiriwa na thamani ya l; kwa hiyo, sisi kwanza tunaamua maadili gani ya l yanaruhusiwa, na kisha tunatumia equation “idadi kubwa ya elektroni ambayo inaweza kuwa katika a\(subshell = 2(2l + 1\))” ili kupata idadi ya elektroni katika kila subshell.
Suluhisho
Kwa sababu\(n = 3\), tunajua kwamba l inaweza kuwa 0, 1, au 2; hivyo, kuna subshells tatu iwezekanavyo. Katika notation ya kawaida, wao ni lebo 3 s, 3 p, na 3 d subshells. Tumeona kwamba elektroni mbili inaweza kuwa katika hali s, na sita katika hali p, lakini hebu kutumia equation “upeo wa idadi ya elektroni ambayo inaweza kuwa katika
subshell\(= 2(2l + 1)\)” ili kuhesabu idadi ya juu katika kila mmoja:
\(3s\)ina\(l = 0\); hivyo,\(2(2l + 1) = 2(0 + 1) = 2\)
\(3p\)ina\(l = 1\); hivyo,\(2(2l + 1) = 2(2 + 1) = 6\)
\(3d\)ina\(l = 2\); hivyo,\(2(2l + 1) = 2(4 + 1) = 10\)
\(Total = 18\)
(katika\(n = 3\) shell).
Equation “upeo wa idadi ya elektroni ambayo inaweza kuwa katika shell =\(2n^2\)” inatoa idadi ya juu katika\(n = 3\) ganda kuwa
Idadi kubwa ya elektroni\(= 2n^2 = 2(3)^2 = 2(9) = 18\).
Umuhimu
Idadi ya elektroni katika subshells tatu iwezekanavyo ni sawa na formula\(2n^2\). Katika kiwango cha kawaida (spectroscopic),\(n = 3\) shell iliyojaa imeonyeshwa kama\(3s^23p^63d^{10}\). Shells hazijaza kwa njia rahisi. Kabla ya\(n = 3\) shell imejazwa kabisa, kwa mfano, tunaanza kupata elektroni kwenye\(n = 4\) shell.
Muundo wa meza ya mara kwa mara (Kielelezo\(\PageIndex{1}\)) inaweza kueleweka kwa suala la shells na subshells, na hatimaye, nishati ya jumla, kasi ya orbital angular, na spin ya elektroni katika atomi. Majadiliano ya kina ya meza ya mara kwa mara yameachwa kwenye kozi ya kemia-tunachunguza vipengele vyake vya msingi hapa. Katika mjadala huu, tunadhani kwamba atomi hazina upande wowote wa umeme; yaani zina idadi sawa ya elektroni na protoni. (Kumbuka kwamba idadi ya protoni katika kiini cha atomiki inaitwa namba ya atomiki, Z.)
Kwanza, meza ya mara kwa mara inapangwa katika nguzo na safu. Jedwali linasomewa kushoto kwenda kulia na juu hadi chini kwa utaratibu wa kuongeza idadi ya atomiki\(Z\). Atomi ambazo ni za safu moja au kikundi cha kemikali hushiriki mali nyingi za kemikali sawa. Kwa mfano, atomi za Li na Na (katika safu ya kwanza) hufunga kwa atomi nyingine kwa namna hiyo. Mstari wa kwanza wa meza unafanana na shell ya 1 s (\(l = 0\)) ya atomi.
Fikiria utaratibu wa nadharia wa kuongeza elektroni, moja kwa moja, kwa atomi. Kwa hidrojeni (H) (juu kushoto), shell ya 1 s imejaa ama spin juu au chini ya elektroni (↑ au ↓). Elektroni hii pekee inashirikiwa kwa urahisi na atomi nyingine, hivyo hidrojeni inafanya kazi kikemia. Kwa heliamu (Yeye) (juu kulia), shell ya 1 s imejazwa na spin up na spin chini (↓) elektroni. Hii “inajaza” ganda la 1 s, hivyo atomu ya heliamu huelekea kutoshiriki elektroni na atomi nyingine. Atomu ya heliamu inasemekana kuwa haitumiki kemikali, inert, au yenye heshima; vivyo hivyo, gesi ya heliamu inasemekana kuwa gesi ya ajizi au gesi yenye heshima.
Kujenga atomu kwa kuongeza na kutoa protoni, nyutroni, na elektroni. Je! Kipengele, malipo, na mabadiliko ya wingi? Ziara Phet Explorations: Kujenga Atom kuchunguza majibu ya maswali haya.
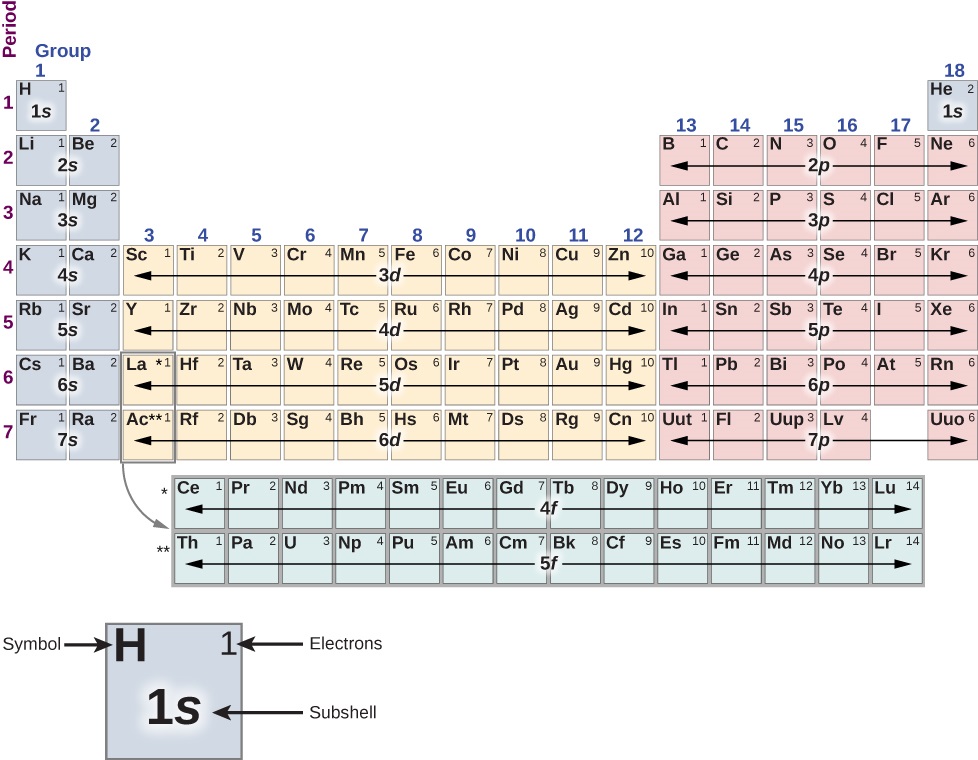
Mstari wa pili unafanana na 2 s na 2 p subshells. Kwa lithiamu (Li) (juu kushoto), shell ya 1 inajazwa na elektroni ya spin-up na spin-down (↓) na shell ya 2 inajazwa na elektroni ya spin-up au -down (↑ au↓). Configuration yake ya elektroni kwa hiyo ni\(1s^22s^1\) au [He] 2 s, ambapo [[Yeye] inaonyesha msingi wa heliamu. Kama hidrojeni, elektroni pekee katika ganda la nje linashirikiwa kwa urahisi na atomi nyingine. Kwa beryllium (Kuwa), shell ya 2 s imejaa elektroni ya spin-up na -down (↓), na ina usanidi wa elektroni [Yeye]\(2s^2\).
Kisha, tunaangalia upande wa kulia wa meza. Kwa boroni (B), shells za 1 na 2 s zinajazwa na shell 2 p (\(l = 1\)) ina ama spin juu au chini ya elektroni (↑ au↓). Kutoka kaboni (C) hadi neon (N), sisi kujaza shell 2 p. Idadi kubwa ya elektroni katika shells 2 p ni\(4l + 2 = 4(2) + 2 = 6\). Kwa neon (Ne), shell ya 1 s imejazwa na elektroni ya spin-up na spin-down (↓), na shell 2 p imejaa elektroni sita (↓). Hii “inajaza” 1 s, 2 s, na 2 p subshells, hivyo kama heliamu, atomi neon huelekea kutoshiriki elektroni na atomi nyingine.
Mchakato wa kujaza elektroni unarudia katika mstari wa tatu. Hata hivyo, kuanzia mstari wa nne, mfano umevunjika. Utaratibu halisi wa utaratibu wa kujaza elektroni hutolewa na
1 s, 2 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s, 4 d, 5 p, 6 s, 4 f, 5 d, 6 p, 7 s,...
Kumbuka kwamba 3 d, 4 d, 4 f, na 5 d subshells (kwa ujasiri) ni kujazwa nje ya utaratibu; hii hutokea kwa sababu ya mwingiliano kati ya elektroni katika atomi, ambayo hadi sasa tuna usahau. Metali ya mpito ni elementi katika pengo kati ya nguzo mbili za kwanza na nguzo sita za mwisho ambazo zina elektroni zinazojaza kifungu cha d (\(l = 1\)). Kama inavyotarajiwa, atomi hizi zinapangwa katika\(4l + 2 = 4(2) + 2 = 10\) nguzo. Mfumo wa meza ya mara kwa mara unaweza kueleweka kwa suala la upimaji wa jumla ya nishati (n), kasi ya angular ya orbital (l), na spin (s). Nguzo mbili za kwanza zinahusiana na sehemu ndogo ya s (\(l = 0\)), nguzo sita zifuatazo zinahusiana na sehemu ndogo ya p (\(l = 1\)), na pengo kati ya nguzo hizi inalingana na subshell d (\(l = 2\)).
Jedwali la mara kwa mara pia linatoa taarifa juu ya kuunganisha Masi. Ili kuona hili, fikiria atomi katika safu ya kushoto zaidi (kinachojulikana kama metali za alkali ikiwa ni pamoja na: Li, Na, na K). Atomi hizi zina elektroni moja katika subshell ya 2 s, ambayo hutolewa kwa urahisi kwa atomi nyingine. Kinyume chake, atomi katika safu ya pili hadi kulia (halojeni: kwa mfano, Cl, F, na Br) ni kiasi stingy katika kugawana elektroni. Atomi hizi zingependelea kukubali elektroni, kwa sababu ni elektroni moja tu yenye aibu ya ganda lililojaa (“ya kuwa mtukufu”).
Kwa hiyo, ikiwa atomu ya Na imewekwa karibu na atomi ya Cl, atomi ya Na huchangia kwa uhuru elektroni yake ya 2 na atomi ya Cl inakubali kwa hamu. Katika mchakato, atomi ya Na (awali ya malipo ya neutral) inakuwa chaji chanya na Cl (awali malipo ya neutral) inakuwa kushtakiwa vibaya. Atomi za kushtakiwa huitwa ions. Katika kesi hii, ions ni\(Na^+\) na\(Cl^-\), ambapo superscript inaonyesha malipo ya ion. Mvuto wa umeme (Coulomb) kati ya atomi hizi huunda molekuli ya NaCl (chumvi). Dhamana ya kemikali kati ya ions mbili inaitwa dhamana ya ionic. Kuna aina nyingi za vifungo vya kemikali. Kwa mfano, katika molekuli ya oksijeni\(O_2\) elektroni zinashirikiwa sawa kati ya atomi. Kuunganishwa kwa atomi za oksijeni ni mfano wa dhamana ya covalent.


