8.6: Spectra ya Atomiki na X-rays
- Page ID
- 175600
Mwishoni mwa sehemu hii, utaweza:
- Eleza ngozi na uchafu wa mionzi kwa suala la viwango vya nishati ya atomiki na tofauti za nishati
- Tumia namba za quantum ili kukadiria nishati, mzunguko, na wavelength ya photons zinazozalishwa na mabadiliko ya atomiki katika atomi nyingi za elektroni
- Eleza dhana za mionzi katika mazingira ya fluorescence ya atomiki na X-rays
Utafiti wa spectra atomiki hutoa maarifa mengi kuhusu atomi. Katika sayansi ya kisasa, spectra ya atomiki hutumiwa kutambua aina za atomi katika vitu mbalimbali, kutoka galaxi za mbali hadi sampuli za damu kwenye eneo la uhalifu.
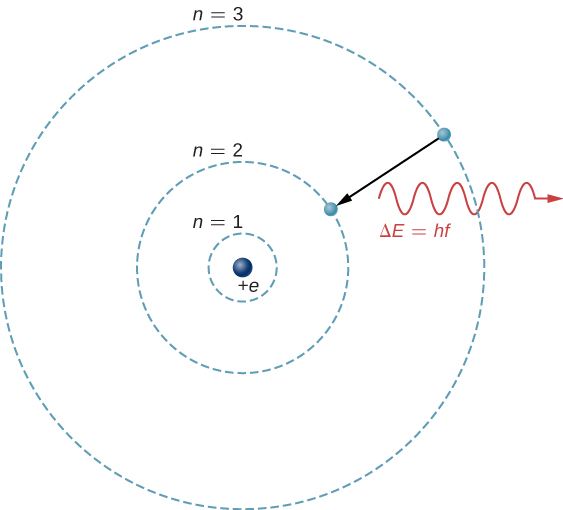
Msingi wa kinadharia wa spectroscopy atomiki ni mpito wa elektroni kati ya viwango vya nishati katika atomi. Kwa mfano, ikiwa elektroni katika atomi ya hidrojeni inafanya mpito kutoka kwenye\(n = 3\)\(n = 2\) shell, atomi hutoa photon yenye wavelength
\[\lambda = \frac{c}{f} = \frac{h \cdot c}{h \cdot f} = \frac{hc}{E_3 - E_2}, \nonumber \]
\(\Delta E = E_3 - E_2\)wapi nishati iliyochukuliwa na photon na\(hc = 1240 \, eV \cdot nm\). Baada ya mionzi hii inapita kupitia spectrometer, inaonekana kama mstari mkali wa spectral kwenye skrini. Mfano wa Bohr wa mchakato huu umeonyeshwa kwenye Kielelezo\(\PageIndex{1}\). Ikiwa elektroni baadaye inachukua photon na nishati\(\Delta E\), elektroni inarudi kwenye\(n = 3\) ganda (tulichunguza mfano wa Bohr hapo awali).
Ili kuelewa mabadiliko ya atomiki katika atomi nyingi za elektroni, ni muhimu kuzingatia madhara mengi, ikiwa ni pamoja na kupinduliwa kwa Coulomb kati ya elektroni na mwingiliano wa ndani wa magnetic (spin-obiti na spin-spin couplings). Kwa bahati nzuri, mali nyingi za mifumo hii zinaweza kueleweka kwa kupuuza mwingiliano kati ya elektroni na kuwakilisha kila elektroni kwa wimbi lake moja la chembe moja\(ψ_{nlm}\).
Mabadiliko ya atomiki yanapaswa kutii sheria za uteuzi. Sheria hizi zinatokana na kanuni za mechanics ya quantum na ulinganifu. Sheria za uteuzi zinaainisha mabadiliko kama ama kuruhusiwa au marufuku. (Mabadiliko yasiyopigwa marufuku hutokea, lakini uwezekano wa mabadiliko ya kawaida ya marufuku ni ndogo sana.) Kwa atomi kama hidrojeni, mabadiliko ya atomiki yanayohusisha mwingiliano wa sumakuumeme (chafu na ngozi ya fotoni) hutii utawala wa uteuzi wafuatayo:
\[\Delta l = \pm 1, \label{select1} \]
ambapo\(l\) inahusishwa na ukubwa wa kasi ya angular orbital,
\[L = \sqrt{l(l + 1)}\hbar. \nonumber \]
Kwa atomi nyingi za elektroni, sheria zinazofanana zinatumika. Ili kuonyesha kanuni hii, fikiria mabadiliko ya atomiki yaliyoonekana katika hidrojeni (H), sodiamu (Na), na zebaki (Hg) (Kielelezo\(\PageIndex{2}\)). Mistari ya usawa katika mchoro huu inalingana na viwango vya nishati ya atomiki, na mabadiliko yanayoruhusiwa na utawala huu wa uteuzi yanaonyeshwa kwa mistari inayotolewa kati ya ngazi hizi. Nguvu za majimbo haya ni juu ya utaratibu wa volts chache za elektroni, na photoni zilizotolewa katika mabadiliko ziko katika aina inayoonekana. Kitaalam, mabadiliko ya atomiki yanaweza kukiuka utawala wa uteuzi, lakini mabadiliko hayo ni ya kawaida.
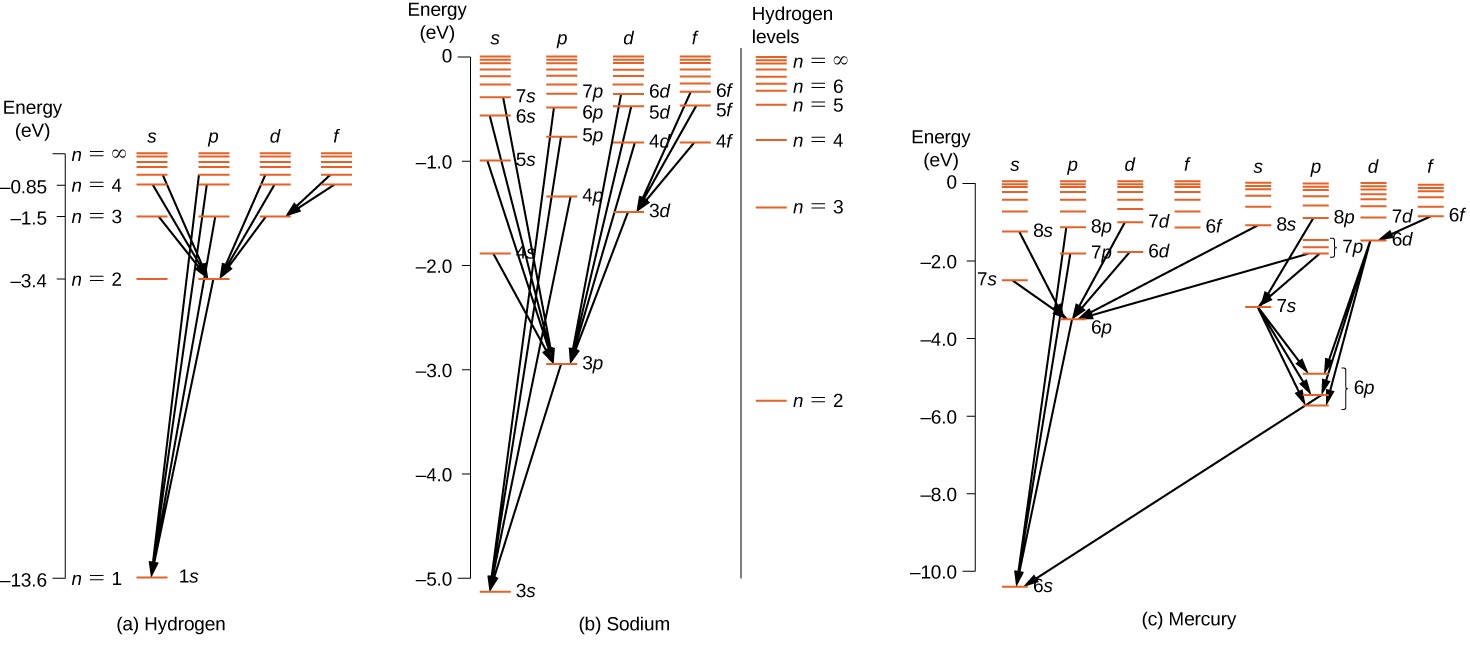
Atomi ya hidrojeni ina mchoro rahisi wa ngazi ya nishati. Kama sisi kupuuza elektroni spin, majimbo yote yenye thamani sawa ya n kuwa sawa jumla ya nishati. Hata hivyo, kuunganisha spin-obiti hugawanya\(n = 2\) majimbo katika majimbo mawili ya kasi ya angular (s na p) ya nguvu tofauti kidogo. (Ngazi hizi si wima makazi yao, kwa sababu kugawanyika nishati ni ndogo mno kuonyesha juu katika mchoro huu.) Vivyo hivyo, kuunganisha spin-obiti hugawanya\(n = 3\) majimbo katika majimbo matatu ya kasi ya angular (s, p, na d).
Mchoro wa kiwango cha nishati kwa hidrojeni ni sawa na sodiamu, kwa sababu atomi zote mbili zina elektroni moja kwenye ganda la nje. Elektroni ya valence ya sodiamu inakwenda katika uwanja wa umeme wa kiini kilichohifadhiwa na elektroni katika shells za ndani, hivyo haipati uwezo rahisi wa 1/ r Coulomb na nishati yake yote inategemea n na l. Kushangaza, zebaki ina michoro mbili tofauti za kiwango cha nishati; michoro hizi zinahusiana na majimbo mawili ya spin ya elektroni zake 6 s (valence).
Wigo wa sodiamu huchambuliwa na spectrometer. Mistari miwili iliyo karibu na wavelengths 589.00 nm na 589.59 nm huzingatiwa.
- Kama doublet sambamba na msisimko (valence) elektroni kwamba mabadiliko kutoka hali fulani msisimko chini ya 3 s hali, nini awali elektroni angular kasi?
- Ni tofauti gani ya nishati kati ya majimbo haya mawili ya msisimko?
Mkakati
Sodiamu na hidrojeni ni ya safu moja au kikundi cha kemikali cha meza ya mara kwa mara, hivyo sodiamu ni “hidrojeni kama.” Electron ya nje katika sodiamu iko katika sehemu ya 3 s (\(l=0\)) na inaweza kuwa na msisimko kwa viwango vya juu vya nishati. Kama kwa hidrojeni, mabadiliko yafuatayo kwa viwango vya chini vya nishati yanapaswa kutii utawala wa uteuzi (Equation\ ref {select1}):
\[\Delta l = \pm 1 \nonumber \]
Tunapaswa kwanza kuamua idadi ya quantum ya hali ya awali ambayo inatimiza utawala wa uteuzi. Kisha, tunaweza kutumia nambari hii kuamua ukubwa wa kasi ya angular ya orbital ya hali ya awali.
Suluhisho
- Mabadiliko ya kuruhusiwa yanapaswa kutii utawala wa uteuzi. Ikiwa idadi ya quantum ya hali ya awali ni\(l = 0\), mpito ni marufuku kwa sababu\(\Delta l = 0\). Ikiwa idadi ya quantum ya hali ya awali ni\(l = 2,3,4,...\) mpito ni marufuku kwa sababu\(\Delta l > 1\). Kwa hiyo, quantum ya hali ya awali lazima iwe\(l=1\). Kasi ya angular ya orbital ya hali ya awali ni\[L = \sqrt{l(l + 1)}\hbar = 1.41 \hbar. \nonumber \]
- Kwa sababu hali ya mwisho ya mabadiliko yote ni sawa (3 s), tofauti katika nguvu za photons ni sawa na tofauti katika nguvu za majimbo mawili ya msisimko. Kutumia equation\[\Delta e = hf = h\left(\frac{c}{\lambda}\right), \nonumber \] tuna\[\begin{align*} E &= hc\left(\frac{1}{\lambda_1} - \frac{1}{\lambda_2}\right) \\[4pt] &=(4.14 \times 10^{-15} eVs)(3.00 \times 10^8 m/s) \times \left(\frac{1}{589.00 \times 10^{-9} m} - \frac{1}{589.59 \times 10^{-9} m}\right) \\[4pt] &= 2.11 \times 10^{-3} eV. \end{align*} \nonumber \]
Umuhimu
Ili kuelewa ugumu wa kupima tofauti hii ya nishati, tunalinganisha tofauti hii na nishati ya wastani ya photons mbili zilizotolewa katika mpito. Kutokana na wavelength wastani wa 589.30 nm, nishati ya wastani ya photons ni
\[E = \frac{hc}{\lambda} = \frac{(4.14 \times 10^{-15} eVs) (3.00 \times 10^8 m/s)}{589.30 \times 10^{-9} m} = 2.11 \, eV. \nonumber \]
Tofauti ya nishati\(\Delta E\) ni karibu 0.1% (sehemu 1 katika 1000) ya nishati hii ya wastani. Hata hivyo, spectrometer nyeti inaweza kupima tofauti.
Atomiki Fluorescence
Fluorescence hutokea wakati elektroni katika atomi inasisimua hatua kadhaa juu ya hali ya ardhi na ngozi ya juu ya nishati ultraviolet (UV) photon. Mara baada ya msisimko, elektroni “de-excites” kwa njia mbili. Electron inaweza kushuka nyuma kwa hali ya ardhi, ikitoa photon ya nishati sawa ambayo ilisisimua, au inaweza kushuka katika mfululizo wa hatua ndogo, ikitoa photoni kadhaa za nishati ya chini. Baadhi ya photons hizi zinaweza kuwa katika aina inayoonekana. Nguo ya fluorescent katika nguo inaweza kufanya rangi kuonekana nyepesi katika jua kwa kubadili mionzi ya UV kuwa mwanga unaoonekana. Taa za fluorescent zinafaa zaidi katika kubadili nishati ya umeme kuwa mwanga unaoonekana kuliko filaments za incandescent (mara nne kama ufanisi). Kielelezo\(\PageIndex{3}\) kinaonyesha nguruwe inayoangazwa na taa ya UV. Protini karibu na uso wa ngozi hutoa mwanga wa bluu wa tabia.

X-rays
Utafiti wa mabadiliko ya nishati ya atomiki hutuwezesha kuelewa eksirei na teknolojia ya X-ray. Kama mionzi yote ya umeme, X-rays hufanywa kwa photoni. Photoni za X-ray zinazalishwa wakati elektroni katika shells za nje za atomu zinashuka kwa shells za ndani. (Atomi za hidrojeni hazitoi X-rays, kwa sababu viwango vya nishati ya elektroni vimewekwa kwa karibu sana ili kuruhusu chafu ya mionzi ya juu-frequency.) Mabadiliko ya aina hii ni kawaida marufuku kwa sababu majimbo ya chini tayari yamejazwa. Hata hivyo, ikiwa shell ya ndani ina nafasi (elektroni ya ndani haipo, labda kutokana na kugongwa na elektroni yenye kasi), elektroni kutoka kwa moja ya maganda ya nje yanaweza kushuka kwa nishati ili kujaza nafasi. Pengo la nishati kwa mpito huo ni kubwa, hivyo wavelength ya photon radiated X-ray ni mfupi.
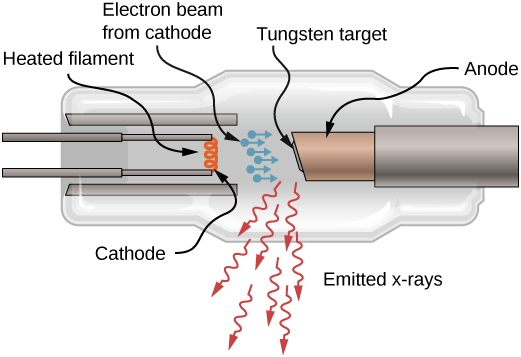
X-rays pia inaweza kuzalishwa na bombarding lengo chuma na elektroni high-nishati, kama inavyoonekana katika Kielelezo\(\PageIndex{4}\). Katika takwimu, elektroni huchemshwa kwenye filament na kuharakishwa na shamba la umeme kwenye lengo la tungsten. Kulingana na nadharia ya classical ya electromagnetism, chembe yoyote ya kushtakiwa inayoharakisha hutoa mionzi. Hivyo, wakati elektroni inapiga lengo la tungsten, na ghafla hupungua, elektroni hutoa mionzi ya kusafisha (mara nyingi neno la Kijerumani linatumika: Bremsstrahlung). Mionzi ya Braking inahusu mionzi inayozalishwa na chembe yoyote ya kushtakiwa ambayo imepungua kwa kati. Katika kesi hii, mionzi ya kuvunja ina masafa ya kuendelea, kwa sababu elektroni zitapigana na atomi za lengo kwa njia tofauti kidogo.
Mionzi ya Braking sio aina pekee ya mionzi inayozalishwa katika mwingiliano huu. Katika baadhi ya matukio, elektroni inagongana na elektroni nyingine ya ndani ya shell ya atomi ya lengo, na hugonga elektroni nje ya mtindo wa mpira wa atomi-billiard. Hali tupu imejaa wakati elektroni katika shell ya juu inapungua ndani ya hali (kushuka kwa kiwango cha nishati) na hutoa photon ya X-ray.
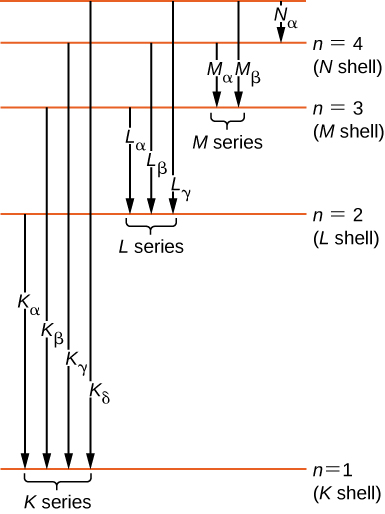
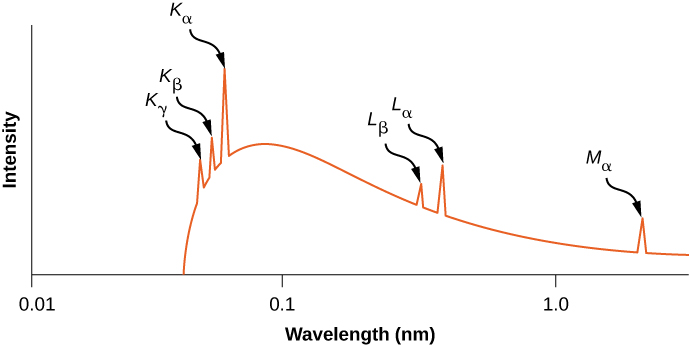
Kwa kihistoria, mistari ya spectral ya X-ray iliandikwa na barua (K, L, M, N,...). Barua hizi zinahusiana na maganda atomia (\(n = 1,2,3,4,...\)). X-rays zinazozalishwa na mpito kutoka shell yoyote ya juu kwa K (\(n = 1\)) shell ni kinachoitwa kama K X-rays. X-rays zinazozalishwa katika mpito kutoka shell L (\(n = 2\)) huitwa\(K_{\alpha}\) X-rays; X-rays zinazozalishwa katika mpito kutoka shell M (\(n = 3\)) huitwa\(K_{\beta}\) X-rays; X-rays zinazozalishwa katika mpito kutoka shell N (\(n = 4\)) huitwa \(K_{\gamma}\)X-rays; na kadhalika. Mabadiliko kutoka kwa makombora ya juu hadi L na M shells yanaandikwa sawa. Mabadiliko haya yanawakilishwa na mchoro wa ngazi ya nishati katika Kielelezo\(\PageIndex{5}\).
Usambazaji wa wavelengths ya X-ray zinazozalishwa na chuma cha kushangaza na boriti ya elektroni hutolewa katika Kielelezo\(\PageIndex{6}\). Mabadiliko ya X-ray katika chuma cha lengo yanaonekana kama kilele juu ya curve ya mionzi ya braking. Mifumo ya photon sambamba na spikes katika usambazaji wa X-ray huitwa masafa ya tabia, kwa sababu yanaweza kutumika kutambua chuma cha lengo. Wavelength mkali wa cutoff (chini ya\(K_{\gamma}\) kilele) inalingana na elektroni ambayo inapoteza nishati yake yote kwa photon moja. Mionzi ya wavelengths fupi ni marufuku na uhifadhi wa nishati.
Tathmini ya nishati ya tabia na mzunguko wa\(K_{\alpha}\) X-ray kwa alumini (\(Z = 13\)).
Mkakati
\(K_{\alpha}\)X-ray huzalishwa na mpito wa elektroni katika shell L (\(n=2\)) kwa shell K (\(n = 1\)). Electron katika shell L “inaona” malipo yenye ufanisi\(Z = 13 - 1 = 12\), kwa sababu elektroni moja katika shell ya K inalinda malipo ya nyuklia. (Kumbuka, elektroni mbili si katika K shell kwa sababu nyingine elektroni hali ni wazi.) Mzunguko wa photon iliyotolewa unaweza kuhesabiwa kutokana na tofauti ya nishati kati ya shells L na K.
Suluhisho
Tofauti ya nishati kati ya shells L na K katika atomi ya hidrojeni ni 10.2 eV. Kwa kuzingatia kwamba elektroni nyingine katika ganda la L au katika shells za juu-nishati hazizuia malipo ya nyuklia, tofauti ya nishati kati ya shells L na K katika atomi na\(Z = 13\) ni takriban
\[\begin{align*} E_{L \rightarrow K} &\approx (Z - 1)^2 (10.2 \, eV) \\[4pt] &\approx (13 - 1)^2(10.2 \, eV) \\[4pt] &\approx 1.47 \times 10^3 eV. \end{align*} \nonumber \]
Kulingana na uhusiano\(f = (\Delta E_{L \rightarrow K})/h\), mzunguko wa X-ray ni
\[f = \frac{1.47 \times 10^3 eV}{4.14 \times 10^{-15} eV \cdot s} = 3.55 \times 10^{17} Hz. \nonumber \]
Umuhimu
Urefu wa X-ray ya kawaida ni 0.1—10 nm. Katika kesi hii, wavelength ni:
\[\lambda = \frac{c}{f} = \frac{3.0 \times 10^8 m/s}{3.55 \times 10^{17} Hz} = 8.5 \times 10^{-10} = 0.85 \, nm. \nonumber \]
Hivyo, mpito L → K katika alumini hutoa mionzi ya X-ray.
Uzalishaji wa X-ray hutoa mtihani muhimu wa mechanics ya quantum. Kwa mujibu wa mfano wa Bohr, nishati ya\(K_{\alpha}\) X-ray inategemea malipo ya nyuklia au namba ya atomiki, Z. Ikiwa Z ni kubwa, vikosi vya Coulomb katika atomi ni kubwa, tofauti za nishati (\(\Delta E\)) ni kubwa, na kwa hiyo, nishati ya photoni za radiated ni kubwa. Ili kuonyesha, fikiria elektroni moja katika atomi nyingi za elektroni. Kupuuza mwingiliano kati ya elektroni, viwango vya nishati vinavyoruhusiwa ni
\[E_n = -\frac{Z^2(13.6 \, eV)}{n^2}, \nonumber \]
ambapo n = 1, 2,... na Z ni idadi ya atomiki ya kiini. Hata hivyo, elektroni katika ganda la L (\(n = 2\)) “inaona” malipo\(Z - 1\), kwa sababu elektroni moja katika shell ya K inalinda malipo ya nyuklia. (Kumbuka kwamba kuna elektroni moja tu katika shell K kwa sababu elektroni nyingine ilikuwa “imefungwa.”) Kwa hiyo, nguvu za takriban za elektroni katika shells L na K ni
\[E_L \approx - \frac{(Z - 1)^2(13.6 \, eV)}{2^2} \nonumber \]
\[E_K \approx - \frac{(Z - 1)^2(13.6 \, eV)}{1^2}. \nonumber \]
Nishati iliyochukuliwa na photon katika mpito kutoka shell L hadi shell K ni hivyo
\[ \begin{align*} \Delta E_{L \rightarrow K} &= (Z - 1)^2 (13.6 \, eV)\left(\frac{1}{1^2} - \frac{1}{2^2} \right) \\[4pt] &= (Z - 1)^2 (10.2 \, eV), \end{align*} \nonumber \]
ambapo Z ni namba atomiki. Kwa ujumla, nishati ya photon ya X-ray kwa mpito kutoka shell ya nje hadi shell K ni
\[E_{L\rightarrow K} = hf = constant \times (Z - 1)^2, \nonumber \]
au
\[(Z - 1) = constant \sqrt{f}, \nonumber \]
\(f\)wapi mzunguko wa\(K_{\alpha}\) X-ray. Ulinganisho huu ni sheria ya Moseley. Kwa thamani kubwa ya\(Z\), tuna takriban
\[Z \approx constant \sqrt{f}. \nonumber \]
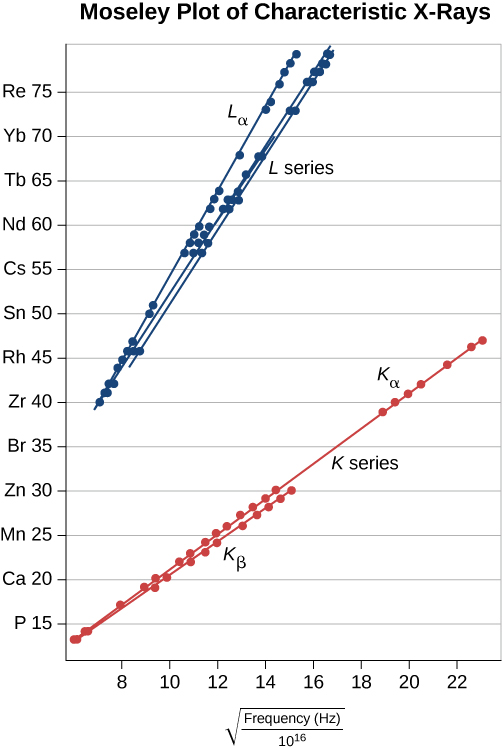
Utabiri huu unaweza kuchunguzwa kwa kupima\(f\) kwa malengo mbalimbali ya chuma. Mfano huu unasaidiwa ikiwa njama ya Z dhidi ya\(\sqrt{f}\) data (inayoitwa njama ya Moseley) ni ya mstari. Kulinganisha utabiri wa mfano na matokeo ya majaribio, kwa mfululizo wa K na L, umeonyeshwa kwenye Mchoro\(\PageIndex{7}\). Data inasaidia mfano kwamba X-rays huzalishwa wakati elektroni ya nje ya shell inapungua kwa nishati ili kujaza nafasi katika shell ya ndani.
X-rays huzalishwa na bombarding lengo la chuma na elektroni za juu-nishati. Ikiwa lengo linabadilishwa na mwingine na mara mbili namba ya atomiki, ni nini kinachotokea kwa mzunguko wa X-rays?
- Jibu
-
quadruples ya mzunguko
Tumia nishati ya takriban ya\(K_{\alpha}\) X-ray kutoka anode ya tungsten kwenye tube ya X-ray.
Mkakati
Electroni mbili huchukua shell iliyojaa K. Nafasi katika shell hii ingeondoka elektroni moja, hivyo malipo ya ufanisi kwa elektroni katika shell L itakuwa Z - 1 badala ya Z. Kwa tungsten, Z = 74, hivyo malipo ya ufanisi ni 73. Nambari hii inaweza kutumika kuhesabu tofauti ya kiwango cha nishati kati ya shells L na K, na kwa hiyo, nishati iliyochukuliwa na photon katika mpito L → K.
Suluhisho
Z ufanisi ni 73, hivyo nishati ya\(K_{\alpha}\) X-ray hutolewa na
\[E_{K_{\alpha}} = \Delta E = E_i - E_f = E_2 - E_1, \nonumber \]
wapi
\[E_1 = - \frac{Z^2}{1^2}E_0 = - \frac{73^2}{1}(13.6 \, eV) = - 72.5 \, keV \nonumber \]
na
\[E_2 = - \frac{Z^2}{2^2}E_0 = - \frac{73^2}{4}(13.6 \, eV) = -18.1 \, keV. \nonumber \]
Hivyo,
\[E_{K_{\alpha}} = - 18.1 \, keV - (- 72.5 \, keV) = 54.4 \, keV. \nonumber \]
Umuhimu
Nishati hii kubwa ya photon ni ya kawaida ya X-rays. X-ray nguvu kuwa kuendelea kubwa kwa ajili ya mambo nzito kwa sababu nishati yao kuongezeka takriban kama\(Z^2\). Voltage ya kasi ya volts zaidi ya 50,000 inahitajika “kubisha nje” elektroni ya ndani kutoka atomi ya tungsten.
Teknolojia ya X-ray
X-rays na maombi mengi, kama vile katika uchunguzi wa matibabu (Kielelezo\(\PageIndex{8}\)), ukaguzi wa mizigo katika viwanja vya ndege (Kielelezo\(\PageIndex{9}\)), na hata kugundua nyufa katika vipengele muhimu vya ndege. Picha za kawaida za X-ray zinatokana na vivuli. Kwa sababu photoni za X-ray zina nishati kubwa, zinapenya vifaa ambavyo ni opaque kwa mwanga unaoonekana. Nishati zaidi na photon ya X-ray ina, nyenzo zaidi huingia. Ya kina cha kupenya ni kuhusiana na wiani wa nyenzo, pamoja na nishati ya photon. Denser nyenzo, picha chache za X-ray hupitia na giza kivuli. X-rays ni bora katika kutambua mapumziko ya mfupa na uvimbe; hata hivyo, overexposure kwa X-rays inaweza kuharibu seli katika viumbe kibiolojia.
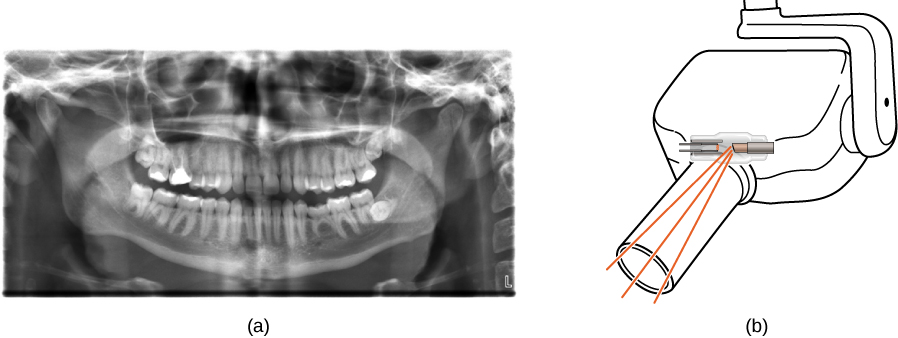

Picha ya kawaida ya X-ray hutoa mtazamo wa pande mbili za kitu. Hata hivyo, katika maombi ya matibabu, mtazamo huu hautoi habari za kutosha ili kutekeleza hitimisho thabiti. Kwa mfano, katika picha mbili-dimensional X-ray ya mwili, mifupa inaweza kwa urahisi kujificha tishu laini au viungo. Scanner ya CAT (computed axial tomography) inashughulikia tatizo hili kwa kukusanya picha nyingi za X-ray katika “vipande” katika mwili wote. Usindikaji kamili wa picha ya kompyuta ya ngozi ya jamaa ya X-rays, kwa njia tofauti, inaweza kuzalisha picha ya kina ya tatu ya X-ray ya mwili.
X-rays pia inaweza kutumika kuchunguza miundo ya atomi na molekuli. Fikiria X-rays tukio juu ya uso wa imara fuwele. Baadhi ya photoni za X-ray zinaonyesha juu ya uso, na wengine huonyesha “ndege” ya atomi chini ya uso. Kuingilia kati ya photons hizi, kwa pembe tofauti za matukio, hutoa picha nzuri kwenye skrini (Kielelezo\(\PageIndex{10}\)). Uingiliano wa X-rays na imara huitwa diffraction ya X-ray. Mfano maarufu zaidi kwa kutumia diffraction ya eksirei ni ugunduzi wa muundo wa mara mbili-helix wa DNA.



