6.5: Mfano wa Bohr wa Atom ya Hidrojeni
- Page ID
- 175363
Mwishoni mwa sehemu hii, utaweza:
- Eleza tofauti kati ya wigo wa ngozi na wigo wa chafu wa mionzi iliyotolewa na atomi
- Eleza majaribio ya foil ya dhahabu ya Rutherford na ugunduzi wa kiini cha atomiki
- Eleza muundo wa atomiki wa hidrojeni
- Eleza postulates ya nadharia ya awali ya quantum kwa atomi ya hidrojeni
- Kufupisha jinsi Bohr quantum mfano wa atomi hidrojeni anaelezea wigo mionzi ya hidrojeni atomiki
Kihistoria, mfano wa Bohr wa atomi ya hidrojeni ni mfano wa kwanza kabisa wa muundo atomia ulioelezea kwa usahihi spectra ya mionzi ya hidrojeni atomia. Mfano huo una nafasi ya pekee katika historia ya fizikia kwa sababu ilianzisha nadharia ya awali ya quantum, ambayo ilileta maendeleo mapya katika mawazo ya kisayansi na baadaye ikafikia kilele katika maendeleo ya mechanics ya quantum. Ili kuelewa maalum ya mfano wa Bohr, lazima kwanza tathmini uvumbuzi wa karne ya kumi na tisa ambayo ilisababisha uundaji wake.
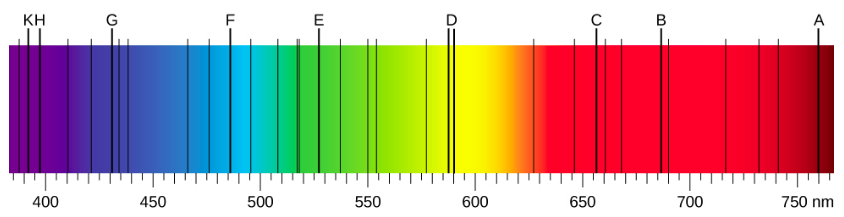
Tunapotumia mche kuchambua mwanga mweupe unaotoka jua, mistari kadhaa ya giza katika wigo wa jua huzingatiwa (Kielelezo\(\PageIndex{1}\)). Mistari ya ngozi ya jua huitwa mistari ya Fraunhofer baada ya Joseph von Fraunhofer, ambaye alipima kwa usahihi wavelengths yao. Wakati wa 1854—1861, Gustav Kirchhoff na Robert Bunsen waligundua kuwa kwa vipengele mbalimbali vya kemikali, wigo wa chafu wa mstari wa kipengele hufanana na wigo wake wa kunyonya mstari. Tofauti kati ya wigo wa ngozi na wigo wa chafu huelezwa kwenye Kielelezo\(\PageIndex{2}\).
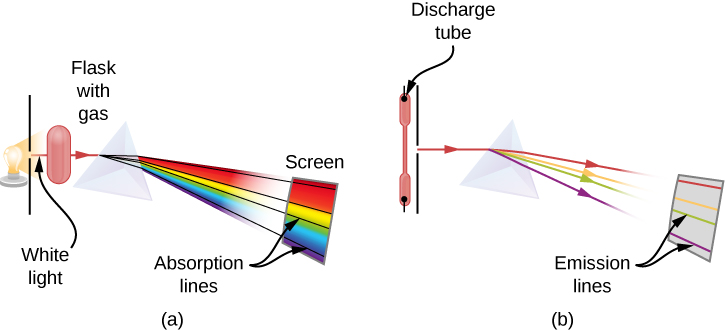
Wigo wa ngozi huzingatiwa wakati mwanga unapita kupitia gesi. Wigo huu unaonekana kama mistari nyeusi ambayo hutokea tu kwa wavelengths fulani kwenye historia ya wigo unaoendelea wa mwanga mweupe (Kielelezo\(\PageIndex{2}\)). Wavelengths kukosa kutuambia ambayo wavelengths ya mionzi ni kufyonzwa na gesi. Wigo wa chafu huzingatiwa wakati mwanga unatolewa na gesi. Wigo huu ni kuonekana kama mistari rangi juu ya background nyeusi (Takwimu\(\PageIndex{3}\) na\(\PageIndex{4}\)). Nafasi za mistari ya uchafu hutuambia ni wavelengths gani za mionzi zinazotolewa na gesi. Kila kipengele cha kemikali kina wigo wake wa chafu. Kwa kila kipengele, nafasi za mistari yake ya uchafu ni sawa na nafasi za mistari yake ya kunyonya. Hii inamaanisha kwamba atomi za elementi maalumu huchukua mionzi tu kwa wavelengths maalum na mionzi isiyo na wavelengths hizi hazipatikani na elementi kabisa. Hii inamaanisha pia kwamba mionzi iliyotolewa na atomi za kila elementi ina wavelengths sawa sawa na mionzi wanayoiingiza.

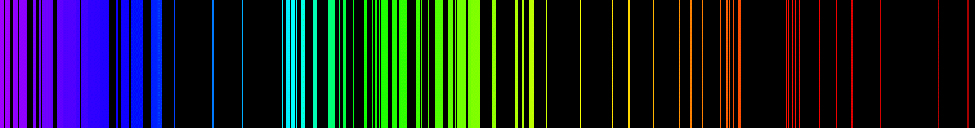
Spectra ya uzalishaji wa elementi ina miundo tata; huwa ngumu zaidi kwa elementi zilizo na namba za atomiki za juu. Wigo rahisi, umeonyeshwa kwenye Mchoro\(\PageIndex{4}\), ni wa atomi ya hidrojeni. Mistari minne tu inayoonekana kwa jicho la mwanadamu. Unaposoma kutoka kulia kwenda kushoto kwenye Mchoro\(\PageIndex{4}\), mistari hii ni: nyekundu (656 nm), inayoitwa\(H-\alpha\) mstari; aqua (486 nm), bluu (434 nm), na violet (410 nm). Mstari wenye wavelengths mfupi kuliko 400 nm huonekana katika sehemu ya ultraviolet ya wigo (Kielelezo\(\PageIndex{4}\), mbali kushoto) na hauonekani kwa jicho la mwanadamu. Kuna mistari mingi isiyoonekana ya spectral katika mfululizo wa hidrojeni.
Fomu ya kimapenzi ya kuelezea nafasi (wavelengths) λ ya mistari ya chafu ya hidrojeni katika mfululizo huu iligunduliwa mwaka 1885 na Johann Balmer. Inajulikana kama formula ya Balmer:
\[ \dfrac{1}{\lambda} = R_H \left( \dfrac{1}{2^2} - \dfrac{1}{n^2}\right). \label{balmer} \]
Mara kwa mara\(R_H = 1.09737 \times 10^7 m^{-1}\) huitwa mara kwa mara ya Rydberg kwa hidrojeni. Katika Equation\ ref {balmer}, n integer chanya inachukua maadili\(n = 3, 4,5,6\) kwa mistari minne inayoonekana katika mfululizo huu. Mfululizo wa mistari ya chafu iliyotolewa na formula ya Balmer inaitwa mfululizo wa Balmer kwa hidrojeni. Mistari mingine ya chafu ya hidrojeni ambayo iligunduliwa katika karne ya ishirini inaelezewa na formula ya Rydberg, ambayo inafupisha data zote za majaribio:
\[ \dfrac{1}{\lambda} = R_H \left( \dfrac{1}{n_f^2} - \dfrac{1}{n_i^2}\right)\label{rydberg} \]
ambapo\(n_i = n_f > n_i\) (katika hatua integer).
Wakati\(n_f = 1\), mfululizo wa mistari ya spectral huitwa mfululizo wa Lyman. Wakati\(n_f = 2\), mfululizo huitwa mfululizo wa Balmer, na katika kesi hii, formula ya Rydberg inafanana na formula ya Balmer (Equation\ ref {balmer}). Wakati\(n_f = 3\), mfululizo huitwa mfululizo wa Paschen. Wakati\(n_f = 4\), mfululizo huitwa mfululizo wa Brackett. Wakati\(n_f = 5\), mfululizo huitwa mfululizo wa Pfund. Wakati\(n_f = 6\), tuna mfululizo wa Humphreys. Kama unaweza kudhani, kuna bendi nyingi za spectral katika wigo wa hidrojeni kwa sababu\(n_f\) inaweza kuwa nambari yoyote nzuri ya integer.
Fomu ya Rydberg ya hidrojeni inatoa nafasi halisi za mistari ya spectral kama zinavyoonekana katika maabara; hata hivyo, mwanzoni mwa karne ya ishirini, hakuna mtu anayeweza kueleza kwa nini ilifanya kazi vizuri. Fomu ya Rydberg ilibakia haijafafanuliwa hadi mfano wa kwanza wa mafanikio wa atomu ya hidrojeni ulipopendekezwa mwaka 1913.
Tumia wavelengths ndefu na fupi zaidi katika mfululizo wa Balmer.
Mkakati
Tunaweza kutumia ama formula ya Balmer (Equation\ ref {balmer}) au formula ya Rydberg (Equation\ ref {rydberg}). wavelength ndefu zaidi hupatikana wakati\(1/n_i\) i ni kubwa, ambayo ni wakati\(n_i = n_f + 1 = 3\),\(n_f = 2\) kwa sababu kwa mfululizo wa Balmer. wavelength ndogo hupatikana wakati\(1/n_i\) ni ndogo, ambayo ni\(1/n_i \rightarrow 0\) wakati\(n_i \rightarrow \infty\).
Suluhisho
Kikomo cha wimbi la muda mrefu:
\[ \dfrac{1}{\lambda} = R_H \left( \dfrac{1}{2^2} - \dfrac{1}{3^2}\right) = (1.09737 \times 10^7) \dfrac{1}{m} \left( \dfrac{1}{4} - \dfrac{1}{9}\right) \Rightarrow \lambda = 656.3 \, nm \nonumber \]
Kikomo cha wimbi la muda mfupi:
\[ \dfrac{1}{\lambda} = R_H \left( \dfrac{1}{2^2} - 0\right) = (1.09737 \times 10^7) \dfrac{1}{m} \left( \dfrac{1}{4} \right) \Rightarrow \lambda = 364.6 \, nm. \nonumber \]
Umuhimu
Kumbuka kuwa kuna mistari mingi ya spectral iliyopo kati ya mipaka hii miwili.
Je! Ni mipaka gani ya mfululizo wa Lyman? Je, unaweza kuona mistari hii ya spectral?
- Jibu
-
121.5 nm na 91.1 nm; hapana, bendi hizi za spectral ziko katika ultraviolet
Funguo la kufungua siri ya spectra ya atomiki ni kuelewa muundo wa atomiki. Wanasayansi wamejulikana kwa muda mrefu jambo hilo linatengenezwa kwa atomi. Kufuatana na sayansi ya karne ya kumi na tisa, atomi ni kiasi kidogo kisichogawanyika cha suala. Imani hii ya kisayansi ilivunjwa na mfululizo wa majaribio yaliyothibitisha kuwepo kwa chembe za subatomiki, kama vile elektroni, protoni, na nyutroni.
Elektroni iligunduliwa na kutambuliwa kama kiasi kidogo cha malipo ya umeme na J.J Thomson mwaka 1897 katika majaribio yake ya ray ya cathode, pia inajulikana kama majaribio β-ray: A β -ray ni boriti ya elektroni. Mwaka 1904, Thomson alipendekeza mfano wa kwanza wa muundo wa atomiki, unaojulikana kama mfano wa “plum pudding”, ambapo atomi ilikuwa na suala lisilojulikana lililochajwa vyema na elektroni hasi zilizoingia ndani yake kama squash katika pudding. Around 1900, E. Rutherford, na kujitegemea, Paul Ulrich Villard, classified mionzi yote inayojulikana wakati huo kama\(\alpha\)\(β\) - rays,\(\gamma\) - rays, na - rays (\(\gamma\)-ray - boriti ya photons juhudi sana). Mnamo mwaka wa 1907, Rutherford na Thomas Royds walitumia mbinu za spectroscopy kuonyesha kwamba chembe zenye chaji chanya\(\alpha\) za\(\alpha\) -mionzi (inayoitwa -particles) ni kweli atomi za ionized mbili za heliamu. Mwaka 1909, Rutherford, Ernest Marsden, na Hans Geiger walitumia\(\alpha\) -chembe katika majaribio yao maarufu ya kutawanya yaliyokataa mfano wa Thomson (tazama Linear Momentum na Migongano).
Katika majaribio ya foil ya dhahabu ya Rutherford (pia inajulikana kama jaribio la Geiger—Marsden), α-chembe zilikuwa tukio kwenye foil nyembamba ya dhahabu na zilitawanyika na atomi za dhahabu ndani ya foil (tazama Aina za migongano). Chembe zinazotoka ziligunduliwa na skrini ya upepo wa 360° inayozunguka shabaha ya dhahabu (kwa maelezo ya kina ya kuanzisha majaribio, angalia Linear Momentum na Migongano). Wakati chembe iliyotawanyika ikampiga skrini, flash ndogo ya mwanga (scintillation) ilionekana mahali hapo. Kwa kuhesabu scintillations kuonekana katika pembe mbalimbali kuhusiana na mwelekeo wa boriti tukio, wanasayansi wanaweza kuamua ni sehemu gani ya chembe tukio walikuwa kutawanyika na ni sehemu gani si deflected kabisa. Ikiwa mfano wa pudding ya plum ulikuwa sahihi, hakutakuwa na chembe za α-zilizotawanyika nyuma. Hata hivyo, matokeo ya majaribio ya Rutherford yalionyesha kuwa, ingawa sehemu kubwa ya α-chembe iliibuka kutoka kwenye foil ambayo haikutawanyika kabisa kama kwamba foil haikuwa katika njia yao, sehemu kubwa ya α-chembe walikuwa nyuma waliotawanyika kuelekea chanzo. Matokeo ya aina hii yaliwezekana tu wakati sehemu kubwa ya masi na chaji chanya chanya yote ya atomi ya dhahabu yalijilimbikizia katika nafasi ndogo ndani ya atomu.
Mwaka 1911, Rutherford alipendekeza mfano wa nyuklia wa atomi. Katika mfano wa Rutherford, atomi ilikuwa na kiini chenye chaji chanya cha ukubwa usio na maana, karibu kama hatua, lakini ilijumuisha karibu molekuli nzima ya atomu. Atomu pia ilikuwa na elektroni hasi zilizokuwepo ndani ya atomu lakini mbali kiasi na kiini. Miaka kumi baadaye, Rutherford aliunda jina protoni kwa kiini cha hidrojeni na jina la neutroni kwa chembe ya nadharia ya elektroniki isiyo na upande wowote ambayo ingeweza kupatanisha kumfunga protoni chanya katika kiini (neutroni iligunduliwa mwaka 1932 na James Chadwick). Rutherford anahesabiwa kwa ugunduzi wa kiini cha atomiki; hata hivyo, mfano wa Rutherford wa muundo wa atomiki hauelezei formula ya Rydberg kwa mistari ya chafu ya hidrojeni.
Mfano wa Bohr wa atomi ya hidrojeni, uliopendekezwa na Niels Bohr mwaka wa 1913, ulikuwa mfano wa kwanza wa quantum ambao ulielezea kwa usahihi wigo wa chafu ya hidrojeni. Mfano wa Bohr unachanganya mitambo ya classical ya mwendo wa sayari na dhana ya quantum ya photons. Mara baada ya Rutherford kuanzisha kuwepo kwa kiini atomiki, Intuition ya Bohr kwamba elektroni hasi katika atomi ya hidrojeni lazima inazunguka kiini chanya ikawa matokeo ya mantiki ya sheria ya umbali wa mraba wa mvuto wa umeme. Kumbuka kwamba sheria ya Coulomb inayoelezea mvuto kati ya mashtaka mawili kinyume ina fomu sawa na sheria ya Newton ya gravitation kwa maana kwamba nguvu ya mvuto na nguvu ya umeme hupungua kama\(1/r^2\), ambapo r ni umbali wa kujitenga kati ya miili . Kwa njia sawa na Dunia inazunguka jua, elektroni hasi katika atomu ya hidrojeni inaweza kuzunguka kiini chanya. Hata hivyo, malipo ya kuharakisha hupunguza nishati yake. Classically, kama elektroni wakiongozwa kuzunguka kiini katika mtindo sayari, itakuwa kufanyiwa centripetal kuongeza kasi, na hivyo itakuwa radiating nishati ambayo kusababisha ni ond chini katika kiini. Atomu hiyo ya hidrojeni ya sayari haiwezi kuwa imara, ambayo ni kinyume na kile tunachokijua kuhusu atomi za kawaida za hidrojeni ambazo hazipatikani. Aidha, mwendo wa classical wa elektroni hauwezi kuelezea wigo wa chafu wa hidrojeni.
Ili kukwepa matatizo haya mawili, Bohr alipendekeza postulates tatu zifuatazo za mfano wa Bohr:
- Elektroni hasi huzunguka kiini chanya (protoni) katika obiti ya mviringo. Njia zote za elektroni zinatokana na kiini. Sio njia zote za kawaida zinazowezekana zinapatikana kwa elektroni iliyofungwa kwenye kiini.
- Njia za elektroni zilizoruhusiwa zinatimiza hali ya kwanza ya quantization: Katika n th obiti, kasi\(L_n\) ya angular ya elektroni inaweza kuchukua maadili tu ya kipekee: Postulate\[L_n = n\hbar, \, where \, n = 1,2,3, . . . \nonumber \] hii inasema kuwa kasi ya angular ya elektroni ni quantized. Imeonyeshwa\(r_n\) na\(v_n\), kwa mtiririko huo, radius ya obiti ya n na kasi ya elektroni ndani yake, hali ya kwanza ya quantization inaweza kuelezwa wazi kama\[m_ev_nr_n = n\hbar. \label{6.34} \]
- Elektroni inaruhusiwa kufanya mabadiliko kutoka obiti moja ambako nishati yake ni\(E_n\) kwa obiti nyingine ambako nishati yake ni\(E_m\). Wakati atomi inachukua photon, elektroni hufanya mpito kwa obiti ya juu-nishati. Wakati atomi ikitoa fotoni, elektroni inapita kwenye obiti ya chini ya nishati. Mabadiliko ya elektroni na ngozi ya photon wakati huo huo au chafu ya photon hufanyika mara moja. Mabadiliko ya elektroni yanayoruhusiwa yanakidhi hali ya pili ya upimaji:\[hf = |E_n - E_m| \nonumber \] wapi\(hf\) nishati ya photon iliyotolewa au iliyoingizwa na mzunguko\(f\). Hali ya pili ya quantization inasema kuwa mabadiliko ya elektroni katika nishati katika atomu ya hidrojeni ni quantized.
Hizi postulates tatu za nadharia ya awali ya quantum ya atomi ya hidrojeni hutuwezesha kupata formula ya Rydberg tu, lakini pia thamani ya mara kwa mara ya Rydberg na mali nyingine muhimu za atomi ya hidrojeni kama vile viwango vyake vya nishati, nishati yake ya ionization, na ukubwa wa mizunguko ya elektroni. Kumbuka kuwa katika mfano wa Bohr, pamoja na mbili nonclassical quantization postulates, sisi pia kuwa na maelezo classical ya elektroni kama chembe kwamba ni wanakabiliwa na nguvu Coulomb, na mwendo wake lazima kutii sheria Newton ya mwendo. Atomi ya hidrojeni, kama mfumo wa pekee, inapaswa kutii sheria za uhifadhi wa nishati na kasi kwa njia tunayojua kutoka kwa fizikia ya kawaida. Kuwa na mfumo huu wa kinadharia katika akili, tuko tayari kuendelea na uchambuzi wetu.
Mizunguko ya elektroni
Ili kupata ukubwa\(r_n\) wa elektroni katika obiti na kasi ya elektroni\(v_n\) ndani yake, tunageuka kwenye mitambo ya Newton. Kama chembe ya kushtakiwa, elektroni hupata kuvuta umeme kuelekea kiini chenye kushtakiwa vyema katikati ya obiti yake ya mviringo. Kuvuta kwa umeme huu ni nguvu ya centripetali inayosababisha elektroni kuhamia kwenye mduara kuzunguka kiini. Kwa hiyo, ukubwa wa nguvu ya centripetal ni kutambuliwa na ukubwa wa nguvu ya umeme:
\[ \dfrac{m_ev_n^2}{r_n} = \dfrac{1}{4\pi \epsilon_0} \dfrac{e^2}{r_n^2}. \label{6.36} \]
Hapa,\(e\) inaashiria thamani ya malipo ya msingi. Electron hasi na proton chanya zina thamani sawa ya malipo,
\[|q| = e. \nonumber \]
Wakati Equation\ ref {6.36} ni pamoja na hali ya kwanza quantization iliyotolewa na Equation\ ref {6.34}, tunaweza kutatua kwa kasi,\(v_n\), na kwa radius,\(r_n\):
\[v_n = \dfrac{1}{4\pi \epsilon_0} \dfrac{e^2}{\hbar} \dfrac{1}{n} \label{6.37} \]
\[r_n = 4\pi \epsilon_0 \dfrac{\hbar^2}{m_ee^2}n^2. \label{6.38} \]
Kumbuka kuwa matokeo haya yanatuambia ya kwamba kasi ya elektroni pamoja na radius ya obiti yake hutegemea tu index n inayoorodhesha obiti kwa sababu kiasi kingine vyote katika equations zilizotangulia ni constants za msingi. Tunaona kutoka Equation\ ref {6.38} kwamba ukubwa wa obiti unakua kama mraba wa n. Hii inamaanisha kuwa obiti ya pili ni mara nne kubwa kama obiti ya kwanza, na obiti ya tatu ni mara tisa kubwa kama obiti ya kwanza, na kadhalika. Pia tunaona kutoka Equation\ ref {6.37} kwamba kasi ya elektroni katika obiti inapungua kadiri ukubwa wa obiti unavyoongezeka. Kasi ya elektroni ni kubwa katika obiti ya kwanza ya Bohr, kwa\(n = 1\), ambayo ni obiti iliyo karibu zaidi na kiini. Radius ya obiti ya kwanza ya Bohr inaitwa Radius ya Bohr ya hidrojeni, iliyoashiria kama\(a_0\). Thamani yake inapatikana kwa kuweka\(n = 1\) katika Equation\ ref {6.38}:
\[a_0 = 4\pi \epsilon_0 \dfrac{\hbar^2}{m_ee^2} = 5.29 \times 10^{-11} m = 0.529\space Å. \nonumber \]
Tunaweza kubadilisha\(a_0\) katika Equation\ ref {6.38} ili kueleza radius ya obiti n th katika suala la\(a_0\):
\[r_n = a_0n^2. \label{6.40} \]
Matokeo haya inamaanisha kuwa njia za elektroni katika atomu ya hidrojeni zinahesabiwa kwa sababu radius orbital inachukua maadili maalum tu ya\(a_0\)\(4a_0\),\(9a_0\),,\(16a_0\)... iliyotolewa na Equation\ ref {6.40}, na hakuna maadili mengine yanaruhusiwa.
Electron nguvu
Nishati\(E_n\) ya jumla ya elektroni katika n ya obiti ni jumla ya nishati yake ya kinetic\(K_n\) na nishati yake ya uwezo wa umeme\(U_n\). Kutumia Equation\ ref {6.37}, tunaona kwamba
\[K_n = \dfrac{1}{2}m_ev_n^2 = \dfrac{1}{32\pi^2 \epsilon^2} \dfrac{m_ee^4}{\hbar^2} \dfrac{1}{n^2}. \label{6.41} \]
Kumbuka kwamba umeme uwezo nishati ya mwingiliano kati ya mashtaka mawili\(q_1\) na\(q_2\) kwamba ni kutengwa na umbali\(r_{12}\) ni\((1/4\pi \epsilon_0)q_1q_2/r_{12}\). Hapa,\(q_1 = +e\) ni malipo ya kiini katika atomi ya hidrojeni (malipo ya protoni),\(q_2 = -e\) ni malipo ya elektroni na\(r_{12} = r_n\) ni radius ya obiti n- th. Sasa tunatumia Equation\ ref {6.38} ili kupata uwezo wa nishati ya elektroni:
\[U_n = - \dfrac{1}{4\pi \epsilon_0} \dfrac{e^2}{r_n} = - \dfrac{1}{16\pi^2 \epsilon_0^2} \dfrac{m_ee^4}{\hbar^2} \dfrac{1}{n^2}. \label{6.42} \]
Nishati ya jumla ya elektroni ni jumla ya Equation\ ref {6.41} na Equation\ ref {6.42}:
\[E_n = K_n + U_n = - \dfrac{1}{32\pi^2 \epsilon_0^2} \dfrac{m_ee^4}{\hbar^2} \dfrac{1}{n^2}. \label{6.43} \]
Kumbuka kuwa nishati inategemea tu index n kwa sababu alama iliyobaki katika Equation\ ref {6.43} ni constants kimwili. Thamani ya sababu ya mara kwa mara katika Equation\ ref {6.43} ni
\[E_0 = \dfrac{1}{32\pi^2 \epsilon_0^2} \dfrac{m_ee^4}{\hbar^2} = \dfrac{1}{8\epsilon_0^2} \dfrac{m_ee^4}{h^2} = 2.17 \times 10^{-18} J = 13.6 \, eV. \label{6.44} \]
Ni rahisi kueleza nishati ya elektroni katika obiti n katika suala la nishati hii, kama
\[E_n = -E_0 \dfrac{1}{n^2}. \label{6.45} \]
Sasa tunaweza kuona kwamba nguvu za elektroni katika atomu ya hidrojeni zinahesabiwa kwa sababu zinaweza kuwa na maadili pekee ya\(-E_0, \, -E_0/4, \, -E_0/9, \, -E_0/16, . . . \) kutolewa na Equation\ ref {6.45}, na hakuna maadili mengine ya nishati yanayoruhusiwa. Seti hii ya nguvu za elektroni za kuruhusiwa inaitwa wigo wa nishati ya hidrojeni (Kielelezo\(\PageIndex{5}\)). Nambari ya n inayoorodhesha viwango vya nishati katika mfano wa Bohr inaitwa nambari ya quantum ya nishati. Tunatambua nishati ya elektroni ndani ya atomu ya hidrojeni na nishati ya atomi ya hidrojeni. Kumbuka kwamba thamani ndogo zaidi ya nishati hupatikana kwa\(n = 1\), hivyo atomu ya hidrojeni haiwezi kuwa na nishati ndogo kuliko ile. Thamani hii ndogo zaidi ya nishati ya elektroni katika atomi ya hidrojeni inaitwa nishati ya hali ya ardhi ya atomi ya hidrojeni na thamani yake ni
\[E_1 = −E_0 = −13.6 \, eV. \label{6.46} \]
Atomu ya hidrojeni inaweza kuwa na nguvu nyingine ambazo ni za juu kuliko hali ya ardhi. Majimbo haya ya juu ya nishati yanajulikana kama majimbo ya nishati ya msisimko ya atomi ya hidrojeni.
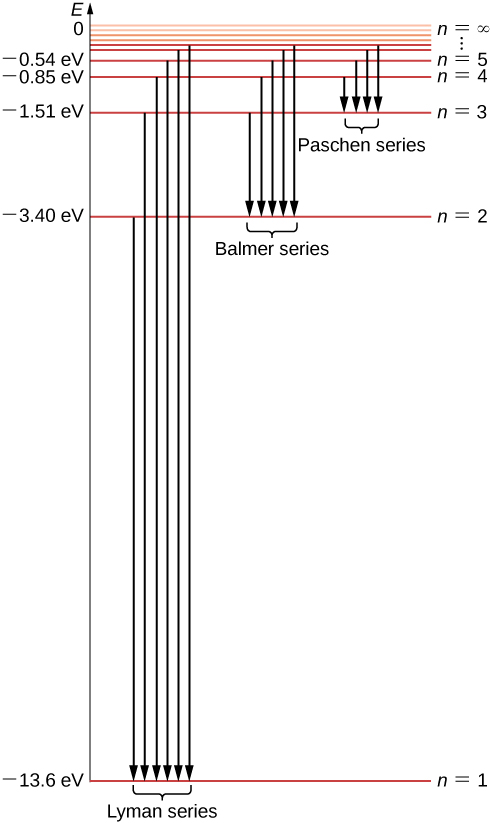
Kuna hali moja tu ya ardhi, lakini kuna majimbo mengi ya msisimko kwa sababu kuna maadili mengi sana ya n katika Equation\ ref {6.45}. Tunasema kuwa elektroni iko katika “hali ya kwanza iliyotoka” wakati nishati yake ni\(E_n\) (wakati\(n = 2\)), hali ya pili ya msisimko wakati nishati yake ni\(E_3\) (wakati\(n = 3\)) na, kwa ujumla, katika hali ya kutolewa wakati nishati yake ni\(E_n + 1\). Hakuna hali ya juu-ya-yote msisimko; Hata hivyo, kuna kikomo kwa mlolongo wa nchi msisimko. Kama sisi kuendelea kuongezeka\(n\) katika Equation\ ref {6.45}, tunaona kwamba kikomo ni\(- lim_{n \rightarrow \infty} \, E_0/n^2 = 0\). Katika kikomo hiki elektroni haifungwa tena na kiini lakini inakuwa elektroni huru. Elektroni inabaki imefungwa katika atomu ya hidrojeni kadiri nishati yake ni hasi. Electroni inayozunguka kiini katika obiti ya kwanza ya Bohr, karibu na kiini, iko katika hali ya ardhi, ambapo nishati yake ina thamani ndogo zaidi. Katika hali ya ardhi elektroni inafungwa sana na kiini na nishati yake inatolewa na Equation\ ref {6.46}. Kama tunataka kuondoa elektroni hii kutoka atomi, ni lazima ugavi kwa nishati ya kutosha\(E_{\infty}\), angalau kusawazisha nje hali yake ya ardhi nishati\(E_1\):
\[E_{\infty} + E_1 = 0 \Rightarrow E_{\infty} = - E_1 = - (- E_0) = E_0 = 13.6 \, eV. \label{6.47} \]
Nishati inayohitajika ili kuondoa elektroni kutoka kwa atomi inaitwa nishati ya ionization. Nishati ya ionization\(E_{\infty}\) inayohitajika ili kuondoa elektroni kutoka obiti ya kwanza ya Bohr inaitwa kikomo cha ionization cha atomi ya hidrojeni. Kikomo cha ionization katika Equation\ ref {6.47} ambacho tunapata katika mfano wa Bohr kinakubaliana na thamani ya majaribio.
Mistari ya Utoaji wa Spectral ya H
Ili kupata wavelengths ya mionzi iliyotolewa wakati elektroni inafanya mpito kutoka obiti ya n- th hadi obiti ya m -th, tunatumia pili ya hali ya quantization ya Bohr na Equation\ ref {6.45} kwa nguvu. Utoaji wa nishati kutoka kwa atomi unaweza kutokea tu wakati elektroni inafanya mpito kutoka hali ya msisimko hadi hali ya chini ya nishati. Katika kipindi cha mpito huo, photon iliyotolewa huchukua tofauti ya nguvu kati ya nchi zinazohusika katika mpito. Mpito hauwezi kwenda katika mwelekeo mwingine kwa sababu nishati ya fotoni haiwezi kuwa hasi, ambayo ina maana kwamba kwa chafu lazima tuwe\(E_n > E_m\) na\(n > m\). Kwa hiyo, ya tatu ya postulates Bohr inatoa
\[\begin{align} hf &= |E_n - E_m| \nonumber \\[4pt] &= E_n - E_m \nonumber \\[4pt] &= -E_0 \dfrac{1}{n^2} + E_m \dfrac{1}{m^2} \nonumber \\[4pt] &= E_0 \left( \dfrac{1}{m^2} - \dfrac{1}{n^2} \right). \label{6.48} \end{align} \]
Sasa tunaelezea nishati ya photon kwa suala la wavelength yake,\(hf = hc/\lambda\), na kugawanya pande zote mbili za Equation\ ref {6.48} na\(hc\). Matokeo yake ni
\[ \dfrac{1}{\lambda} = \dfrac{E_0}{hc} \left( \dfrac{1}{m^2} - \dfrac{1}{n^2} \right). \label{6.49} \]
Thamani ya mara kwa mara katika equation hii ni
\[\dfrac{E_0}{hc} = \dfrac{13.6 \, eV}{(4.136 \times 10^{-15} eV \cdot s)(2.997 \times 10^8 m/s)} = 1.097 \times 10^7 \dfrac{1}{m}. \label{6.50} \]
Thamani hii ni hasa Rydberg mara kwa mara\(R_H\) katika Rydberg heuristic formula Equation\ ref {rydberg}. Kwa kweli, Equation\ ref {6.49} ni sawa na formula Rydberg, kwa sababu kwa m kupewa, tuna\(n = m + 1, \, m + 2, . . .\). Kwa njia hii, mfano wa Bohr quantum wa atomi ya hidrojeni inatuwezesha kupata majaribio ya Rydberg mara kwa mara kutoka kwa kanuni za kwanza na kuelezea kwa suala la vipindi vya msingi. Mabadiliko kati ya njia za elektroni zilizoruhusiwa zinaonyeshwa kwenye Kielelezo\(\PageIndex{5}\).
Tunaweza kurudia hatua zileile zilizosababisha Equation\ ref {6.49} ili kupata wavelength ya mionzi iliyofyonzwa; hii tena inatoa Equation\ ref {6.49} lakini wakati huu kwa nafasi za mistari ya kunyonya katika wigo wa ngozi ya hidrojeni. Tofauti pekee ni kwamba kwa ajili ya ngozi, idadi ya quantum\(m\) ni index ya obiti ulichukua na elektroni kabla ya mpito (chini ya nishati obiti) na idadi ya quantum\(n\) ni index ya obiti ambayo elektroni hufanya mpito (juu-nishati obiti). Tofauti kati ya nguvu za elektroni katika njia hizi mbili ni nishati ya photon iliyoingizwa.
Ikiwa atomi ya hidrojeni katika hali ya ardhi inachukua photon 93.7-nm, inayohusiana na mstari wa mpito katika mfululizo wa Lyman, hii inaathirije nishati na ukubwa wa atomi? Ni kiasi gani cha nishati kinachohitajika ili ionize atomi wakati iko katika hali hii ya msisimko? Kutoa majibu yako katika vitengo kabisa, na kuhusiana na hali ya ardhi.
Mkakati
Kabla ya kunyonya, atomi iko katika hali yake ya ardhi. Hii ina maana kwamba mpito wa elektroni unafanyika kutoka obiti\(m = 1\) hadi baadhi ya juu katika obiti. Kwanza, ni lazima kuamua nn kwa wavelength kufyonzwa\(\lambda = 93.7 \, nm\). Kisha, tunaweza kutumia Equation\ ref {6.45} ili kupata nishati ya hali\(E_n\) ya msisimko na nishati yake ya ionization\(E_{\infty,n}\), na kutumia Equation\ ref {6.40} ili kupata radius\(r_n\) ya atomu katika hali ya msisimko. Ili kukadiria n, tunatumia Equation\ ref {6.49}.
Suluhisho
Mbadala\(m = 1\) na λ = 93.7 nm katika Equation\ ref {6.49} na kutatua kwa n Unapaswa kutarajia kupata jibu kamili la integer kwa sababu ya makosa ya mzunguko, lakini jibu lako litakuwa karibu na integer, na unaweza kukadiria n kwa kuchukua sehemu muhimu ya jibu lako:
\[ \begin{align*} \dfrac{1}{\lambda} &= R_H \left( \dfrac{1}{1^1} - \dfrac{1}{n^2}\right) \\[4pt] \Rightarrow n &= \dfrac{1}{\sqrt{1 - \dfrac{1}{\lambda R_H}}} \\[4pt] &= \dfrac{1}{\sqrt{1 - \dfrac{1}{(93.7 \times 10^{−9}m)(1.097 \times 10^7 m^{−1})}}} \\[4pt] &= 6.07 \\[4pt] \Rightarrow n &= 6. \end{align*} \]
Radi ya\(n = 6\) obiti ni
\[r_n = a_0n^2= a_06^2 = 36a_0 = 36(0.529 \times 10^{−10} \, m) = 19.04 \times 10^{−10}\space m ≅ 19.0 \, Å. \nonumber \]
Hivyo, baada ya kunyonya photon 93.7-nm, ukubwa wa atomi ya hidrojeni katika\(n = 6\) hali ya msisimko ni mara 36 kubwa kuliko kabla ya kunyonya, wakati atomi ilikuwa katika hali ya ardhi. Nishati ya hali ya tano ya msisimko (\(n = 6\)) ni:
\[E_n = - \dfrac{E_0}{n^2} = - \dfrac{E_0}{6^2} = - \dfrac{E_0}{36} = - \dfrac{13.6 \, eV}{36} ≅ − 0.378 \, eV. \nonumber \]
Baada ya kunyonya photon 93.7-nm, nishati ya atomi ya hidrojeni ni kubwa kuliko ilivyokuwa kabla ya kunyonya. Ionization ya atomi wakati iko katika hali ya tano ya msisimko (\(n = 6\)) inahitaji mara 36 chini ya nishati kuliko inahitajika wakati atomi iko katika hali ya ardhi:
\[E_{\infty,6} = -E_6 = -(-0.378 \, eV) = 0.378 \, eV. \nonumber \]
Umuhimu
Tunaweza kuchambua mstari wowote wa spectral katika wigo wa hidrojeni kwa njia ile ile. Hivyo, vipimo vya majaribio ya mistari ya spectral hutupa habari kuhusu muundo wa atomiki wa atomi ya hidrojeni.
Wakati elektroni katika atomi ya hidrojeni iko katika hali ya kwanza ya msisimko, ni utabiri gani ambao mfano wa Bohr hutoa kuhusu kasi yake ya orbital na nishati ya kinetic? Je! Ni ukubwa gani wa kasi yake ya angular ya orbital?
- Jibu
-
\(v_2 = 1.1 \times 10^6 m/s ≅0.0036 \, c;\)
\(L_2 = 2\hbar K_2 = 3.4 \, eV\)
Mfano wa Bohr wa atomi ya hidrojeni pia unatabiri kwa usahihi spectra ya baadhi ya ioni kama hidrojeni. Ioni kama hidrojeni ni atomi za elementi zenye namba atomia Z kubwa kuliko moja (\(Z = 1\)kwa hidrojeni) lakini kwa elektroni zote zinaondolewa isipokuwa moja. Kwa mfano, atomi ya heliamu isiyo na upande wa umeme ina namba atomia\(Z = 2\). Hii ina maana ina elektroni mbili zinazozunguka kiini na chaji ya\(q = +Ze\). Wakati moja ya elektroni zinazozunguka ni kuondolewa kutoka atomi ya heliamu (tunasema, wakati atomi ya heliamu ni wimbo ionized), nini bado ni hidrojeni kama muundo atomiki ambapo elektroni iliyobaki huzunguka kiini na malipo ya\(q = +Ze\). Aina hii ya hali inaelezwa na mfano wa Bohr. Kutokana kwamba malipo ya kiini si\(+e\) lakini\(+Ze\), tunaweza kurudia hatua zote, kuanzia na Equation\ ref {6.36}, ili kupata matokeo ya ioni kama hidrojeni:
\[r_n = \dfrac{a_0}{Z}n^2 \label{6.51} \]
\(a_0\)wapi obiti ya Bohr ya hidrojeni, na
\[E_n = -Z^2E_0 \dfrac{1}{n^2} \label{6.52} \]
\(E_0\)wapi kikomo cha ionization cha atomi ya hidrojeni. Milinganyo hii ni makadirio mazuri kwa muda mrefu kama namba atomia Z si kubwa mno.
Mfano wa Bohr ni muhimu kwa sababu ulikuwa mfano wa kwanza kudai upimaji wa mizunguko ya elektroni katika atomi. Hivyo, inawakilisha nadharia ya awali ya quantum ambayo ilitoa mwanzo wa kuendeleza nadharia ya kisasa ya quantum. Ilianzisha dhana ya namba ya quantum kuelezea majimbo ya atomia. Upeo wa nadharia ya awali ya quantum ni kwamba haiwezi kuelezea atomi ambamo idadi ya elektroni zinazozunguka kiini ni kubwa kuliko moja. Mfano wa Bohr wa hidrojeni ni mfano wa nusu-classical kwa sababu unachanganya dhana classical ya orbits elektroni na dhana mpya ya quantization. Mafanikio ya ajabu ya mfano huu yalisababisha wanafizikia wengi kutafuta maelezo kwa nini mfano huo unapaswa kufanya kazi wakati wote, na kutafuta ufahamu wa fizikia nyuma ya postulates ya nadharia ya mapema ya quantum. Utafutaji huu ulileta mwanzo wa dhana mpya kabisa ya “mawimbi ya jambo.”


