18.8: Ocorrência, preparação e propriedades do fósforo
- Page ID
- 185000
- Descreva as propriedades, a preparação e os usos do fósforo
A preparação industrial do fósforo é através do aquecimento do fosfato de cálcio, obtido da rocha fosfática, com areia e coque:
\[\ce{2Ca3(PO4)2}(s)+\ce{6SiO2}(s)+\ce{10C}(s) \xrightarrow{Δ} \ce{6CaSiO3}(l)+\ce{10CO}(g)+\ce{P4}(g) \nonumber \]
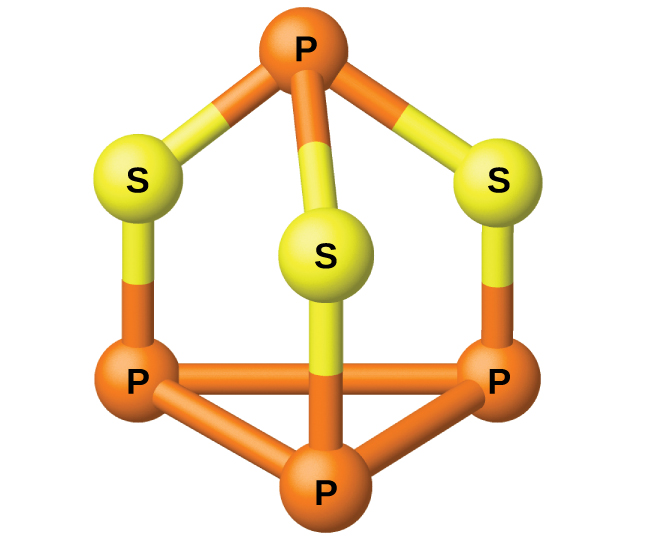
O fósforo é destilado do forno e condensado em um sólido ou queimado para formar P 4 O 10. A preparação de muitos outros compostos de fósforo começa com P 4 O 10. Os ácidos e fosfatos são úteis como fertilizantes e na indústria química. Outros usos são na fabricação de ligas especiais, como ferrofósforo e bronze fosforoso. O fósforo é importante na fabricação de pesticidas, fósforos e alguns plásticos. O fósforo é um não metal ativo. Em compostos, o fósforo geralmente ocorre em estados de oxidação de 3−, 3+ e 5+. O fósforo exibe números de oxidação que são incomuns para um elemento do grupo 15 em compostos que contêm ligações fósforo-fósforo; exemplos incluem tetraidreto de difósforo, H 2 P-PH 2 e trissulfeto de tetrafosforo, P 4 S 3, ilustrado na Figura\(\PageIndex{1}\).
Compostos de fósforo e oxigênio
O fósforo forma dois óxidos comuns, óxido de fósforo (III) (ou hexaóxido de tetrafosforo), P 4 O 6 e óxido de fósforo (V) (ou decaóxido de tetrafosforo), P 4 O 10, ambos mostrados na Figura\(\PageIndex{2}\). O óxido de fósforo (III) é um sólido cristalino branco com odor semelhante ao alho. Seu vapor é muito venenoso. Ele oxida lentamente no ar e inflama quando aquecido a 70 °C, formando P 4 O 10. O óxido de fósforo (III) se dissolve lentamente em água fria para formar ácido fosforoso, H 3 PO 3.
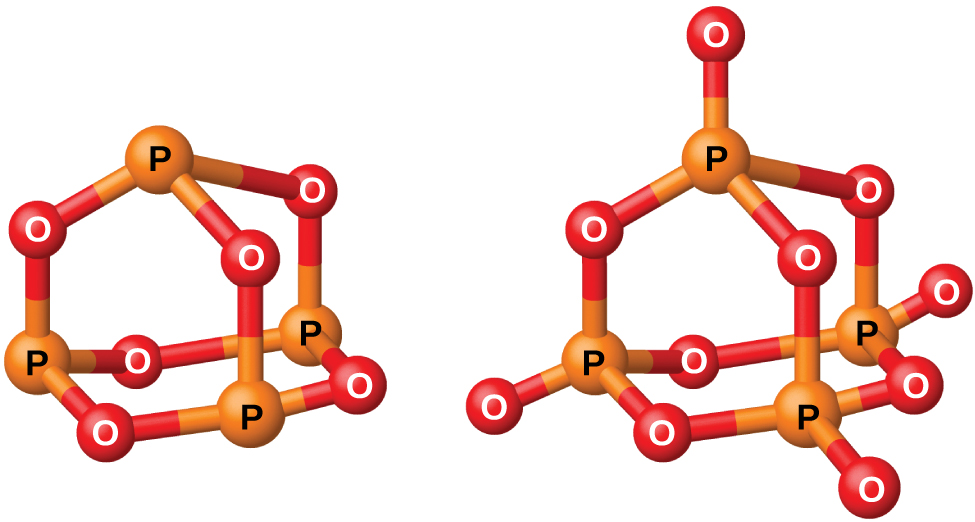
O óxido de fósforo (V), P 4 O 10, é um pó branco que é preparado pela queima de fósforo em excesso de oxigênio. Sua entalpia de formação é muito alta (−2984 kJ) e é bastante estável e um agente oxidante muito pobre. Jogar P 4 O 10 na água produz um som sibilante, calor e ácido ortofosfórico:
\[\ce{P4O10}(s)+\ce{6H2O}(l)⟶\ce{4H3PO4}(aq) \nonumber \]
Devido à sua grande afinidade com a água, o óxido de fósforo (V) é um excelente agente de secagem para gases e solventes e para remover a água de muitos compostos.
Compostos de halogênio de fósforo
O fósforo reagirá diretamente com os halogênios, formando trihaletos, PX 3 e pentahaletos, PX 5. Os trihaletos são muito mais estáveis do que os trihaletos de nitrogênio correspondentes; os pentahaletos de nitrogênio não se formam devido à incapacidade do nitrogênio de formar mais de quatro ligações.
Os cloretos pCl 3 e pCl 5, ambos mostrados na Figura\(\PageIndex{3}\), são os haletos mais importantes do fósforo. O tricloreto de fósforo é um líquido incolor que é preparado pela passagem do cloro sobre o fósforo fundido. O pentacloreto de fósforo é um sólido esbranquiçado que é preparado pela oxidação do tricloreto com excesso de cloro. O pentacloreto sublima quando aquecido e forma um equilíbrio com o tricloreto e o cloro quando aquecido.
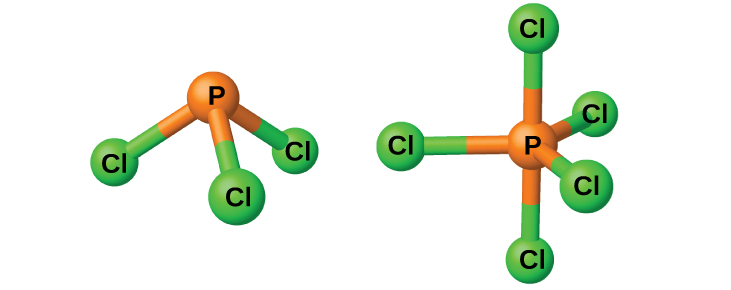
Como a maioria dos outros haletos não metálicos, ambos os cloretos de fósforo reagem com o excesso de água e produzem cloreto de hidrogênio e um oxiácido: pCl 3 produz ácido fosforoso H 3 PO 3 e pCl 5 produz ácido fosfórico, H 3 PO 4.
Os pentahaletos do fósforo são ácidos de Lewis devido aos orbitais vazios de valência d do fósforo. Esses compostos reagem prontamente com íons halogenetos (bases de Lewis) para dar o ânion\(\ce{PX6-}\). Enquanto o pentafluoreto de fósforo é um composto molecular em todos os estados, estudos de raios-X mostram que o pentacloreto de fósforo sólido é um composto iônico\(\ce{[PCl4+][PCl6- ]}\), assim como o pentabrometo de fósforo,\(\ce{[PBr4+]}\) [Br −] e o pentaiodeto de fósforo,\(\ce{[PI4+]}\) [I −].
Resumo
O fósforo (grupo 15) geralmente exibe estados de oxidação de 3− com metais ativos e de 3+ e 5+ com mais não-metais eletronegativos. Os halogênios e o oxigênio oxidarão o fósforo. Os óxidos são óxido de fósforo (V), P 4 O 10 e óxido de fósforo (III), P 4 O 6. Os dois métodos comuns para preparar o ácido ortofosfórico, H 3 PO 4, são a reação de um fosfato com ácido sulfúrico ou a reação da água com o óxido de fósforo (V). O ácido ortofosfórico é um ácido triprótico que forma três tipos de sais.


