18.9: Ocorrência, preparação e compostos de oxigênio
- Page ID
- 184985
- Descreva as propriedades, a preparação e os compostos do oxigênio
- Descreva a preparação, propriedades e usos de alguns óxidos metálicos, peróxidos e hidróxidos representativos
O oxigênio é o elemento mais abundante na crosta terrestre. A superfície da Terra é composta pela crosta, atmosfera e hidrosfera. Cerca de 50% da massa da crosta terrestre consiste em oxigênio (combinado com outros elementos, principalmente silício). O oxigênio ocorre como moléculas de O 2 e, de forma limitada, como moléculas de O 3 (ozônio) no ar. Ele forma cerca de 20% da massa do ar. Cerca de 89% da água em massa consiste em oxigênio combinado. Em combinação com carbono, hidrogênio e nitrogênio, o oxigênio é uma grande parte das plantas e dos animais.
O oxigênio é um gás incolor, inodoro e insípido em temperaturas normais. É um pouco mais denso que o ar. Embora seja apenas ligeiramente solúvel em água (49 mL de gás se dissolvem em 1 L no STP), a solubilidade do oxigênio é muito importante para a vida aquática.
A maior parte do oxigênio isolado comercialmente vem do ar e o restante da eletrólise da água. A separação do oxigênio do ar começa com o resfriamento e a compressão do ar até que ele se liquefaça. À medida que o ar líquido aquece, o oxigênio com seu ponto de ebulição mais alto (90 K) se separa do nitrogênio, que tem um ponto de ebulição mais baixo (77 K). É possível separar os outros componentes do ar ao mesmo tempo com base nas diferenças em seus pontos de ebulição.
O oxigênio é essencial nos processos de combustão, como a queima de combustíveis. Plantas e animais usam o oxigênio do ar na respiração. A administração de ar enriquecido com oxigênio é uma prática médica importante quando um paciente está recebendo um suprimento inadequado de oxigênio devido a choque, pneumonia ou alguma outra doença.
A indústria química emprega oxigênio para oxidar muitas substâncias. Uma quantidade significativa de oxigênio produzida comercialmente é importante na remoção do carbono do ferro durante a produção do aço. Grandes quantidades de oxigênio puro também são necessárias na fabricação de metais e no corte e soldagem de metais com tochas de oxihidrogênio e oxiacetileno.
O oxigênio líquido é importante para a indústria espacial. É um agente oxidante em motores de foguete. É também a fonte de oxigênio gasoso para suporte de vida no espaço.
Como sabemos, o oxigênio é muito importante para a vida. A energia necessária para a manutenção das funções normais do corpo em seres humanos e em outros organismos vem da lenta oxidação de compostos químicos. O oxigênio é o agente oxidante final nessas reações. Em humanos, o oxigênio passa dos pulmões para o sangue, onde se combina com a hemoglobina, produzindo oxiemoglobina. Nessa forma, o sangue transporta o oxigênio para os tecidos, onde é transferido para os tecidos. Os melhores produtos são dióxido de carbono e água. O sangue transporta o dióxido de carbono pelas veias até os pulmões, onde o sangue libera o dióxido de carbono e coleta outro suprimento de oxigênio. A digestão e a assimilação dos alimentos regeneram os materiais consumidos pela oxidação no corpo; a energia liberada é a mesma que se o alimento fosse queimado fora do corpo.
As plantas verdes reabastecem continuamente o oxigênio na atmosfera por meio de um processo chamado fotossíntese. Os produtos da fotossíntese podem variar, mas, em geral, o processo converte dióxido de carbono e água em glicose (um açúcar) e oxigênio usando a energia da luz:
\ [\ begin {alignat} {3}
&\ ce {6CO2} (g)\ :+\: &&\ ce {6H2O} (l)\:\ mathrm {\ underset {light} {
\ xrightarrow {clorofila}}}\: &&\ ce {C6H12O6} (aq)\ :+\:
&&\ ce {C6H12O6} (aq)\ :+\: &&\ ce {C6H12O6} (aq)\ :+\: &&\ ce {C6H12O6} (aq)\ O2} (g)\\
&\ mathrm {carbono\\ dióxido} &&\ ce {água} &&\ ce { glicose} &&\ ce {oxigênio}
\ end {alignat}\ nonumber\]
Assim, o oxigênio que se tornou dióxido de carbono e água pelos processos metabólicos em plantas e animais retorna à atmosfera por fotossíntese.
Quando o oxigênio seco passa entre duas placas eletricamente carregadas, forma-se o ozônio (O 3, ilustrado na Figura\(\PageIndex{1}\)), um alótropo de oxigênio que possui um odor característico. A formação de ozônio a partir do oxigênio é uma reação endotérmica, na qual a energia vem de uma descarga elétrica, calor ou luz ultravioleta:
\[\ce{3O2}(g)\xrightarrow{\ce{electric\: discharge}}\ce{2O3}(g) \hspace{20px} ΔH°=\mathrm{287\: kJ} \nonumber \]
O forte odor associado à faísca de equipamentos elétricos se deve, em parte, ao ozônio.
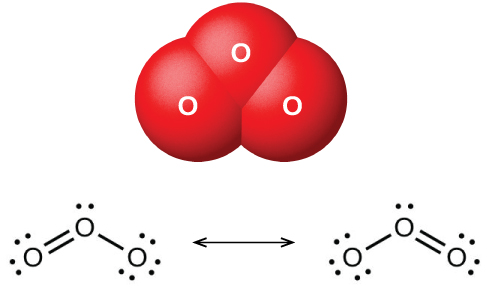
O ozônio se forma naturalmente na alta atmosfera pela ação da luz ultravioleta do sol sobre o oxigênio de lá. A maior parte do ozônio atmosférico ocorre na estratosfera, uma camada da atmosfera que se estende de cerca de 10 a 50 quilômetros acima da superfície da Terra. Esse ozônio atua como uma barreira à luz ultravioleta nociva do sol, absorvendo-a por meio de uma reação de decomposição química:
\[\ce{O3}(g)\xrightarrow{\ce{ultraviolet\: light}}\ce{O}(g)+\ce{O2}(g) \nonumber \]
Os átomos reativos de oxigênio se recombinam com o oxigênio molecular para completar o ciclo do ozônio. A presença de ozônio estratosférico diminui a frequência do câncer de pele e outros efeitos nocivos da radiação ultravioleta. Foi claramente demonstrado que os clorofluorcarbonetos, CFCs (conhecidos comercialmente como Freons), que estavam presentes como propelentes de aerossol em latas de spray e refrigerantes, causaram o esgotamento do ozônio na estratosfera. Isso ocorreu porque a luz ultravioleta também faz com que os CFCs se decomponham, produzindo cloro atômico. Os átomos de cloro reagem com as moléculas de ozônio, resultando na remoção líquida das moléculas de O 3 da estratosfera. Esse processo é explorado em detalhes em nossa cobertura de cinética química. Há um esforço mundial para reduzir a quantidade de CFCs usados comercialmente, e o buraco de ozônio já está começando a diminuir de tamanho à medida que as concentrações atmosféricas de cloro atômico diminuem. Enquanto o ozônio na estratosfera ajuda a nos proteger, o ozônio na troposfera é um problema. Este ozônio é um componente tóxico da poluição fotoquímica.
Os usos do ozônio dependem de sua reatividade com outras substâncias. Pode ser usado como agente branqueador para óleos, ceras, tecidos e amido: oxida os compostos coloridos dessas substâncias em compostos incolores. É uma alternativa ao cloro como desinfetante para água.
Reações
O oxigênio elementar é um forte agente oxidante. Ele reage com a maioria dos outros elementos e muitos compostos.
Reação com elementos
O oxigênio reage diretamente à temperatura ambiente ou em temperaturas elevadas com todos os outros elementos, exceto os gases nobres, os halogênios e alguns metais de transição de segunda e terceira fileiras de baixa reatividade (aqueles com maiores potenciais de redução do que o cobre). A ferrugem é um exemplo da reação do oxigênio com o ferro. Os metais mais ativos formam peróxidos ou superóxidos. Metais menos ativos e não metais produzem óxidos. Dois exemplos dessas reações são:
\[\ce{2Mg}(s)+\ce{O2}(g)⟶\ce{2MgO}(s) \nonumber \]
\[\ce{P4}(s)+\ce{5O2}(g)⟶\ce{P4O10}(s) \nonumber \]
Os óxidos de halogênios, pelo menos um dos gases nobres, e metais com maior potencial de redução do que o cobre não se formam pela ação direta dos elementos com oxigênio.
Reação com compostos
O oxigênio elementar também reage com alguns compostos. Se for possível oxidar qualquer um dos elementos em um determinado composto, pode ocorrer uma oxidação adicional pelo oxigênio. Por exemplo, o sulfeto de hidrogênio, H 2 S, contém enxofre com um estado de oxidação de 2−. Como o enxofre não apresenta seu estado máximo de oxidação, esperaríamos que o H 2 S reagisse com o oxigênio. Sim, produzindo água e dióxido de enxofre. A reação é:
\[\ce{2H2S}(g)+\ce{3O2}(g)⟶\ce{2H2O}(l)+\ce{2SO2}(g) \nonumber \]
Também é possível oxidar óxidos como CO e P 4 O 6 que contêm um elemento com um estado de oxidação mais baixo. A facilidade com que o oxigênio elementar capta elétrons é refletida pela dificuldade de remover elétrons do oxigênio na maioria dos óxidos. Dos elementos, somente o flúor muito reativo pode oxidar óxidos para formar gás oxigênio.
Óxidos, peróxidos e hidróxidos
Os compostos dos metais representativos com oxigênio se dividem em três categorias: (1) óxidos, contendo íons óxido, O 2−; (2) peróxidos, contendo íons peróxidos\(\ce{O2^2-}\), com ligações simples covalentes oxigênio-oxigênio e um número muito limitado de superóxidos, contendo íons superóxido,\(\ce{O2-}\), com ligações covalentes oxigênio-oxigênio que têm uma ordem de ligação de\(\frac{3}{2}\), Além disso, existem (3) hidróxidos, contendo íons hidróxido, OH −. Todos os metais representativos formam óxidos. Alguns dos metais do grupo 2 também formam peróxidos, MO 2, e os metais do grupo 1 também formam peróxidos, M 2 O 2, e superóxidos, MO 2.
Óxidos
É possível produzir os óxidos dos metais mais representativos aquecendo os hidróxidos correspondentes (formando o óxido e a água gasosa) ou carbonatos (formando o óxido e o CO 2 gasoso). As equações, por exemplo, reações são:
\[\ce{2Al(OH)3}(s)\xrightarrow{Δ}\ce{Al2O3}(s)+\ce{3H2O}(g) \nonumber \]
\[\ce{CaCO3}(s)\xrightarrow{Δ}\ce{CaO}(s)+\ce{CO2}(g) \nonumber \]
No entanto, os sais de metais alcalinos geralmente são muito estáveis e não se decompõem facilmente quando aquecidos. Os óxidos de metais alcalinos resultam das reações de redução de oxidação criadas pelo aquecimento de nitratos ou hidróxidos com os metais. As equações para reações de amostra são:
\[\ce{2KNO3}(s)+\ce{10K}(s)\xrightarrow{Δ}\ce{6K2O}(s)+\ce{N2}(g) \nonumber \]
\[\ce{2LiOH}(s)+\ce{2Li}(s)\xrightarrow{Δ}\ce{2Li2O}(s)+\ce{H2}(g) \nonumber \]
Com exceção do óxido de mercúrio (II), é possível produzir os óxidos dos metais dos grupos 2—15 queimando o metal correspondente no ar. O membro mais pesado de cada grupo, o membro para o qual o efeito do par inerte é mais pronunciado, forma um óxido no qual o estado de oxidação do íon metálico é dois a menos do que o estado de oxidação do grupo (efeito de par inerte). Assim, Tl 2 O, PbO e Bi 2 O 3 se formam ao queimar tálio, chumbo e bismuto, respectivamente. Os óxidos dos membros mais leves de cada grupo exibem o estado de oxidação do grupo. Por exemplo, o SnO 2 se forma da queima de estanho. O óxido de mercúrio (II), HgO, se forma lentamente quando o mercúrio é aquecido abaixo de 500° C; ele se decompõe em temperaturas mais altas.
Queimar os membros dos grupos 1 e 2 no ar não é uma forma adequada de formar os óxidos desses elementos. Esses metais são reativos o suficiente para se combinarem com o nitrogênio no ar, então eles formam misturas de óxidos e nitretos iônicos. Vários também formam peróxidos ou superóxidos quando aquecidos no ar.
Todos os óxidos iônicos contêm o íon óxido, um poderoso aceitador de íons de hidrogênio. Com exceção do óxido de alumínio muito insolúvel, Al 2 O 3, estanho (IV), SnO 2 e chumbo (IV), PbO 2, os óxidos dos metais representativos reagem com os ácidos para formar sais. Algumas equações para essas reações são:
\[\ce{Na2O}+\ce{2HNO3}(aq)⟶\ce{2NaNO3}(aq)+\ce{H2O}(l) \nonumber \]
\[\ce{CaO}(s)+\ce{2HCL}(aq)⟶\ce{CaCl2}(aq)+\ce{H2O}(l) \nonumber \]
\[\ce{SnO}(s)+\ce{2HClO4}(aq)⟶\ce{Sn(ClO4)2}(aq)+\ce{H2O}(l) \nonumber \]
Os óxidos dos metais dos grupos 1 e 2 e do óxido de tálio (I) reagem com a água e formam hidróxidos. Exemplos de tais reações são:
\[\ce{Na2O}(s)+\ce{H2O}(l)⟶\ce{NaOH}(aq) \nonumber \]
\[\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(aq) \nonumber \]
\[\ce{Tl2O}(s)+\ce{H2O}(aq)⟶\ce{2TlOH}(aq) \nonumber \]
Os óxidos dos metais alcalinos têm pouca utilidade industrial, ao contrário do óxido de magnésio, óxido de cálcio e óxido de alumínio. O óxido de magnésio é importante na fabricação de tijolos refratários, cadinhos, revestimentos de fornos e isolamento térmico — aplicações que exigem estabilidade química e térmica. O óxido de cálcio, às vezes chamado de cal viva ou cal no mercado industrial, é muito reativo e seus principais usos refletem sua reatividade. O óxido de cálcio puro emite uma luz branca intensa quando aquecido a uma temperatura alta (conforme ilustrado na Figura\(\PageIndex{2}\):). Blocos de óxido de cálcio aquecidos por chamas de gás eram as luzes do palco nos cinemas antes da eletricidade estar disponível. Essa é a fonte da frase “no centro das atenções”.
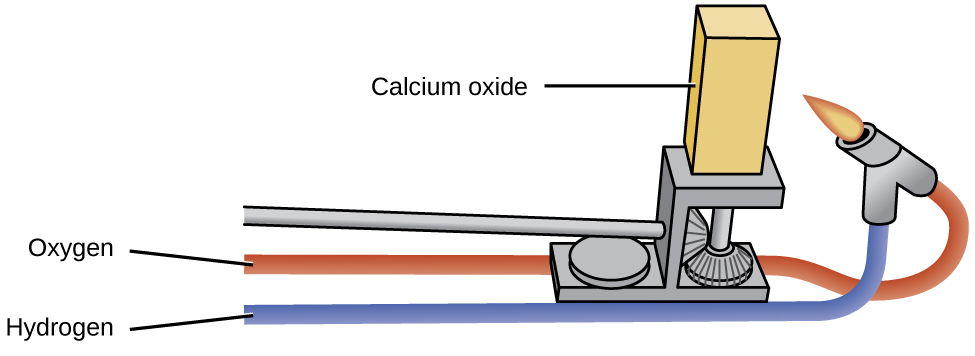
O óxido de cálcio e o hidróxido de cálcio são bases baratas usadas extensivamente no processamento químico, embora a maioria dos produtos úteis preparados a partir deles não contenha cálcio. O óxido de cálcio, CaO, é produzido pelo aquecimento do carbonato de cálcio, CaCO 3, que está amplamente e barato disponível como calcário ou conchas de ostra:
\[\ce{CaCO3}(s)⟶\ce{CaO}(s)+\ce{CO2}(g) \nonumber \]
Embora essa reação de decomposição seja reversível, é possível obter um rendimento de 100% de CaO permitindo que o CO 2 escape. É possível preparar hidróxido de cálcio pela conhecida reação ácido-base de um óxido metálico solúvel com água:
\[\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(s) \nonumber \]
Tanto o CaO quanto o Ca (OH) 2 são úteis como bases; eles aceitam prótons e neutralizam os ácidos.
A alumina (Al 2 O 3) ocorre na natureza como o mineral corindo, uma substância muito dura usada como abrasivo para lixar e polir. O corindo é importante para o comércio de joias como rubi e safira. A cor do rubi se deve à presença de uma pequena quantidade de cromo; outras impurezas produzem a grande variedade de cores possíveis para as safiras. Os rubis e safiras artificiais agora são fabricados pela fusão do óxido de alumínio (ponto de fusão = 2050° C) com pequenas quantidades de óxidos para produzir as cores desejadas e resfriar a massa fundida de forma a produzir cristais grandes. Os lasers de rubi usam cristais sintéticos de rubi.
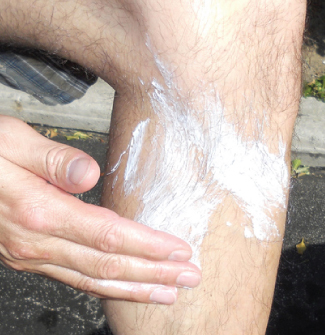
O óxido de zinco, ZnO, era um pigmento de tinta branca útil; no entanto, os poluentes tendem a descolorir o composto. O composto também é importante na fabricação de pneus de automóveis e outros produtos de borracha e na preparação de pomadas medicinais. Por exemplo, protetores solares à base de óxido de zinco, conforme mostrado na Figura\(\PageIndex{3}\), ajudam a evitar queimaduras solares. O óxido de zinco nesses protetores solares está presente na forma de grãos muito pequenos conhecidos como nanopartículas. O dióxido de chumbo é um componente das baterias de armazenamento de chumbo carregadas. O chumbo (IV) tende a reverter para o íon chumbo (II) mais estável ao ganhar dois elétrons, então o dióxido de chumbo é um poderoso agente oxidante.
Peróxidos e superóxidos
Peróxidos e superóxidos são oxidantes fortes e são importantes em processos químicos. O peróxido de hidrogênio, H 2 O 2, preparado a partir de peróxidos metálicos, é um importante alvejante e desinfetante. Os peróxidos e superóxidos se formam quando o metal ou os óxidos metálicos dos grupos 1 e 2 reagem com o oxigênio puro em temperaturas elevadas. O peróxido de sódio e os peróxidos de cálcio, estrôncio e bário se formam aquecendo o metal ou óxido metálico correspondente em oxigênio puro:
\[\ce{2Na}(s)+\ce{O2}(g)\xrightarrow{Δ}\ce{Na2O2}(s) \nonumber \]
\[\ce{2Na2O}(s)+\ce{O2}(g)\xrightarrow{Δ}\ce{2Na2O2}(s) \nonumber \]
\[\ce{2SrO}(s)+\ce{O2}(g)\xrightarrow{Δ}\ce{2SrO2}(s) \nonumber \]
Os peróxidos de potássio, rubídio e césio podem ser preparados aquecendo o metal ou seu óxido em uma quantidade de oxigênio cuidadosamente controlada:
\[\ce{2K}(s)+\ce{O2}(g)⟶\ce{K2O2}(s) \hspace{20px} \mathrm{(2\:mol\: K\: per\: mol\: O_2)} \nonumber \]
Com excesso de oxigênio, os superóxidos KO 2, RbO 2 e CsO 2 se formam. Por exemplo:
\[\ce{K}(s)+\ce{O2}(g)⟶\ce{KO2}(s) \hspace{20px} \ce{(1\: mol\: K\: per\: mol\: O_2)} \nonumber \]
A estabilidade dos peróxidos e superóxidos dos metais alcalinos aumenta à medida que o tamanho do cátion aumenta.
Hidróxidos
Os hidróxidos são compostos que contêm o íon OH −. É possível preparar esses compostos por meio de dois tipos gerais de reações. Os hidróxidos metálicos solúveis podem ser produzidos pela reação do metal ou do óxido metálico com a água. Hidróxidos metálicos insolúveis se formam quando uma solução de um sal solúvel do metal se combina com uma solução contendo íons hidróxido.
Com exceção do berílio e do magnésio, os metais dos grupos 1 e 2 reagem com a água para formar hidróxidos e gás hidrogênio. Exemplos de tais reações incluem:
\[\ce{2Li}(s)+\ce{2H2O}(l)⟶\ce{2LiOH}(aq)+\ce{H2}(g) \nonumber \]
\[\ce{Ca}(s)+\ce{2H2O}(l)⟶\ce{Ca(OH)2}(aq)+\ce{H2}(g) \nonumber \]
No entanto, essas reações podem ser violentas e perigosas; portanto, é preferível produzir hidróxidos metálicos solúveis pela reação do respectivo óxido com a água:
\[\ce{Li2O}(s)+\ce{H2O}(l)⟶\ce{2LiOH}(aq) \nonumber \]
\[\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(aq) \nonumber \]
A maioria dos óxidos metálicos são anidridos básicos. Isso é óbvio para os óxidos solúveis porque eles formam hidróxidos metálicos. A maioria dos outros óxidos metálicos são insolúveis e não formam hidróxidos na água; no entanto, eles ainda são anidridos básicos porque reagem com os ácidos.
É possível preparar os hidróxidos insolúveis de berílio, magnésio e outros metais representativos pela adição de hidróxido de sódio a uma solução de um sal do respectivo metal. As equações iônicas líquidas para as reações envolvendo um sal de magnésio, um sal de alumínio e um sal de zinco são:
\[\ce{Mg^2+}(aq)+\ce{2OH-}(aq)⟶\ce{Mg(OH)2}(s) \nonumber \]
\[\ce{Al^3+}(aq)+\ce{3OH-}(aq)⟶\ce{Al(OH)3}(s) \nonumber \]
\[\ce{Zn^2+}(aq)+\ce{2OH-}(aq)⟶\ce{Zn(OH)2}(s) \nonumber \]
O excesso de hidróxido deve ser evitado ao preparar os hidróxidos de alumínio, gálio, zinco e estanho (II), ou os hidróxidos se dissolverão com a formação dos íons complexos correspondentes:\(\ce{Al(OH)4-}\)\(\ce{Ga(OH)4-}\),\(\ce{Zn(OH)4^2-}\),, e\(\ce{Sn(OH)3-}\) (Figura\(\PageIndex{4}\)). O aspecto importante dos íons complexos para este capítulo é que eles se formam por uma reação ácido-base de Lewis com o metal sendo o ácido de Lewis.

A indústria usa grandes quantidades de hidróxido de sódio como uma base forte e barata. O cloreto de sódio é o material de partida para a produção de NaOH porque o NaCl é um material de partida mais barato que o óxido. O hidróxido de sódio está entre os 10 principais produtos químicos em produção nos Estados Unidos, e essa produção foi quase inteiramente por eletrólise de soluções de cloreto de sódio. Esse processo é o processo de cloro e álcali e é o principal método para a produção de cloro.
O hidróxido de sódio é um composto iônico e derrete sem decomposição. É muito solúvel em água, liberando uma grande quantidade de calor e formando soluções muito básicas: 40 gramas de hidróxido de sódio se dissolvem em apenas 60 gramas de água a 25 °C. O hidróxido de sódio é empregado na produção de outros compostos de sódio e é usado para neutralizar soluções ácidas durante a produção de outros produtos químicos, como petroquímicos e polímeros.
Muitas das aplicações dos hidróxidos são para a neutralização de ácidos (como o antiácido mostrado na Figura\(\PageIndex{5}\)) e para a preparação de óxidos por decomposição térmica. Uma suspensão aquosa de hidróxido de magnésio constitui o leite antiácido da magnésia. Devido à sua disponibilidade imediata (a partir da reação da água com o óxido de cálcio preparado pela decomposição do calcário, CaCO 3), ao baixo custo e à atividade, o hidróxido de cálcio é amplamente utilizado em aplicações comerciais que precisam de uma base forte e barata. A reação de hidróxidos com ácidos apropriados também é usada para preparar sais.

O processo de cloro e álcali
Embora sejam muito diferentes quimicamente, existe uma ligação entre o cloro e o hidróxido de sódio porque há um importante processo eletroquímico que produz os dois produtos químicos simultaneamente. O processo conhecido como processo de cloro e álcali, utiliza cloreto de sódio, que ocorre em grandes depósitos em muitas partes do mundo. Este é um processo eletroquímico para oxidar o íon cloreto em cloro e gerar hidróxido de sódio.
A passagem de uma corrente contínua de eletricidade através de uma solução de NaCl faz com que os íons cloreto migrem para o eletrodo positivo, onde a oxidação em cloro gasoso ocorre quando o íon libera um elétron para o eletrodo:
\[\ce{2Cl-}(aq)⟶\ce{Cl2}(g)+\ce{2e-} \hspace{20px} \textrm{(at the positive electrode)} \nonumber \]
Os elétrons produzidos viajam pelo circuito elétrico externo até o eletrodo negativo. Embora os íons de sódio positivos migrem para esse eletrodo negativo, o sódio metálico não se forma porque os íons de sódio são muito difíceis de reduzir nas condições usadas. (Lembre-se de que o sódio metálico é ativo o suficiente para reagir com a água e, portanto, mesmo se produzido, reagiria imediatamente com a água para produzir íons de sódio novamente.) Em vez disso, as moléculas de água captam elétrons do eletrodo e sofrem redução para formar gás hidrogênio e íons hidróxido:
\[\ce{2H2O}(l)+\ce{2e-}\textrm{ (from the negative electrode)}⟶\ce{H2}(g)+\ce{2OH-}(aq) \nonumber \]
O resultado geral é a conversão da solução aquosa de NaCl em uma solução aquosa de NaOH, Cl 2 gasoso e H 2 gasoso:
\[\ce{2Na+}(aq)+\ce{2Cl-}(aq)+\ce{2H2O}(l)\xrightarrow{\ce{electrolysis}}\ce{2Na+}(aq)+\ce{2OH-}(aq)+\ce{Cl2}(g)+\ce{H2}(g) \nonumber \]
Compostos de oxigênio não metálico
A maioria dos não metais reage com o oxigênio para formar óxidos não metálicos. Dependendo dos estados de oxidação disponíveis para o elemento, uma variedade de óxidos pode se formar. O flúor se combinará com o oxigênio para formar fluoretos como o OF 2, onde o oxigênio tem um estado de oxidação 2+.
Compostos de enxofre e oxigênio
Os dois óxidos comuns de enxofre são dióxido de enxofre, SO 2 e trióxido de enxofre, SO 3. O odor da queima de enxofre vem do dióxido de enxofre. O dióxido de enxofre, mostrado na Figura\(\PageIndex{6}\), ocorre em gases vulcânicos e na atmosfera perto de plantas industriais que queimam combustível contendo compostos de enxofre.
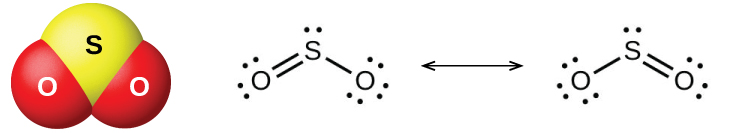
A produção comercial de dióxido de enxofre é proveniente da queima de enxofre ou da torrefação de minérios de sulfeto, como ZnS, FeS 2 e Cu 2 S no ar. (A torrefação, que forma o óxido metálico, é o primeiro passo na separação de muitos metais de seus minérios.) Um método conveniente para preparar o dióxido de enxofre em laboratório é pela ação de um ácido forte nos sais de sulfito contendo o\(\ce{SO3^2-}\) íon ou nos sais de sulfito de hidrogênio que contêm\(\ce{HSO3-}\). O ácido sulfuroso, H 2 SO 3, se forma primeiro, mas se decompõe rapidamente em dióxido de enxofre e água. O dióxido de enxofre também se forma quando muitos agentes redutores reagem com o ácido sulfúrico quente e concentrado. O trióxido de enxofre se forma lentamente ao aquecer o dióxido de enxofre e o oxigênio juntos, e a reação é exotérmica:
\[\ce{2SO2}(g)+\ce{O2}(g)⟶\ce{2SO3}(g) \hspace{20px} ΔH°=\mathrm{−197.8\:kJ} \nonumber \]
O dióxido de enxofre é um gás à temperatura ambiente e a molécula de SO 2 é dobrada. O trióxido de enxofre derrete a 17° C e ferve a 43° C. No estado de vapor, suas moléculas são unidades únicas de SO 3 (Figura\(\PageIndex{7}\)), mas no estado sólido, o SO 3 existe em várias formas poliméricas.
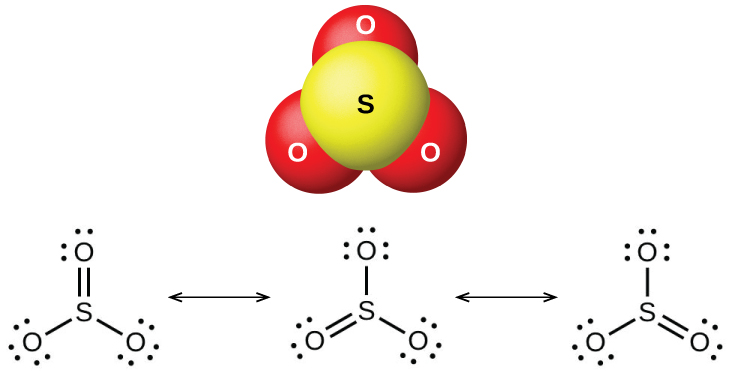
Os óxidos de enxofre reagem como ácidos de Lewis com muitos óxidos e hidróxidos nas reações ácido-base de Lewis, com a formação de sulfitos ou sulfitos de hidrogênio e sulfatos ou sulfatos de hidrogênio, respectivamente.
Compostos de oxigênio halógeno
Os halogênios não reagem diretamente com o oxigênio, mas é possível preparar compostos binários de oxigênio-halogênio pelas reações dos halogênios com compostos contendo oxigênio. Compostos de oxigênio com cloro, bromo e iodo são óxidos porque o oxigênio é o elemento mais eletronegativo nesses compostos. Por outro lado, compostos de flúor com oxigênio são fluoretos porque o flúor é o elemento mais eletronegativo.
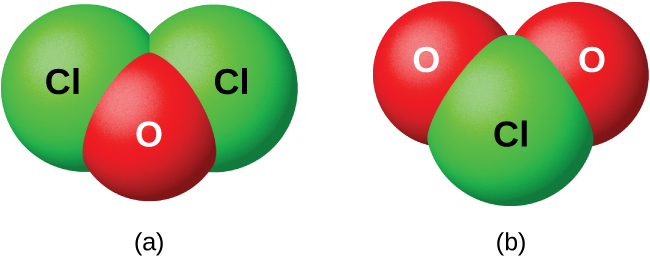
Como classe, os óxidos são extremamente reativos e instáveis, e sua química tem pouca importância prática. O óxido de dicloro, formalmente chamado de monóxido de dicloro, e o dióxido de cloro, ambos mostrados na Figura\(\PageIndex{8}\), são os únicos compostos comercialmente importantes. Eles são importantes como agentes clareadores (para uso com polpa e farinha) e para tratamento de água.
Oxiácidos não metálicos e seus sais
Óxidos não metálicos formam ácidos quando podem reagir com a água; são anidridos ácidos. Os oxiânions resultantes podem formar sais com vários íons metálicos.
Oxiácidos e sais de nitrogênio
O pentóxido de nitrogênio, N 2 O 5 e NO 2 reagem com a água para formar ácido nítrico, HNO 3. Os alquimistas, já no século VIII, conheciam o ácido nítrico (mostrado na Figura\(\PageIndex{9}\)) como aqua fortis (que significa “água forte”). O ácido foi útil na separação do ouro da prata porque dissolve a prata, mas não o ouro. Traços de ácido nítrico ocorrem na atmosfera após tempestades e seus sais são amplamente distribuídos na natureza. Existem enormes depósitos de salitre chileno, NaNo 3, na região desértica, perto da fronteira entre o Chile e o Perú. O salitre de Bengala, KNO 3, ocorre na Índia e em outros países do Extremo Oriente.
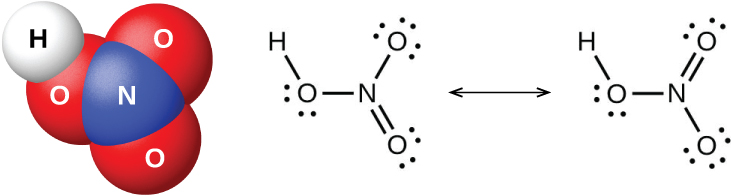
No laboratório, é possível produzir ácido nítrico aquecendo um sal de nitrato (como nitrato de sódio ou potássio) com ácido sulfúrico concentrado:
\[\ce{NaNO3}(s)+\ce{H2SO4}(l)\xrightarrow{Δ}\ce{NaHSO4}(s)+\ce{HNO3}(g) \nonumber \]
O processo O stwald é o método comercial para a produção de ácido nítrico. Esse processo envolve a oxidação da amônia em óxido nítrico, NO; a oxidação do óxido nítrico em dióxido de nitrogênio, NO 2; e posterior oxidação e hidratação do dióxido de nitrogênio para formar ácido nítrico:
\[\ce{4NH3}(g)+\ce{5O2}(g)⟶\ce{4NO}(g)+\ce{6H2O}(g) \nonumber \]
\[\ce{2NO}(g)+\ce{O2}(g)⟶\ce{2NO2}(g) \nonumber \]
\[\ce{3NO2}(g)+\ce{H2O}(l)⟶\ce{2HNO3}(aq)+\ce{NO}(g) \nonumber \]
ou
\[\ce{4NO2}(g)+\ce{O2}(g)+\ce{2H2O}(g)⟶\ce{4HNO3}(l) \nonumber \]
O ácido nítrico puro é um líquido incolor. No entanto, geralmente é de cor amarela ou marrom porque o NO 2 se forma à medida que o ácido se decompõe. O ácido nítrico é estável em solução aquosa; soluções contendo 68% do ácido são ácido nítrico concentrado comercialmente disponíveis. É um agente oxidante forte e um ácido forte.
A ação do ácido nítrico em um metal raramente produz H 2 (por redução de H +) em mais do que pequenas quantidades. Em vez disso, ocorre a redução do nitrogênio. Os produtos formados dependem da concentração do ácido, da atividade do metal e da temperatura. Normalmente, forma-se uma mistura de nitratos, óxidos de nitrogênio e vários produtos de redução. Metais menos ativos, como cobre, prata e chumbo, reduzem o ácido nítrico concentrado principalmente em dióxido de nitrogênio. A reação do ácido nítrico diluído com o cobre produz NO. Em cada caso, os sais de nitrato dos metais cristalizam após a evaporação das soluções resultantes.
Elementos não metálicos, como enxofre, carbono, iodo e fósforo, sofrem oxidação pelo ácido nítrico concentrado em seus óxidos ou oxiácidos, com a formação de NO 2:
\[\ce{S}(s)+\ce{6HNO3}(aq)⟶\ce{H2SO4}(aq)+\ce{6NO2}(g)+\ce{2H2O}(l) \nonumber \]
\[\ce{C}(s)+\ce{4HNO3}(aq)⟶\ce{CO2}(g)+\ce{4NO2}(g)+\ce{2H2O}(l) \nonumber \]
O ácido nítrico oxida muitos compostos; por exemplo, o ácido nítrico concentrado oxida prontamente o ácido clorídrico em cloro e dióxido de cloro. Uma mistura de uma parte de ácido nítrico concentrado e três partes de ácido clorídrico concentrado (chamada aqua regia, que significa água real) reage vigorosamente com os metais. Essa mistura é particularmente útil na dissolução de ouro, platina e outros metais que são mais difíceis de oxidar do que o hidrogênio. Uma equação simplificada para representar a ação da aqua regia sobre o ouro é:
\[\ce{Au}(s)+\ce{4HCl}(aq)+\ce{3HNO3}(aq)⟶\ce{HAuCl4}(aq)+\ce{3NO2}(g)+\ce{3H2O}(l) \nonumber \]
Vídeo\(\PageIndex{1}\): Embora o ouro geralmente não seja reativo, você pode assistir a um vídeo da complexa mistura de compostos presentes na água régia dissolvendo-a em solução.
Os nitratos, sais do ácido nítrico, se formam quando metais, óxidos, hidróxidos ou carbonatos reagem com o ácido nítrico. A maioria dos nitratos é solúvel em água; de fato, um dos usos significativos do ácido nítrico é preparar nitratos metálicos solúveis.
O ácido nítrico é amplamente utilizado no laboratório e nas indústrias químicas como ácido forte e agente oxidante forte. É importante na fabricação de explosivos, corantes, plásticos e medicamentos. Os sais de ácido nítrico (nitratos) são valiosos como fertilizantes. A pólvora é uma mistura de nitrato de potássio, enxofre e carvão vegetal.
A reação do N 2 O 3 com a água dá uma solução azul pálida de ácido nitroso, HNO 2. No entanto, o HNO 2 (mostrado na Figura\(\PageIndex{10}\)) é mais fácil de preparar pela adição de um ácido a uma solução de nitrito; o ácido nitroso é um ácido fraco, então o íon nitrito é básico em solução aquosa:
\[\ce{NO2-}(aq)+\ce{H3O+}(aq)⟶\ce{HNO2}(aq)+\ce{H2O}(l) \nonumber \]
O ácido nitroso é muito instável e existe apenas em solução. Ele se desproporciona lentamente à temperatura ambiente (rapidamente quando aquecido) em ácido nítrico e óxido nítrico. O ácido nitroso é um agente oxidante ativo com agentes redutores fortes, e agentes oxidantes fortes o oxidam em ácido nítrico.
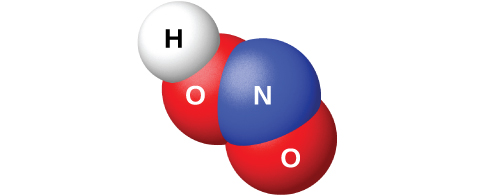
O nitrito de sódio, NaNO 2, é um aditivo para carnes como cachorros-quentes e frios. O íon nitrito tem duas funções. Limita o crescimento de bactérias que podem causar intoxicação alimentar e prolonga a retenção da cor vermelha da carne. A adição de nitrito de sódio aos produtos cárneos é controversa porque o ácido nitroso reage com certos compostos orgânicos para formar uma classe de compostos conhecidos como nitrosaminas. As nitrosaminas produzem câncer em animais de laboratório. Isso levou o FDA a limitar a quantidade de NaNO 2 nos alimentos.
Os nitritos são muito mais estáveis do que o ácido, mas os nitritos, como os nitratos, podem explodir. Os nitritos, como os nitratos, também são solúveis em água (o AgNO 2 é apenas ligeiramente solúvel).
Oxiácidos e sais de fósforo
O ácido ortofosfórico puro, H 3 PO 4 (Figura\(\PageIndex{11}\)), forma cristais incolores e deliquescentes que se fundem a 42 °C. O nome comum desse composto é ácido fosfórico e está disponível comercialmente como uma solução viscosa de 82% conhecida como ácido xaropofosfórico. Um uso do ácido fosfórico é como aditivo para muitos refrigerantes.
Um método comercial de preparação de ácido ortofosfórico é tratar rocha fosfática de cálcio com ácido sulfúrico concentrado:
\[\ce{Ca3(PO4)2}(s)+\ce{3H2SO4}(aq)⟶\ce{2H3PO4}(aq)+\ce{3CaSO4}(s) \nonumber \]
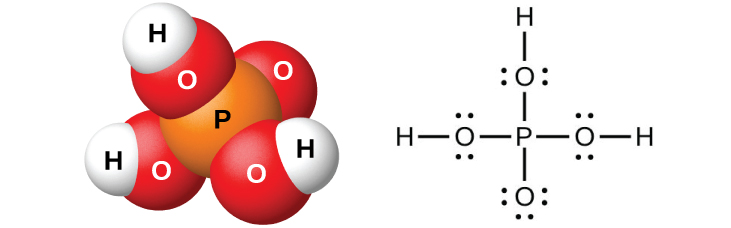
A diluição dos produtos com água, seguida de filtração para remover o sulfato de cálcio, fornece uma solução ácida diluída contaminada com dihidrogenofosfato de cálcio, Ca (H 2 PO 4) 2 e outros compostos associados à rocha fosfática de cálcio. É possível preparar ácido ortofosfórico puro dissolvendo P 4 O 10 em água.
A ação da água sobre P 4 O 6, PCl 3, PBr 3 ou PI 3 forma ácido fosforoso, H 3 PO 3 (mostrado na Figura\(\PageIndex{12}\)). O melhor método para preparar ácido fosforoso puro é hidrolisar o tricloreto de fósforo:
\[\ce{PCl3}(l)+\ce{3H2O}(l)⟶\ce{H3PO3}(aq)+\ce{3HCl}(g) \nonumber \]
O aquecimento da solução resultante expulsa o cloreto de hidrogênio e leva à evaporação da água. Quando água suficiente evapora, cristais brancos de ácido fosforoso aparecerão após o resfriamento. Os cristais são deliquescentes, muito solúveis em água e têm um odor semelhante ao do alho. O sólido derrete a 70,1° C e se decompõe a cerca de 200° C por desproporção em fosfina e ácido ortofosfórico:
\[\ce{4H3PO3}(l)⟶\ce{PH3}(g)+\ce{3H3PO4}(l) \nonumber \]
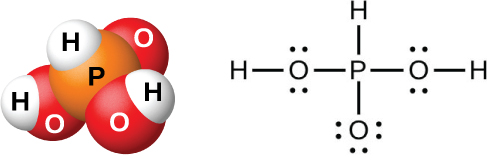
O ácido fosforoso forma apenas duas séries de sais, que contêm o íon dihidrogenofosfito\(\ce{H2PO3-}\), ou o íon fosfato de hidrogênio\(\ce{HPO3^2-}\), respectivamente. Não é possível substituir o terceiro átomo de hidrogênio porque ele não é muito ácido, pois não é fácil ionizar a ligação P-H.
Oxiácidos e sais de enxofre
A preparação do ácido sulfúrico, H 2 SO 4 (Figura\(\PageIndex{13}\)), começa com a oxidação do enxofre em trióxido de enxofre e, em seguida, a conversão do trióxido em ácido sulfúrico. O ácido sulfúrico puro é um líquido oleoso e incolor que congela a 10,5 °C. É fumegante quando aquecido porque o ácido se decompõe em água e trióxido de enxofre. O processo de aquecimento causa a perda de mais trióxido de enxofre do que a água, até atingir uma concentração de 98,33% de ácido. O ácido desta concentração ferve a 338° C sem mais alterações na concentração (uma solução de ebulição constante) e é comercialmente concentrado H 2 SO 4. A quantidade de ácido sulfúrico usada na indústria excede a de qualquer outro composto fabricado.
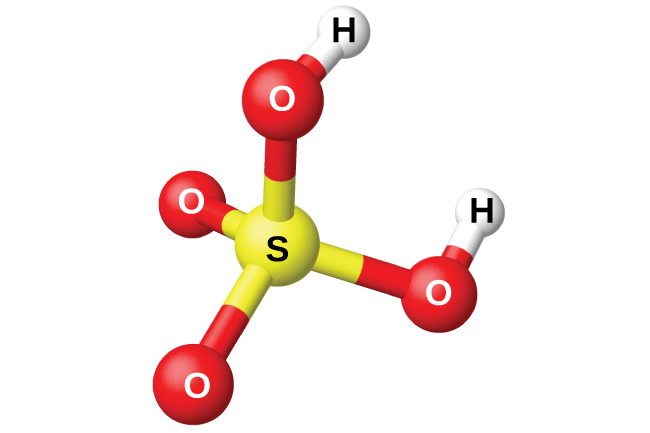
A forte afinidade do ácido sulfúrico concentrado pela água o torna um bom agente desidratante. É possível secar gases e líquidos imiscíveis que não reagem com o ácido passando-os pelo ácido.
O ácido sulfúrico é um ácido diprótico forte que ioniza em dois estágios. Em solução aquosa, o primeiro estágio está essencialmente completo. A ionização secundária não está quase tão completa e\(\ce{HSO4-}\) é um ácido moderadamente forte (cerca de 25% ionizado em solução de um\(\ce{HSO4-}\) sal: K a = 1,2 × 10 −2).
Sendo um ácido diprótico, o ácido sulfúrico forma tanto sulfatos, como Na 2 SO 4, quanto sulfatos de hidrogênio, como NaHSO 4. A maioria dos sulfatos é solúvel em água; no entanto, os sulfatos de bário, estrôncio, cálcio e chumbo são apenas ligeiramente solúveis em água.
Entre os sulfatos importantes estão Na 2 SO 4 kg/10H 2 O e os sais de Epsom, MgSO 4 ⋅7H 2 O. Como o\(\ce{HSO4-}\) íon é um ácido, os sulfatos de hidrogênio, como o NaHSO 4, apresentam comportamento ácido, e esse composto é o ingrediente principal em alguns limpadores domésticos.
O ácido sulfúrico quente e concentrado é um agente oxidante. Dependendo de sua concentração, da temperatura e da força do agente redutor, o ácido sulfúrico oxida muitos compostos e, no processo, sofre redução para SO 2,\(\ce{HSO3-}\),\(\ce{SO3^2-}\), S, H 2 S ou S 2−.
O dióxido de enxofre se dissolve na água para formar uma solução de ácido sulfuroso, conforme esperado para o óxido de um não metal. O ácido sulfuroso é instável e não é possível isolar o H 2 SO 3 anidro. O aquecimento de uma solução de ácido sulfuroso expele o dióxido de enxofre. Como outros ácidos dipróticos, o ácido sulfuroso ioniza em duas etapas: o íon sulfito de hidrogênio,\(\ce{HSO3-}\), e o íon sulfito,\(\ce{SO3^2-}\), formam. O ácido sulfuroso é um ácido moderadamente forte. A ionização é de cerca de 25% no primeiro estágio, mas é muito menor no segundo (K a1 = 1,2 × 10 −2 e K a2 = 6,2 × 10 −8).
Para preparar sais sólidos de sulfito e sulfito de hidrogênio, é necessário adicionar uma quantidade estequiométrica de uma base a uma solução de ácido sulfuroso e depois evaporar a água. Esses sais também se formam a partir da reação do SO 2 com óxidos e hidróxidos. O aquecimento de sulfito de hidrogênio de sódio sólido forma sulfito de sódio, dióxido de enxofre e água:
\[\ce{2NaHSO3}(s)\xrightarrow{Δ}\ce{Na2SO3}(s)+\ce{SO2}(g)+\ce{H2O}(l) \nonumber \]
Agentes oxidantes fortes podem oxidar o ácido sulfuroso. O oxigênio no ar o oxida lentamente até o ácido sulfúrico mais estável:
\[\ce{2H2SO3}(aq)+\ce{O2}(g)+\ce{2H2O}(l)\xrightarrow{Δ}\ce{2H3O+}(aq)+\ce{2HSO4-}(aq) \nonumber \]
Soluções de sulfitos também são muito suscetíveis à oxidação do ar para produzir sulfatos. Assim, as soluções de sulfitos sempre contêm sulfatos após a exposição ao ar.
Oxiácidos halógenos e seus sais
Os compostos HXO, HXO 2, HXO 3 e HXO 4, onde X representa Cl, Br ou I, são os ácidos hipotálico, haloso, hálico e perálico, respectivamente. A força desses ácidos aumenta dos ácidos hipotálicos, que são ácidos muito fracos, para os ácidos perálicos, que são muito fortes. A tabela\(\PageIndex{1}\) lista os ácidos conhecidos e, quando conhecidos, seus valores de pK a são dados entre parênteses.
| Nome | Flúor | Cloro | Bromo | Iodo |
|---|---|---|---|---|
| hipotálico | HOF | HOCl (7,5) | HoBr (8,7) | OI (11) |
| haloso | Chlo (2.0) | |||
| hálico | Chlo 3 | Bro 3 | OHIO (30,8) | |
| perálico | Chlo 4 | Irmão 4 | OHIO 4 (1,6) | |
| paraperálico | HP 5 E 6 (1,6) |
O único oxiácido conhecido do flúor é o ácido hipofluoroso muito instável, HOF, que é preparado pela reação do flúor gasoso com o gelo:
\[\ce{F2}(g)+\ce{H2O}(s)⟶\ce{HOF}(g)+\ce{HF}(g) \nonumber \]
O composto é muito instável e se decompõe acima de −40 °C. Este composto não ioniza na água e não há sais conhecidos. É incerto se o nome ácido hipofluoroso é mesmo apropriado para HOF; um nome mais apropriado pode ser hipofluorito de hidrogênio.
As reações do cloro e do bromo com a água são análogas às do flúor com gelo, mas essas reações não se completam, resultando em misturas do halogênio e dos respectivos ácidos hipotálico e hidrohálico. Além do HOF, os ácidos hipotalosos só existem em solução. Os ácidos hipotalosos são todos ácidos muito fracos; no entanto, o HOCl é um ácido mais forte que o HOBr, que, por sua vez, é mais forte que o HOI.
A adição de base às soluções dos ácidos hipotalosos produz soluções de sais contendo os íons hipohalitos básicos, OX −. É possível isolar esses sais como sólidos. Todos os hipohalitos são instáveis em relação à desproporção na solução, mas a reação é lenta para o hipoclorito. O hipobromito e o hipoiodito são desproporcionais rapidamente, mesmo no frio:
\[\ce{3XO-}(aq)⟶\ce{2X-}(aq)+\ce{XO3-}(aq) \nonumber \]
O hipoclorito de sódio é um alvejante barato (Clorox) e germicida. A preparação comercial envolve a eletrólise de soluções aquosas, frias e diluídas de cloreto de sódio sob condições em que o cloro e o íon hidróxido resultantes podem reagir. A próxima reação é:
\[\ce{Cl-}(aq)+\ce{H2O}(l)\xrightarrow{\ce{electrical\: energy}}\ce{ClO-}(aq)+\ce{H2}(g) \nonumber \]
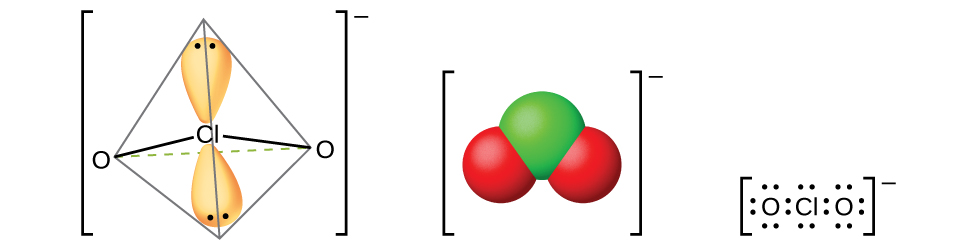
O único ácido haloso definitivamente conhecido é o ácido cloroso, HClO 2, obtido pela reação do clorito de bário com o ácido sulfúrico diluído:
\[\ce{Ba(ClO2)2}(aq)+\ce{H2SO4}(aq)⟶\ce{BaSO4}(s)+\ce{2HClO2}(aq) \nonumber \]
A filtragem do sulfato de bário insolúvel deixa uma solução de HClO 2. O ácido cloroso não é estável; ele se decompõe lentamente em solução para produzir dióxido de cloro, ácido clorídrico e água. O ácido cloroso reage com as bases para dar sais contendo o íon clorito (mostrado na Figura\(\PageIndex{14}\)). O clorito de sódio encontra uma ampla aplicação no branqueamento de papel porque é um agente oxidante forte e não danifica o papel.
O ácido clórico, HClO 3 e o ácido brômico, HBrO 3, são estáveis somente em solução. A reação do iodo com o ácido nítrico concentrado produz ácido iódico branco estável, HIO 3:
\[\ce{I2}(s)+\ce{10HNO3}(aq)⟶\ce{2HIO3}(s)+\ce{10NO2}(g)+\ce{4H2O}(l) \nonumber \]
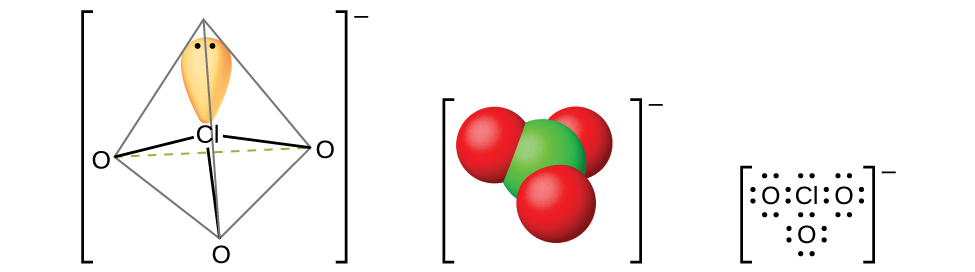
É possível obter os ácidos hálicos mais leves a partir de seus sais de bário por reação com o ácido sulfúrico diluído. A reação é análoga à usada para preparar o ácido cloroso. Todos os ácidos hálicos são ácidos fortes e agentes oxidantes muito ativos. Os ácidos reagem com as bases para formar sais contendo íons clorato (mostrados na Figura\(\PageIndex{15}\)). Outro método preparativo é a oxidação eletroquímica de uma solução quente de um haleto metálico para formar os cloratos metálicos apropriados. O clorato de sódio é um herbicida; o clorato de potássio é usado como agente oxidante.
O ácido perclórico, HClO 4, se forma ao tratar um perclorato, como o perclorato de potássio, com ácido sulfúrico sob pressão reduzida. O HClO 4 pode ser destilado da mistura:
\[\ce{KClO4}(s)+\ce{H2SO4}(aq)⟶\ce{HClO4}(g)+\ce{KHSO4}(s) \nonumber \]
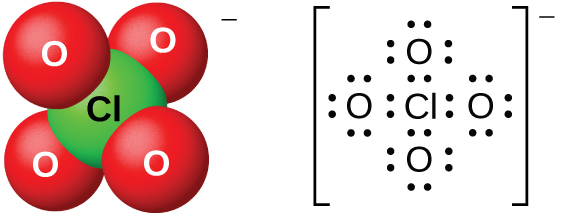
As soluções aquosas diluídas de ácido perclórico são bastante estáveis termicamente, mas concentrações acima de 60% são instáveis e perigosas. O ácido perclórico e seus sais são poderosos agentes oxidantes, pois o cloro muito eletronegativo é mais estável em um estado de oxidação inferior ao 7+. Ocorreram explosões graves ao aquecer soluções concentradas com substâncias facilmente oxidáveis. No entanto, suas reações como agente oxidante são lentas quando o ácido perclórico está frio e diluído. O ácido está entre os mais fortes de todos os ácidos. A maioria dos sais que contêm o íon perclorato (Figura\(\PageIndex{16}\)) são solúveis. É possível prepará-los a partir de reações de bases com ácido perclórico e, comercialmente, pela eletrólise de soluções quentes de seus cloretos.
Os sais de perbromato são difíceis de preparar, e as melhores sínteses atualmente envolvem a oxidação de bromatos em solução básica com gás flúor seguida de acidificação. Existem poucos ou nenhum uso comercial desse ácido ou de seus sais.
Existem vários ácidos diferentes contendo iodo no estado de oxidação 7+; eles incluem ácido metaperiódico, HIO 4 e ácido paraperiódico, H 5 IO 6. Esses ácidos são agentes oxidantes fortes e reagem com as bases para formar os sais apropriados.
Resumo
O oxigênio é um dos elementos mais reativos. Essa reatividade, aliada à sua abundância, torna a química do oxigênio muito rica e bem compreendida. Os compostos dos metais representativos com oxigênio existem em três categorias (1) óxidos, (2) peróxidos e superóxidos e (3) hidróxidos. O aquecimento dos hidróxidos, nitratos ou carbonatos correspondentes é o método mais comum para a produção de óxidos. O aquecimento do metal ou óxido metálico em oxigênio pode levar à formação de peróxidos e superóxidos. Os óxidos solúveis se dissolvem em água para formar soluções de hidróxidos. A maioria dos óxidos de metais são anidridos básicos e reagem com ácidos. Os hidróxidos dos metais representativos reagem com os ácidos nas reações ácido-base para formar sais e água. Os hidróxidos têm muitos usos comerciais.
Todos os não metais, exceto o flúor, formam vários óxidos. Quase todos os óxidos não metálicos são anidridos ácidos. A acidez dos oxiácidos requer que os átomos de hidrogênio se liguem aos átomos de oxigênio na molécula e não ao outro átomo não metálico. Geralmente, a força do oxiácido aumenta com o número de átomos de oxigênio ligados ao átomo não metálico e não a um hidrogênio.
Glossário
- anidrido básico
- óxido de metal que se comporta como base em relação aos ácidos
- processo de cloro e álcali
- processo de eletrólise para a síntese de cloro e hidróxido de sódio
- sulfato de hidrogênio
- \(\ce{HSO4-}\)íon
- sulfito de hidrogênio
- \(\ce{HSO3-}\)íon
- hidróxido
- composto de um metal com o íon hidróxido OH − ou o grupo −OH
- nitrato
- \(\ce{NO3-}\)íon; sal do ácido nítrico
- Processo Ostwald
- processo industrial usado para converter amônia em ácido nítrico
- óxido
- composto binário de oxigênio com outro elemento ou grupo, normalmente contendo íons O 2− ou o grupo —O— ou =O
- ozônio
- alótropo de oxigênio; O 3
- peróxido
- molécula contendo dois átomos de oxigênio ligados entre si ou como ânion,\(\ce{O2^2-}\)
- fotossíntese
- processo pelo qual a energia luminosa promove a reação da água e do dióxido de carbono para formar carboidratos e oxigênio; isso permite que organismos fotossintéticos armazenem energia
- sulfato
- \(\ce{SO4^2-}\)íon
- sulfito
- \(\ce{SO3^2-}\)íon
- superóxido
- óxido contendo o ânion\(\ce{O2-}\)


