18.7: Ocorrência, preparação e propriedades do nitrogênio
- Page ID
- 184983
- Descreva as propriedades, a preparação e os usos do nitrogênio
A maior parte do nitrogênio puro vem da destilação fracionada do ar líquido. A atmosfera consiste em 78% de nitrogênio por volume. Isso significa que há mais de 20 milhões de toneladas de nitrogênio em cada milha quadrada da superfície da Terra. O nitrogênio é um componente das proteínas e do material genético (DNA/RNA) de todas as plantas e animais.
Em condições normais, o nitrogênio é um gás incolor, inodoro e insípido. Ele ferve a 77 K e congela a 63 K. O nitrogênio líquido é um refrigerante útil porque é barato e tem um baixo ponto de ebulição. O nitrogênio não é muito reativo devido à ligação tripla muito forte entre os átomos de nitrogênio. As únicas reações comuns à temperatura ambiente ocorrem com o lítio para formar Li 3 N, com certos complexos de metais de transição e com hidrogênio ou oxigênio em bactérias fixadoras de nitrogênio. A falta geral de reatividade do nitrogênio torna a notável capacidade de algumas bactérias de sintetizar compostos de nitrogênio usando o gás nitrogênio atmosférico como fonte um dos eventos químicos mais emocionantes do nosso planeta. Esse processo é um tipo de fixação de nitrogênio. Nesse caso, a fixação de nitrogênio é o processo em que os organismos convertem o nitrogênio atmosférico em produtos químicos biologicamente úteis. A fixação do nitrogênio também ocorre quando um raio passa pelo ar, fazendo com que o nitrogênio molecular reaja com o oxigênio para formar óxidos de nitrogênio, que são então transportados para o solo.
Fixação de nitrogênio
Todos os organismos vivos precisam de compostos de nitrogênio para sobreviver. Infelizmente, a maioria desses organismos não consegue absorver nitrogênio de sua fonte mais abundante: a atmosfera. O nitrogênio atmosférico consiste em moléculas de N 2, que não são muito reativas devido à forte ligação tripla nitrogênio-nitrogênio. No entanto, alguns organismos podem superar esse problema por meio de um processo conhecido como fixação de nitrogênio, ilustrado na Figura\(\PageIndex{1}\).
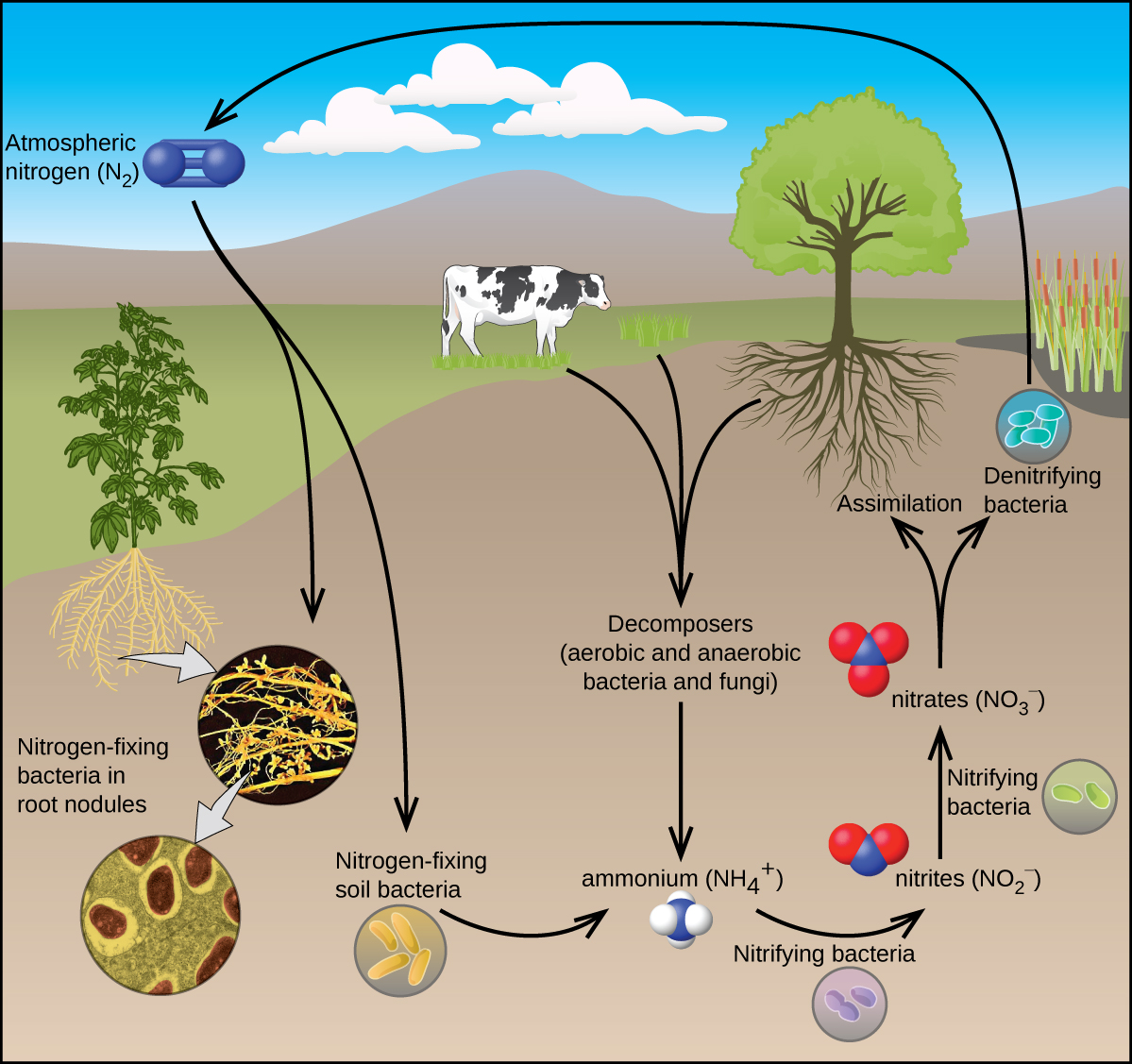
A fixação de nitrogênio é o processo em que os organismos convertem o nitrogênio atmosférico em produtos químicos biologicamente úteis. Até o momento, o único tipo conhecido de organismo biológico capaz de fixar nitrogênio são os microrganismos. Esses organismos empregam enzimas chamadas nitrogenases, que contêm ferro e molibdênio. Muitos desses microrganismos vivem em uma relação simbiótica com as plantas, com o exemplo mais conhecido sendo a presença de rizóbios nos nódulos radiculares das leguminosas.
Grandes volumes de nitrogênio atmosférico são necessários para produzir amônia - o principal material de partida usado para a preparação de grandes quantidades de outros compostos contendo nitrogênio. A maioria dos outros usos do nitrogênio elementar depende de sua inatividade. É útil quando um processo químico requer uma atmosfera inerte. Alimentos enlatados e carnes de almoço não podem oxidar em uma atmosfera de nitrogênio puro, então eles retêm um sabor e uma cor melhores e estragam menos rapidamente quando selados em nitrogênio em vez de ar. Essa tecnologia permite que produtos frescos estejam disponíveis durante todo o ano, independentemente da estação de cultivo.
Existem compostos com nitrogênio em todos os seus estados de oxidação de 3− a 5+. Grande parte da química do nitrogênio envolve reações de redução de oxidação. Alguns metais ativos (como metais alcalinos e metais alcalino-terrosos) podem reduzir o nitrogênio para formar nitretos metálicos. No restante desta seção, examinaremos a química do nitrogênio-oxigênio.
Existem óxidos de nitrogênio bem caracterizados nos quais o nitrogênio exibe cada um de seus números positivos de oxidação de 1+ a 5+. Quando o nitrato de amônio é cuidadosamente aquecido, formam-se óxido nitroso (óxido de dinitrogênio) e vapor de água. Um aquecimento mais forte gera gás nitrogênio, gás oxigênio e vapor de água. Ninguém deveria tentar essa reação — ela pode ser muito explosiva. Em 1947, houve uma grande explosão de nitrato de amônio na cidade do Texas, Texas, e, em 2013, houve outra grande explosão em West, Texas. Nos últimos 100 anos, houve quase 30 desastres semelhantes em todo o mundo, resultando na perda de inúmeras vidas. Nessa reação de oxidação-redução, o nitrogênio no íon nitrato oxida o nitrogênio no íon amônio. O óxido nitroso, mostrado na Figura\(\PageIndex{2}\), é um gás incolor que possui um odor suave e agradável e um sabor doce. Ele é aplicado como anestésico para pequenas operações, especialmente em odontologia, sob o nome de “gás do riso”.

Os baixos rendimentos de óxido nítrico, NO, se formam ao aquecer o nitrogênio e o oxigênio juntos. O NO também se forma quando um raio passa pelo ar durante tempestades. A queima de amônia é o método comercial de preparação do óxido nítrico. Em laboratório, a redução do ácido nítrico é o melhor método para preparar o óxido nítrico. Quando o cobre reage com o ácido nítrico diluído, o óxido nítrico é o principal produto de redução:
\[\ce{3Cu}(s)+\ce{8HNO3}(aq)⟶\ce{2NO}(g)+\ce{3Cu(NO3)2}(aq)+\ce{4H2O}(l) \nonumber \]
O óxido nítrico gasoso é o mais termicamente estável dos óxidos de nitrogênio e é a molécula termicamente estável mais simples conhecida com um elétron desemparelhado. É um dos poluentes atmosféricos gerados pelos motores de combustão interna, resultante da reação do nitrogênio atmosférico e do oxigênio durante o processo de combustão.
À temperatura ambiente, o óxido nítrico é um gás incolor que consiste em moléculas diatômicas. Como costuma acontecer com moléculas que contêm um elétron não pareado, duas moléculas se combinam para formar um dímero ao emparelhar seus elétrons desemparelhados para formar uma ligação. O NO líquido e o sólido contêm dímeros N 2 O 2, como o mostrado na Figura\(\PageIndex{3}\). A maioria das substâncias com elétrons desemparelhados exibe cor ao absorver a luz visível; no entanto, o NO é incolor porque a absorção da luz não está na região visível do espectro.
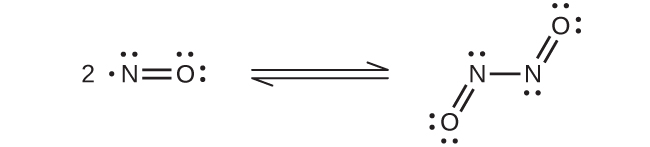
O resfriamento de uma mistura de partes iguais de óxido nítrico e dióxido de nitrogênio a −21° C produz trióxido de dinitrogênio, um líquido azul que consiste em moléculas de N 2 O 3 (Figura\(\PageIndex{4}\)). O trióxido de dinitrogênio existe apenas nos estados líquido e sólido. Quando aquecido, ele reverte para uma mistura de NO e NO 2.
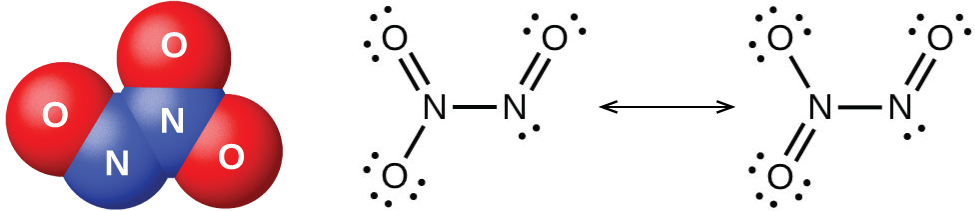
É possível preparar o dióxido de nitrogênio em laboratório aquecendo o nitrato de um metal pesado ou reduzindo o ácido nítrico concentrado com cobre metálico, conforme mostrado na Figura\(\PageIndex{5}\). Comercialmente, é possível preparar o dióxido de nitrogênio oxidando o óxido nítrico com o ar.

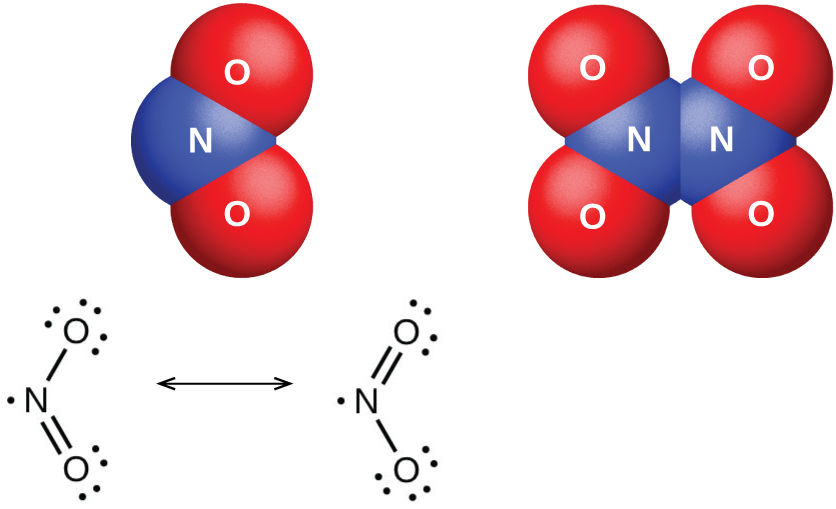
A molécula de dióxido de nitrogênio (Figura\(\PageIndex{6}\)) contém um elétron não pareado, responsável por sua cor e paramagnetismo. Também é responsável pela dimerização do NO 2. Em baixas pressões ou em altas temperaturas, o dióxido de nitrogênio tem uma cor marrom profunda que se deve à presença da molécula de NO 2. Em baixas temperaturas, a cor desaparece quase totalmente à medida que se forma o tetraóxido de dinitrogênio, N 2 O 4. À temperatura ambiente, existe um equilíbrio:
\[\ce{2NO2}(g)⇌\ce{N2O4}(g) \hspace{20px} K_P=6.86 \nonumber \]
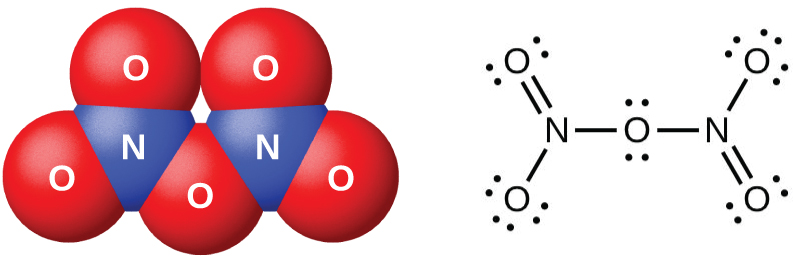
O pentóxido de dinitrogênio, N 2 O 5 (Figura\(\PageIndex{7}\)), é um sólido branco formado pela desidratação do ácido nítrico pelo óxido de fósforo (V) (decoóxido de tetrafosforo):
\[\ce{P4O10}(s)+\ce{4HNO3}(l)⟶\ce{4HPO3}(s)+\ce{2N2O5}(s) \nonumber \]
É instável acima da temperatura ambiente, decompondo-se em N 2 O 4 e O 2.
Os óxidos de nitrogênio (III), nitrogênio (IV) e nitrogênio (V) reagem com a água e formam oxiácidos contendo nitrogênio. O óxido de nitrogênio (III), N 2 O 3, é o anidrido do ácido nitroso; o HNO 2 se forma quando o N 2 O 3 reage com a água. Não há oxiácidos estáveis contendo nitrogênio com um estado de oxidação de 4+; portanto, o óxido de nitrogênio (IV), NO 2, é desproporcional de duas maneiras quando reage com a água. Em água fria, forma-se uma mistura de HNO 2 e HNO 3. Em temperaturas mais altas, HNO 3 e NO se formarão. O óxido de nitrogênio (V), N 2 O 5, é o anidrido do ácido nítrico; o HNO 3 é produzido quando o N 2 O 5 reage com a água:
\[\ce{N2O5}(s)+\ce{H2O}(l)⟶\ce{2HNO3}(aq) \nonumber \]
Os óxidos de nitrogênio apresentam extenso comportamento de redução da oxidação. O óxido nitroso se assemelha ao oxigênio em seu comportamento quando aquecido com substâncias combustíveis. N 2 O é um agente oxidante forte que se decompõe quando aquecido para formar nitrogênio e oxigênio. Como um terço do gás liberado é oxigênio, o óxido nitroso suporta a combustão melhor do que o ar (um quinto de oxigênio). Uma lasca brilhante explode em chamas quando é colocada em uma garrafa desse gás. O óxido nítrico atua tanto como agente oxidante quanto como agente redutor. Por exemplo:
\[\textrm{oxidizing agent: }\ce{P4}(s)+\ce{6NO}(g)⟶\ce{P4O6}(s)+\ce{3N2}(g) \nonumber \]
\[\textrm{reducing agent: }\ce{Cl2}(g)+\ce{2NO}(g)⟶\ce{2ClNO}(g) \nonumber \]
O dióxido de nitrogênio (ou tetraóxido de dinitrogênio) é um bom agente oxidante. Por exemplo:
\[\ce{NO2}(g)+\ce{CO}(g)⟶\ce{NO}(g)+\ce{CO2}(g) \nonumber \]
\[\ce{NO2}(g)+\ce{2HCl}(aq)⟶\ce{NO}(g)+\ce{Cl2}(g)+\ce{H2O}(l) \nonumber \]
Resumo
O nitrogênio exibe estados de oxidação que variam de 3− a 5+. Devido à estabilidade da ligação tripla NN, ela requer uma grande quantidade de energia para produzir compostos a partir do nitrogênio molecular. Metais ativos, como metais alcalinos e metais alcalino-terrosos, podem reduzir o nitrogênio para formar nitretos metálicos. Óxidos de nitrogênio e hidretos de nitrogênio também são substâncias importantes.
Glossário
- fixação de nitrogênio
- formação de compostos de nitrogênio a partir do nitrogênio molecular


