14.3: Forças relativas de ácidos e bases
- Page ID
- 185519
- Avalie as forças relativas de ácidos e bases de acordo com suas constantes de ionização
- Racionalizar tendências na resistência ácido-base em relação à estrutura molecular
- Execute cálculos de equilíbrio para sistemas ácido-base fracos
Podemos classificar os pontos fortes dos ácidos pela medida em que eles ionizam em solução aquosa. A reação de um ácido com a água é dada pela expressão geral:
\[\ce{HA}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{A-}(aq) \nonumber \]
A água é a base que reage com o ácido\(\ce{HA}\),\(\ce{A^{−}}\) é a base conjugada do ácido\(\ce{HA}\) e o íon hidrônio é o ácido conjugado da água. Um ácido forte produz 100% (ou quase) de\(\ce{H3O+}\) e\(\ce{A^{−}}\) quando o ácido se ioniza na água; a Figura\(\PageIndex{1}\) lista vários ácidos fortes. Um ácido fraco fornece pequenas quantidades de\(\ce{H3O+}\)\(\ce{A^{−}}\) e.
| Seis ácidos fortes | Seis bases fortes | ||
|---|---|---|---|
| \(\ce{HClO4}\) | ácido perclórico | \(\ce{LiOH}\) | hidróxido de lítio |
| \(\ce{HCl}\) | ácido clorídrico | \(\ce{NaOH}\) | hidróxido de sódio |
| \(\ce{HBr}\) | ácido bromídrico | \(\ce{KOH}\) | hidróxido de potássio |
| \(\ce{HI}\) | ácido hidroiódico | \(\ce{Ca(OH)2}\) | hidróxido de cálcio |
| \(\ce{HNO3}\) | ácido nítrico | \(\ce{Sr(OH)2}\) | hidróxido de estrôncio |
| \(\ce{H2SO4}\) | ácido sulfúrico | \(\ce{Ba(OH)2}\) | hidróxido de bário |
As forças relativas dos ácidos podem ser determinadas medindo suas constantes de equilíbrio em soluções aquosas. Em soluções com a mesma concentração, os ácidos mais fortes ionizam em maior medida e, portanto, produzem maiores concentrações de íons hidrônio do que os ácidos mais fracos. A constante de equilíbrio de um ácido é chamada de constante de ionização ácida, K a. Para a reação de um ácido\(\ce{HA}\):
\[\ce{HA}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{A-}(aq) \nonumber \]
escrevemos a equação para a constante de ionização como:
\[K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}} \nonumber \]
onde as concentrações são aquelas em equilíbrio. Conforme observado na seção sobre constantes de equilíbrio, embora a água seja um reagente na reação, ela também é o solvente, então sua atividade tem um valor de 1, o que não altera o valor de\(K_a\).
É um erro comum afirmar que a concentração molar do solvente está de alguma forma envolvida na lei do equilíbrio. Esse erro é resultado de um mal-entendido da termodinâmica da solução. Por exemplo, costuma-se afirmar que K a = K eq [H 2 O] para soluções aquosas. Essa equação está incorreta porque é uma interpretação errônea da equação correta K a = K eq (\(\textit{a}_{H_2O}\)). Porque\(\textit{a}_{H_2O}\) = 1 para uma solução diluída, K a = K eq (1) ou K a = K eq.
Quanto maior o\(K_a\) ácido, maior a concentração\(\ce{H3O+}\) e\(\ce{A^{−}}\) em relação à concentração do ácido não ionizado,\(\ce{HA}\). Assim, um ácido mais forte tem uma constante de ionização maior do que um ácido mais fraco. As constantes de ionização aumentam à medida que a força dos ácidos aumenta.
Os seguintes dados sobre constantes de ionização ácida indicam a ordem da força do ácido:\(\ce{CH3CO2H} < \ce{HNO2} < \ce{HSO4-}\)
\[ \begin{aligned} \ce{CH3CO2H}(aq) + \ce{H2O}(l) &⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \quad &K_\ce{a}=1.8×10^{−5} \\[4pt] \ce{HNO2}(aq)+\ce{H2O}(l) &⇌\ce{H3O+}(aq)+\ce{NO2-}(aq) &K_\ce{a}=4.6×10^{-4} \\[4pt] \ce{HSO4-}(aq)+\ce{H2O}(l) &⇌\ce{H3O+}(aq)+\ce{SO4^2-}(aq) & K_\ce{a}=1.2×10^{−2} \end{aligned} \nonumber \]
Outra medida da força de um ácido é sua porcentagem de ionização. A porcentagem de ionização de um ácido fraco é a razão entre a concentração do ácido ionizado e a concentração inicial de ácido, vezes 100:
\[\% \:\ce{ionization}=\ce{\dfrac{[H3O+]_{eq}}{[HA]_0}}×100\% \label{PercentIon} \]
Como a proporção inclui a concentração inicial, a porcentagem de ionização de uma solução de um determinado ácido fraco varia de acordo com a concentração original do ácido e, na verdade, diminui com o aumento da concentração de ácido.
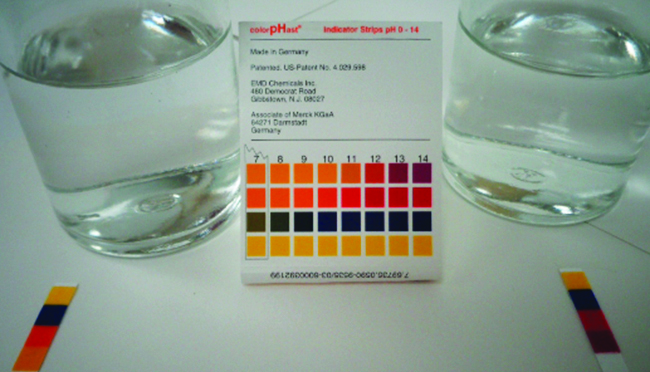
Calcule a porcentagem de ionização de uma solução de 0,125- M de ácido nitroso (um ácido fraco), com um pH de 2,09.
Solução
A porcentagem de ionização de um ácido é:
\[\ce{\dfrac{[H3O+]_{eq}}{[HNO2]_0}}×100 \nonumber \]
A equação química para a dissociação do ácido nitroso é:
\[\ce{HNO2}(aq)+\ce{H2O}(l)⇌\ce{NO2-}(aq)+\ce{H3O+}(aq). \nonumber \]
Desde então\(10^{−pH} = \ce{[H3O+]}\), descobrimos que\(10^{−2.09} = 8.1 \times 10^{−3}\, M\), então essa porcentagem de ionização (Equação\ ref {percEntion}) é:
\[\dfrac{8.1×10^{−3}}{0.125}×100=6.5\% \nonumber \]
Lembre-se de que o logaritmo 2,09 indica uma concentração de íons hidrônio com apenas dois números significativos.
Calcule a porcentagem de ionização de uma solução de 0,10 M de ácido acético com um pH de 2,89.
- Resposta
-
1,3% ionizado
Podemos classificar os pontos fortes das bases por sua tendência de formar íons hidróxido em solução aquosa. A reação de uma base de Brønsted-Lowry com a água é dada por:
\[\ce{B}(aq)+\ce{H2O}(l)⇌\ce{HB+}(aq)+\ce{OH-}(aq) \nonumber \]
A água é o ácido que reage com a base,\(\ce{HB^{+}}\) é o ácido conjugado da base\(\ce{B}\) e o íon hidróxido é a base conjugada da água. Uma base forte produz 100% (ou quase) de OH − e HB + quando reage com a água; a Figura\(\PageIndex{1}\) lista várias bases fortes. Uma base fraca produz uma pequena proporção de íons hidróxido. Hidróxidos iônicos solúveis, como o NaOH, são considerados bases fortes porque se dissociam completamente quando dissolvidos em água.
Como fizemos com os ácidos, podemos medir a força relativa das bases medindo sua constante de ionização de base (K b) em soluções aquosas. Em soluções da mesma concentração, bases mais fortes ionizam em maior medida e, portanto, produzem maiores concentrações de íons hidróxido do que bases mais fracas. Uma base mais forte tem uma constante de ionização maior do que uma base mais fraca. Para a reação de uma base,\(\ce{B}\):
\[\ce{B}(aq)+\ce{H2O}(l)⇌\ce{HB+}(aq)+\ce{OH-}(aq), \nonumber \]
escrevemos a equação para a constante de ionização como:
\[K_\ce{b}=\ce{\dfrac{[HB+][OH- ]}{[B]}} \nonumber \]
onde as concentrações são aquelas em equilíbrio. Novamente, não vemos água na equação porque a água é o solvente e tem uma atividade de 1. As reações químicas e constantes de ionização das três bases mostradas são:
\[ \begin{aligned} \ce{NO2-}(aq)+\ce{H2O}(l) &⇌\ce{HNO2}(aq)+\ce{OH-}(aq) \quad &K_\ce{b}=2.17×10^{−11} \\[4pt] \ce{CH3CO2-}(aq)+\ce{H2O}(l) &⇌\ce{CH3CO2H}(aq)+\ce{OH-}(aq) &K_\ce{b}=5.6×10^{−10} \\[4pt] \ce{NH3}(aq)+\ce{H2O}(l) &⇌\ce{NH4+}(aq)+\ce{OH-}(aq) &K_\ce{b}=1.8×10^{−5} \end{aligned} \nonumber \]
Uma tabela de constantes de ionização de bases fracas aparece na Tabela E2. Assim como acontece com os ácidos, a porcentagem de ionização pode ser medida para soluções básicas, mas varia de acordo com a constante de ionização básica e a concentração inicial da solução.
Considere as reações de ionização para um par ácido-base conjugado,\(\ce{HA − A^{−}}\):
\[\ce{HA}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{A-}(aq) \nonumber \]
com\(K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}}\).
\[\ce{A-}(aq)+\ce{H2O}(l)⇌\ce{OH-}(aq)+\ce{HA}(aq) \nonumber \]
com\(K_\ce{b}=\ce{\dfrac{[HA][OH]}{[A- ]}}\).
A adição dessas duas equações químicas produz a equação para a autoionização da água:
\[\begin{align*} \cancel{\ce{HA}(aq)}+\ce{H2O}(l)+\cancel{\ce{A-}(aq)}+\ce{H2O}(l) &⇌ \ce{H3O+}(aq)+\cancel{\ce{A-}(aq)}+\ce{OH-}(aq)+\cancel{\ce{HA}(aq)} \\[4pt] \ce{2H2O}(l) &⇌\ce{H3O+}(aq)+\ce{OH-}(aq) \end{align*} \nonumber \]
Conforme mostrado no capítulo anterior sobre equilíbrio, a\(K\) expressão para uma equação química derivada da adição de duas ou mais outras equações é o produto matemático das\(K\) expressões das outras equações. Multiplicando as expressões de ação em massa e cancelando termos comuns, vemos que:
\[K_\ce{a}×K_\ce{b}=\ce{\dfrac{[H3O+][A- ]}{[HA]}×\dfrac{[HA][OH- ]}{[A- ]}}=\ce{[H3O+][OH- ]}=K_\ce{w} \nonumber \]
Por exemplo, a constante de ionização ácida do ácido acético (CH 3 COOH) é 1,8 × 10 −5, e a constante de ionização básica de sua base conjugada, íon acetato (\(\ce{CH3COO-}\)), é 5,6 × 10 −10. O produto dessas duas constantes é de fato igual a\(K_w\):
\[K_\ce{a}×K_\ce{b}=(1.8×10^{−5})×(5.6×10^{−10})=1.0×10^{−14}=K_\ce{w} \nonumber \]
A medida em que um ácido\(\ce{HA}\),, doa prótons para moléculas de água depende da força da base conjugada\(\ce{A^{−}}\),, do ácido. Se\(\ce{A^{−}}\) for uma base forte, todos os prótons doados às moléculas de água são recapturados por\(\ce{A^{−}}\). Assim, há relativamente pouco\(\ce{A^{−}}\) e\(\ce{H3O+}\) em solução, e o ácido,\(\ce{HA}\), é fraco. Se\(\ce{A^{−}}\) for uma base fraca, a água liga os prótons com mais força, e a solução contém principalmente\(\ce{A^{−}}\) e\(\ce{H3O^{+}}\) — o ácido é forte. Ácidos fortes formam bases conjugadas muito fracas e ácidos fracos formam bases conjugadas mais fortes (Figura\(\PageIndex{2}\)).
 “style="largura: 784px; altura: 271px;” width="784px” height="271px” src=”/@api /deki/files/65684/CNX_Chem_14_03_strengths.jpg “>
“style="largura: 784px; altura: 271px;” width="784px” height="271px” src=”/@api /deki/files/65684/CNX_Chem_14_03_strengths.jpg “>
A figura\(\PageIndex{3}\) lista uma série de ácidos e bases na ordem das forças decrescentes dos ácidos e das forças crescentes correspondentes das bases. O ácido e a base em uma determinada linha são conjugados entre si.
Os primeiros seis ácidos na Figura\(\PageIndex{3}\) são os ácidos fortes mais comuns. Esses ácidos são completamente dissociados em solução aquosa. As bases conjugadas desses ácidos são bases mais fracas que a água. Quando um desses ácidos se dissolve na água, seus prótons são completamente transferidos para a água, a base mais forte.
Os ácidos que ficam entre o íon hidrônio e a água na Figura\(\PageIndex{3}\) formam bases conjugadas que podem competir com a água pela posse de um próton. Tanto os íons hidrônio quanto as moléculas de ácido não ionizado estão presentes em equilíbrio em uma solução de um desses ácidos. Compostos que são ácidos mais fracos que a água (aqueles encontrados abaixo da água na coluna de ácidos) na Figura não\(\PageIndex{3}\) apresentam comportamento ácido observável quando dissolvidos em água. Suas bases conjugadas são mais fortes que o íon hidróxido e, se alguma base conjugada fosse formada, ela reagiria com a água para reformar o ácido.
 “style="largura: 798px; altura: 715px;” width="798px” height="715px” src=”/@api /deki/files/65685/CNX_Chem_14_03_Corresp.jpg “>
“style="largura: 798px; altura: 715px;” width="798px” height="715px” src=”/@api /deki/files/65685/CNX_Chem_14_03_Corresp.jpg “>
A extensão em que uma base forma o íon hidróxido em solução aquosa depende da força da base em relação à do íon hidróxido, conforme mostrado na última coluna da Figura\(\PageIndex{3}\). Uma base forte, como uma das que estão abaixo do íon hidróxido, aceita prótons da água para produzir 100% do ácido conjugado e do íon hidróxido. Essas bases situadas entre a água e o íon hidróxido aceitam prótons da água, mas resulta uma mistura do íon hidróxido e da base. Bases que são mais fracas que a água (aquelas que estão acima da água na coluna de bases) não mostram nenhum comportamento básico observável em solução aquosa.
Use o\(K_b\) para o íon nitrito,\(\ce{NO2-}\), para calcular o\(K_a\) para seu ácido conjugado.
Solução
K b for\(\ce{NO2-}\) é dado nesta seção como 2,17 × 10 −11. O ácido conjugado de\(\ce{NO2-}\) é HNO 2; K a para HNO 2 pode ser calculado usando a relação:
\[K_\ce{a}×K_\ce{b}=1.0×10^{−14}=K_\ce{w} \nonumber \]
Resolvendo para K a, obtemos:
\[\begin{align*} K_\ce{a} &=\dfrac{K_\ce{w}}{K_\ce{b}} \\[4pt] &=\dfrac{1.0×10^{−14}}{2.17×10^{−11}} \\[4pt] &=4.6×10^{−4} \end{align*} \nonumber \]
Essa resposta pode ser verificada encontrando o K a para HNO 2 na Tabela E1
Podemos determinar as forças ácidas relativas de\(\ce{NH4+}\) e\(\ce{HCN}\) comparando suas constantes de ionização. A constante de ionização de\(\ce{HCN}\) é dada na Tabela E1 como 4,9 × 10 −10. A constante de ionização de não\(\ce{NH4+}\) está listada, mas a constante de ionização de sua base conjugada,\(\ce{NH3}\), está listada como 1,8 × 10 −5. Determine a constante de ionização de\(\ce{NH4+}\) e decida qual é o ácido mais forte,\(\ce{HCN}\) ou\(\ce{NH4+}\).
- Resposta
-
\(\ce{NH4+}\)é o ácido ligeiramente mais forte (K a for\(\ce{NH4+}\) = 5,6 × 10 −10).
A ionização de ácidos fracos e bases fracas
Muitos ácidos e bases são fracos; ou seja, eles não se ionizam totalmente em solução aquosa. Uma solução de um ácido fraco em água é uma mistura do ácido não ionizado, do íon hidrônio e da base conjugada do ácido, com o ácido não ionizado presente na maior concentração. Assim, um ácido fraco aumenta a concentração de íons hidrônio em uma solução aquosa (mas não tanto quanto a mesma quantidade de um ácido forte).
O ácido acético (\(\ce{CH3CO2H}\)) é um ácido fraco. Quando adicionamos ácido acético à água, ele ioniza em pequena medida de acordo com a equação:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
dando uma mistura de equilíbrio com a maior parte do ácido presente na forma não ionizada (molecular). Esse equilíbrio, como outros equilíbrios, é dinâmico; moléculas de ácido acético doam íons de hidrogênio para moléculas de água e formam íons hidrônio e íons acetato na mesma proporção que os íons hidrônio doam íons hidrogênio a íons acetato para reformar moléculas de ácido acético e moléculas de água. Medindo o pH de uma solução aquosa de concentração conhecida, podemos dizer que apenas uma fração do ácido fraco é ionizada a qualquer momento (Figura\(\PageIndex{4}\)). O ácido fraco restante está presente na forma não ionizada.
Para o ácido acético, em equilíbrio:
\[K_\ce{a}=\ce{\dfrac{[H3O+][CH3CO2- ]}{[CH3CO2H]}}=1.8 \times 10^{−5} \nonumber \]

| Reação de ionização | K a 25 °C |
|---|---|
| \(\ce{HSO4- + H2O ⇌ H3O+ + SO4^2-}\) | 1,2 × 10 −2 |
| \(\ce{HF + H2O ⇌ H3O+ + F-}\) | 3,5 × 10 −4 |
| \(\ce{HNO2 + H2O ⇌ H3O+ + NO2-}\) | 4,6 × 10 −4 |
| \(\ce{HNCO + H2O ⇌ H3O+ + NCO-}\) | 2 × 10 −4 |
| \(\ce{HCO2H + H2O ⇌ H3O+ + HCO2-}\) | 1,8 × 10 −4 |
| \(\ce{CH3CO2H + H2O ⇌ H3O+ + CH3CO2-}\) | 1,8 × 10 −5 |
| \(\ce{HCIO + H2O ⇌ H3O+ + CIO-}\) | 2,9 × 10 −8 |
| \(\ce{HBrO + H2O ⇌ H3O+ + BrO-}\) | 2,8 × 10 −9 |
| \(\ce{HCN + H2O ⇌ H3O+ + CN-}\) | 4,9 × 10 −10 |
A tabela\(\PageIndex{1}\) fornece as constantes de ionização para vários ácidos fracos; constantes de ionização adicionais podem ser encontradas na Tabela E1.
Em equilíbrio, uma solução de uma base fraca em água é uma mistura da base não ionizada, do ácido conjugado da base fraca e do íon hidróxido com a base não ionizada presente na maior concentração. Assim, uma base fraca aumenta a concentração de íons hidróxido em uma solução aquosa (mas não tanto quanto a mesma quantidade de uma base forte).
Por exemplo, uma solução da trimetilamina de base fraca, (CH 3) 3 N, na água reage de acordo com a equação:
\[\ce{(CH3)3N}(aq)+\ce{H2O}(l)⇌\ce{(CH3)3NH+}(aq)+\ce{OH-}(aq) \nonumber \]
Isso fornece uma mistura de equilíbrio com a maior parte da base presente como amina não ionizada. Esse equilíbrio é análogo ao descrito para ácidos fracos.
Podemos confirmar medindo o pH de uma solução aquosa de uma base fraca de concentração conhecida que apenas uma fração da base reage com a água (Figura 14.4.5). A base fraca restante está presente como a forma não reagida. A constante de equilíbrio para a ionização de uma base fraca\(K_b\),, é chamada de constante de ionização da base fraca e é igual ao quociente de reação quando a reação está em equilíbrio. Para a trimetilamina, em equilíbrio:
\[K_\ce{b}=\ce{\dfrac{[(CH3)3NH+][OH- ]}{[(CH3)3N]}} \nonumber \]
As constantes de ionização de várias bases fracas são dadas na Tabela\(\PageIndex{2}\) e na Tabela E2.
| Reação de ionização | K b a 25 °C |
|---|---|
| \(\ce{(CH3)2NH + H2O ⇌ (CH3)2NH2+ + OH-}\) | 5,9 × 10 −4 |
| \(\ce{CH3NH2 + H2O ⇌ CH3NH3+ + OH-}\) | 4,4 × 10 −4 |
| \(\ce{(CH3)3N + H2O ⇌ (CH3)3NH+ + OH-}\) | 6,3 × 10 −5 |
| \(\ce{NH3 + H2O ⇌ NH4+ + OH-}\) | 1,8 × 10 −5 |
| \(\ce{C6H5NH2 + H2O ⇌ C6N5NH3+ + OH-}\) | 4,3 × 10 −10 |
O ácido acético é o principal ingrediente do vinagre; é por isso que tem um sabor amargo. Em equilíbrio, uma solução contém [CH 3 CO 2 H] = 0,0787 M\(\ce{[H3O+]}=\ce{[CH3CO2- ]}=0.00118\:M\) e. Qual é o valor do\(K_a\) ácido acético?

Solução
Somos solicitados a calcular uma constante de equilíbrio a partir das concentrações de equilíbrio. No equilíbrio, o valor da constante de equilíbrio é igual ao quociente de reação da reação:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
\[\begin{align*} K_\ce{a} &=\ce{\dfrac{[H3O+][CH3CO2- ]}{[CH3CO2H]}} \\[4pt] &=\dfrac{(0.00118)(0.00118)}{0.0787} \\[4pt] &=1.77×10^{−5} \end{align*} \nonumber \]
Qual é a constante de equilíbrio para a ionização do\(\ce{HSO4-}\) íon, o ácido fraco usado em alguns produtos de limpeza domésticos:
\[\ce{HSO4-}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{SO4^2-}(aq) \nonumber \]
Em uma mistura de NaHSO 4 e Na 2 SO 4 em equilíbrio,\(\ce{[H3O+]}\) = 0,027 M\(\ce{[HSO4- ]}=0.29\:M\);;\(\ce{[SO4^2- ]}=0.13\:M\) e.
- Resposta
-
\(K_a\)para\(\ce{HSO_4^-}= 1.2 ×\times 10^{−2}\)
A cafeína, C 8 H 10 N 4 O 2 é uma base fraca. Qual é o valor de K b para cafeína se uma solução em equilíbrio tem [C 8 H 10 N 4 O 2] = 0,050 M,\(\ce{[C8H10N4O2H+]}\) = 5,0 × 10 −3 M e [OH −] = 2,5 × 10 −3 M?
Solução
No equilíbrio, o valor da constante de equilíbrio é igual ao quociente de reação da reação:
\[\ce{C8H10N4O2}(aq)+\ce{H2O}(l)⇌\ce{C8H10N4O2H+}(aq)+\ce{OH-}(aq) \nonumber \]
então
\[K_\ce{b}=\ce{\dfrac{[C8H10N4O2H+][OH- ]}{[C8H10N4O2]}}=\dfrac{(5.0×10^{−3})(2.5×10^{−3})}{0.050}=2.5×10^{−4} \nonumber \]
Qual é a constante de equilíbrio para a ionização do\(\ce{HPO4^2-}\) íon, uma base fraca:
\[\ce{HPO4^2-}(aq)+\ce{H2O}(l)⇌\ce{H2PO4-}(aq)+\ce{OH-}(aq) \nonumber \]
Em uma solução contendo uma mistura de\(\ce{NaH2PO4}\) e\(\ce{Na2HPO4}\) em equilíbrio com:
- \([\ce{OH^{−}}] = 1.3 × 10^{−6} M\)
- \(\ce{[H2PO4^{-}]=0.042\:M}\)e
- \(\ce{[HPO4^{2-}]=0.341\:M}\).
- Resposta
-
K b para\(\ce{HPO4^2-}=1.6×10^{−7} \)
O pH de uma solução 0,0516-M de ácido nitroso,\(\ce{HNO2}\), é 2,34. Qual é o seu\(K_a\)?
\[\ce{HNO2}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{NO2-}(aq) \nonumber \]
Solução
Determinamos uma constante de equilíbrio começando com as concentrações iniciais de HNO 2 e\(\ce{H3O+}\), bem\(\ce{NO2-}\) como uma das concentrações finais, a concentração de íon hidrônio em equilíbrio. (Lembre-se de que o pH é simplesmente outra forma de expressar a concentração do íon hidrônio.)
Podemos resolver esse problema com as seguintes etapas nas quais x é uma mudança na concentração de uma espécie na reação:
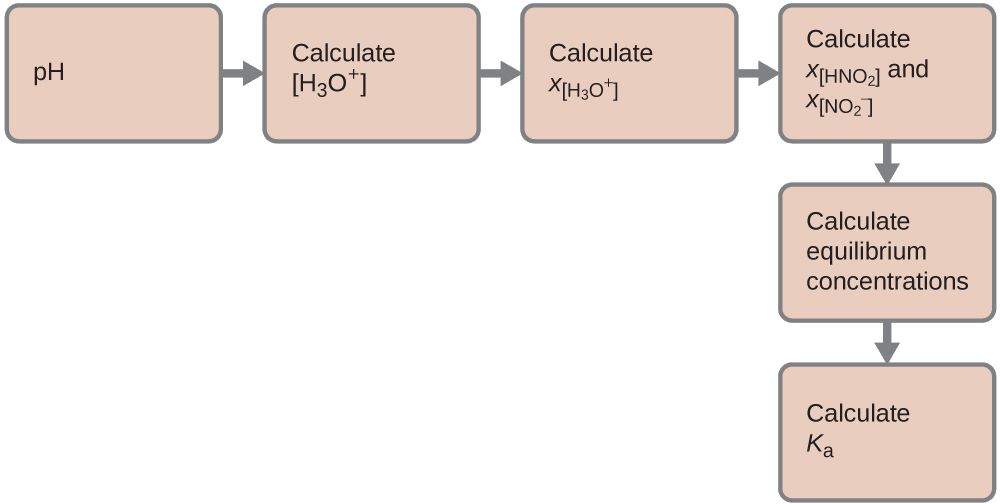
Podemos resumir as várias concentrações e mudanças conforme mostrado aqui. Como a água é o solvente, ela tem uma atividade fixa igual a 1. Qualquer pequena quantidade de água produzida ou usada durante a reação não mudará o papel da água como solvente, então o valor de sua atividade permanece igual a 1 durante toda a reação.
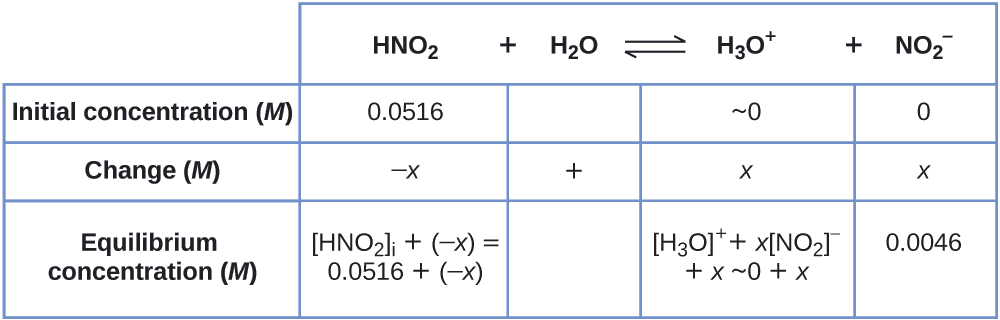
Para obter os vários valores na tabela ICE (Inicial, Mudança, Equilíbrio), primeiro\(\ce{[H3O+]}\) calculamos a concentração de equilíbrio de\(\ce{H3O+}\), a partir do pH:
\[\ce{[H3O+]}=10^{−2.34}=0.0046\:M \nonumber \]
A mudança na concentração de\(\ce{H3O+}\),\(x_{\ce{[H3O+]}}\), é a diferença entre a concentração de equilíbrio de H 3 O +, que determinamos a partir do pH, e a concentração inicial,\(\mathrm{[H_3O^+]_i}\). A concentração inicial de\(\ce{H3O+}\) é sua concentração em água pura, que é muito menor que a concentração final que a aproximamos como zero (~ 0).
A mudança na concentração de\(\ce{NO2-}\) é igual à mudança na concentração de\(\ce{[H3O+]}\). Para cada 1 mol\(\ce{H3O+}\) dessas formas, 1 mol de\(\ce{NO2-}\) formas. A concentração de equilíbrio de HNO 2 é igual à sua concentração inicial mais a mudança em sua concentração.
Agora podemos preencher a tabela ICE com as concentrações em equilíbrio, conforme mostrado aqui:
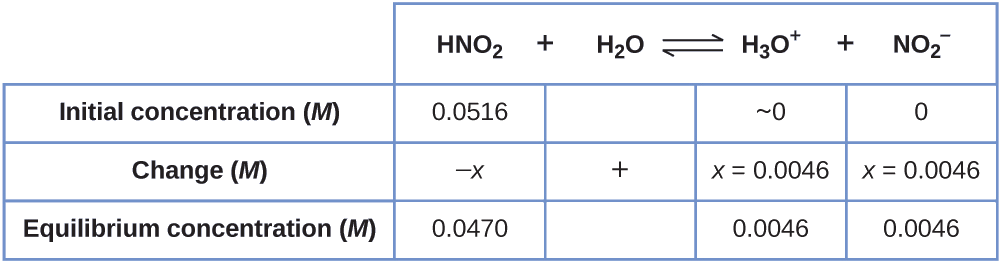
Finalmente, calculamos o valor da constante de equilíbrio usando os dados na tabela:
\[K_\ce{a}=\ce{\dfrac{[H3O+][NO2- ]}{[HNO2]}}=\dfrac{(0.0046)(0.0046)}{(0.0470)}=4.5×10^{−4} \nonumber \]
O pH de uma solução de amônia doméstica, uma solução de 0,950-M de NH 3, é 11,612. O que é K b para NH 3.
- Resposta
-
\(K_b = 1.8 × 10^{−5}\)
O ácido fórmico, HCO 2 H, é o irritante que causa a reação do corpo às picadas de formigas.

Qual é a concentração de íon hidrônio e o pH em uma solução 0,534- M de ácido fórmico?
\[\ce{HCO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{HCO2-}(aq) \hspace{20px} K_\ce{a}=1.8×10^{−4} \nonumber \]
Solução em
1. Determine as concentrações de x e equilíbrio. A expressão de equilíbrio é:
\[\ce{HCO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{HCO2-}(aq) \nonumber \]
Como a água é o solvente, ela tem uma atividade fixa igual a 1. Qualquer pequena quantidade de água produzida ou usada durante a reação não mudará o papel da água como solvente, portanto, o valor de sua atividade permanece igual a 1 durante toda a reação, portanto, não precisamos considerá-lo ao configurar a tabela ICE.
A tabela mostra as concentrações iniciais (concentrações antes da ionização do ácido), as mudanças na concentração e as seguintes concentrações de equilíbrio (os dados fornecidos no problema aparecem em cores):
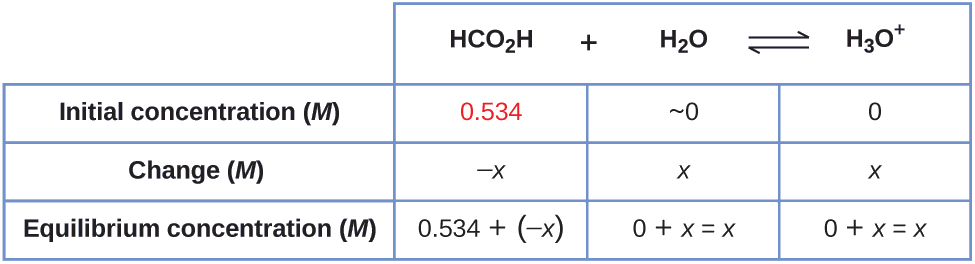
2. Resolva as concentrações\(x\) e o equilíbrio. Em equilíbrio:
\[\begin{align*} K_\ce{a} &=1.8×10^{−4}=\ce{\dfrac{[H3O+][HCO2- ]}{[HCO2H]}} \\[4pt] &=\dfrac{(x)(x)}{0.534−x}=1.8×10^{−4} \end{align*} \nonumber \]
Agora resolva\(x\). Como a concentração inicial de ácido é razoavelmente grande e\(K_a\) muito pequena, assumimos que\(x << 0.534\), o que nos permite simplificar o termo denominador como\((0.534 − x) = 0.534\). Isso dá:
\[K_\ce{a}=1.8×10^{−4}=\dfrac{x^{2}}{0.534} \nonumber \]
Resolva da\(x\) seguinte forma:
\[\begin{align*} x^2 &=0.534×(1.8×10^{−4}) \\[4pt] &=9.6×10^{−5} \\[4pt] x &=\sqrt{9.6×10^{−5}} \\[4pt] &=9.8×10^{−3} \end{align*} \nonumber \]
Para verificar a suposição de que\(x\) é pequena em comparação com 0,534, calculamos:
\[\begin{align*} \dfrac{x}{0.534} &=\dfrac{9.8×10^{−3}}{0.534} \\[4pt] &=1.8×10^{−2} \, \textrm{(1.8% of 0.534)} \end{align*} \nonumber \]
\(x\)é inferior a 5% da concentração inicial; a suposição é válida.
Encontramos a concentração de equilíbrio do íon hidrônio nesta solução de ácido fórmico a partir de sua concentração inicial e a mudança nessa concentração conforme indicado na última linha da tabela:
\[\begin{align*} \ce{[H3O+]} &=~0+x=0+9.8×10^{−3}\:M. \\[4pt] &=9.8×10^{−3}\:M \end{align*} \nonumber \]
O pH da solução pode ser encontrado tomando o log negativo do\(\ce{[H3O+]}\), então:
\[pH = −\log(9.8×10^{−3})=2.01 \nonumber \]
Apenas uma pequena fração de um ácido fraco ioniza em solução aquosa. Qual é a porcentagem de ionização do ácido acético em uma solução de 0,10-M de ácido acético, CH 3 CO 2 H?
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \hspace{20px} K_\ce{a}=1.8×10^{−5} \nonumber \]
- Dica
-
Determine\(\ce{[CH3CO2- ]}\) em equilíbrio.) Lembre-se de que a porcentagem de ionização é a fração do ácido acético ionizado × 100, ou\(\ce{\dfrac{[CH3CO2- ]}{[CH3CO2H]_{initial}}}×100\).
- Resposta
-
percentual de ionização = 1,3%
O exemplo a seguir mostra que a concentração de produtos produzidos pela ionização de uma base fraca pode ser determinada pela mesma série de etapas usadas com um ácido fraco.
Encontre a concentração de íon hidróxido em uma solução de 0,25- M de trimetilamina, uma base fraca:
\[\ce{(CH3)3N}(aq)+\ce{H2O}(l)⇌\ce{(CH3)3NH+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{b}=6.3×10^{−5} \nonumber \]
Solução Esse problema requer que calculemos uma concentração de equilíbrio determinando as mudanças de concentração à medida que a ionização de uma base vai para o equilíbrio. A solução é abordada da mesma forma que para a ionização do ácido fórmico em Example\(\PageIndex{6}\). Os reagentes e produtos serão diferentes e os números serão diferentes, mas a lógica será a mesma:

1. Determine as concentrações de x e equilíbrio. A tabela mostra as mudanças e concentrações:
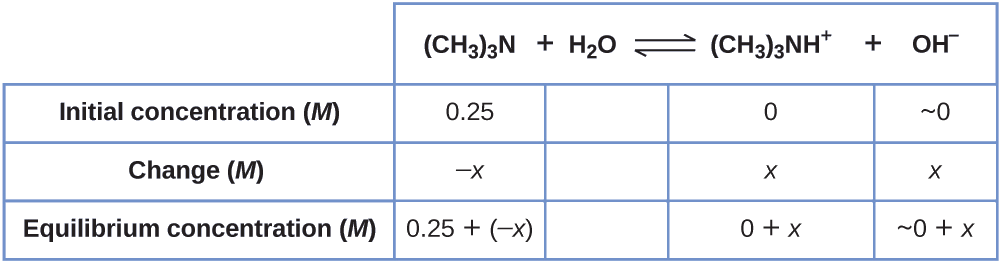
2. Resolva as concentrações\(x\) e o equilíbrio. Em equilíbrio:
\[K_\ce{b}=\ce{\dfrac{[(CH3)3NH+][OH- ]}{[(CH3)3N]}}=\dfrac{(x)(x)}{0.25−x=}6.3×10^{−5} \nonumber \]
Se assumirmos que x é pequeno em relação a 0,25, então podemos substituir (0,25 − x) na equação anterior por 0,25. Resolver a equação simplificada fornece:
\[x=4.0×10^{−3} \nonumber \]
Essa mudança é inferior a 5% da concentração inicial (0,25), então a suposição é justificada.
Lembre-se de que, para este cálculo,\(x\) é igual à concentração de equilíbrio do íon hidróxido na solução (veja a tabulação anterior):
\[\begin{align*} (\ce{[OH- ]}=~0+x=x=4.0×10^{−3}\:M \\[4pt] &=4.0×10^{−3}\:M \end{align*} \nonumber \]
Em seguida, calcule o pOH da seguinte forma:
\[\ce{pOH}=−\log(4.3×10^{−3})=2.40 \nonumber \]
Usando a relação apresentada na seção anterior deste capítulo:
\[\mathrm{pH + pOH=p\mathit{K}_w=14.00}\nonumber \]
permite o cálculo do pH:
\[\mathrm{pH=14.00−pOH=14.00−2.37=11.60} \nonumber \]
Verifique o trabalho. Uma verificação da nossa aritmética mostra isso\(K_b = 6.3 \times 10^{−5}\).
- Mostre que o cálculo na Etapa 2 deste exemplo fornece um x de 4,3 × 10 −3 e o cálculo na Etapa 3 mostra K b = 6,3 × 10 −5.
- Encontre a concentração de íon hidróxido em uma solução de 0,0325- M de amônia, uma base fraca com K b de 1,76 × 10 −5. Calcular a porcentagem de ionização da amônia, a fração ionizada × 100, ou\(\ce{\dfrac{[NH4+]}{[NH3]}}×100 \%\)
- Responda a
-
\(7.56 × 10^{−4}\, M\), 2,33%
- Resposta b
-
2,33%
Alguns ácidos fracos e bases fracas ionizam a tal ponto que a suposição simplificada de que x é pequeno em relação à concentração inicial do ácido ou base é inadequada. Ao resolvermos as concentrações de equilíbrio nesses casos, veremos que não podemos negligenciar a mudança na concentração inicial do ácido ou da base e devemos resolver as equações de equilíbrio usando a equação quadrática.
O bissulfato de sódio, NaHSO 4, é usado em alguns produtos de limpeza domésticos porque contém o\(\ce{HSO4-}\) íon, um ácido fraco. Qual é o pH de uma solução de 0,50- M de\(\ce{HSO4-}\)?
\[\ce{HSO4-}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{a}=1.2×10^{−2} \nonumber \]
Solução em
Precisamos determinar a concentração de equilíbrio do íon hidrônio que resulta da ionização de para que\(\ce{HSO4-}\) possamos usar\(\ce{[H3O+]}\) para determinar o pH. Como nos exemplos anteriores, podemos abordar a solução seguindo as seguintes etapas:

1. Determine\(x\) e equilibre as concentrações. Esta tabela mostra as mudanças e concentrações:

2. Resolva para\(x\) e as concentrações.
Quando começarmos a resolver\(x\), descobriremos que isso é mais complicado do que nos exemplos anteriores. Ao discutirmos essas complicações, não devemos perder a noção de que ainda é o objetivo desta etapa determinar o valor de\(x\).
Em equilíbrio:
\[K_\ce{a}=1.2×10^{−2}=\ce{\dfrac{[H3O+][SO4^2- ]}{[HSO4- ]}}=\dfrac{(x)(x)}{0.50−x} \nonumber \]
Se assumirmos que x é pequeno e aproximado (0,50 − x) como 0,50, encontramos:
\[x=7.7×10^{−2} \nonumber \]
Quando verificamos a suposição, confirmamos:
\[\dfrac{x}{\mathrm{[HSO_4^- ]_i}} \overset{?}{\le} 0.05 \nonumber \]
que para este sistema é
\[\dfrac{x}{0.50}=\dfrac{7.7×10^{−2}}{0.50}=0.15(15\%) \nonumber \]
O valor de não\(x\) é inferior a 5% de 0,50, portanto, a suposição não é válida. Precisamos da fórmula quadrática para encontrar\(x\).
A equação:
\[K_\ce{a}=1.2×10^{−2}=\dfrac{(x)(x)}{0.50−x}\nonumber \]
concede
\[6.0×10^{−3}−1.2×10^{−2}x=x^{2+} \nonumber \]
ou
\[x^{2+}+1.2×10^{−2}x−6.0×10^{−3}=0 \nonumber \]
Essa equação pode ser resolvida usando a fórmula quadrática. Para uma equação da forma
\[ax^{2+} + bx + c=0, \nonumber \]
\(x\)é dado pela equação quadrática:
\[x=\dfrac{−b±\sqrt{b^{2+}−4ac}}{2a} \nonumber \]
Nesse problema\(a = 1\),\(b = 1.2 × 10^{−3}\),\(c = −6.0 × 10^{−3}\) e.
Resolver x fornece uma raiz negativa (que não pode ser correta, pois a concentração não pode ser negativa) e uma raiz positiva:
\[x=7.2×10^{−2} \nonumber \]
Agora determine a concentração do íon hidrônio e o pH:
\[\begin{align*} \ce{[H3O+]} &=~0+x=0+7.2×10^{−2}\:M \\[4pt] &=7.2×10^{−2}\:M \end{align*} \nonumber \]
O pH dessa solução é:
\[\mathrm{pH=−log[H_3O^+]=−log7.2×10^{−2}=1.14} \nonumber \]
- Mostre que a fórmula quadrática fornece\(x = 7.2 × 10^{−2}\).
- Calcule o pH em uma solução de 0,010-M de cafeína, uma base fraca:
\[\ce{C8H10N4O2}(aq)+\ce{H2O}(l)⇌\ce{C8H10N4O2H+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{b}=2.5×10^{−4} \nonumber \]
- Dica
-
Será necessário converter [OH −] em\(\ce{[H3O+]}\) ou pOH em pH no final do cálculo.
- Resposta
-
pH 11,16
Os pontos fortes relativos de ácidos e bases fortes
Ácidos fortes\(\ce{HCl}\), como\(\ce{HBr}\), e\(\ce{HI}\), exibem a mesma força na água. A molécula de água é uma base tão forte em comparação com as bases conjugadas Cl −, Br − e I − que a ionização desses ácidos fortes é essencialmente completa em soluções aquosas. Em solventes menos básicos que a água\(\ce{HCl}\)\(\ce{HBr}\), encontramos e\(\ce{HI}\) diferimos marcadamente em sua tendência de entregar um próton ao solvente. Por exemplo, quando dissolvido em etanol (uma base mais fraca que a água), a extensão da ionização aumenta na ordem e\(\ce{HCl < HBr < HI}\), portanto,\(\ce{HI}\) é demonstrado que é o mais forte desses ácidos. A incapacidade de discernir as diferenças de força entre os ácidos fortes dissolvidos na água é conhecida como efeito de nivelamento da água.
A água também exerce um efeito de nivelamento nas forças das bases fortes. Por exemplo, o íon óxido, O 2−, e o íon amida,\(\ce{NH2-}\), são bases tão fortes que reagem completamente com a água:
\[\ce{O^2-}(aq)+\ce{H2O}(l)⟶\ce{OH-}(aq)+\ce{OH-}(aq) \nonumber \]
\[\ce{NH2-}(aq)+\ce{H2O}(l)⟶\ce{NH3}(aq)+\ce{OH-}(aq) \nonumber \]
Assim, O 2− e\(\ce{NH2-}\) parecem ter a mesma força básica na água; ambos fornecem um rendimento de 100% do íon hidróxido.
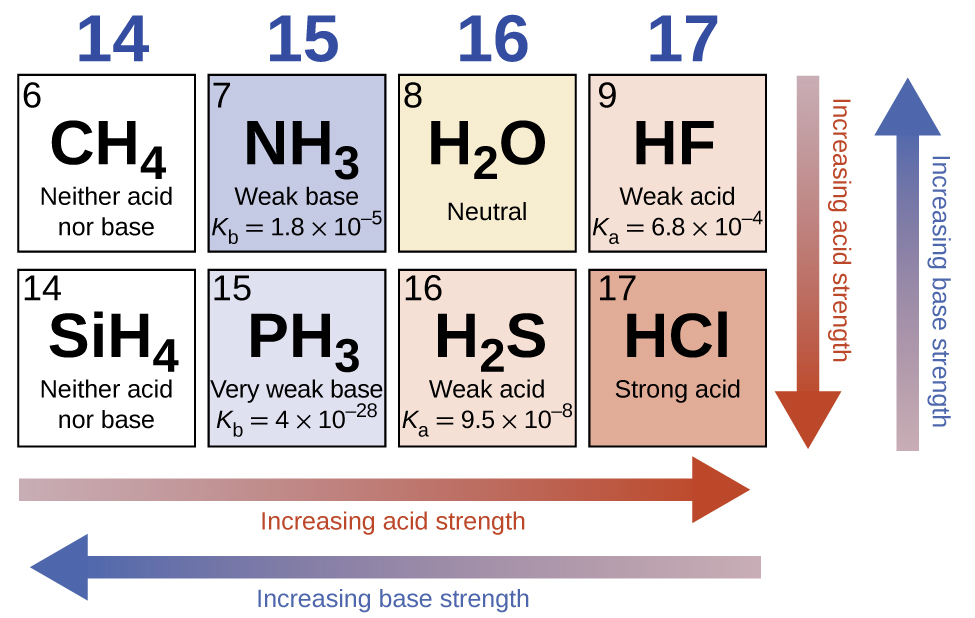
Na ausência de qualquer efeito de nivelamento, a resistência ácida de compostos binários de hidrogênio com não metais (A) aumenta à medida que a força de união H-A diminui em um grupo na tabela periódica. Para o grupo 17, a ordem de aumento da acidez é\(\ce{HF < HCl < HBr < HI}\). Da mesma forma, para o grupo 16, a ordem de aumento da força ácida é H 2 O < H 2 S < H 2 Se < H 2 Te. Em uma linha na tabela periódica, a força ácida dos compostos binários de hidrogênio aumenta com o aumento da eletronegatividade do átomo não metálico porque a polaridade da ligação H-A aumenta. Assim, a ordem de aumento da acidez (para remoção de um próton) na segunda linha é\(\ce{CH4 < NH3 < H2O < HF}\); na terceira linha, é\(\ce{SiH4 < PH3 < H2S < HCl}\) (veja a Figura\(\PageIndex{6}\)).
Compostos contendo oxigênio e um ou mais grupos hidroxila (OH) podem ser ácidos, básicos ou anfotéricos, dependendo da posição na tabela periódica do átomo central E, o átomo ligado ao grupo hidroxila. Esses compostos têm a fórmula geral O n E (OH) m e incluem ácido sulfúrico\(\ce{O2S(OH)2}\), ácido sulfuroso\(\ce{OS(OH)2}\), ácido nítrico\(\ce{O2NOH}\), ácido perclórico\(\ce{O3ClOH}\), hidróxido de alumínio\(\ce{Al(OH)3}\), hidróxido de cálcio e hidróxido de potássio,\(\ce{KOH}\):\(\ce{Ca(OH)2}\)
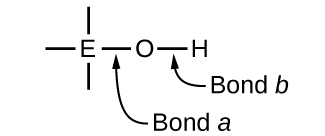
Se o átomo central, E, tem baixa eletronegatividade, sua atração por elétrons é baixa. Existe pouca tendência para o átomo central formar uma forte ligação covalente com o átomo de oxigênio, e a ligação a entre o elemento e o oxigênio é mais facilmente quebrada do que a ligação b entre oxigênio e hidrogênio. Portanto, a ligação a é iônica, os íons hidróxido são liberados para a solução e o material se comporta como uma base — esse é o caso do Ca (OH) 2 e do KOH. A menor eletronegatividade é característica dos elementos mais metálicos; portanto, os elementos metálicos formam hidróxidos iônicos que são, por definição, compostos básicos.
Se, por outro lado, o átomo E tem uma eletronegatividade relativamente alta, ele atrai fortemente os elétrons que compartilha com o átomo de oxigênio, tornando a ligação uma ligação relativamente fortemente covalente. A ligação oxigênio-hidrogênio, ligação b, é assim enfraquecida porque os elétrons são deslocados em direção a E. A ligação b é polar e libera prontamente íons de hidrogênio para a solução, então o material se comporta como um ácido. As altas eletronegatividades são características dos elementos mais não metálicos. Assim, elementos não metálicos formam compostos covalentes contendo grupos −OH ácidos que são chamados de oxiácidos.
Aumentar o número de oxidação do átomo central E também aumenta a acidez de um oxiácido porque isso aumenta a atração de E pelos elétrons que ele compartilha com o oxigênio e, assim, enfraquece a ligação O-H. O ácido sulfúrico, H 2 SO 4 ou O 2 S (OH) 2 (com um número de oxidação de enxofre de +6), é mais ácido que o ácido sulfuroso, H 2 SO 3 ou OS (OH) 2 (com um número de oxidação de enxofre de +4). Da mesma forma, o ácido nítrico, HNO 3 ou O 2 NOH (número de oxidação N = +5), é mais ácido do que o ácido nitroso, HNO 2 ou ONOH (número de oxidação N = +3). Em cada um desses pares, o número de oxidação do átomo central é maior para o ácido mais forte (Figura\(\PageIndex{7}\)).
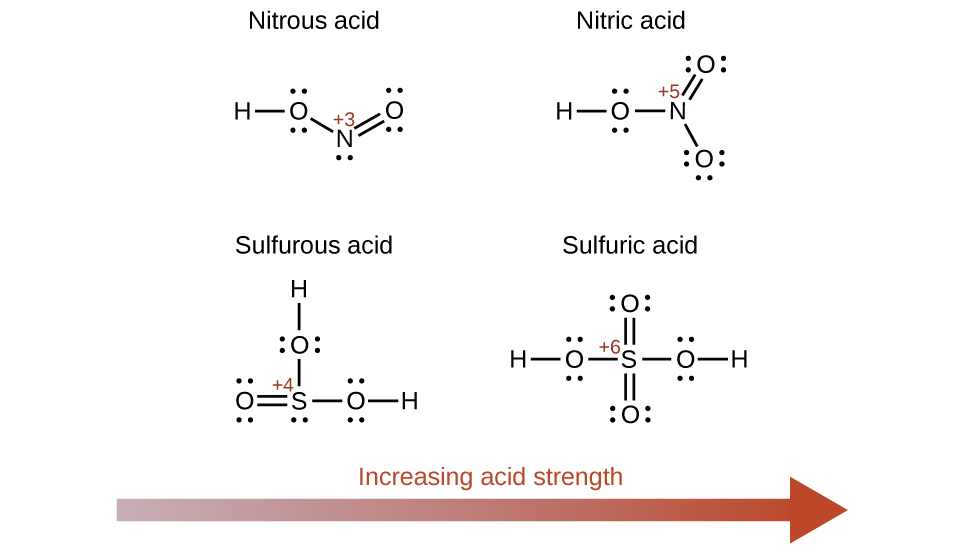
Os compostos hidroxiados de elementos com eletronegatividades intermediárias e números de oxidação relativamente altos (por exemplo, elementos próximos à linha diagonal que separa os metais dos não metais na tabela periódica) geralmente são anfotéricos. Isso significa que os compostos hidroxiácidos agem como ácidos quando reagem com bases fortes e como bases quando reagem com ácidos fortes. O anfoterismo do hidróxido de alumínio, que geralmente existe como hidrato\(\ce{Al(H2O)3(OH)3}\), se reflete em sua solubilidade em ácidos fortes e bases fortes. Em bases fortes, o hidróxido de alumínio hidratado relativamente insolúvel,\(\ce{Al(H2O)3(OH)3}\), é convertido no íon solúvel,\(\ce{[Al(H2O)2(OH)4]-}\), por reação com o íon hidróxido:
\[[\ce{Al(H2O)3(OH)3}](aq)+\ce{OH-}(aq)⇌\ce{H2O}(l)+\ce{[Al(H2O)2(OH)4]-}(aq) \nonumber \]
Nessa reação, um próton é transferido de uma das moléculas de H 2 O ligadas ao alumínio para um íon hidróxido em solução. O\(\ce{Al(H2O)3(OH)3}\) composto, portanto, atua como um ácido nessas condições. Por outro lado, quando dissolvido em ácidos fortes, é convertido em íon solúvel\(\ce{[Al(H2O)6]^3+}\) por reação com o íon hidrônio:
\[\ce{3H3O+}(aq)+\ce{Al(H2O)3(OH)3}(aq)⇌\ce{Al(H2O)6^3+}(aq)+\ce{3H2O}(l) \nonumber \]
Nesse caso, os prótons são transferidos dos íons hidrônio em solução para\(\ce{Al(H2O)3(OH)3}\), e o composto funciona como uma base.
Resumo
Os pontos fortes dos ácidos e bases de Brønsted-Lowry em soluções aquosas podem ser determinados por suas constantes de ionização ácida ou básica. Ácidos mais fortes formam bases conjugadas mais fracas e ácidos mais fracos formam bases conjugadas mais fortes. Assim, os ácidos fortes são completamente ionizados em solução aquosa porque suas bases conjugadas são bases mais fracas que a água. Os ácidos fracos são apenas parcialmente ionizados porque suas bases conjugadas são fortes o suficiente para competir com sucesso com a água pela posse de prótons. Bases fortes reagem com a água para formar quantitativamente íons hidróxido. Bases fracas fornecem apenas pequenas quantidades de íon hidróxido. As forças dos ácidos binários aumentam da esquerda para a direita em um período da tabela periódica (CH 4 < NH 3 < H 2 O < HF) e aumentam em um grupo (HF < HCl < HBr < HI). As forças dos oxiácidos que contêm o mesmo elemento central aumentam à medida que o número de oxidação do elemento aumenta (H 2 SO 3 < H 2 SO 4). As forças dos oxiácidos também aumentam à medida que a eletronegatividade do elemento central aumenta [H 2 SeO 4 < H 2 SO 4].
Equações chave
- \(K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}}\)
- \(K_\ce{b}=\ce{\dfrac{[HB+][OH- ]}{[B]}}\)
- \(K_a \times K_b = 1.0 \times 10^{−14} = K_w \,(\text{at room temperature})\)
- \(\textrm{Percent ionization}=\ce{\dfrac{[H3O+]_{eq}}{[HA]_0}}×100\)
Glossário
- constante de ionização ácida (K a)
- constante de equilíbrio para a ionização de um ácido fraco
- constante de ionização básica (K b)
- constante de equilíbrio para a ionização de uma base fraca
- efeito de nivelamento da água
- qualquer ácido mais\(\ce{H3O+}\) forte ou qualquer base mais forte que OH − reagirá com a água para se formar\(\ce{H3O+}\), ou OH −, respectivamente; a água atua como uma base para fazer com que todos os ácidos fortes pareçam igualmente fortes e atua como um ácido para fazer com que todas as bases fortes pareçam igualmente fortes
- oxiácido
- composto contendo um elemento não metálico e um ou mais grupos hidroxilo
- por cento de ionização
- razão entre a concentração do ácido ionizado e a concentração inicial de ácido, vezes 100


