14.2: pH e pOH
- Page ID
- 185582
- Explicar a caracterização de soluções aquosas como ácidas, básicas ou neutras
- Expresse as concentrações de íons hidrônio e hidróxido nas escalas de pH e pOH
- Execute cálculos relacionados ao pH e pOH
Conforme discutido anteriormente, os íons hidrônio e hidróxido estão presentes tanto na água pura quanto em todas as soluções aquosas, e suas concentrações são inversamente proporcionais, conforme determinado pelo produto iônico da água (\(K_w\)). As concentrações desses íons em uma solução são frequentemente determinantes críticos das propriedades da solução e do comportamento químico de seus outros solutos, e um vocabulário específico foi desenvolvido para descrever essas concentrações em termos relativos. Uma solução é neutra se contiver concentrações iguais de íons hidrônio e hidróxido; ácida se contiver uma concentração maior de íons hidrônio do que íons hidróxido; e básica se contiver uma concentração menor de íons hidrônio do que íons hidróxido.
Um meio comum de expressar quantidades, cujos valores podem abranger várias ordens de magnitude, é usar uma escala logarítmica. Uma dessas escalas que é muito popular para concentrações químicas e constantes de equilíbrio é baseada na função p, definida conforme mostrado, onde “X” é a quantidade de interesse e “log” é o logaritmo de base 10:
\[\mathrm{pX=−\log X} \label{1} \]
O pH de uma solução é, portanto, definido conforme mostrado aqui, onde [H 3 O +] é a concentração molar do íon hidrônio na solução:
\[\mathrm{pH=-\log[H_3O^+]}\label{\(\PageIndex{2}\)} \]
Reorganizar essa equação para isolar a molaridade do íon hidrônio produz a expressão equivalente:
\[\mathrm{[H_3O^+]=10^{−pH}}\label{\(\PageIndex{3}\)} \]
Da mesma forma, a molaridade do íon hidróxido pode ser expressa como uma função p, ou pOH:
\[\mathrm{pOH=-\log [OH^−]}\label{\(\PageIndex{4}\)} \]
ou
\[\mathrm{[OH^-]=10^{−pOH}} \label{\(\PageIndex{5}\)} \]
Finalmente, a relação entre a concentração desses dois íons expressa como funções p é facilmente derivada da\(K_w\) expressão:
\[K_\ce{w}=\ce{[H_3O^+][OH^- ]} \label{\(\PageIndex{6}\)} \]
\[-\log K_\ce{w}=\mathrm{-\log([H_3O^+][OH^−])=-\log[H_3O^+] + -\log[OH^-]}\label{\(\PageIndex{7}\)} \]
\[\mathrm{p\mathit{K}_w=pH + pOH} \label{\(\PageIndex{8}\)} \]
A 25 °C, o valor de\(K_w\) é\(1.0 \times 10^{−14}\), e então:
\[\mathrm{14.00=pH + pOH} \label{\(\PageIndex{9}\)} \]
A molaridade do íon hidrônio em água pura (ou qualquer solução neutra) está\( 1.0 \times 10^{-7}\; M\) a 25 °C. O pH e o pOH de uma solução neutra a esta temperatura são, portanto:
\[\mathrm{pH=-\log[H_3O^+]=-\log(1.0\times 10^{−7}) = 7.00} \label{10} \]
\[\mathrm{pOH=-\log[OH^−]=-\log(1.0\times 10^{−7}) = 7.00} \label{11} \]
E assim, nessa temperatura, as soluções ácidas são aquelas com molaridades do íon hidrônio maiores que\( 1.0 \times 10^{-7}\; M\) e molaridades do íon hidróxido menores que\( 1.0 \times 10^{-7}\; M\) (correspondendo a valores de pH menores que 7,00 e valores de pOH maiores que 7,00). As soluções básicas são aquelas com molaridades do íon hidrônio menores que\( 1.0 \times 10^{-7}\; M\) e molaridades do íon hidróxido maiores que\( 1.0 \times 10^{-7}\; M\) (correspondendo a valores de pH maiores que 7,00 e valores de pH menores que 7,00).
Como a constante\(K_w\) de autoionização depende da temperatura, essas correlações entre os valores de pH e os adjetivos ácido/neutro/básico serão diferentes em temperaturas diferentes de 25 °C. Por exemplo, a molaridade do hidrônio da água pura a 80 °C é 4,9 × 10 −7 M, o que corresponde aos valores de pH e pOH de:
\[\begin{align*} pH &=-\log[\ce{H_3O^+}] \\[4pt] &= -\log(4.9\times 10^{−7}) \\[4pt] &=6.31 \label{12} \end{align*} \]
\[\begin{align*} pOH &=-\log[\ce{OH^-}]\\[4pt] & =-\log(4.9\times 10^{−7}) \\[4pt] &=6.31 \label{13}\end{align*} \]
Nessa temperatura, então, soluções neutras exibem pH = pOH = 6,31, soluções ácidas exibem pH menor que 6,31 e pOH maior que 6,31, enquanto soluções básicas exibem pH maior que 6,31 e pOH menor que 6,31. Essa distinção pode ser importante ao estudar certos processos que ocorrem em temperaturas não padronizadas, como reações enzimáticas em organismos de sangue quente. Salvo indicação em contrário, presume-se que as referências aos valores de pH sejam aquelas à temperatura padrão (25 °C) (Tabela\(\PageIndex{1}\)).
| Classificação | Concentrações de íons | pH a 25 °C |
|---|---|---|
| ácida | [H 3 O +] > [OH −] | pH < 7 |
| neutro | [H 3 O +] = [OH −] | pH = 7 |
| básico | [H 3 O +] < [OH −] | pH > 7 |
A figura\(\PageIndex{1}\) mostra as relações entre [H 3 O +], [OH −], pH e pOH, e fornece valores para essas propriedades em temperaturas padrão para algumas substâncias comuns.
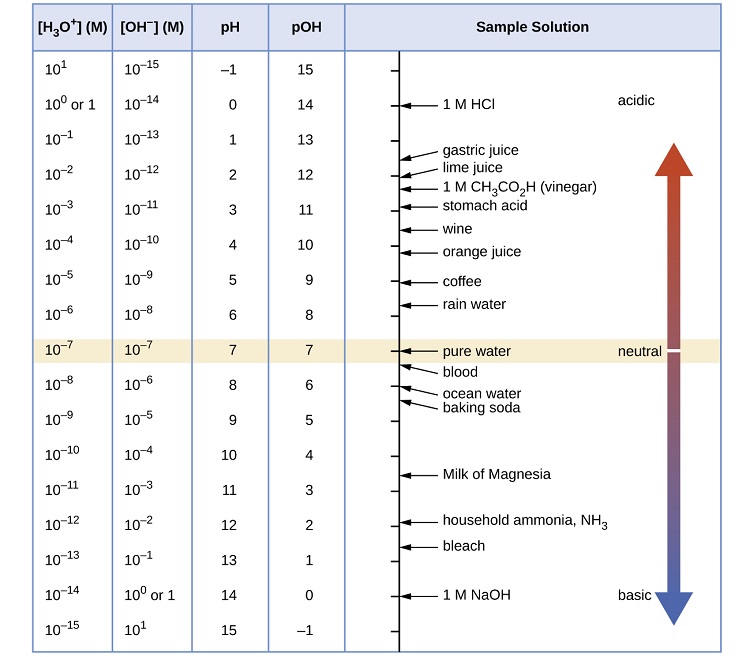
Qual é o pH do ácido estomacal, uma solução de HCl com uma concentração de íon hidrônio de\(1.2 \times 10^{−3}\; M\)?
Solução
\[\begin{align*} pH &=-\log [H_3O^+] \\[4pt] &= -\log(1.2 \times 10^{−3}) \\[4pt] &=−(−2.92) \\[4pt]&=2.92 \end{align*} \nonumber \]
A água exposta ao ar contém ácido carbônico, H 2 CO 3, devido à reação entre o dióxido de carbono e a água:
\[\ce{CO2(aq) + H2O (l) \rightleftharpoons H2CO3(aq)} \nonumber \]
A água saturada com ar tem uma concentração de íons hidrônio causada pela dissolução\(\ce{CO_2}\) de\(2.0 \times 10^{−6}\; M\), cerca de 20 vezes maior que a da água pura. Calcular o pH da solução a 25 °C.
- Responda
-
5,70
Calcule a concentração de íons hidrônio no sangue, cujo pH é 7,3 (ligeiramente alcalino).
Solução
\[\mathrm{pH=-\log[H_3O^+]=7.3} \nonumber \]
\[\mathrm{\log[H_3O^+]=−7.3} \nonumber \]
\[\mathrm{[H_3O^+]=10^{−7.3}} \nonumber \]
ou
\[[\ce{H_3O^+}]=\textrm{antilog of} −7.3 \nonumber \]
\[[\ce{H_3O^+}]=5\times 10^{−8}\;M \nonumber \]
(Em uma calculadora, pegue o antílogo, ou o log “inverso”, de −7,3, ou calcule 10 −7,3.)
Calcule a concentração de íons hidrônio de uma solução com um pH de −1,07.
- Responda
-
12 MM
Ciência ambiental
A água da chuva normal tem um pH entre 5 e 6 devido à presença de CO 2 dissolvido que forma ácido carbônico:
\[\ce{H2O (l) + CO2(g) ⟶ H2CO3(aq)} \label{14} \]
\[\ce{H2CO3(aq) \rightleftharpoons H^+(aq) + HCO3^- (aq)} \label{15} \]
A chuva ácida é a água da chuva que tem um pH inferior a 5, devido a uma variedade de óxidos não metálicos, incluindo CO 2, SO 2, SO 3, NO e NO 2 sendo dissolvidos na água e reagindo com ela para formar não apenas ácido carbônico, mas ácido sulfúrico e ácido nítrico. A formação e subsequente ionização do ácido sulfúrico são mostradas aqui:
\[\ce{H2O (l) + SO3(g) ⟶ H2SO4(aq)} \label{16} \]
\[\ce{H2SO4(aq) ⟶ H^+(aq) + HSO4^- (aq)} \label{17} \]
O dióxido de carbono está naturalmente presente na atmosfera porque nós e a maioria dos outros organismos o produzimos como um produto residual do metabolismo. O dióxido de carbono também é formado quando os incêndios liberam carbono armazenado na vegetação ou quando queimamos madeira ou combustíveis fósseis. O trióxido de enxofre na atmosfera é produzido naturalmente pela atividade vulcânica, mas também decorre da queima de combustíveis fósseis, que têm traços de enxofre, e do processo de “torrefação” de minérios de sulfetos metálicos em processos de refino de metais. Os óxidos de nitrogênio são formados em motores de combustão interna, onde as altas temperaturas permitem que o nitrogênio e o oxigênio no ar se combinem quimicamente.
A chuva ácida é um problema específico em áreas industriais onde os produtos da combustão e fundição são liberados no ar sem serem retirados dos óxidos de enxofre e nitrogênio. Na América do Norte e na Europa até a década de 1980, foi responsável pela destruição de florestas e lagos de água doce, quando a acidez da chuva realmente matou árvores, danificou o solo e tornou os lagos inabitáveis para todas as espécies, exceto as mais tolerantes a ácidos. A chuva ácida também corrói as fachadas de estátuas e edifícios que são feitas de mármore e calcário (Figura\(\PageIndex{2}\)). As regulamentações que limitam a quantidade de óxidos de enxofre e nitrogênio que podem ser liberados na atmosfera pela indústria e pelos automóveis reduziram a gravidade dos danos causados por ácidos em ambientes naturais e artificiais na América do Norte e na Europa. Agora é um problema crescente nas áreas industriais da China e da Índia.

Quais são o pOH e o pH de uma solução de 0,0125 M de hidróxido de potássio, KOH?
Solução
O hidróxido de potássio é um composto iônico altamente solúvel e se dissocia completamente quando dissolvido em solução diluída, produzindo [OH −] = 0,0125 M:
\[\mathrm{pOH=-\log[OH^− ]=-\log 0.0125} \nonumber \]
\[=−(−1.903)=1.903 \nonumber \]
O pH pode ser encontrado em\(\ce{pOH}\):
\[\mathrm{pH+pOH=14.00} \nonumber \]
\[\mathrm{pH=14.00−pOH=14.00−1.903=12.10} \nonumber \]
A concentração de íons hidrônio do vinagre é de aproximadamente\(4 \times 10^{−3}\; M\). Quais são os valores correspondentes de pOH e pH?
- Responda
-
pH = 11,6,
pH = 14,00 - pOH = 2,4
A acidez de uma solução é normalmente avaliada experimentalmente pela medição de seu pH. O pOH de uma solução geralmente não é medido, pois é facilmente calculado a partir de um valor de pH determinado experimentalmente. O pH de uma solução pode ser medido diretamente usando um medidor de pH (Figura\(\PageIndex{3}\)).

O pH de uma solução também pode ser estimado visualmente usando indicadores coloridos (Figura\(\PageIndex{3}\)).

Resumo
A concentração de íon hidrônio em uma solução de um ácido em água é maior do que\( 1.0 \times 10^{-7}\; M\) a 25 °C. A concentração de íon hidróxido em uma solução de uma base em água é maior que\( 1.0 \times 10^{-7}\; M\) a 25 °C. A concentração de H 3 O + em uma solução pode ser expressa como o pH do solução;\(\ce{pH} = -\log \ce{H3O+}\). A concentração de OH − pode ser expressa como o pOH da solução:\(\ce{pOH} = -\log[\ce{OH-}]\). Em água pura, pH = 7,00 e pOH = 7,00
Equações-chave
- \(\ce{pH}=-\log[\ce{H3O+}]\)
- \(\ce{pOH} = -\log[\ce{OH-}]\)
- [H 3 O +] = 10 −pH
- [OH −] = 10 −pOH
- pH + pOH = p K w = 14,00 a 25 °C
Glossário
- ácida
- descreve uma solução na qual [H 3 O +] > [OH −]
- básico
- descreve uma solução na qual [H 3 O +] < [OH −]
- neutro
- descreve uma solução na qual [H 3 O +] = [OH −]
- pH
- medida logarítmica da concentração de íons hidrônio em uma solução
- Oh
- medida logarítmica da concentração de íons hidróxido em uma solução


