14.1: Ácidos e bases de Brønsted-Lowry
- Page ID
- 185518
- Identifique ácidos, bases e pares ácido-base conjugados de acordo com a definição de Brønsted-Lowry
- Escreva equações para reações de ionização ácida e básica
- Use a constante do produto iônico para a água para calcular as concentrações de íons hidrônio e hidróxido
- Descreva o comportamento ácido-base das substâncias anfipróticas
Os ácidos e bases são conhecidos há muito tempo. Quando Robert Boyle os caracterizou em 1680, ele observou que os ácidos dissolvem muitas substâncias, mudam a cor de certos corantes naturais (por exemplo, eles mudam o tornassol de azul para vermelho) e perdem essas propriedades características após entrarem em contato com álcalis (bases). No século XVIII, foi reconhecido que os ácidos têm sabor amargo, reagem com o calcário para liberar uma substância gasosa (agora conhecida como CO 2) e interagem com álcalis para formar substâncias neutras. Em 1815, Humphry Davy contribuiu muito para o desenvolvimento do moderno conceito ácido-base ao demonstrar que o hidrogênio é o constituinte essencial dos ácidos. Na mesma época, Joseph Louis Gay-Lussac concluiu que os ácidos são substâncias que podem neutralizar as bases e que essas duas classes de substâncias só podem ser definidas em termos uma da outra. A importância do hidrogênio foi enfatizada novamente em 1884, quando Svante Arrhenius definiu um ácido como um composto que se dissolve na água para produzir cátions de hidrogênio (agora reconhecidos como íons hidrônio) e uma base como um composto que se dissolve na água para produzir ânions hidróxido.
Em um capítulo anterior sobre reações químicas, definimos ácidos e bases como fez Arrhenius: identificamos um ácido como um composto que se dissolve na água para produzir íons hidrônio (H 3 O +) e uma base como um composto que se dissolve na água para produzir íons hidróxido (\(\ce{OH-}\)). Essa definição não está errada; ela é simplesmente limitada.
Posteriormente, ampliamos a definição de ácido ou base usando a definição mais geral proposta em 1923 pelo químico dinamarquês Johannes Brønsted e pelo químico inglês Thomas Lowry. Sua definição se concentra no próton,\(\ce{H^+}\). Um próton é o que resta quando um átomo de hidrogênio normal,\(\ce{^1_1H}\), perde um elétron. Um composto que doa um próton para outro composto é chamado de ácido Brønsted-Lowry, e um composto que aceita um próton é chamado de base Brønsted-Lowry. Uma reação ácido-base é a transferência de um próton de um doador de prótons (ácido) para um aceitador de prótons (base). Em um capítulo subsequente deste texto, apresentaremos o modelo mais geral de comportamento ácido-base introduzido pelo químico americano G. N. Lewis.
Os ácidos podem ser compostos como HCl ou H 2 SO 4, ácidos orgânicos como ácido acético (\(\ce{CH_3COOH}\)) ou ácido ascórbico (vitamina C) ou H 2 O. Os ânions (como\(\ce{HSO_4^-}\)\(\ce{H_2PO_4^-}\)\(\ce{HS^-}\),,, e\(\ce{HCO_3^-}\)) e cátions (como\(\ce{H_3O^+}\)\(\ce{NH_4^+}\), e\(\ce{[Al(H_2O)_6]^{3+}}\)) podem também atuam como ácidos. As bases se enquadram nas mesmas três categorias. As bases podem ser moléculas neutras (como\(\ce{H_2O}\)\(\ce{NH_3}\), e\(\ce{CH_3NH_2}\)), ânions (como\(\ce{OH^-}\)\(\ce{HS^-}\)\(\ce{HCO_3^-}\),\(\ce{CO_3^{2−}}\),\(\ce{F^-}\),, e\(\ce{PO_4^{3−}}\)) ou cátions (como\(\ce{[Al(H_2O)_5OH]^{2+}}\)). As bases mais conhecidas são os compostos iônicos, como\(\ce{NaOH}\) e\(\ce{Ca(OH)_2}\), que contêm o íon hidróxido,\(\ce{OH^-}\). O íon hidróxido nesses compostos aceita um próton de ácidos para formar água:
\[\ce{H^+ + OH^- \rightarrow H_2O} \label{14.11} \]
Chamamos o produto que permanece depois que um ácido doa um próton de base conjugada do ácido. Esta espécie é uma base porque pode aceitar um próton (para reformar o ácido):
\[\text{acid} \rightleftharpoons \text{proton} + \text{conjugate base}\label{14.12a} \]
\[\ce{HF \rightleftharpoons H^+ + F^-} \label{14.12b} \]
\[\ce{H_2SO_4 \rightleftharpoons H^+ + HSO_4^{−}}\label{14.12c} \]
\[\ce{H_2O \rightleftharpoons H^+ + OH^-}\label{14.12d} \]
\[\ce{HSO_4^- \rightleftharpoons H^+ + SO_4^{2−}}\label{14.12e} \]
\[\ce{NH_4^+ \rightleftharpoons H^+ + NH_3} \label{14.12f} \]
Chamamos o produto que resulta quando uma base aceita um próton de ácido conjugado da base. Esta espécie é um ácido porque pode liberar um próton (e, assim, reformar a base):
\[\text{base} + \text{proton} \rightleftharpoons \text{conjugate acid} \label{14.13a} \]
\[\ce{OH^- +H^+ \rightleftharpoons H2O}\label{14.13b} \]
\[\ce{H_2O + H^+ \rightleftharpoons H3O+}\label{14.13c} \]
\[\ce{NH_3 +H^+ \rightleftharpoons NH4+}\label{14.13d} \]
\[\ce{S^{2-} +H^+ \rightleftharpoons HS-}\label{14.13e} \]
\[\ce{CO_3^{2-} +H^+ \rightleftharpoons HCO3-}\label{14.13f} \]
\[\ce{F^- +H^+ \rightleftharpoons HF} \label{14.13g} \]
Nesses dois conjuntos de equações, os comportamentos dos ácidos como doadores de prótons e das bases como aceitadores de prótons são representados isoladamente. Na realidade, todas as reações ácido-base envolvem a transferência de prótons entre ácidos e bases. Por exemplo, considere a reação ácido-base que ocorre quando a amônia é dissolvida na água. Uma molécula de água (funcionando como um ácido) transfere um próton para uma molécula de amônia (funcionando como base), produzindo a base conjugada da água\(\ce{OH^-}\), e o ácido conjugado da amônia,\(\ce{NH4+}\):
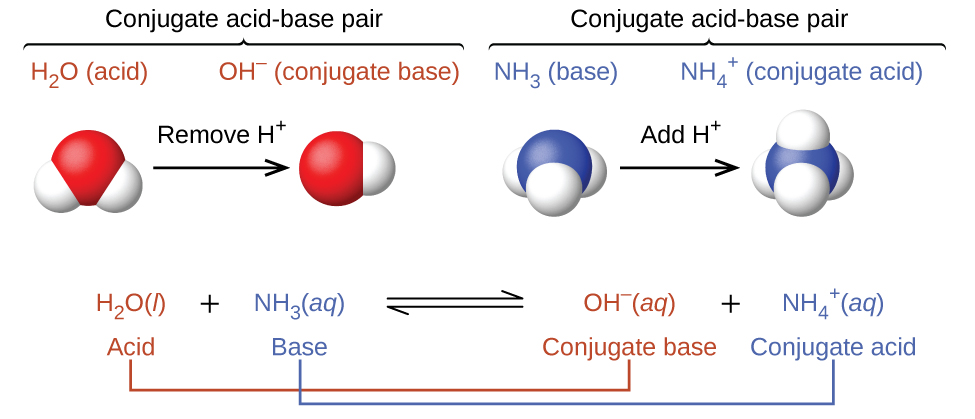
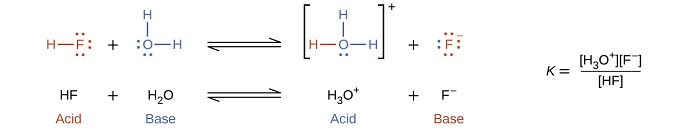
A reação entre um ácido Brønsted-Lowry e a água é chamada de ionização ácida. Por exemplo, quando o fluoreto de hidrogênio se dissolve na água e ioniza, os prótons são transferidos das moléculas de fluoreto de hidrogênio para as moléculas de água, produzindo íons hidrônio e íons fluoreto:
Quando adicionamos uma base à água, ocorre uma reação de ionização básica na qual os prótons são transferidos das moléculas de água para as moléculas básicas. Por exemplo, adicionar piridina à água produz íons hidróxido e íons piridínio:
Observe que essas duas reações de ionização são representadas como processos de equilíbrio. A extensão relativa em que essas reações de ionização ácida e básica ocorrem é um tópico importante tratado em uma seção posterior deste capítulo. Nos parágrafos anteriores, vimos que a água pode funcionar como ácido ou base, dependendo da natureza do soluto dissolvido nela. De fato, em água pura ou em qualquer solução aquosa, a água atua tanto como ácido quanto como base. Uma fração muito pequena das moléculas de água doa prótons para outras moléculas de água para formar íons hidrônio e íons hidróxido:
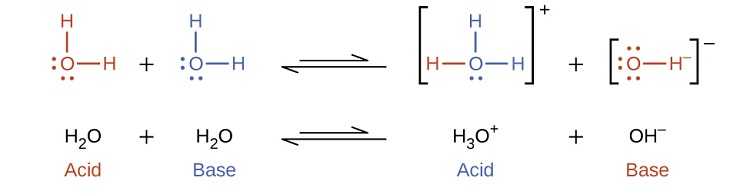
Esse tipo de reação, em que uma substância ioniza quando uma molécula da substância reage com outra molécula da mesma substância, é chamado de autoionização. A água pura sofre autoionização em uma extensão muito pequena. Apenas cerca de duas de cada\(10^9\) molécula em uma amostra de água pura são ionizadas a 25 °C. A constante de equilíbrio para a ionização da água é chamada de constante do produto iônico para a água (K w):
\[\ce{H_2O}_{(l)}+\ce{H_2O}_{(l)} \rightleftharpoons \ce{H_3O^+}_{(aq)}+\ce{OH^-}_{(aq)}\;\;\; K_\ce{w}=\ce{[H_3O^+][OH^- ]} \label{14.14} \]
A leve ionização da água pura é refletida no pequeno valor da constante de equilíbrio; a 25° C, Kw tem um valor de\(1.0 \times 10^{−14}\). O processo é endotérmico e, portanto, a extensão da ionização e as concentrações resultantes de íon hidrônio e íon hidróxido aumentam com a temperatura. Por exemplo, a 100 °C, o valor para\(K_\ce{w}\) é aproximadamente\(5.1 \times 10^{−13}\) 50 vezes maior do que o valor a 25 °C.
Qual é a concentração de íons hidrônio e a concentração de íons hidróxido em água pura a 25° C?
Solução
A autoionização da água produz o mesmo número de íons hidrônio e hidróxido. Portanto, em água pura,\(\ce{[H_3O^+]} = \ce{[OH^- ]}\). A 25 °C:
\[K_\ce{w}=\ce{[H_3O^+][OH^- ]}=\ce{[H_3O^+]^2}=\ce{[OH^- ]^2}=1.0 \times 10^{−14} \nonumber \]
Então:
\[\ce{[H_3O^+]}=\ce{[OH^- ]}=\sqrt{1.0 \times 10^{−14}} =1.0 \times 10^{−7}\; M \nonumber \]
A concentração do íon hidrônio e a concentração do íon hidróxido são as mesmas, e descobrimos que ambas são iguais\(1.0 \times 10^{−7}\; M\).
O produto iônico da água a 80° C é\(2.4 \times 10^{−13}\). Quais são as concentrações de íons hidrônio e hidróxido em água pura a 80 °C?
- Responda
-
\(\ce{[H_3O^+]} = \ce{[OH^- ]} = 4.9 \times 10^{−7}\; M\)
É importante perceber que o equilíbrio de autoionização da água é estabelecido em todas as soluções aquosas. Adicionar um ácido ou base à água não mudará a posição do equilíbrio. O exemplo 14.12 demonstra os aspectos quantitativos dessa relação entre as concentrações de íons hidrônio e hidróxido.
A proporcionalidade inversa de [H 3 O +] e [OH -] Uma solução de dióxido de carbono na água tem uma concentração de íon hidrônio de\(2.0 \times 10^{−6}\; M\). Qual é a concentração do íon hidróxido a 25 °C?
Solução
Sabemos o valor da constante do produto iônico para água a 25 °C:
\[\ce{2 H_2O}_{(l)} \rightleftharpoons \ce{H_3O^+}_{(aq)} + \ce{OH^-}_{(aq)} \nonumber \]
\[K_\ce{w}=\ce{[H3O+][OH^- ]}=1.0 \times 10^{−14} \nonumber \]
Assim, podemos calcular a concentração de equilíbrio que falta.
O rearranjo da expressão K w produz isso\([\ce{OH^- }]\) é diretamente proporcional ao inverso de [H 3 O +]:
\[[\ce{OH^- }]=\dfrac{K_{\ce w}}{[\ce{H_3O^+}]}=\dfrac{1.0 \times 10^{−14}}{2.0 \times 10^{−6}}=5.0 \times 10^{−9} \nonumber \]
A concentração do íon hidróxido na água é reduzida à\(5.0 \times 10^{−9}\: M\) medida que a concentração do íon hidrogênio aumenta para\(2.0 \times 10^{−6}\; M\). Isso é esperado do princípio de Le Chatelier; a reação de autoionização se desloca para a esquerda para reduzir o estresse do aumento da concentração de íons hidrônio e a\(\ce{[OH^- ]}\) é reduzida em relação à da água pura.
Uma verificação dessas concentrações confirma que nossa aritmética está correta:
\[\begin{align*} K_\ce{w} &=\ce{[H_3O^+][OH^- ]} \\[4pt] &=(2.0 \times 10^{−6})(5.0 \times 10^{−9})\\[4pt] &=1.0 \times 10^{−14} \end{align*} \nonumber \]
Qual é a concentração de íons hidrônio em uma solução aquosa com uma concentração de íon hidróxido de 0,001 M a 25 °C?
- Responda
-
\[\ce{[H3O+]} = 1 \times 10^{−11} M \nonumber \]
Espécies anfipróticas
Como a água, muitas moléculas e íons podem ganhar ou perder um próton nas condições apropriadas. Diz-se que essas espécies são anfipróticas. Outro termo usado para descrever essas espécies é anfotérico, que é um termo mais geral para uma espécie que pode atuar como ácido ou base por qualquer definição (não apenas a de Brønsted-Lowry). Considere, por exemplo, o íon bicarbonato, que pode doar ou aceitar um próton, conforme mostrado aqui:
\[\ce{HCO^-}_{3(aq)} + \ce{H_2O}_{(l)} \rightleftharpoons \ce{CO^{2-}}_{3(aq)} + \ce{H_3O^+}_{(aq)} \label{14.15a} \]
\[ \ce{HCO^-}_{3(aq)} + \ce{H_2O}_{(l)} \rightleftharpoons \ce{H_2CO}_{3(aq)} + \ce{OH^-}_{(aq)} \label{14.15b} \]
Escreva equações separadas representando a reação de\(\ce{HSO3-}\)
- como um ácido com\(\ce{OH^-}\)
- como base com HI
Solução
- \(\ce{HSO3-}(aq)+ \ce{OH^-}(aq)\rightleftharpoons \ce{SO3^2-}(aq)+ \ce{H_2O}_{(l)} \)
- \(\ce{HSO3-}(aq)+\ce{HI}(aq)\rightleftharpoons \ce{H2SO3}(aq)+\ce{I-}(aq)\)
Escreva equações separadas representando a reação de\(\ce{H2PO4-}\)
- como base com HBr
- como um ácido com\(\ce{OH^-}\)
- Responda a
-
\(\ce{H2PO4-}(aq)+\ce{HBr}(aq)\rightleftharpoons \ce{H3PO4}(aq)+\ce{Br-}(aq)\)
- Resposta b
-
\(\ce{H2PO4-}(aq)+\ce{OH^-} (aq)\rightleftharpoons \ce{HPO4^2-}(aq)+ \ce{H_2O}_{(l)} \)
Resumo
Um composto que pode doar um próton (um íon de hidrogênio) para outro composto é chamado de ácido Brønsted-Lowry. O composto que aceita o próton é chamado de base Brønsted-Lowry. A espécie restante após um ácido Brønsted-Lowry perder um próton é a base conjugada do ácido. A espécie formada quando uma base de Brønsted-Lowry ganha um próton é o ácido conjugado da base. Assim, uma reação ácido-base ocorre quando um próton é transferido de um ácido para uma base, com formação da base conjugada do ácido reagente e formação do ácido conjugado da base reagente. As espécies anfipróticas podem atuar tanto como doadoras de prótons quanto como aceitadoras de prótons. A água é a espécie anfiprótica mais importante. Ele pode formar tanto o íon hidrônio, H 3 O +, quanto o íon hidróxido,\(\ce{OH^-}\) quando sofre autoionização:
\[\ce{2 H_2O}_{(l)} \rightleftharpoons \ce{H_3O^+}(aq)+\ce{OH^-} (aq) \nonumber \]
O produto iônico da água, K w, é a constante de equilíbrio para a reação de autoionização:
\[K_\ce{w}=\mathrm{[H_3O^+][OH^- ]=1.0 \times 10^{−14} \; at\; 25°C} \nonumber \]
Equações-chave
- \[K_{\ce w} = \ce{[H3O+][OH^- ]} = 1.0 \times 10^{−14}\textrm{ (at 25 °C)} \nonumber \]
Glossário
- ionização ácida
- reação envolvendo a transferência de um próton de um ácido para a água, produzindo íons hidrônio e a base conjugada do ácido
- anfiprótico
- espécies que podem ganhar ou perder um próton em uma reação
- anfotérico
- espécies que podem atuar como ácido ou base
- autoionização
- reação entre espécies idênticas produzindo produtos iônicos; para a água, essa reação envolve a transferência de prótons para produzir íons hidrônio e hidróxido
- ionização de base
- reação envolvendo a transferência de um próton da água para uma base, produzindo íons hidróxido e o ácido conjugado da base
- Ácido Brønsted-Lowry
- doador de prótons
- Base Brønsted-Lowry
- aceitador de prótons
- ácido conjugado
- substância formada quando uma base ganha um próton
- base conjugada
- substância formada quando um ácido perde um próton
- constante de produto iônico para água (K w)
- constante de equilíbrio para a autoionização da água


