14.4: Hidrólise de soluções salinas
- Page ID
- 185563
- Preveja se uma solução salina será ácida, básica ou neutra
- Calcule as concentrações das várias espécies em uma solução salina
- Descreva o processo que faz com que as soluções de certos íons metálicos sejam ácidas
Como vimos na seção sobre reações químicas, quando um ácido e uma base são misturados, eles sofrem uma reação de neutralização. A palavra “neutralização” parece sugerir que uma solução estequiometricamente equivalente de um ácido e uma base seria neutra. Às vezes, isso é verdade, mas os sais que se formam nessas reações podem ter propriedades ácidas ou básicas próprias, como veremos agora.
Neutralização ácido-base
Uma solução é neutra quando contém concentrações iguais de íons hidrônio e hidróxido. Quando misturamos soluções de um ácido e uma base, ocorre uma reação de neutralização ácido-base. No entanto, mesmo se misturarmos quantidades estequiometricamente equivalentes, podemos descobrir que a solução resultante não é neutra. Ele pode conter um excesso de íons hidrônio ou um excesso de íons hidróxido porque a natureza do sal formado determina se a solução é ácida, neutra ou básica. As quatro situações a seguir ilustram como soluções com vários valores de pH podem surgir após uma reação de neutralização usando quantidades estequiometricamente equivalentes:
- Um ácido forte e uma base forte, como HCl (aq) e NaOH (aq), reagirão para formar uma solução neutra, pois os parceiros conjugados produzidos são de força insignificante:\[\ce{HCl}(aq)+\ce{NaOH}(aq)⇌\ce{NaCl}(aq)+\ce{H2O}(l) \nonumber \]
- Um ácido forte e uma base fraca produzem uma solução fracamente ácida, não por causa do ácido forte envolvido, mas por causa do ácido conjugado da base fraca.
- Um ácido fraco e uma base forte produzem uma solução fracamente básica. Uma solução de um ácido fraco reage com uma solução de uma base forte para formar a base conjugada do ácido fraco e o ácido conjugado da base forte. O ácido conjugado da base forte é um ácido mais fraco que a água e não tem efeito na acidez da solução resultante. No entanto, a base conjugada do ácido fraco é uma base fraca e ioniza levemente na água. Isso aumenta a quantidade de íon hidróxido na solução produzida na reação e a torna um pouco básica.
- Um ácido fraco mais uma base fraca pode produzir uma solução ácida, básica ou neutra. Esse é o mais complexo dos quatro tipos de reações. Quando o ácido conjugado e a base conjugada têm forças desiguais, a solução pode ser ácida ou básica, dependendo das forças relativas dos dois conjugados. Ocasionalmente, o ácido fraco e a base fraca terão a mesma força, então sua respectiva base conjugada e ácido terão a mesma força e a solução será neutra. Para prever se uma combinação específica será ácida, básica ou neutra, os valores tabulados de K dos conjugados devem ser comparados.
Antiácidos estomacais
Nossos estômagos contêm uma solução de aproximadamente 0,03 M de HCl, o que nos ajuda a digerir os alimentos que ingerimos. A sensação de queimação associada à azia é resultado do vazamento do ácido do estômago pela válvula muscular na parte superior do estômago para a parte inferior do esôfago. O revestimento do esôfago não está protegido dos efeitos corrosivos do ácido estomacal da mesma forma que o revestimento do estômago, e os resultados podem ser muito dolorosos. Quando temos azia, é melhor reduzir o excesso de ácido no esôfago tomando um antiácido. Como você deve ter adivinhado, os antiácidos são bases. Um dos antiácidos mais comuns é o carbonato de cálcio, CaCO 3. A reação,
\[CaCO_3(s)+2HCl(aq)⇌CaCl_2(aq)+H_2O(l)+CO_2(g) \nonumber \]
não apenas neutraliza o ácido estomacal, mas também produz CO 2 (g), o que pode resultar em um arroto satisfatório.
O leite de magnésia é uma suspensão da base moderadamente solúvel de hidróxido de magnésio, Mg (OH) 2. Funciona de acordo com a reação:
\[Mg(OH)_2(s)⇌Mg^{2+}(aq)+2OH^-(aq) \nonumber \]
Os íons hidróxido gerados nesse equilíbrio então reagem com os íons hidrônio do ácido estomacal, de modo que:
\[H_3O^+ + OH^- ⇌ 2H_2O(l) \nonumber \]
Essa reação não produz dióxido de carbono, mas os antiácidos contendo magnésio podem ter um efeito laxante. Vários antiácidos têm hidróxido de alumínio, Al (OH) 3, como ingrediente ativo. O hidróxido de alumínio tende a causar constipação, e alguns antiácidos usam hidróxido de alumínio em conjunto com hidróxido de magnésio para equilibrar os efeitos colaterais das duas substâncias.
Aspectos culinários da química
Cozinhar é essencialmente uma química sintética que por acaso é segura para comer. Existem vários exemplos de química ácido-base no mundo culinário. Um exemplo é o uso de bicarbonato de sódio ou bicarbonato de sódio na panificação. O NaHCo 3 é uma base. Quando reage com um ácido como suco de limão, soro de leite coalhado ou creme de leite em uma massa, bolhas de gás dióxido de carbono são formadas a partir da decomposição do ácido carbônico resultante e a massa “sobe”. O fermento em pó é uma combinação de bicarbonato de sódio e um ou mais sais ácidos que reagem quando os dois produtos químicos entram em contato com a água da massa.
Muitas pessoas gostam de colocar suco de limão ou vinagre, ambos ácidos, no peixe cozido (Figura\(\PageIndex{1}\)). Acontece que os peixes têm aminas (bases) voláteis em seus sistemas, que são neutralizadas pelos ácidos para produzir sais de amônio involáteis. Isso reduz o odor do peixe e também adiciona um sabor “amargo” que parece que gostamos.
A decapagem é um método usado para conservar vegetais usando um ambiente ácido produzido naturalmente. O vegetal, como um pepino, é colocado em um frasco selado submerso em uma solução de salmoura. A solução de salmoura favorece o crescimento de bactérias benéficas e suprime o crescimento de bactérias nocivas. As bactérias benéficas se alimentam de amidos no pepino e produzem ácido lático como resíduo em um processo chamado fermentação. O ácido lático eventualmente aumenta a acidez da salmoura a um nível que mata qualquer bactéria nociva, que requer um ambiente básico. Sem as bactérias nocivas que consomem os pepinos, eles podem durar muito mais do que se estivessem desprotegidos. Um subproduto do processo de decapagem altera o sabor dos vegetais com o ácido, tornando-os azedos.
Sais de bases fracas e ácidos fortes
Quando neutralizamos uma base fraca com um ácido forte, o produto é um sal contendo o ácido conjugado da base fraca. Este ácido conjugado é um ácido fraco. Por exemplo, o cloreto de amônio, NH 4 Cl, é um sal formado pela reação da amônia de base fraca com o ácido forte HCl:
\[\ce{NH3}(aq)+\ce{HCl}(aq)⟶\ce{NH4Cl}(aq) \nonumber \]
Uma solução desse sal contém íons de amônio e íons cloreto. O íon cloreto não tem efeito na acidez da solução, pois o HCl é um ácido forte. O cloreto é uma base muito fraca e não aceita um próton de forma mensurável. No entanto, o íon amônio, o ácido conjugado da amônia, reage com a água e aumenta a concentração do íon hidrônio:
\[\ce{NH4+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{NH3}(aq) \nonumber \]
A equação de equilíbrio para essa reação é simplesmente a constante de ionização. K a, para o ácido\(\ce{NH4+}\):
\[\ce{\dfrac{[H3O+][NH3]}{[NH4+]}}=K_\ce{a} \nonumber \]
Não encontraremos um valor de K a para o íon amônio na Tabela E1. No entanto, não é difícil determinar K a for a\(\ce{NH4+}\) partir do valor da constante de ionização da água, K w e K b, a constante de ionização de sua base conjugada, NH 3, usando a seguinte relação:
\[K_\ce{w}=K_\ce{a}×K_\ce{b} \nonumber \]
Essa relação vale para qualquer base e seu ácido conjugado ou para qualquer ácido e sua base conjugada.
A anilina é uma amina usada para fabricar corantes. É isolado como cloridrato de anilina\(\ce{[C6H5NH3+]Cl}\), um sal preparado pela reação da base fraca anilina e do ácido clorídrico. Qual é o pH de uma solução de 0,233 M de cloridrato de anilina?
\[\ce{C6H5NH3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{C6H5NH2}(aq) \nonumber \]
Solução
A nova etapa neste exemplo é determinar K a para o\(\ce{C6H5NH3+}\) íon. O\(\ce{C6H5NH3+}\) íon é o ácido conjugado de uma base fraca. O valor de K a para este ácido não está listado na Tabela E1, mas podemos determiná-lo a partir do valor de K b para anilina, C 6 H 5 NH 2, que é dado como 4,6 × 10 −10:
\[\mathrm{\mathit{K}_a(for\:C_6H_5NH_3^+)×\mathit{K}_b(for\:C_6H_5NH_2)=\mathit{K}_w=1.0×10^{−14}} \nonumber \]
\[\mathrm{\mathit{K}_a(for\:C_6H_5NH_3^+)=\dfrac{\mathit{K}_w}{\mathit{K}_b(for\:C_6H_5NH_2)}=\dfrac{1.0×10^{−14}}{4.6×10^{−10}}=2.3×10^{−5}} \nonumber \]
Agora temos a constante de ionização e a concentração inicial do ácido fraco, as informações necessárias para determinar a concentração de equilíbrio de H 3 O + e o pH:
Com essas etapas, encontramos [H 3 O +] = 2,3 × 10 −3 M e pH = 2,64
- Faça os cálculos e mostre que a concentração de íons hidrônio para uma solução de 0,233- M de\(\ce{C6H5NH3+}\) é 2,3 × 10 −3 e o pH é 2,64.
- Qual é a concentração de íons hidrônio em uma solução de 0,100- M de nitrato de amônio, NH 4 NO 3, um sal composto pelos íons\(\ce{NH4+}\)\(\ce{NO3-}\) e. Use os dados na Tabela E1 para determinar K b para o íon amônio. Qual é o ácido mais forte\(\ce{C6H5NH3+}\) ou\(\ce{NH4+}\)?
- Responda a
-
\(K_a\ce{(for\:NH4+)}=5.6×10^{−10}\), [H 3 O +] = 7,5 × 10−6 M
- Resposta b
-
\(\ce{C6H5NH3+}\)é o ácido mais forte (a) (b).
Sais de ácidos fracos e bases fortes
Quando neutralizamos um ácido fraco com uma base forte, obtemos um sal que contém a base conjugada do ácido fraco. Essa base conjugada geralmente é uma base fraca. Por exemplo, o acetato de sódio, NaCH 3 CO 2, é um sal formado pela reação do ácido acético fraco com o hidróxido de sódio de base forte:
\[\ce{CH3CO2H}(aq)+\ce{NaOH}(aq)⟶\ce{NaCH3CO2}(aq)+\ce{H2O}(aq) \nonumber \]
Uma solução desse sal contém íons sódio e íons acetato. O íon sódio não tem efeito sobre a acidez da solução. No entanto, o íon acetato, a base conjugada do ácido acético, reage com a água e aumenta a concentração do íon hidróxido:
\[\ce{CH3CO2-}(aq)+\ce{H2O}(l)⇌\ce{CH3CO2H}(aq)+\ce{OH-}(aq) \nonumber \]
A equação de equilíbrio para essa reação é a constante de ionização, K b, para a base\(\ce{CH3CO2-}\). O valor de K b pode ser calculado a partir do valor da constante de ionização da água, K w e K a, a constante de ionização do ácido conjugado do ânion usando a equação:
\[_\ce{w}=K_\ce{a}×K_\ce{b} \nonumber \]
Para o íon acetato e seu ácido conjugado, temos:
\[\mathrm{\mathit{K}_b(for\:\ce{CH_3CO_2^-})=\dfrac{\mathit{K}_w}{\mathit{K}_a(for\:CH_3CO_2H)}=\dfrac{1.0×10^{−14}}{1.8×10^{−5}}=5.6×10^{−10}} \nonumber \]
Alguns manuais não relatam valores de K b. Eles só relatam constantes de ionização para ácidos. Se quisermos determinar um valor de K b usando um desses manuais, devemos procurar o valor de K a para o ácido conjugado e convertê-lo em um valor de K b.
Determine a concentração de ácido acético em uma solução com\(\ce{[CH3CO2- ]}=0.050\:M\) e [OH −] = 2,5 × 10 −6 M em equilíbrio. A reação é:
\[\ce{CH3CO2-}(aq)+\ce{H2O}(l)⇌\ce{CH3CO2H}(aq)+\ce{OH-}(aq) \nonumber \]
Solução
Recebemos duas das três concentrações de equilíbrio e solicitamos que encontremos a concentração que falta. Se conseguirmos encontrar a constante de equilíbrio para a reação, o processo é simples.
O íon acetato se comporta como base nessa reação; os íons hidróxido são um produto. Determinamos K b da seguinte forma:
\[\mathrm{\mathit{K}_b(for\:\ce{CH_3CO_2^-})=\dfrac{\mathit{K}_w}{\mathit{K}_a(for\:CH_3CO_2H)}=\dfrac{1.0×10^{−14}}{1.8×10^{−5}}=5.6×10^{−10}} \nonumber \]
Agora encontre a concentração que falta:
\[K_\ce{b}=\ce{\dfrac{[CH3CO2H][OH- ]}{[CH3CO2- ]}}=5.6×10^{−10} \nonumber \]
\[=\dfrac{[\ce{CH3CO2H}](2.5×10^{−6})}{(0.050)}=5.6×10^{−10} \nonumber \]
Resolvendo essa equação, obtemos [CH 3 CO 2 H] = 1,1 × 10 −5 M.
Qual é o pH de uma solução de 0,083- M de CN −? Use 4,9 × 10 −10 como K a para HCN. Dica: Provavelmente precisaremos converter pOH em pH ou encontrar [H 3 O +] usando [OH −] nos estágios finais desse problema.
- Responda
-
11,16
Equilíbrio em uma solução de um sal de um ácido fraco e uma base fraca
Em uma solução de sal formada pela reação de um ácido fraco e uma base fraca, para prever o pH, devemos conhecer tanto o K a do ácido fraco quanto o K b da base fraca. Se K a > K b, a solução é ácida e se K b > K a, a solução é básica.
Determine se as soluções aquosas dos seguintes sais são ácidas, básicas ou neutras:
- KBr
- NaHCO 3
- NH 4 Cl
- Na 2 HPO 4
- NH 4 F
Solução
Considere cada um dos íons separadamente em termos de seu efeito no pH da solução, conforme mostrado aqui:
- O cátion K + e o ânion Br − são ambos espectadores, pois são o cátion de uma base forte (KOH) e o ânion de um ácido forte (HBr), respectivamente. A solução é neutra.
- O cátion Na + é um espectador e não afetará o pH da solução; o\(\ce{HCO3-}\) ânion é anfiprótico. O K a de\(\ce{HCO3-}\) é 4,7 × 10 −11, então o K b de sua base conjugada é\(\dfrac{1.0×10^{−14}}{4.7×10^{−11}}=2.1×10^{−4}\). Como K b >> K a, a solução é básica.
- O\(\ce{NH4+}\) íon é ácido e o íon Cl − é um espectador. A solução será ácida.
- O íon Na + é um espectador e não afetará o pH da solução, enquanto o\(\ce{HPO4^{2-}}\) íon é anfiprótico. O K a de\(\ce{HPO_4^{2-}}\) é 4,2 × 10 −13 e seu K b é\(\dfrac{1.0×10^{−14}}{4.2×10^{−13}}=2.4×10^{−2}\). Como K b >> K a, a solução é básica.
- O\(\ce{NH4+}\) íon está listado como sendo ácido e o íon F − está listado como base, então devemos comparar diretamente o K a e o K b dos dois íons. K a de\(\ce{NH4+}\) é 5,6 × 10 −10, o que parece muito pequeno, mas o K b de F − é 1,4 × 10 −11, então a solução é ácida, já que K a > K b.
Determine se as soluções aquosas dos seguintes sais são ácidas, básicas ou neutras:
- K 2 CO 3
- CaCl 2
- KH 2 PRO 4
- (NH 42) CO 3
- Laboratório 3
- Responda a
-
básico
- Resposta b
-
neutro
- Resposta c
-
ácida
- Resposta d
-
básico
- Responda e
-
ácida
A ionização de íons metálicos hidratados
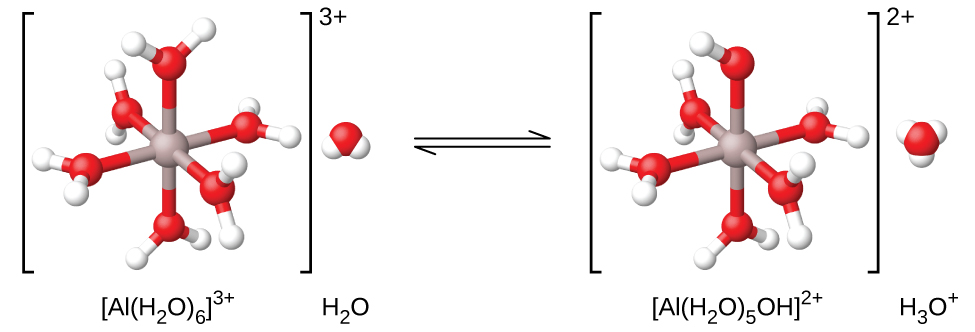
Se medirmos o pH das soluções de uma variedade de íons metálicos, descobriremos que esses íons agem como ácidos fracos quando em solução. O íon alumínio é um exemplo. Quando o nitrato de alumínio se dissolve na água, o íon alumínio reage com a água para dar um íon de alumínio hidratado\(\ce{Al(H2O)6^3+}\), dissolvido em água a granel. O que isso significa é que o íon alumínio tem as interações mais fortes com as seis moléculas de água mais próximas (a chamada primeira camada de solvatação), embora também interaja com as outras moléculas de água ao redor desse\(\ce{Al(H2O)6^3+}\) aglomerado:
\[\ce{Al(NO3)3}(s)+\ce{6H2O}(l)⟶\ce{Al(H2O)6^3+}(aq)+\ce{3NO3-}(aq) \nonumber \]
Frequentemente vemos a fórmula desse íon simplesmente como “Al 3 + (aq)”, sem observar explicitamente as seis moléculas de água que são as mais próximas do íon alumínio e apenas descrever o íon como sendo solvatado em água (hidratada). Isso é semelhante à simplificação da fórmula do íon hidrônio, H 3 O + para H +. No entanto, nesse caso, o íon alumínio hidratado é um ácido fraco (Figura\(\PageIndex{2}\)) e doa um próton para uma molécula de água. Assim, a hidratação se torna importante e podemos usar fórmulas que mostrem a extensão da hidratação:
\[\ce{Al(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)5(OH)^2+}(aq) \hspace{20px} K_\ce{a}=1.4×10^{−5} \nonumber \]
Como acontece com outros ácidos polipróticos, o íon alumínio hidratado ioniza em etapas, conforme mostrado por:
\[\ce{Al(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)5(OH)^2+}(aq) \nonumber \]
\[\ce{Al(H2O)5(OH)^2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)4(OH)2+}(aq) \nonumber \]
\[\ce{Al(H2O)4(OH)2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)3(OH)3}(aq) \nonumber \]
Observe que algumas dessas espécies de alumínio estão exibindo comportamento anfiprótico, pois estão atuando como ácidos quando aparecem no lado esquerdo das expressões de equilíbrio e como bases quando aparecem no lado direito.
No entanto, a ionização de um cátion carregando mais de uma carga geralmente não é extensa além do primeiro estágio. Exemplos adicionais do primeiro estágio na ionização de íons metálicos hidratados são:
\[\ce{Fe(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Fe(H2O)5(OH)^2+}(aq) \hspace{20px} K_\ce{a}=2.74 \nonumber \]
\[\ce{Cu(H2O)6^2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Cu(H2O)5(OH)+}(aq) \hspace{20px} K_\ce{a}=~6.3 \nonumber \]
\[\ce{Zn(H2O)4^2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Zn(H2O)3(OH)+}(aq) \hspace{20px} K_\ce{a}=9.6 \nonumber \]
Calcule o pH de uma solução de 0,10-M de cloreto de alumínio, que se dissolve completamente para dar o íon alumínio hidratado\(\ce{[Al(H2O)6]^3+}\) em solução.
Solução
Apesar da aparência incomum do ácido, esse é um problema típico de ionização ácida.
- Determine a direção da mudança. A equação para a reação e K a são:
\(\ce{Al(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)5(OH)^2+}(aq) \hspace{20px} K_\ce{a}=1.4×10^{−5}\)
A reação muda para a direita para alcançar o equilíbrio. - Determine as concentrações de x e equilíbrio. Use a mesa
:

Resolva para x e as concentrações de equilíbrio. Substituir as expressões pelas concentrações de equilíbrio na equação da constante de ionização produz:
- \[K_\ce{a}=\ce{\dfrac{[H3O+][Al(H2O)5(OH)^2+]}{[Al(H2O)6^3+]}} \nonumber \]
\(=\dfrac{(x)(x)}{0.10−x}=1.4 \times 10^{−5}\)
Solving this equation gives:
\[x=1.2×10^{−3}\:M \nonumber \]
From this we find:
\[\ce{[H3O+]}=0+x=1.2×10^{−3}\:M \nonumber \]
\[\mathrm{pH=−log[H_3O^+]=2.92(an\: acidic\: solution)} \nonumber \]
Check the work. The arithmetic checks; when 1.2 × 10−3 M is substituted for x, the result = Ka.
What is \(\ce{[Al(H2O)5(OH)^2+]}\) in a 0.15-M solution of Al(NO3)3 that contains enough of the strong acid HNO3 to bring [H3O+] to 0.10 M?
- Answer
-
2.1 × 10−5 M
The constants for the different stages of ionization are not known for many metal ions, so we cannot calculate the extent of their ionization. However, practically all hydrated metal ions other than those of the alkali metals ionize to give acidic solutions. Ionization increases as the charge of the metal ion increases or as the size of the metal ion decreases.
Summary
The characteristic properties of aqueous solutions of Brønsted-Lowry acids are due to the presence of hydronium ions; those of aqueous solutions of Brønsted-Lowry bases are due to the presence of hydroxide ions. The neutralization that occurs when aqueous solutions of acids and bases are combined results from the reaction of the hydronium and hydroxide ions to form water. Some salts formed in neutralization reactions may make the product solutions slightly acidic or slightly basic. Solutions that contain salts or hydrated metal ions have a pH that is determined by the extent of the hydrolysis of the ions in the solution. The pH of the solutions may be calculated using familiar equilibrium techniques, or it may be qualitatively determined to be acidic, basic, or neutral depending on the relative Ka and Kb of the ions involved.


