12.2: Fatores que afetam as taxas de reação
- Page ID
- 184978
- Descreva os efeitos da natureza química, estado físico, temperatura, concentração e catálise nas taxas de reação
As taxas nas quais os reagentes são consumidos e os produtos são formados durante as reações químicas variam muito. Podemos identificar cinco fatores que afetam as taxas de reações químicas: a natureza química das substâncias que reagem, o estado de subdivisão (um grande nódulo versus muitas partículas pequenas) dos reagentes, a temperatura dos reagentes, a concentração dos reagentes e a presença de um catalisador.
A natureza química das substâncias que reagem
A taxa de uma reação depende da natureza das substâncias participantes. As reações que parecem semelhantes podem ter taxas diferentes nas mesmas condições, dependendo da identidade dos reagentes. Por exemplo, quando pequenos pedaços dos metais ferro e sódio são expostos ao ar, o sódio reage completamente com o ar durante a noite, enquanto o ferro mal é afetado. Os metais ativos cálcio e sódio reagem com a água para formar gás hidrogênio e uma base. No entanto, o cálcio reage a uma taxa moderada, enquanto o sódio reage tão rapidamente que a reação é quase explosiva.
O estado de subdivisão dos reagentes
Exceto para substâncias no estado gasoso ou em solução, as reações ocorrem no limite, ou interface, entre duas fases. Portanto, a taxa de reação entre duas fases depende em grande parte do contato superficial entre elas. Um sólido finamente dividido tem mais área de superfície disponível para reação do que um grande pedaço da mesma substância. Assim, um líquido reagirá mais rapidamente com um sólido finamente dividido do que com um grande pedaço do mesmo sólido. Por exemplo, grandes pedaços de ferro reagem lentamente com os ácidos; o ferro finamente dividido reage muito mais rapidamente (Figura\(\PageIndex{1}\)). Pedaços grandes de madeira ardem, pedaços menores queimam rapidamente e a poeira da serra queima de forma explosiva.

Vídeo\(\PageIndex{1}\): A reação do césio com a água em câmera lenta e uma discussão sobre como o estado dos reagentes e o tamanho das partículas afetam as taxas de reação.
Temperatura dos reagentes
As reações químicas normalmente ocorrem mais rapidamente em temperaturas mais altas. A comida pode estragar rapidamente quando deixada no balcão da cozinha. No entanto, a temperatura mais baixa dentro de um refrigerador retarda esse processo para que o mesmo alimento permaneça fresco por dias. Usamos um queimador ou uma placa quente em laboratório para aumentar a velocidade das reações que ocorrem lentamente em temperaturas normais. Em muitos casos, um aumento na temperatura de apenas 10 °C aproximadamente dobrará a taxa de uma reação em um sistema homogêneo.
Concentrações dos reagentes
As taxas de muitas reações dependem das concentrações dos reagentes. As taxas geralmente aumentam quando a concentração de um ou mais dos reagentes aumenta. Por exemplo, o carbonato de cálcio (\(\mathrm{CaCO_3}\)) se deteriora como resultado de sua reação com o poluente dióxido de enxofre. A taxa dessa reação depende da quantidade de dióxido de enxofre no ar (Figura\(\PageIndex{2}\)). Como um óxido ácido, o dióxido de enxofre se combina com o vapor de água no ar para produzir ácido sulfuroso na seguinte reação:
\[\ce{SO}_{2(g)}+\ce{H_2O}_{(g)}⟶\ce{H_2SO}_{3(aq)} \label{12.3.1} \]
O carbonato de cálcio reage com o ácido sulfuroso da seguinte forma:
\[\ce{CaCO}_{3(s)}+\ce{H_2SO}_{3(aq)}⟶\ce{CaSO}_{3(aq)}+\ce{CO}_{2(g)}+\ce{H_2O}_{(l)} \label{12.3.2} \]
Em uma atmosfera poluída, onde a concentração de dióxido de enxofre é alta, o carbonato de cálcio se deteriora mais rapidamente do que em um ar menos poluído. Da mesma forma, o fósforo queima muito mais rapidamente em uma atmosfera de oxigênio puro do que no ar, que é apenas cerca de 20% de oxigênio.

Vídeo\(\PageIndex{2}\): O fósforo queima rapidamente no ar, mas queima ainda mais rapidamente se a concentração de oxigênio for maior.
A presença de um catalisador
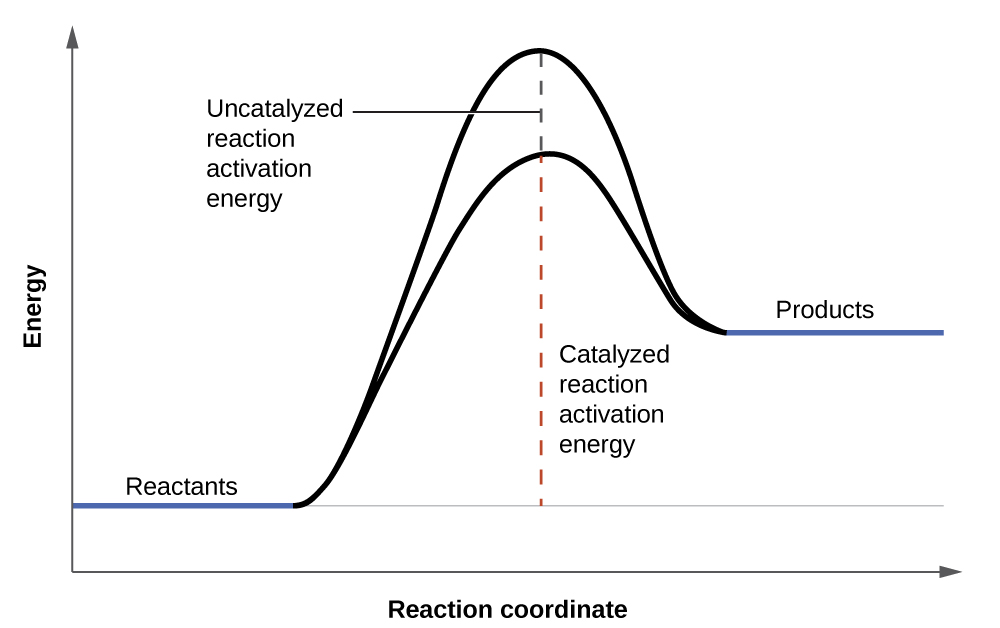
As soluções de peróxido de hidrogênio espumam quando colocadas em uma ferida aberta porque as substâncias nos tecidos expostos atuam como catalisadores, aumentando a taxa de decomposição do peróxido de hidrogênio. No entanto, na ausência desses catalisadores (por exemplo, no frasco do armário de remédios), a decomposição completa pode levar meses. Um catalisador é uma substância que aumenta a taxa de uma reação química ao diminuir a energia de ativação sem ser consumida pela reação. A energia de ativação é a quantidade mínima de energia necessária para que uma reação química prossiga na direção para frente. Um catalisador aumenta a taxa de reação fornecendo um caminho ou mecanismo alternativo para a reação seguir (Figura\(\PageIndex{3}\)). A catálise será discutida com mais detalhes posteriormente neste capítulo no que se refere aos mecanismos de reações.
As reações químicas ocorrem quando as moléculas colidem umas com as outras e passam por uma transformação química. Antes de realizar fisicamente uma reação em um laboratório, os cientistas podem usar simulações de modelagem molecular para prever como os parâmetros discutidos anteriormente influenciarão a taxa de uma reação. Use o PhET Reactions & Rates interativo para explorar como a temperatura, a concentração e a natureza dos reagentes afetam as taxas de reação.
Resumo
A taxa de uma reação química é afetada por vários parâmetros. As reações envolvendo duas fases ocorrem mais rapidamente quando há maior contato com a área de superfície. Se a temperatura ou a concentração do reagente aumentarem, a taxa de uma determinada reação geralmente também aumenta. Um catalisador pode aumentar a taxa de uma reação fornecendo uma via alternativa que faz com que a energia de ativação da reação diminua.
Glossário
- catalisador
- substância que aumenta a taxa de uma reação sem ser consumida pela reação


