9.6: Comportamento não ideal do gás
- Page ID
- 185457
- Descreva os fatores físicos que levam a desvios do comportamento ideal do gás
- Explique como esses fatores são representados na equação de van der Waals
- Defina a compressibilidade (Z) e descreva como sua variação com a pressão reflete o comportamento não ideal
- Quantifique o comportamento não ideal comparando cálculos das propriedades do gás usando a lei do gás ideal e a equação de van der Waals
Até agora, a lei do gás ideal, PV = NrT, tem sido aplicada a uma variedade de tipos diferentes de problemas, desde estequiometria de reação e problemas de fórmula empírica e molecular até a determinação da densidade e massa molar de um gás. Conforme mencionado nos módulos anteriores deste capítulo, no entanto, o comportamento de um gás geralmente não é ideal, o que significa que as relações observadas entre sua pressão, volume e temperatura não são descritas com precisão pelas leis do gás. Nesta seção, as razões para esses desvios do comportamento ideal do gás são consideradas.
Uma maneira pela qual a precisão de PV = NrT pode ser avaliada é comparando o volume real de 1 mol de gás (seu volume molar, Vm) com o volume molar de um gás ideal na mesma temperatura e pressão. Essa relação é chamada de fator de compressibilidade (Z) com:
\[\mathrm{Z=\dfrac{molar\: volume\: of\: gas\: at\: same\:\mathit{T}\:and\:\mathit{P}}{molar\: volume\: of\: ideal\: gas\: at\: same\:\mathit{T}\:and\:\mathit{P}}}=\left(\dfrac{PV_m}{RT}\right)_\ce{measured} \nonumber \]
O comportamento ideal do gás é, portanto, indicado quando essa razão é igual a 1, e qualquer desvio de 1 é uma indicação de comportamento não ideal. A figura\(\PageIndex{1}\) mostra gráficos de Z em uma grande faixa de pressão para vários gases comuns.
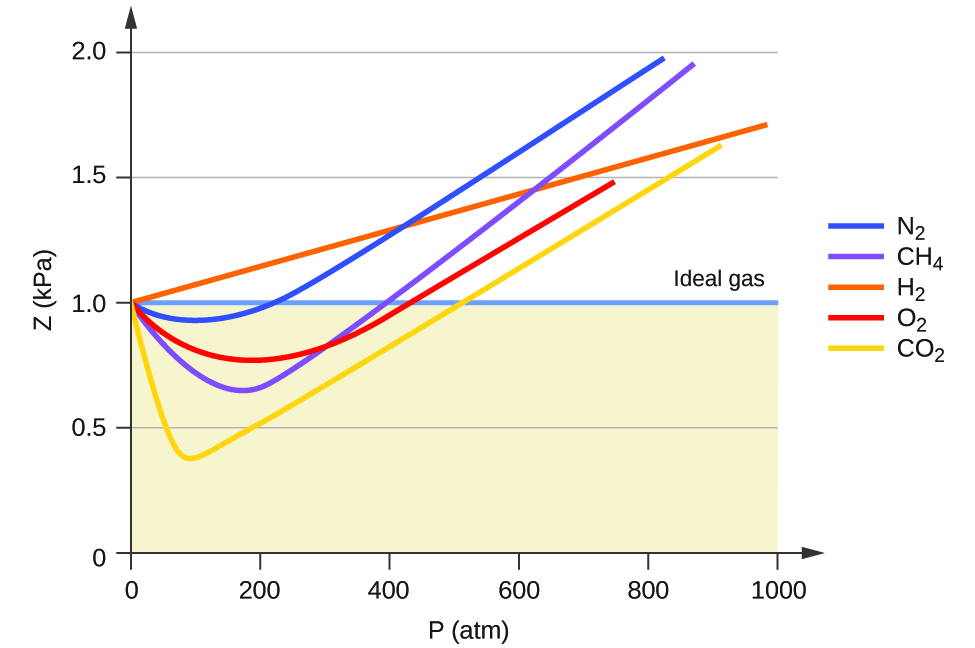
Como é evidente na Figura\(\PageIndex{1}\), a lei do gás ideal não descreve bem o comportamento do gás em pressões relativamente altas. Para determinar por que isso ocorre, considere as diferenças entre as propriedades reais do gás e o que se espera de um gás ideal hipotético.
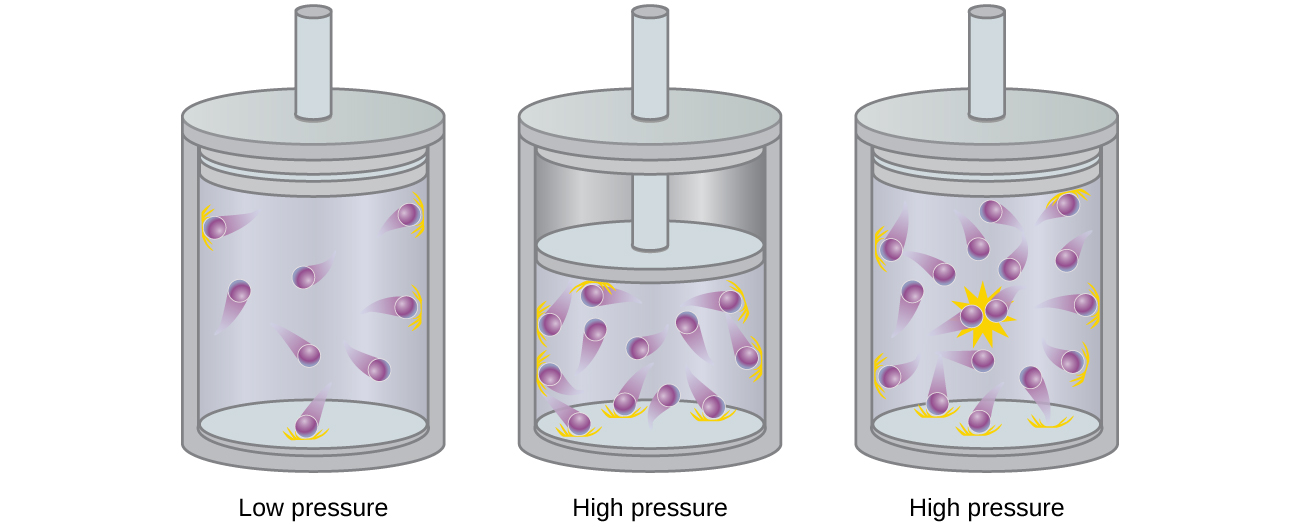
Partículas de um gás hipotético ideal não têm volume significativo e não se atraem nem se repelem. Em geral, gases reais se aproximam desse comportamento em pressões e altas temperaturas relativamente baixas. No entanto, em altas pressões, as moléculas de um gás ficam mais próximas e a quantidade de espaço vazio entre as moléculas é reduzida. Nessas pressões mais altas, o volume das próprias moléculas de gás se torna apreciável em relação ao volume total ocupado pelo gás (Figura\(\PageIndex{2}\)). O gás, portanto, se torna menos compressível nessas altas pressões e, embora seu volume continue diminuindo com o aumento da pressão, essa diminuição não é proporcional, conforme previsto pela lei de Boyle.
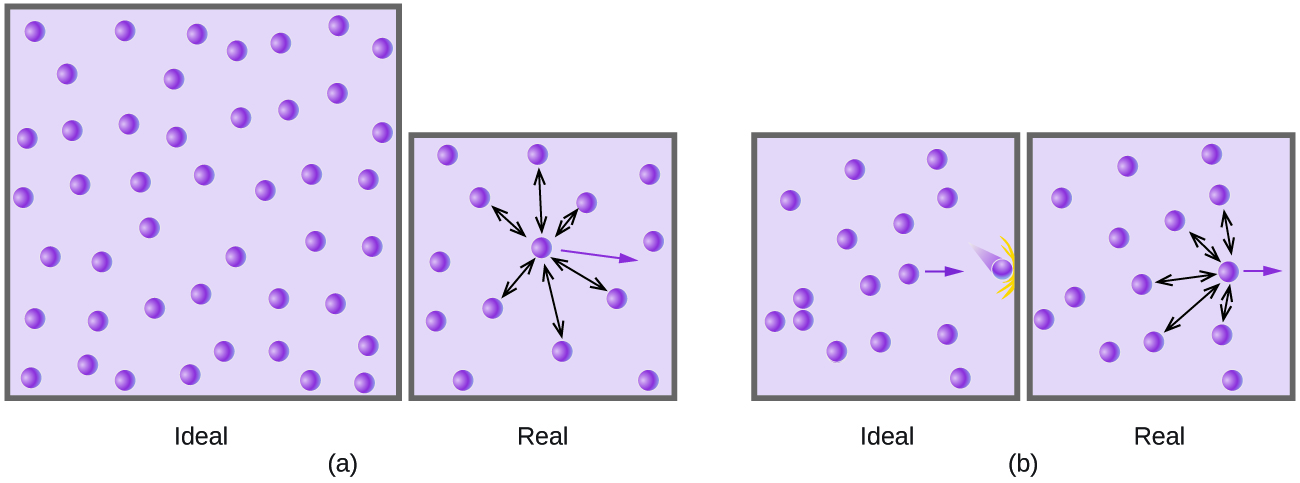
Em pressões relativamente baixas, as moléculas de gás praticamente não têm atração uma pela outra porque estão (em média) muito distantes e se comportam quase como partículas de um gás ideal. Em pressões mais altas, no entanto, a força de atração também não é mais insignificante. Essa força aproxima um pouco as moléculas, diminuindo levemente a pressão (se o volume for constante) ou diminuindo o volume (com pressão constante) (Figura\(\PageIndex{3}\)). Essa mudança é mais pronunciada em baixas temperaturas porque as moléculas têm menor KE em relação às forças de atração e, portanto, são menos eficazes para superar essas atrações após colidirem umas com as outras.
Existem várias equações diferentes que se aproximam melhor do comportamento do gás do que a lei do gás ideal. A primeira e mais simples delas foi desenvolvida pelo cientista holandês Johannes van der Waals em 1879. A equação de van der Waals melhora a lei do gás ideal adicionando dois termos: um para explicar o volume das moléculas de gás e outro para as forças de atração entre elas.
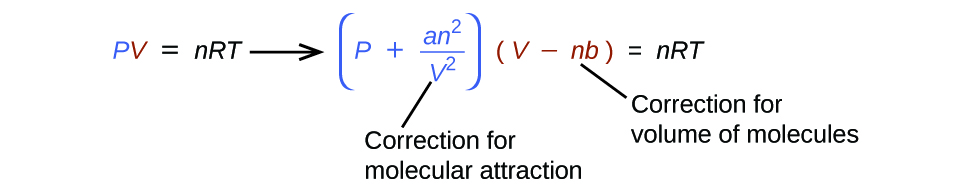
A constante a corresponde à força da atração entre as moléculas de um determinado gás, e a constante b corresponde ao tamanho das moléculas de um determinado gás. A “correção” do termo de pressão na lei do gás ideal é\(\dfrac{n^2a}{V^2}\), e a “correção” do volume é nb. Observe que quando V é relativamente grande e n é relativamente pequeno, esses dois termos de correção se tornam insignificantes, e a equação de van der Waals se reduz à lei ideal do gás, PV = NrT. Essa condição corresponde a um gás no qual um número relativamente baixo de moléculas está ocupando um volume relativamente grande, ou seja, um gás a uma pressão relativamente baixa. Os valores experimentais para as constantes de van der Waals de alguns gases comuns são apresentados na Tabela\(\PageIndex{1}\).
| Gás | a (L 2 atm/mol 2) | b (L/mol) |
|---|---|---|
| N 2 | 1,39 | 0,0391 |
| OU 2 | 1,36 | 0,0318 |
| CO 2 | 3,59 | 0,0427 |
| H 2 O | 5.46 | 0,0305 |
| Ele | 0,0342 | 0,0237 |
| CCl 4 | 20,4 | 0,1383 |
Em baixas pressões, a correção da atração intermolecular, a, é mais importante do que a do volume molecular, b. Em altas pressões e pequenos volumes, a correção do volume das moléculas se torna importante porque as próprias moléculas são incompressíveis e constituem uma fração apreciável do volume total. Em alguma pressão intermediária, as duas correções têm influências opostas e o gás parece seguir a relação dada por PV = NrT em uma pequena faixa de pressões. Esse comportamento é refletido pelas “quedas” em várias das curvas de compressibilidade mostradas na Figura\(\PageIndex{1}\). A força de atração entre as moléculas inicialmente torna o gás mais compressível do que um gás ideal, à medida que a pressão aumenta (Z diminui com o aumento de P). Em pressões muito altas, o gás se torna menos compressível (Z aumenta com P), à medida que as moléculas do gás começam a ocupar uma fração cada vez mais significativa do volume total do gás.
Estritamente falando, a equação do gás ideal funciona bem quando as atrações intermoleculares entre as moléculas de gás são insignificantes e as próprias moléculas de gás não ocupam uma parte apreciável de todo o volume. Esses critérios são satisfeitos em condições de baixa pressão e alta temperatura. Sob tais condições, diz-se que o gás se comporta de maneira ideal, e os desvios das leis do gás são pequenos o suficiente para serem ignorados — esse, no entanto, muitas vezes não é o caso.
Um frasco de 4,25 L contém 3,46 mol de CO 2 a 229 °C. Calcule a pressão desta amostra de CO 2:
- da lei do gás ideal
- da equação de van der Waals
- Explique o (s) motivo (s) da diferença.
Solução
(a) Da lei do gás ideal:
(b) Da equação de van der Waals:
\(\left(P+\dfrac{n^2a}{V^2}\right)×(V−nb)=nRT⟶P=\dfrac{nRT}{(V−nb)}−\dfrac{n^2a}{V^2}\)
\(P=\mathrm{\dfrac{3.46\:mol×0.08206\:L\:atm\:mol^{−1}\:K^{−1}×502\: K}{(4.25\:L−3.46\:mol×0.0427\:L\:mol^{−1})}−\dfrac{(3.46\:mol)^2×3.59\:L^2\:atm\:mol^2}{(4.25\:L)^2}}\)
Isso finalmente produz P = 32,4 atm.
(c) Isso não é muito diferente do valor da lei do gás ideal porque a pressão não é muito alta e a temperatura não é muito baixa. O valor é um pouco diferente porque as moléculas de CO 2 têm algum volume e atrações entre as moléculas, e a lei do gás ideal pressupõe que elas não tenham volume ou atrações.
Um frasco de 560 ml contém 21,3 g de N 2 a 145 °C. Calcule a pressão de N 2:
- da lei do gás ideal
- da equação de van der Waals
- Explique o (s) motivo (s) da diferença.
- Responda a
-
46,562 atm
- Resposta b
-
46.594 atm
- Resposta c
-
A equação de van der Waals leva em consideração o volume das próprias moléculas de gás, bem como as atrações intermoleculares.
Resumo
As moléculas de gás possuem um volume finito e experimentam forças de atração umas pelas outras. Consequentemente, o comportamento do gás não é necessariamente bem descrito pela lei do gás ideal. Sob condições de baixa pressão e alta temperatura, esses fatores são insignificantes, a equação ideal do gás é uma descrição precisa do comportamento do gás e diz-se que o gás apresenta um comportamento ideal. No entanto, em temperaturas mais baixas e pressões mais altas, correções no volume molecular e nas atrações moleculares são necessárias para contabilizar o tamanho molecular finito e as forças de atração. A equação de van der Waals é uma versão modificada da lei do gás ideal que pode ser usada para explicar o comportamento não ideal dos gases nessas condições.
Equações-chave
- \(\mathrm{Z=\dfrac{molar\:volume\: of\: gas\: at\: same\:\mathit{T}\:and\:\mathit{P}}{molar\: volume\: of\: ideal\: gas\: at\: same\:\mathit{T}\:and\:\mathit{P}}}=\left(\dfrac{P×V_m}{R×T}\right)_\ce{measured}\)
- \(\left(P+\dfrac{n^2a}{V^2}\right)×(V−nb)=nRT\)
Glossário
- fator de compressibilidade (Z)
- razão entre o volume molar medido experimentalmente para um gás e seu volume molar, conforme calculado a partir da equação do gás ideal
- equação de van der Waals
- versão modificada da equação do gás ideal contendo termos adicionais para explicar o comportamento não ideal do gás


