9.5: A Teoria Cinético-Molecular
- Page ID
- 185440
- Declare os postulados da teoria cinético-molecular
- Use os postulados dessa teoria para explicar as leis do gás
As leis dos gases que vimos até agora, assim como a equação ideal do gás, são empíricas, ou seja, foram derivadas de observações experimentais. As formas matemáticas dessas leis descrevem de perto o comportamento macroscópico da maioria dos gases em pressões menores que cerca de 1 ou 2 atm. Embora as leis dos gases descrevam relações que foram verificadas por muitos experimentos, elas não nos dizem por que os gases seguem essas relações.
A teoria molecular cinética (KMT) é um modelo microscópico simples que explica efetivamente as leis dos gases descritas nos módulos anteriores deste capítulo. Essa teoria é baseada nos seguintes cinco postulados descritos aqui. (Nota: O termo “molécula” será usado para se referir às espécies químicas individuais que compõem o gás, embora alguns gases sejam compostos por espécies atômicas, por exemplo, os gases nobres.)
- Os gases são compostos por moléculas que estão em movimento contínuo, viajando em linhas retas e mudando de direção somente quando colidem com outras moléculas ou com as paredes de um recipiente.
- As moléculas que compõem o gás são insignificantemente pequenas em comparação com as distâncias entre elas.
- A pressão exercida por um gás em um recipiente resulta de colisões entre as moléculas do gás e as paredes do recipiente.
- As moléculas de gás não exercem forças atrativas ou repulsivas umas sobre as outras ou sobre as paredes do recipiente; portanto, suas colisões são elásticas (não envolvem perda de energia).
- A energia cinética média das moléculas de gás é proporcional à temperatura kelvin do gás.
O teste do KMT e seus postulados é sua capacidade de explicar e descrever o comportamento de um gás. As várias leis dos gases podem ser derivadas das suposições do KMT, que levaram os químicos a acreditar que as suposições da teoria representam com precisão as propriedades das moléculas de gás. Primeiro, examinaremos conceitualmente as leis individuais do gás (leis de Boyle, Charles, Amontons, Avogadro e Dalton) para ver como o KMT as explica. Em seguida, consideraremos com mais cuidado as relações entre massas moleculares, velocidades e energias cinéticas com a temperatura e explicaremos a lei de Graham.
A teoria cinético-molecular explica o comportamento dos gases, parte I
Lembrando que a pressão do gás é exercida por moléculas de gás que se movem rapidamente e depende diretamente do número de moléculas que atingem uma unidade de área da parede por unidade de tempo, vemos que o KMT explica conceitualmente o comportamento de um gás da seguinte forma:
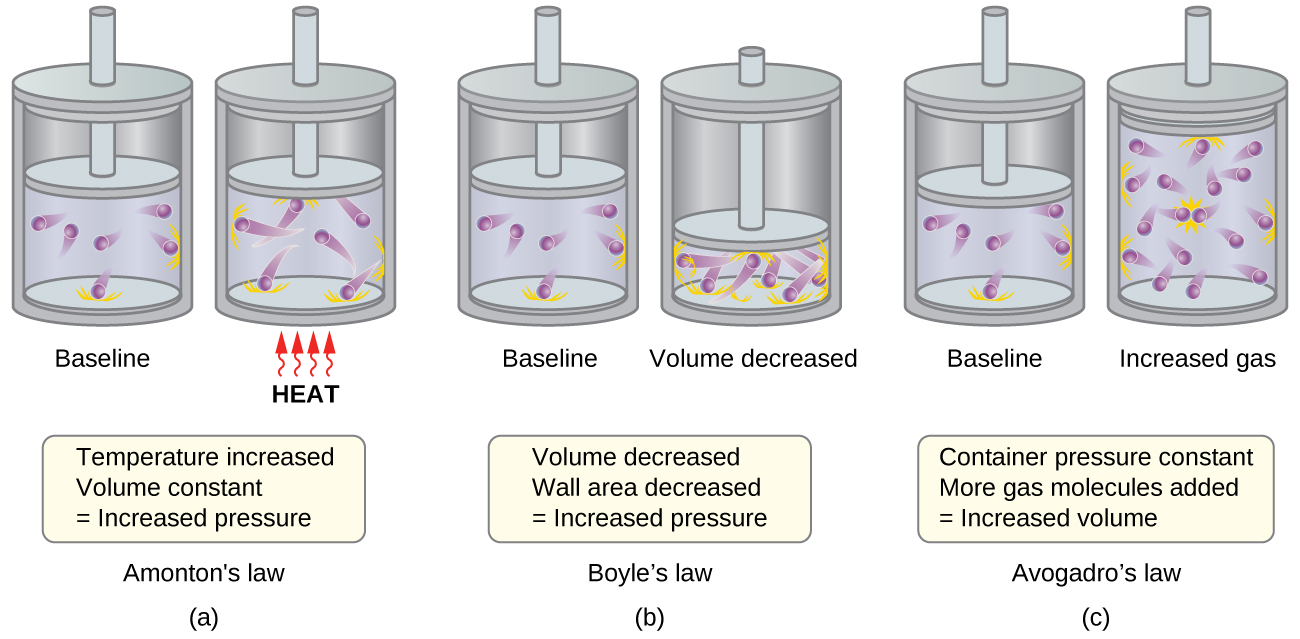
- Lei de Amontons. Se a temperatura for aumentada, a velocidade média e a energia cinética das moléculas de gás aumentam. Se o volume for mantido constante, o aumento da velocidade das moléculas de gás resulta em colisões mais frequentes e mais fortes com as paredes do recipiente, aumentando assim a pressão (Figura\(\PageIndex{1a}\)).
- A lei de Charles. Se a temperatura de um gás for aumentada, uma pressão constante só pode ser mantida se o volume ocupado pelo gás aumentar. Isso resultará em maiores distâncias médias percorridas pelas moléculas para alcançar as paredes do recipiente, bem como em uma maior área de superfície da parede. Essas condições diminuirão a frequência das colisões da parede molecular e o número de colisões por unidade de área, cujos efeitos combinados equilibram o efeito do aumento das forças de colisão devido à maior energia cinética na temperatura mais alta.
- Lei de Boyle. Se o volume do gás diminuir, a área da parede do recipiente diminui e a frequência de colisão da parede da molécula aumenta, o que aumenta a pressão exercida pelo gás (Figura\(\PageIndex{1b}\)).
- Lei de Avogadro. Em pressão e temperatura constantes, a frequência e a força das colisões da parede molecular são constantes. Sob tais condições, aumentar o número de moléculas gasosas exigirá um aumento proporcional no volume do recipiente para reduzir o número de colisões por unidade de área para compensar o aumento da frequência de colisões (Figura\(\PageIndex{1c}\)).
- Lei de Dalton. Devido às grandes distâncias entre eles, as moléculas de um gás em uma mistura bombardeiam as paredes do recipiente com a mesma frequência, independentemente de outros gases estarem presentes ou não, e a pressão total de uma mistura gasosa é igual à soma das pressões (parciais) dos gases individuais.
Velocidades moleculares e energia cinética
A discussão anterior mostrou que o KMT explica qualitativamente os comportamentos descritos pelas várias leis do gás. Os postulados dessa teoria podem ser aplicados de uma forma mais quantitativa para derivar essas leis individuais. Para fazer isso, devemos primeiro observar as velocidades e energias cinéticas das moléculas de gás e a temperatura de uma amostra de gás.
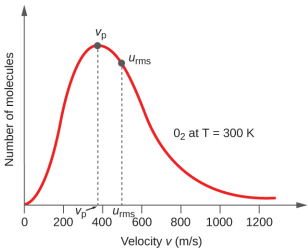
Em uma amostra de gás, moléculas individuais têm velocidades amplamente variadas; no entanto, devido ao grande número de moléculas e colisões envolvidas, a distribuição da velocidade molecular e a velocidade média são constantes. Essa distribuição de velocidade molecular é conhecida como distribuição Maxwell-Boltzmann e representa o número relativo de moléculas em uma amostra a granel de gás que possui uma determinada velocidade (Figura\(\PageIndex{2}\)).
A energia cinética (KE) de uma partícula de massa (m) e velocidade (u) é dada por:
\[\ce{KE}=\dfrac{1}{2}mu^2 \nonumber \]
Expressar massa em quilogramas e velocidade em metros por segundo produzirá valores de energia em unidades de joules (J = kg m 2 s —2). Para lidar com um grande número de moléculas de gás, usamos médias de velocidade e energia cinética. No KMT, a raiz da velocidade quadrada média de uma partícula, u rms, é definida como a raiz quadrada da média dos quadrados das velocidades com n = o número de partículas:
\[u_\ce{rms}=\sqrt{\overline{u^2}}=\sqrt{\dfrac{u^2_1+u^2_2+u^2_3+u^2_4+…}{n}} \nonumber \]
A energia cinética média, KE avg, é então igual a:
\[\mathrm{KE_{avg}}=\dfrac{1}{2}mu^2_\ce{rms} \nonumber \]
A média KE de uma coleção de moléculas de gás também é diretamente proporcional à temperatura do gás e pode ser descrita pela equação:
\[\mathrm{KE_{avg}}=\dfrac{3}{2}RT \nonumber \]
onde R é a constante do gás e T é a temperatura kelvin. Quando usada nessa equação, a forma apropriada da constante do gás é 8,314 J mol -1 K -1 (8,314 kg m 2 s — 2 mol -1 K —1). Essas duas equações separadas para a média KE podem ser combinadas e reorganizadas para produzir uma relação entre velocidade molecular e temperatura:
\[\dfrac{1}{2}mu^2_\ce{rms}=\dfrac{3}{2}RT \nonumber \]
\[u_\ce{rms}=\sqrt{\dfrac{3RT}{m}} \label{RMS} \]
Calcule a velocidade quadrada média de uma molécula de nitrogênio a 30 °C.
Solução
Converta a temperatura em Kelvin:
\[30°C+273=303\: K \nonumber \]
Determine a massa de uma molécula de nitrogênio em quilogramas:
\[\mathrm{\dfrac{28.0\cancel{g}}{1\: mol}×\dfrac{1\: kg}{1000\cancel{g}}=0.028\:kg/mol} \nonumber \]
Substitua as variáveis e constantes na fórmula da velocidade quadrada média (Equação\ ref {RMS}), substituindo Joules pelo equivalente kg m 2 s —2:
\[ \begin{align*} u_\ce{rms} &= \sqrt{\dfrac{3RT}{m}} \\ u_\ce{rms} &=\sqrt{\dfrac{3(8.314\:J/mol\: K)(303\: K)}{(0.028\:kg/mol)}} \\ &=\sqrt{2.70 \times 10^5\:m^2s^{−2}} \\ &= 519\:m/s \end{align*} \nonumber \]
Calcule a velocidade quadrada média de uma molécula de oxigênio a —23 °C.
- Resposta
-
441 m/s
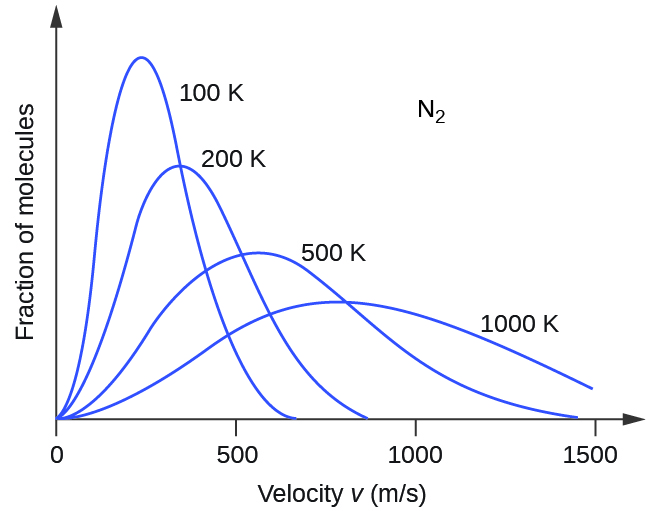
Se a temperatura de um gás aumenta, sua média de KE aumenta, mais moléculas têm velocidades mais altas e menos moléculas têm velocidades mais baixas, e a distribuição muda para velocidades mais altas em geral, ou seja, para a direita. Se a temperatura diminuir, a média KE diminui, mais moléculas têm velocidades mais baixas e menos moléculas têm velocidades mais altas, e a distribuição muda para velocidades mais baixas em geral, ou seja, para a esquerda. Esse comportamento é ilustrado para o gás nitrogênio na Figura\(\PageIndex{3}\).
Em uma determinada temperatura, todos os gases têm a mesma média de KE para suas moléculas. Gases compostos por moléculas mais leves têm mais partículas de alta velocidade e um u rms mais alto, com uma distribuição de velocidade que atinge o pico em velocidades relativamente mais altas. Gases que consistem em moléculas mais pesadas têm mais partículas de baixa velocidade, u rms mais baixos e uma distribuição de velocidade que atinge o pico em velocidades relativamente mais baixas. Essa tendência é demonstrada pelos dados de uma série de gases nobres mostrados na Figura\(\PageIndex{4}\).

O simulador de gás pode ser usado para examinar o efeito da temperatura nas velocidades moleculares. Examine os “histogramas de energia” (distribuições de velocidade molecular) e as “informações de espécies” do simulador (que fornecem valores médios de velocidade) para moléculas de diferentes massas em várias temperaturas.
A teoria cinético-molecular explica o comportamento dos gases, parte II
De acordo com a lei de Graham, as moléculas de um gás estão em movimento rápido e as próprias moléculas são pequenas. A distância média entre as moléculas de um gás é grande em comparação com o tamanho das moléculas. Como consequência, as moléculas de gás podem se mover umas sobre as outras facilmente e se difundir a taxas relativamente rápidas.
A taxa de efusão de um gás depende diretamente da velocidade (média) de suas moléculas:
\[\textrm{effusion rate} ∝ u_\ce{rms} \nonumber \]
Usando essa relação e a equação que relaciona a velocidade molecular à massa, a lei de Graham pode ser facilmente derivada conforme mostrado aqui:
\[u_\ce{rms}=\sqrt{\dfrac{3RT}{m}} \nonumber \]
\[m=\dfrac{3RT}{u^2_\ce{rms}}=\dfrac{3RT}{\overline{u}^2} \nonumber \]
\[\mathrm{\dfrac{effusion\: rate\: A}{effusion\: rate\: B}}=\dfrac{u_\mathrm{rms\:A}}{u_\mathrm{rms\:B}}=\dfrac{\sqrt{\dfrac{3RT}{m_\ce{A}}}}{\sqrt{\dfrac{3RT}{m_\ce{B}}}}=\sqrt{\dfrac{m_\ce{B}}{m_\ce{A}}} \nonumber \]
A razão das taxas de efusão é, portanto, derivada para ser inversamente proporcional à proporção das raízes quadradas de suas massas. Essa é a mesma relação observada experimentalmente e expressa como a lei de Graham.
Resumo
A teoria molecular cinética é um modelo simples, mas muito eficaz, que explica efetivamente o comportamento ideal do gás. A teoria pressupõe que os gases consistem em moléculas amplamente separadas de volume insignificante que estão em constante movimento, colidindo elasticamente umas com as outras e as paredes de seu recipiente com velocidades médias determinadas por suas temperaturas absolutas. As moléculas individuais de um gás exibem uma faixa de velocidades, sendo a distribuição dessas velocidades dependente da temperatura do gás e da massa de suas moléculas.
Equações-chave
- \(u_\ce{rms}=\sqrt{\overline{u^2}}=\sqrt{\dfrac{u^2_1+u^2_2+u^2_3+u^2_4+…}{n}}\)
- \(\mathrm{KE_{avg}}=\dfrac{3}{2}RT\)
- \(u_\ce{rms}=\sqrt{\dfrac{3RT}{m}}\)
Resumo
- teoria molecular cinética
- teoria baseada em princípios e suposições simples que efetivamente explica o comportamento ideal do gás
- velocidade quadrada média (u rms)
- medida da velocidade média para um grupo de partículas calculada como a raiz quadrada da velocidade média quadrada


