7.6: Estrutura molecular e polaridade
- Page ID
- 185111
- Preveja as estruturas de moléculas pequenas usando a teoria de repulsão de pares de elétrons de camada de valência (VSEPR)
- Explicar os conceitos de ligações covalentes polares e polaridade molecular
- Avalie a polaridade de uma molécula com base em sua ligação e estrutura
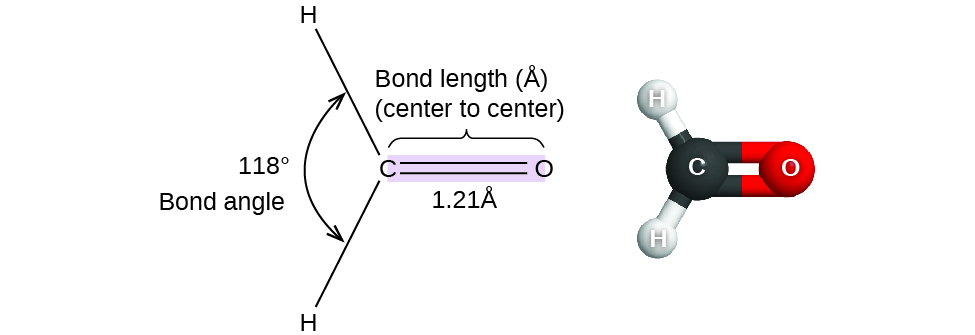
Até agora, usamos estruturas bidimensionais de Lewis para representar moléculas. No entanto, a estrutura molecular é na verdade tridimensional e é importante ser capaz de descrever as ligações moleculares em termos de suas distâncias, ângulos e arranjos relativos no espaço (Figura\(\PageIndex{1}\)). Um ângulo de ligação é o ângulo entre quaisquer duas ligações que incluam um átomo comum, geralmente medido em graus. A distância de ligação (ou comprimento da ligação) é a distância entre os núcleos de dois átomos ligados ao longo da linha reta que une os núcleos. As distâncias de ligação são medidas em Ångstroms (1 Å = 10 —10 m) ou picômetros (1 pm = 10 —12 m, 100pm = 1 Å).
Teoria VSEPR
A teoria da repulsão de pares de elétrons da camada de valência (teoria VSEPR) nos permite prever a estrutura molecular, incluindo ângulos de ligação aproximados em torno de um átomo central, de uma molécula a partir de um exame do número de ligações e pares de elétrons solitários em sua estrutura de Lewis. O modelo VSEPR assume que os pares de elétrons na camada de valência de um átomo central adotarão um arranjo que minimiza as repulsões entre esses pares de elétrons, maximizando a distância entre eles. Os elétrons na camada de valência de um átomo central formam pares de elétrons ligados, localizados principalmente entre átomos ligados, ou pares solitários. A repulsão eletrostática desses elétrons é reduzida quando as várias regiões de alta densidade eletrônica assumem posições o mais distantes possível umas das outras.
A teoria VSEPR prevê a disposição dos pares de elétrons ao redor de cada átomo central e, geralmente, a disposição correta dos átomos em uma molécula. Devemos entender, no entanto, que a teoria considera apenas repulsões de pares de elétrons. Outras interações, como repulsões nucleares e atrações nucleares de elétrons, também estão envolvidas no arranjo final que os átomos adotam em uma estrutura molecular específica.
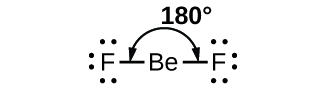
Como um exemplo simples da teoria VSEPR, vamos prever a estrutura de uma molécula gasosa de BeF 2. A estrutura de Lewis do BeF 2 (Figura\(\PageIndex{2}\)) mostra apenas dois pares de elétrons ao redor do átomo central de berílio. Com duas ligações e nenhum par solitário de elétrons no átomo central, as ligações estão tão distantes quanto possível, e a repulsão eletrostática entre essas regiões de alta densidade eletrônica é reduzida ao mínimo quando elas estão em lados opostos do átomo central. O ângulo de aderência é de 180° (Figura\(\PageIndex{2}\)).
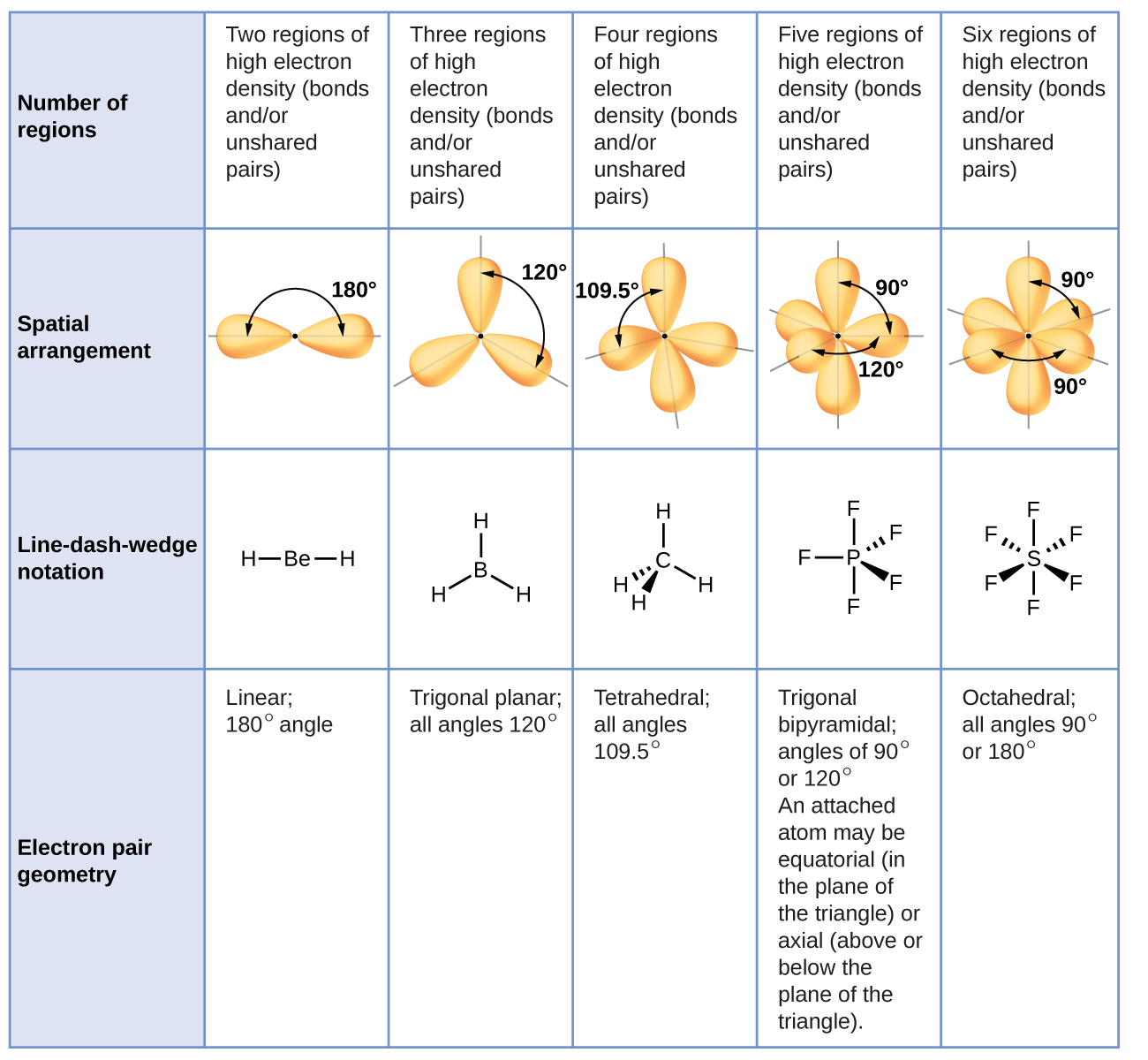
\(\PageIndex{3}\)A figura ilustra esta e outras geometrias de pares de elétrons que minimizam as repulsões entre regiões de alta densidade de elétrons (ligações e/ou pares solitários). Duas regiões de densidade eletrônica em torno de um átomo central em uma molécula formam uma geometria linear; três regiões formam uma geometria plana trigonal; quatro regiões formam uma geometria tetraédrica; cinco regiões formam uma geometria bipiramidal trigonal; e seis regiões formam uma geometria octaédrica.
Geometria de pares de elétrons versus estrutura molecular
É importante observar que a geometria do par de elétrons em torno de um átomo central não é a mesma coisa que sua estrutura molecular. As geometrias de pares de elétrons mostradas na Figura\(\PageIndex{3}\) descrevem todas as regiões onde os elétrons estão localizados, ligações e pares solitários. A estrutura molecular descreve a localização dos átomos, não dos elétrons.
Diferenciamos essas duas situações nomeando a geometria que inclui todos os pares de elétrons como a geometria do par de elétrons. A estrutura que inclui apenas a colocação dos átomos na molécula é chamada de estrutura molecular. As geometrias do par de elétrons serão as mesmas das estruturas moleculares quando não houver pares de elétrons solitários ao redor do átomo central, mas serão diferentes quando houver pares solitários presentes no átomo central.
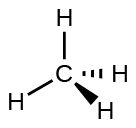
Por exemplo, a molécula de metano, CH 4, que é o principal componente do gás natural, tem quatro pares de elétrons em torno do átomo de carbono central; a geometria do par de elétrons é tetraédrica, assim como a estrutura molecular (Figura\(\PageIndex{4}\)). Por outro lado, a molécula de amônia, NH 3, também tem quatro pares de elétrons associados ao átomo de nitrogênio e, portanto, tem uma geometria tetraédrica de par de elétrons. Uma dessas regiões, no entanto, é um par solitário, que não está incluído na estrutura molecular, e esse par solitário influencia a forma da molécula (Figura\(\PageIndex{5}\)).
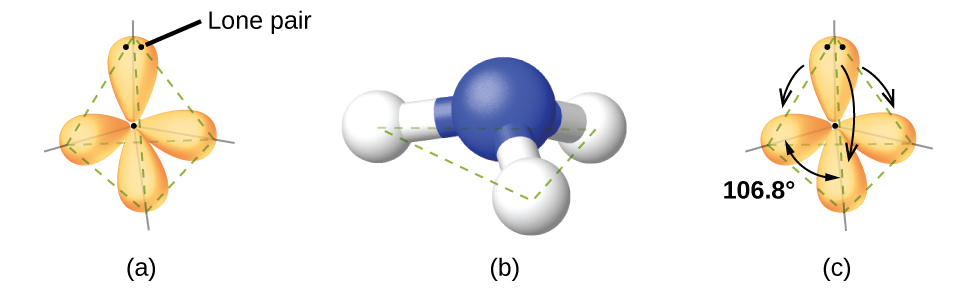
Pequenas distorções dos ângulos ideais na Figura\(\PageIndex{5}\) podem resultar de diferenças na repulsão entre várias regiões da densidade eletrônica. A teoria VSEPR prevê essas distorções estabelecendo uma ordem de repulsões e uma ordem da quantidade de espaço ocupado por diferentes tipos de pares de elétrons. A ordem das repulsões do par de elétrons da maior para a menor repulsão é:
par solitário par solitário > par solitário par de união > par de união par de união
Essa ordem de repulsões determina a quantidade de espaço ocupado por diferentes regiões de elétrons. Um par solitário de elétrons ocupa uma região maior do espaço do que os elétrons em uma ligação tripla; por sua vez, os elétrons em uma ligação tripla ocupam mais espaço do que aqueles em uma ligação dupla, e assim por diante. A ordem dos tamanhos do maior para o menor é:
par solitário > ligação tripla > ligação dupla > ligação simples
Considere o formaldeído, H 2 CO, que é usado como conservante para amostras biológicas e anatômicas. Essa molécula tem regiões de alta densidade eletrônica que consistem em duas ligações simples e uma ligação dupla. A geometria básica é plana trigonal com ângulos de ligação de 120°, mas vemos que a ligação dupla causa ângulos um pouco maiores (121°) e o ângulo entre as ligações simples é um pouco menor (118°).
Na molécula de amônia, os três átomos de hidrogênio ligados ao nitrogênio central não estão dispostos em uma estrutura molecular plana e trigonal, mas sim em uma pirâmide trigonal tridimensional (Figura\(\PageIndex{6}\)) com o átomo de nitrogênio no ápice e os três átomos de hidrogênio formando a base. Os ângulos de ligação ideais em uma pirâmide trigonal são baseados na geometria do par de elétrons tetraédricos. Novamente, há pequenos desvios do ideal porque pares solitários ocupam regiões maiores do espaço do que os elétrons de ligação. Os ângulos de ligação H—N—H em NH 3 são ligeiramente menores do que o ângulo de 109,5° em um tetraedro regular (Figura\(\PageIndex{6}\)) porque a repulsão do par de união solitária é maior do que a repulsão do par de união. As estruturas moleculares ideais são previstas com base nas geometrias de pares de elétrons para várias combinações de pares solitários e pares de ligação.
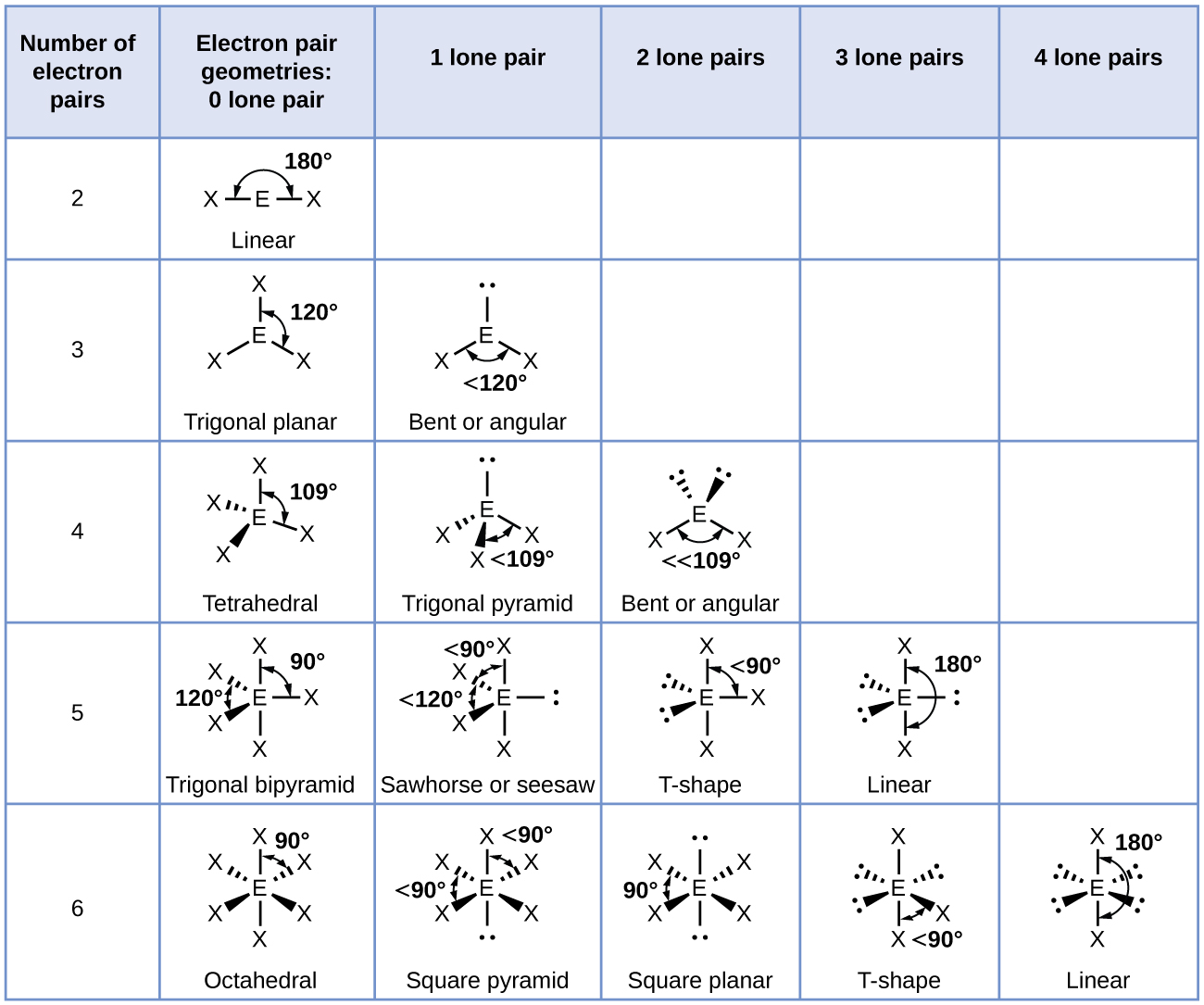
De acordo com a teoria VSEPR, as localizações dos átomos terminais (Xs na Figura\(\PageIndex{7}\)) são equivalentes dentro das geometrias lineares, planares trigonais e tetraédricas de pares de elétrons (as três primeiras linhas da tabela). Não importa qual X seja substituído por um par solitário, pois as moléculas podem ser giradas para converter posições. Para geometrias de pares de elétrons bipiramidais trigonais, no entanto, existem duas posições X distintas (Figura\(\PageIndex{7}\) a): uma posição axial (se mantivermos um modelo de uma bipirâmide trigonal pelas duas posições axiais, temos um eixo em torno do qual podemos girar o modelo) e uma posição equatorial (três posições formam um equador ao redor do meio da molécula). A posição axial é cercada por ângulos de união de 90°, enquanto a posição equatorial tem mais espaço disponível devido aos ângulos de união de 120°. Em uma geometria de par de elétrons bipiramidal trigonal, pares solitários sempre ocupam posições equatoriais porque essas posições mais espaçosas podem acomodar mais facilmente os pares solitários maiores.
Teoricamente, podemos criar três arranjos possíveis para as três ligações e dois pares solitários para a molécula ClF 3 (Figura\(\PageIndex{7}\)). A estrutura estável é aquela que coloca os pares solitários em localizações equatoriais, dando uma estrutura molecular em forma de T.
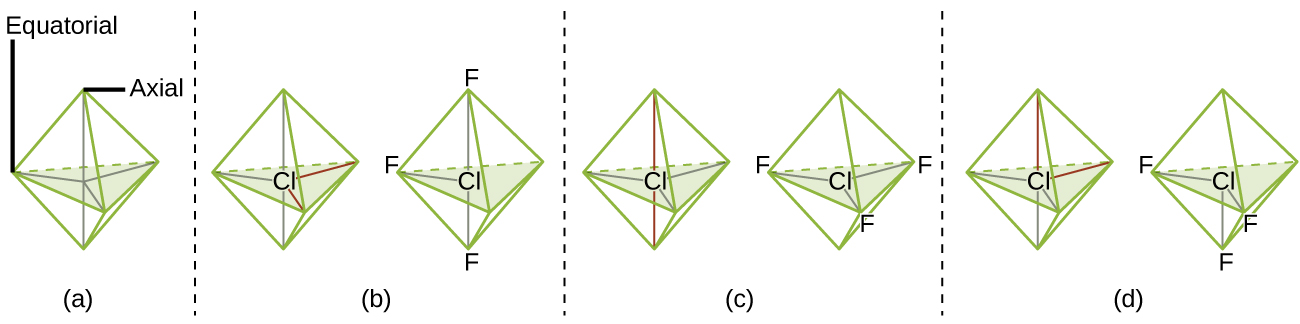
Quando um átomo central tem dois pares de elétrons solitários e quatro regiões de ligação, temos uma geometria octaédrica de pares de elétrons. Os dois pares solitários estão em lados opostos do octaedro (180° separados), fornecendo uma estrutura molecular plana quadrada que minimiza as repulsões de um par solitário.
O procedimento a seguir usa a teoria VSEPR para determinar as geometrias do par de elétrons e as estruturas moleculares:
- Escreva a estrutura de Lewis da molécula ou íon poliatômico.
- Conte o número de regiões de densidade de elétrons (pares solitários e ligações) ao redor do átomo central. Uma ligação simples, dupla ou tripla conta como uma região da densidade eletrônica.
- Identifique a geometria do par de elétrons com base no número de regiões de densidade eletrônica: linear, trigonal planar, tetraédrica, trigonal bipiramidal ou octaédrica (Figura\(\PageIndex{7}\), primeira coluna).
- Use o número de pares solitários para determinar a estrutura molecular (Figura\(\PageIndex{7}\)). Se mais de um arranjo de pares solitários e ligações químicas for possível, escolha aquele que minimizará as repulsões, lembrando que pares solitários ocupam mais espaço do que ligações múltiplas, que ocupam mais espaço do que ligações simples. Em arranjos trigonais bipiramidais, a repulsão é minimizada quando cada par solitário está em uma posição equatorial. Em um arranjo octaédrico com dois pares solitários, a repulsão é minimizada quando os pares solitários estão em lados opostos do átomo central.
Os exemplos a seguir ilustram o uso da teoria VSEPR para prever a estrutura molecular de moléculas ou íons que não têm pares solitários de elétrons. Nesse caso, a estrutura molecular é idêntica à geometria do par de elétrons.
Preveja a geometria do par de elétrons e a estrutura molecular para cada um dos seguintes:
- dióxido de carbono, CO 2, uma molécula produzida pela combustão de combustíveis fósseis
- tricloreto de boro, BCl 3, um importante produto químico industrial
Solução
(a) Escrevemos a estrutura de Lewis do CO 2 como:

Isso nos mostra duas regiões de alta densidade de elétrons ao redor do átomo de carbono - cada ligação dupla conta como uma região e não há pares solitários no átomo de carbono. Usando a teoria VSEPR, prevemos que as duas regiões de densidade eletrônica se organizam em lados opostos do átomo central com um ângulo de ligação de 180°. A geometria do par de elétrons e a estrutura molecular são idênticas e as moléculas de CO 2 são lineares.
(b) Escrevemos a estrutura de Lewis do BCl 3 como:
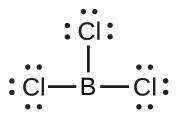
Assim, vemos que o BCl 3 contém três ligações e não há pares solitários de elétrons no boro. O arranjo de três regiões de alta densidade eletrônica fornece uma geometria de par de elétrons planares trigonais. As ligações B—Cl estão em um plano com ângulos de 120° entre elas. O BCl 3 também tem uma estrutura molecular planar trigonal.
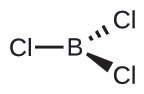
A geometria do par de elétrons e a estrutura molecular do BCl 3 são ambas planas trigonais. Observe que a geometria VSEPR indica os ângulos de ligação corretos (120°), diferentemente da estrutura de Lewis mostrada acima.
O carbonato\(\ce{CO3^2-}\),, é um íon poliatômico comum encontrado em vários materiais, desde cascas de ovos até antiácidos. Quais são a geometria do par de elétrons e a estrutura molecular desse íon poliatômico?
- Responda
-
A geometria do par de elétrons é plana trigonal e a estrutura molecular é plana trigonal. Devido à ressonância, todas as três ligações C—O são idênticas. Sejam simples, duplas ou uma média das duas, cada ligação conta como uma região de densidade eletrônica.
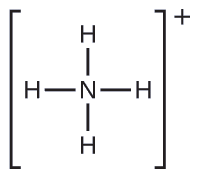
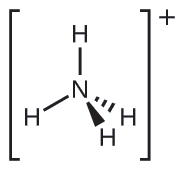
Dois dos 50 principais produtos químicos produzidos nos Estados Unidos, nitrato de amônio e sulfato de amônio, ambos usados como fertilizantes, contêm o íon amônio. Preveja a geometria do par de elétrons e a estrutura molecular do\(\ce{NH4+}\) cátion.
Solução
Escrevemos a estrutura de Lewis\(\ce{NH4+}\) como:
Identifique uma molécula com estrutura molecular trigonal bipiramidal.
- Responda
-
Qualquer molécula com cinco pares de elétrons ao redor dos átomos centrais, incluindo nenhum par solitário, será trigonal bipiramidal. \(\ce{PF5}\)é um exemplo comum
Os próximos exemplos ilustram o efeito de pares solitários de elétrons na estrutura molecular.
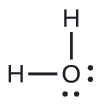
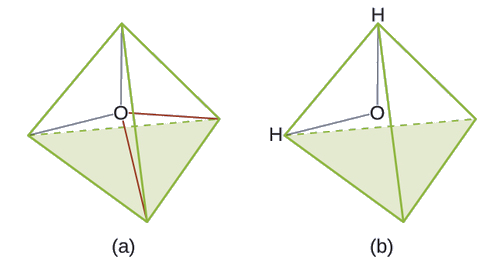
Preveja a geometria do par de elétrons e a estrutura molecular de uma molécula de água.
Solução
A estrutura de Lewis de H 2 O indica que existem quatro regiões de alta densidade eletrônica ao redor do átomo de oxigênio: dois pares solitários e duas ligações químicas:
O íon hidrônio, H 3 O +, se forma quando os ácidos são dissolvidos na água. Preveja a geometria do par de elétrons e a estrutura molecular desse cátion.
- Responda
-
geometria de pares de elétrons: tetraédrica; estrutura molecular: piramidal trigonal
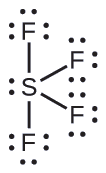
Prevendo a geometria do par de elétrons e a estrutura molecular: SF 4 é extremamente valioso para a preparação de compostos contendo flúor usados como herbicidas (ou seja, o SF 4 é usado como agente fluorante). Preveja a geometria do par de elétrons e a estrutura molecular de uma molécula SF 4.
Solução
A estrutura de Lewis do SF 4 indica cinco regiões de densidade eletrônica ao redor do átomo de enxofre: um par solitário e quatro pares de ligação:
Preveja a geometria do par de elétrons e a estrutura molecular para moléculas de XeF 2.
- Responda
-
A geometria do par de elétrons é trigonal bipiramidal. A estrutura molecular é linear.
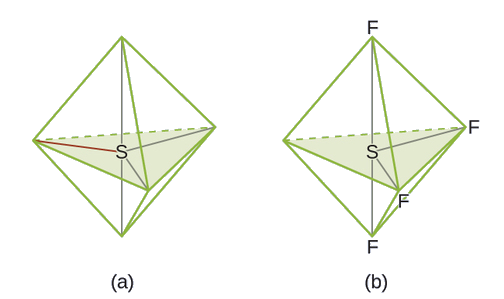
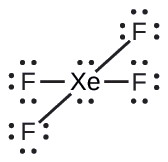
De todos os gases nobres, o xenônio é o mais reativo, reagindo frequentemente com elementos como oxigênio e flúor. Preveja a geometria do par de elétrons e a estrutura molecular da molécula XeF 4.
Solução
A estrutura de Lewis do XeF 4 indica seis regiões de alta densidade eletrônica ao redor do átomo de xenônio: dois pares solitários e quatro ligações:
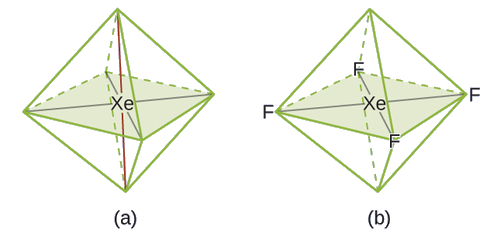
Em uma determinada molécula, o átomo central tem três pares solitários e duas ligações. Quais serão a geometria e a estrutura molecular do par de elétrons?
- Responda
-
geometria de pares de elétrons: trigonal bipiramidal; estrutura molecular: linear
Estrutura molecular para moléculas multicêntricas
Quando uma molécula ou íon poliatômico tem apenas um átomo central, a estrutura molecular descreve completamente a forma da molécula. As moléculas maiores não têm um único átomo central, mas são conectadas por uma cadeia de átomos internos, cada um com uma geometria “local”. A forma como essas estruturas locais são orientadas uma em relação à outra também influencia a forma molecular, mas essas considerações estão muito além do escopo desta discussão introdutória. Para nossos propósitos, nos concentraremos apenas em determinar as estruturas locais.
A estrutura de Lewis para o aminoácido mais simples, glicina, H 2 NCH 2 CO 2 H, é mostrada aqui. Preveja a geometria local para o átomo de nitrogênio, os dois átomos de carbono e o átomo de oxigênio com um átomo de hidrogênio conectado:
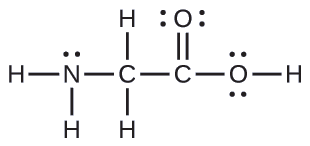
Solução
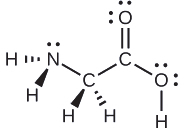
Considere cada átomo central de forma independente. As geometrias do par de elétrons:
- nitrogênio — quatro regiões de densidade eletrônica; tetraédrica
- carbono (C H 2) ——quatro regiões de densidade eletrônica; tetraédrica
- carbono (C O 2) — três regiões de densidade eletrônica; plano trigonal
- oxigênio (O H) — quatro regiões de densidade eletrônica; tetraédrica
As estruturas locais:
- nitrogênio — três ligações, um par solitário; piramidal trigonal
- carbono (C H 2) — quatro ligações, sem pares solitários; tetraédrico
- carbono (C O 2) — três ligações (ligação dupla conta como uma ligação), sem pares solitários; plano trigonal
- oxigênio (O H) — duas ligações, dois pares solitários; dobrado (109°)
Outro aminoácido é a alanina, que tem a estrutura de Lewis mostrada aqui. Preveja a geometria do par de elétrons e a estrutura local do átomo de nitrogênio, dos três átomos de carbono e do átomo de oxigênio com hidrogênio ligado:
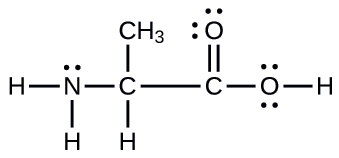
- Responda
-
geometrias de pares de elétrons: nitrogênio — tetraédrico; carbono (C H) —tetraédrico; carbono (C H 3) —tetraédrico; carbono (C O 2) —plano trigonal; oxigênio (O H) —tetraédrico; estruturas locais: nitrogênio — piramidal trigonal; carbono (C H) — tetraédrico; carbono (C H 3) —tetraédrico; carbono (C O 2) —plano trigonal; oxigênio (O H) —curvado (109°)
O uso deste simulador de forma molecular nos permite controlar se os ângulos de ligação e/ou pares solitários são exibidos marcando ou desmarcando as caixas em “Opções” à direita. Também podemos usar as caixas de seleção “Nome” no canto inferior esquerdo para exibir ou ocultar a geometria do par de elétrons (chamada de “geometria eletrônica” no simulador) e/ou a estrutura molecular (chamada de “forma molecular” no simulador).
Construa a molécula HCN no simulador com base na seguinte estrutura de Lewis:
Clique em cada tipo de ligação ou par solitário à direita para adicionar esse grupo ao átomo central. Depois de ter a molécula completa, rotacione-a para examinar a estrutura molecular prevista. Que estrutura molecular é essa?
Solução
A estrutura molecular é linear.
Crie uma molécula mais complexa no simulador. Identifique a geometria do grupo de elétrons, a estrutura molecular e os ângulos de ligação. Em seguida, tente encontrar uma fórmula química que corresponda à estrutura que você desenhou.
- Responda
-
As respostas podem variar. Por exemplo, um átomo com quatro ligações simples, uma ligação dupla e um par solitário tem uma geometria octaédrica de grupo de elétrons e uma estrutura molecular piramidal quadrada. O XeOF 4 é uma molécula que adota essa estrutura.
Polaridade molecular e momento de dipolo
Conforme discutido anteriormente, as ligações covalentes polares conectam dois átomos com eletronegatividades diferentes, deixando um átomo com uma carga positiva parcial (δ+) e o outro com uma carga negativa parcial (δ—), à medida que os elétrons são puxados em direção ao átomo mais eletronegativo. Essa separação de carga dá origem a um momento de dipolo de ligação. A magnitude de um momento de dipolo de ligação é representada pela letra grega mu (µ) e é dada por
\[μ=Qr \label{7.6.X} \]
onde
- \(Q\)é a magnitude das cargas parciais (determinada pela diferença de eletronegatividade) e
- \(r\)é a distância entre as cargas:
Esse momento de ligação pode ser representado como um vetor, uma quantidade com direção e magnitude (Figura\(\PageIndex{12}\)). Os vetores dipolares são mostrados como setas apontando ao longo da ligação do átomo menos eletronegativo em direção ao átomo mais eletronegativo. Um pequeno sinal de mais é desenhado na extremidade menos eletronegativa para indicar a extremidade parcialmente positiva da ligação. O comprimento da flecha é proporcional à magnitude da diferença de eletronegatividade entre os dois átomos.
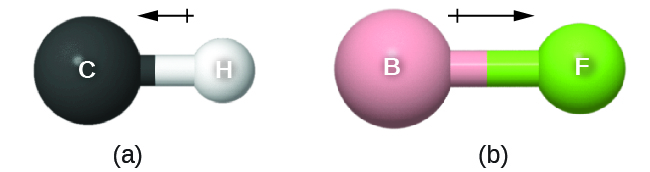
Uma molécula inteira também pode ter uma separação de carga, dependendo de sua estrutura molecular e da polaridade de cada uma de suas ligações. Se essa separação de carga existir, diz-se que a molécula é uma molécula polar (ou dipolo); caso contrário, a molécula é considerada não polar. O momento de dipolo mede a extensão da separação da carga líquida na molécula como um todo. Determinamos o momento de dipolo adicionando os momentos de ligação no espaço tridimensional, levando em consideração a estrutura molecular.
Para moléculas diatômicas, há apenas uma ligação, então seu momento de dipolo de ligação determina a polaridade molecular. Moléculas diatômicas homonucleares, como Br 2 e N 2, não têm diferença na eletronegatividade, então seu momento de dipolo é zero. Para moléculas heteronucleares como o CO, há um pequeno momento de dipolo. Para HF, há um momento de dipolo maior porque há uma diferença maior na eletronegatividade.
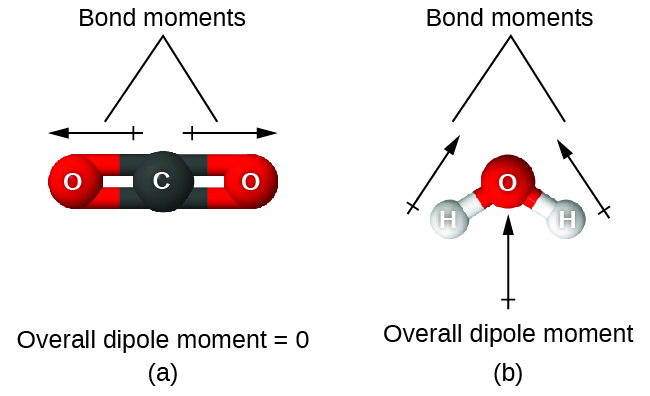
Quando uma molécula contém mais de uma ligação, a geometria deve ser levada em consideração. Se as ligações em uma molécula estiverem dispostas de forma que seus momentos de ligação sejam cancelados (a soma vetorial é igual a zero), então a molécula é apolar. Essa é a situação no CO 2 (Figura\(\PageIndex{13A}\)). Cada uma das ligações é polar, mas a molécula como um todo não é polar. A partir da estrutura de Lewis e usando a teoria VSEPR, determinamos que a molécula de CO 2 é linear com ligações polares C = O em lados opostos do átomo de carbono. Os momentos de vínculo são cancelados porque estão apontados em direções opostas. No caso da molécula de água (Figura\(\PageIndex{13B}\)), a estrutura de Lewis mostra novamente que existem duas ligações a um átomo central, e a diferença de eletronegatividade mostra novamente que cada uma dessas ligações tem um momento de ligação diferente de zero. Nesse caso, no entanto, a estrutura molecular é dobrada por causa dos pares solitários em O, e os dois momentos de ligação não se cancelam. Portanto, a água tem um momento de dipolo líquido e é uma molécula polar (dipolo).
A molécula de OCS tem uma estrutura semelhante ao CO 2, mas um átomo de enxofre substituiu um dos átomos de oxigênio. Para determinar se essa molécula é polar, desenhamos a estrutura molecular. A teoria VSEPR prevê uma molécula linear:
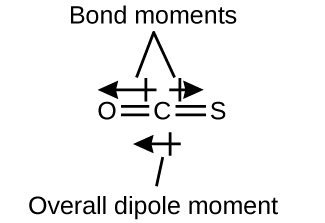
A ligação C—O é consideravelmente polar. Embora C e S tenham valores de eletronegatividade muito semelhantes, S é um pouco mais eletronegativo que C e, portanto, a ligação C-S é apenas ligeiramente polar. Como o oxigênio é mais eletronegativo do que o enxofre, a extremidade do oxigênio da molécula é a extremidade negativa.
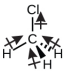
O clorometano, CH 3 Cl, é outro exemplo de molécula polar. Embora as ligações polares C—Cl e C—H estejam dispostas em uma geometria tetraédrica, as ligações C—Cl têm um momento de ligação maior do que a ligação C—H, e os momentos de ligação não se cancelam completamente. Todos os dipolos têm um componente ascendente na orientação mostrada, já que o carbono é mais eletronegativo que o hidrogênio e menos eletronegativo que o cloro:
Quando examinamos as moléculas altamente simétricas BF 3 (trigonal planar), CH 4 (tetraédrica), PF 5 (trigonal bipiramidal) e SF 6 (octaédrica), nas quais todas as ligações polares são idênticas, as moléculas são não polares. As ligações nessas moléculas são organizadas de forma que seus dipolos se cancelem. No entanto, só porque uma molécula contém ligações idênticas não significa que os dipolos sempre serão cancelados. Muitas moléculas que têm ligações idênticas e pares solitários nos átomos centrais têm dipolos de ligação que não se cancelam. Os exemplos incluem H 2 S e NH 3. Um átomo de hidrogênio está na extremidade positiva e um átomo de nitrogênio ou enxofre está na extremidade negativa das ligações polares nessas moléculas:
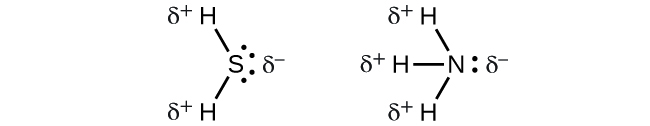
Para resumir, para ser polar, uma molécula deve:
- Contenha pelo menos uma ligação polar covalente.
- Tenha uma estrutura molecular tal que a soma dos vetores de cada momento de dipolo de ligação não se cancele.
Propriedades das moléculas polares
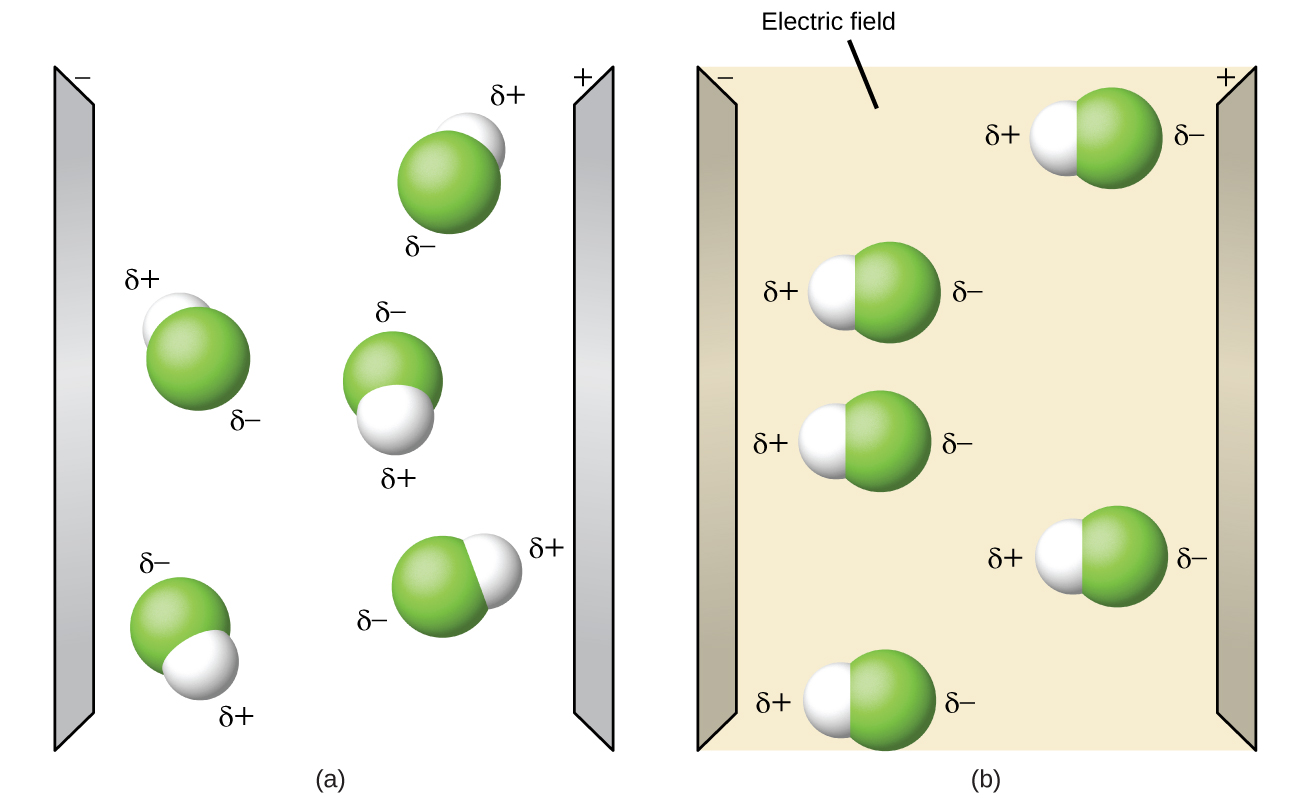
As moléculas polares tendem a se alinhar quando colocadas em um campo elétrico com a extremidade positiva da molécula orientada para a placa negativa e a extremidade negativa em direção à placa positiva (Figura\(\PageIndex{14}\)). Podemos usar um objeto eletricamente carregado para atrair moléculas polares, mas moléculas não polares não são atraídas. Além disso, os solventes polares são melhores na dissolução de substâncias polares e os solventes não polares são melhores na dissolução de substâncias não polares.
Abra a simulação da polaridade da molécula e selecione a guia “Três átomos” na parte superior. Isso deve exibir uma molécula ABC com três ajustadores de eletronegatividade. Você pode exibir ou ocultar os momentos de ligação, os dipolos moleculares e as cargas parciais à direita. Ativar o campo elétrico mostrará se a molécula se move quando exposta a um campo, semelhante à Figura\(\PageIndex{14}\).
Use os controles de eletronegatividade para determinar como o dipolo molecular procurará a molécula inicial dobrada se:
- A e C são muito eletronegativos e B está no meio da faixa.
- A é muito eletronegativo, e B e C não.
Solução
- O momento de dipolo molecular aponta imediatamente entre A e C.
- O momento de dipolo molecular aponta ao longo da ligação A-B, em direção a A.
Determine as cargas parciais que fornecerão os maiores dipolos de ligação possíveis.
- Responda
-
Os maiores momentos de fiança ocorrerão com as maiores cobranças parciais. As duas soluções acima representam o quão desigualmente os elétrons são compartilhados na ligação. Os momentos de ligação serão maximizados quando a diferença de eletronegatividade for maior. Os controles para A e C devem ser ajustados para um extremo e B para o extremo oposto. Embora a magnitude do momento de ligação não mude com base no fato de B ser o mais eletronegativo ou o menor, a direção do momento de ligação mudará.
Resumo
A teoria VSEPR prevê o arranjo tridimensional dos átomos em uma molécula. Ele afirma que os elétrons de valência assumirão uma geometria de par de elétrons que minimiza as repulsões entre áreas de alta densidade de elétrons (ligações e/ou pares solitários). A estrutura molecular, que se refere apenas à colocação de átomos em uma molécula e não aos elétrons, é equivalente à geometria do par de elétrons somente quando não há pares de elétrons solitários ao redor do átomo central. Um momento de dipolo mede a separação da carga. Para uma ligação, o momento do dipolo da ligação é determinado pela diferença na eletronegatividade entre os dois átomos. Para uma molécula, o momento geral de dipolo é determinado pelos momentos de ligação individuais e pela forma como esses dipolos são organizados na estrutura molecular. As moléculas polares (aquelas com um momento dipolar apreciável) interagem com os campos elétricos, enquanto as moléculas não polares não.
Glossário
- posição axial
- localização em uma geometria bipiramidal trigonal na qual há outro átomo em um ângulo de 180° e as posições equatoriais estão em um ângulo de 90°
- ângulo de ligação
- ângulo entre quaisquer duas ligações covalentes que compartilham um átomo comum
- distância de ligação
- (também, comprimento da ligação) distância entre os núcleos de dois átomos ligados
- momento de dipolo de ligação
- separação de carga em uma ligação que depende da diferença na eletronegatividade e da distância de ligação representada por cargas parciais ou por um vetor
- momento de dipolo
- propriedade de uma molécula que descreve a separação de carga determinada pela soma dos momentos de ligação individuais com base na estrutura molecular
- geometria de par de elétrons
- arranjo em torno de um átomo central de todas as regiões de densidade eletrônica (ligações, pares solitários ou elétrons desemparelhados)
- posição equatorial
- uma das três posições em uma geometria bipiramidal trigonal com ângulos de 120° entre elas; as posições axiais estão localizadas em um ângulo de 90°
- linear
- forma na qual dois grupos externos são colocados em lados opostos de um átomo central
- estrutura molecular
- estrutura que inclui apenas a colocação dos átomos na molécula
- octaédrico
- forma na qual seis grupos externos são colocados ao redor de um átomo central, de forma que uma forma tridimensional é gerada com quatro grupos formando um quadrado e os outros dois formando o ápice de duas pirâmides, uma acima e outra abaixo do plano quadrado
- molécula polar
- (também, dipolo) molécula com um momento geral de dipolo
- tetraédrico
- forma na qual quatro grupos externos são colocados em torno de um átomo central, de forma que uma forma tridimensional é gerada com quatro cantos e ângulos de 109,5° entre cada par e o átomo central
- trigonal bipiramidal
- forma na qual cinco grupos externos são colocados em torno de um átomo central, de forma que três formam um triângulo plano com ângulos de 120° entre cada par e o átomo central, e os outros dois formam o ápice de duas pirâmides, uma acima e outra abaixo do plano triangular
- plano trigonal
- forma na qual três grupos externos são colocados em um triângulo plano em torno de um átomo central com ângulos de 120° entre cada par e o átomo central
- teoria da repulsão de pares de elétrons de camada de valência (VSEPR)
- teoria usada para prever os ângulos de ligação em uma molécula com base no posicionamento de regiões de alta densidade eletrônica o mais distantes possível para minimizar a repulsão eletrostática
- vetor
- quantidade com magnitude e direção


