7.E: Ligação química e geometria molecular (exercícios)
- Page ID
- 185172
7.1: Ligação iônica
Q7.1.1
Um cátion ganha prótons para formar uma carga positiva ou perde elétrons?
S7.1.1
Os prótons no núcleo não mudam durante as reações químicas normais. Somente os elétrons externos se movem. Cargas positivas se formam quando os elétrons são perdidos.
Q7.1.2
O sulfato de ferro (III) [Fe 2 (SO 4) 3] é composto por Fe 3+ e\(\ce{SO4^2-}\) íons. Explique por que uma amostra de sulfato de ferro (III) não está carregada.
Q7.1.3
Espera-se que qual dos seguintes átomos forme íons negativos em compostos iônicos binários e quais formariam íons positivos: P, I, Mg, Cl, In, Cs, O, Pb, Co?
S7.1.3
P, I, Cl e O formariam ânions porque não são metais. Mg, In, Cs, Pb e Co formariam cátions porque são metais.
Q7.1.4
Espera-se que qual dos seguintes átomos forme íons negativos em compostos iônicos binários e quais formariam íons positivos: Br, Ca, Na, N, F, Al, Sn, S, Cd?
Q7.1.5
Preveja a carga nos íons monoatômicos formados pelos seguintes átomos em compostos iônicos binários:
- P
- Mg
- Al
- O
- Cl
- Cs
S 7.1.5
P 3—; Mg 2+; Al 3+; O 2—; Cl —; Cs +
Q7.1.6
Preveja a carga nos íons monoatômicos formados pelos seguintes átomos em compostos iônicos binários:
- EU
- Sr
- K
- N
- S
- Em
S7.1.6
- EU -
- Sr 2+
- K +
- EM 3-
- S 2-
- Em 3+
Q7.1.7
Escreva a configuração eletrônica para cada um dos seguintes íons:
- Como 3—
- Eu —
- Seja 2+
- Cd 2+
- O 2—
- Gay 3+
- Leite +
- (h) N —3
- (i) Sn 2+
- (j) Co 2+
- (k) Fez +2
- (l) Como 3+
S7.1.7
[Ar] 4 s 2 3 d 10 4 p 6; [Kr] 4 d 10 5 s 2 5 p 6 1 s 2 [Kr] 4 d 10; [Ele] 2 s 2 2 p 6; [Ar] 3 d 10; 1 s 2 (h) [Ele] 2 s 2 p 6 (i) [Kr] 4 d 10 5 s 2 (j) [Ar] 3 d 7 (k) [Ar] 3 d 6, (l) [Ar] 3 d 10 4 s 2
Q7.1.8
Escreva a configuração eletrônica para os íons monoatômicos formados pelos seguintes elementos (que formam a maior concentração de íons monoatômicos na água do mar):
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- (h) F
Q7.1.9
Escreva a configuração eletrônica completa para cada um dos seguintes átomos e para o íon monoatômico encontrado em compostos iônicos binários contendo o elemento:
- Al
- Br
- Sr
- Li
- Como
- S
S7.1.9
1 s 2 2 s 2 p 6 3 s 2 3 p 1; Al 3+: 1 s 2 2 s 2 2 p 6; 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 5; 1 s 2 2 s 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6; 1 s 2 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 5 s 2;
Sr 2+: 1 s 2 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6; 1 s 2 2 é 1;
Li +: 1 s 2; 1 s 2 2 2 p 6 3 s 2 3 s 2 3 p 6 3 d 10 4 s 2 4 p 3; 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6; 1 s 2 2 s 2 2 p 6 3 s 2 3 p 4; 1 s 2 2 s 2 p 6 3 s 2 3 s 2 3 p 6
Q7.1.10
A partir dos rótulos de vários produtos comerciais, prepare uma lista de seis compostos iônicos nos produtos. Para cada composto, escreva a fórmula. (Talvez seja necessário procurar algumas fórmulas em uma referência adequada.)
7.3: Ligação covalente
Por que é incorreto falar de uma molécula de NaCl sólido?
O NaCl consiste em íons discretos dispostos em uma rede cristalina, não moléculas ligadas covalentemente.
Quais informações você pode usar para prever se uma ligação entre dois átomos é covalente ou iônica?
Preveja quais dos seguintes compostos são iônicos e quais são covalentes, com base na localização de seus átomos constituintes na tabela periódica:
- Cl 2 CO
- Não
- NCl 3
- CoBR 2
- K 2 S
- CO
- CaF 2
- (h) Oi
- (i) CaO
- (j) iBR
- (k) CO 2
iônico: (b), (d), (e), (g) e (i); covalente: (a), (c), (f), (h), (j) e (k)
Explique a diferença entre uma ligação covalente não polar, uma ligação covalente polar e uma ligação iônica.
A partir de sua posição na tabela periódica, determine qual átomo em cada par é mais eletronegativo:
- Bar ou Cl
- N ou O
- S ou O
- P ou S
- Si ou N
- Ba ou PC
- N ou K
Cl; O; O; S; N; P; N
A partir de sua posição na tabela periódica, determine qual átomo em cada par é mais eletronegativo:
- N ou P
- Não ou Idade
- S ou F
- Cl ou S
- H ou C
- Set para PC
- C ou Si
A partir de suas posições na tabela periódica, organize os átomos em cada uma das seguintes séries em ordem crescente de eletronegatividade:
- C, F, H, NÃO, NÃO
- Br, Cl, F, H, II
- SE, OH, NÃO, PS,
- Tudo, H, Não, OK,
- Ba, H, N, O, As
H, C, N, O, F; H, I, Br, Cl, F; H, P, S, O, F; Na, Al, H, P, O; Ba, H, As, N, O
A partir de suas posições na tabela periódica, organize os átomos em cada uma das seguintes séries em ordem crescente de eletronegatividade:
- Como, H, N, P, Sb
- Cl, H, P, S, Si
- Br, Cl, Ge, H, Sr
- Ca, H, K, N, Si
- Cl, Cs, Ge, H, Sr
Quais átomos podem se ligar ao enxofre para produzir uma carga parcial positiva no átomo de enxofre?
N, O, F e Cl
Qual é a ligação mais polar?
- C—C
- C—H
- N—H
- O—H
- Se—H
Identifique a ligação mais polar em cada um dos seguintes pares de ligações:
- HF ou HCl
- NO ou CO
- SH ou OH
- PCl ou sCl
- CH ou NH
- SO ou PO
- CN ou NN
HF; CO; OH; PCl; NH; PO; CN
Quais das seguintes moléculas ou íons contêm ligações polares?
- OU 3
- S 8
- \(\ce{O2^2-}\)
- \(\ce{NO3-}\)
- CO 2
- H 2 S
- \(\ce{BH4-}\)
7.4: Símbolos e estruturas de Lewis
Q7.4.1
Escreva os símbolos de Lewis para cada um dos seguintes íons:
- Como 3—
- Eu —
- Seja 2+
- O 2—
- Gay 3+
- Leite +
- EM 3—
S7.4.1
oito elétrons:
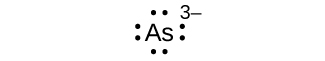
oito elétrons:

sem elétrons
Seja 2+;
oito elétrons:
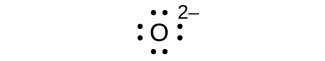
sem elétrons
Gay +3;
sem elétrons
Lábio +;
oito elétrons:
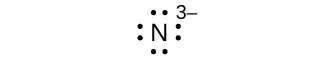
Q7.4.2
Muitos íons monoatômicos são encontrados na água do mar, incluindo os íons formados a partir da seguinte lista de elementos. Escreva os símbolos de Lewis para os íons monoatômicos formados pelos seguintes elementos:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
Q7.4.3
Escreva os símbolos de Lewis dos íons em cada um dos seguintes compostos iônicos e os símbolos de Lewis do átomo do qual eles são formados:
- MGs
- Todos os 2 ou 3
- GaCl 3
- K 2 O
- Lápis 3 N
- DE
(uma)
 ;
;
(b)
 ;
;
(c)
 ;
;
(d)
 ;
;
(e)
 ;
;
(f)

Nas estruturas de Lewis listadas aqui, M e X representam vários elementos no terceiro período da tabela periódica. Escreva a fórmula de cada composto usando os símbolos químicos de cada elemento:
(uma)

(b)

(c)

(d)

Escreva a estrutura de Lewis para a molécula diatômica P 2, uma forma instável de fósforo encontrada no vapor de fósforo em alta temperatura.

Escreva estruturas de Lewis para o seguinte:
- H 2
- HBr
- PCl 3
- SF 2
- H 2 CCH 2
- HNNH
- H 2 CNH
- (h) NÃO —
- (em) N 2
- (j) CO
- (k) NC —
Escreva estruturas de Lewis para o seguinte:
- OU 2
- H 2 CO
- AsF 3
- CLnO
- SiCl 4
- H 3 O +
- \(\ce{NH4+}\)
- (h) \(\ce{BF4-}\)
- (i) HCCH
- (j) ClCN
- (k) \(\ce{C2^2+}\)
(a)

In this case, the Lewis structure is inadequate to depict the fact that experimental studies have shown two unpaired electrons in each oxygen molecule.
(b)
 ;
;
(c)
 ;
;
(d)
 ;
;
(e)
 ;
;
(f)
 ;
;
(g)
 ;
;
(h)
 ;
;
(i)
 ;
;
(j)
 ;
;
(k)

Escreva estruturas de Lewis para o seguinte:
- ClF 3
- PCl 5
- BF 3
- \(\ce{PF6-}\)
Write Lewis structures for the following:
- SeF6
- XeF4
- \(\ce{SeCl3+}\)
- Cl2BBCl2 (contains a B–B bond)
SeF6:
 ;
;
XeF4:
 ;
;
\(\ce{SeCl3+}\):
 ;
;
Cl 2 BBCl 2:

Escreva estruturas de Lewis para:
- \(\ce{PO4^3-}\)
- \(\ce{ICl4-}\)
- \(\ce{SO3^2-}\)
- HONO
Correct the following statement: “The bonds in solid PbCl2 are ionic; the bond in a HCl molecule is covalent. Thus, all of the valence electrons in PbCl2 are located on the Cl– ions, and all of the valence electrons in a HCl molecule are shared between the H and Cl atoms.”
Two valence electrons per Pb atom are transferred to Cl atoms; the resulting Pb2+ ion has a 6s2 valence shell configuration. Two of the valence electrons in the HCl molecule are shared, and the other six are located on the Cl atom as lone pairs of electrons.
Write Lewis structures for the following molecules or ions:
- SbH3
- XeF2
- Se8 (a cyclic molecule with a ring of eight Se atoms)
Methanol, H3COH, is used as the fuel in some race cars. Ethanol, C2H5OH, is used extensively as motor fuel in Brazil. Both methanol and ethanol produce CO2 and H2O when they burn. Write the chemical equations for these combustion reactions using Lewis structures instead of chemical formulas.

Many planets in our solar system contain organic chemicals including methane (CH4) and traces of ethylene (C2H4), ethane (C2H6), propyne (H3CCCH), and diacetylene (HCCCCH). Write the Lewis structures for each of these molecules.
Carbon tetrachloride was formerly used in fire extinguishers for electrical fires. It is no longer used for this purpose because of the formation of the toxic gas phosgene, Cl2CO. Write the Lewis structures for carbon tetrachloride and phosgene.

Identifique os átomos que correspondem a cada uma das seguintes configurações eletrônicas. Em seguida, escreva o símbolo de Lewis para o íon comum formado por cada átomo:
- 1 x 2 2 s 2 2 p 5
- 1 s 2 2 s 2 p 6 3 s 2
- 1 s 2 2 s 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10
- 1 s 2 2 s 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 4
- 1 s 2 2 s 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 1
A disposição dos átomos em várias moléculas biologicamente importantes é dada aqui. Complete as estruturas de Lewis dessas moléculas adicionando várias ligações e pares solitários. Não adicione mais átomos.
o aminoácido serina:

ureia:

ácido pirúvico:

uracilo:

ácido carbônico:

(uma)
 ;
;
(b)
 ;
;
(c)
 ;
;
(d)
 ;
;
(e)

Um composto com uma massa molar de cerca de 28 g/mol contém 85,7% de carbono e 14,3% de hidrogênio em massa. Escreva a estrutura de Lewis para uma molécula do composto.
Um composto com uma massa molar de cerca de 42 g/mol contém 85,7% de carbono e 14,3% de hidrogênio em massa. Escreva a estrutura de Lewis para uma molécula do composto.

Dois arranjos de átomos são possíveis para um composto com uma massa molar de cerca de 45 g/mol que contém 52,2% C, 13,1% H e 34,7% O em massa. Escreva as estruturas de Lewis para as duas moléculas.
Como as ligações simples, duplas e triplas são semelhantes? Como eles diferem?
Cada ligação inclui um compartilhamento de elétrons entre átomos. Dois elétrons são compartilhados em uma única ligação; quatro elétrons são compartilhados em uma ligação dupla; e seis elétrons são compartilhados em uma ligação tripla.
7.5: Cargas formais e ressonância
Escreva formas de ressonância que descrevam a distribuição de elétrons em cada uma dessas moléculas ou íons.
- dióxido de selênio, SeO
- íon nitrato,\(\ce{NO3-}\)
- nitric acid, HNO3 (N is bonded to an OH group and two O atoms)
- benzene, C6H6:

o ícone de formato:

Escreva formas de ressonância que descrevam a distribuição de elétrons em cada uma dessas moléculas ou íons.
- dióxido de enxofre, SO 2
- íon carbonato,\(\ce{CO3^2-}\)
- hydrogen carbonate ion, \(\ce{HCO3-}\) (C is bonded to an OH group and two O atoms)
- pyridine:

o íon alilo:

(uma)
 ;
;
(b)
 ;
;
(c)
 ;
;
(d)
 ;
;
(e)

Escreva as formas de ressonância do ozônio, O 3, o componente da alta atmosfera que protege a Terra da radiação ultravioleta.
O nitrito de sódio, que tem sido usado para conservar bacon e outras carnes, é um composto iônico. Escreva as formas de ressonância do íon nitrito,\(\ce{NO2-}\).

Em termos das ligações presentes, explique por que o ácido acético, CH 3 CO 2 H, contém dois tipos distintos de ligações carbono-oxigênio, enquanto o íon acetato, formado pela perda de um íon hidrogênio do ácido acético, contém apenas um tipo de ligação carbono-oxigênio. As estruturas esqueléticas dessas espécies são mostradas:

Escreva as estruturas de Lewis para o seguinte e inclua estruturas de ressonância quando apropriado. Indique qual tem a ligação carbono-oxigênio mais forte.
- CO 2
- CO
(uma)

(b)

O CO tem a ligação carbono-oxigênio mais forte porque há uma ligação tripla unindo C e O. O CO 2 tem ligações duplas.
Cremes dentais contendo hidrogenocarbonato de sódio (bicarbonato de sódio) e peróxido de hidrogênio são amplamente utilizados. Escreva estruturas de Lewis para o íon carbonato de hidrogênio e a molécula de peróxido de hidrogênio, com formas de ressonância quando apropriado.
Determine a carga formal de cada elemento da seguinte forma:
- HCl
- CF 4
- PCl 3
- PDF 5
H: 0, Cl: 0; C: 0, F: 0; P: 0, Cl 0; P: 0, F: 0
Determine a carga formal de cada elemento da seguinte forma:
- H 3 O +
- \(\ce{SO4^2-}\)
- NH3
- \(\ce{O2^2-}\)
- H2O2
Calculate the formal charge of chlorine in the molecules Cl2, BeCl2, and ClF5.
Cl in Cl2: 0; Cl in BeCl2: 0; Cl in ClF5: 0
Calculate the formal charge of each element in the following compounds and ions:
- F2CO
- NO–
- \(\ce{BF4-}\)
- \(\ce{SnCl3-}\)
- H2CCH2
- ClF3
- SeF6
- (h) \(\ce{PO4^3-}\)
Draw all possible resonance structures for each of these compounds. Determine the formal charge on each atom in each of the resonance structures:
- O3
- SO2
- \(\ce{NO2-}\)
- \(\ce{NO3-}\)
 ;
;
(b)
 ;
;
(c)
![[Two Lewis structures are shown, with brackets surrounding each with a superscripted negative sign and a double ended arrow in between. The left structure shows a nitrogen atom with one lone pair of electrons single bonded to an oxygen atom with three lone pairs of electrons and double bonded to an oxygen atom with two lone pairs of electrons. The symbols and numbers below this structure read “open parenthesis, 0, close parenthesis, open parenthesis, 0, close parenthesis, open parenthesis, negative 1, close parenthesis. The right structure appears as a mirror image of the left and the symbols and numbers below this structure read “open parenthesis, negative 1, close parenthesis, open parenthesis, 0, close parenthesis, open parenthesis, 0, close parenthesis.]](http://cnx.org/resources/1fdade826754e56f88dd8009bac80fa91af0bebc/CNX_Chem_07_04_Exercis12c_img.jpg) ;
;
(d)
![[Três estruturas de Lewis são mostradas, com colchetes ao redor de cada uma com um sinal negativo sobrescrito e uma seta de ponta dupla no meio. A estrutura esquerda mostra um átomo de nitrogênio ligado de forma simples a dois átomos de oxigênio, cada um com três pares solitários de elétrons e duplamente ligado a um átomo de oxigênio com dois pares solitários de elétrons. Os átomos de oxigênio de ligação simples são rotulados, do topo da estrutura e no sentido horário, como “parêntese aberto, menos 1, parêntese fechado, parêntese aberto, positivo 1, parêntese fechado”. Os símbolos e números abaixo dessa estrutura dizem “parêntese aberta”, 0, parêntese de fechamento, parêntese aberto, menos 1, parêntese de fechamento. A estrutura média mostra um átomo de nitrogênio ligado de forma simples a dois átomos de oxigênio, cada um com três pares solitários de elétrons, um dos quais é rotulado como “parêntese aberto, positivo 1, parêntese fechado” e duplo ligado a um átomo de oxigênio com dois pares solitários de elétrons rotulados como “parêntese aberto, 0, parêntese fechado”. Os símbolos e números abaixo dessa estrutura dizem “parêntese aberta, menos 1, parêntese fechada, parêntese aberto, menos 1, parêntese fechada”. A estrutura certa mostra um átomo de nitrogênio ligado de forma simples a dois átomos de oxigênio, cada um com três pares solitários de elétrons e duplamente ligado a um átomo de oxigênio com dois pares solitários de elétrons. Um dos átomos de oxigênio de ligação simples é rotulado como “parêntese aberto, menos 1, parêntese fechado, enquanto o oxigênio de ligação dupla é rotulado como “parêntese aberto, positivo 1, parêntese fechado”. Os símbolos e números abaixo dessa estrutura dizem “parêntese aberta, menos 1, parêntese fechada” e “parêntese aberto, 0, parêntese fechada”.]](http://cnx.org/resources/263fd2cd3c8d574474c489b5bb2f41b94cd81ae5/CNX_Chem_07_04_Exercis12d_img.jpg)
Com base em considerações formais de carga, qual das seguintes opções provavelmente seria a disposição correta dos átomos no cloreto de nitrosila: ClNO ou ClON?
Com base em considerações formais de carga, qual das seguintes opções provavelmente seria a disposição correta dos átomos no ácido hipocloroso: HOCl ou OClH?
HOCl
Com base em considerações formais de carga, qual das seguintes opções provavelmente seria a disposição correta dos átomos no dióxido de enxofre: OSO ou SOO?
Desenhe a estrutura da hidroxilamina, H 3 NO, e atribua cargas formais; procure a estrutura. A estrutura real é consistente com as cobranças formais?
A estrutura que fornece zero cobranças formais é consistente com a estrutura real:

O iodo forma uma série de fluoretos (listados aqui). Escreva estruturas de Lewis para cada um dos quatro compostos e determine a carga formal do átomo de iodo em cada molécula:
- E SE
- SE 3
- SE 5
- SE 7
Escreva a estrutura de Lewis e a fórmula química do composto com uma massa molar de cerca de 70 g/mol que contém 19,7% de nitrogênio e 80,3% de flúor em massa e determine a carga formal dos átomos nesse composto.
NF 3;

Qual das seguintes estruturas esperaríamos para o ácido nitroso? Determine as cobranças formais:

O ácido sulfúrico é o produto químico industrial produzido em maior quantidade em todo o mundo. Cerca de 90 bilhões de libras são produzidas a cada ano somente nos Estados Unidos. Escreva a estrutura de Lewis para o ácido sulfúrico, H 2 SO 4, que tem dois átomos de oxigênio e dois grupos OH ligados ao enxofre.

7.6: Pontos fortes das ligações iônicas e covalentes
Qual vínculo em cada um dos seguintes pares de vínculos é o mais forte?
- C—C ou\(\mathrm{C=C}\)
- C–N or \(\mathrm{C≡N}\)
- \(\mathrm{C≡O}\) or \(\mathrm{C=O}\)
- H–F or H–Cl
- C–H or O–H
- C–N or C–O
Using the bond energies in Table, determine the approximate enthalpy change for each of the following reactions:
- \(\ce{H2}(g)+\ce{Br2}(g)⟶\ce{2HBr}(g)\)
- \(\ce{CH4}(g)+\ce{I2}(g)⟶\ce{CH3I}(g)+\ce{HI}(g)\)
- (c) \(\ce{C2H4}(g)+\ce{3O2}(g)⟶\ce{2CO2}(g)+\ce{2H2O}(g)\)
- −114 kJ;
- 30 kJ;
- (c) −1055 kJ
Using the bond energies in Table, determine the approximate enthalpy change for each of the following reactions:
- \(\ce{Cl2}(g)+\ce{3F2}(g)⟶\ce{2ClF3}(g)\)
- \(\mathrm{H_2C=CH_2}(g)+\ce{H2}(g)⟶\ce{H3CCH3}(g)\)
- (c) \(\ce{2C2H6}(g)+\ce{7O2}(g)⟶\ce{4CO2}(g)+\ce{6H2O}(g)\)
When a molecule can form two different structures, the structure with the stronger bonds is usually the more stable form. Use bond energies to predict the correct structure of the hydroxylamine molecule:

The greater bond energy is in the figure on the left. It is the more stable form.
How does the bond energy of HCldiffer from the standard enthalpy of formation of HCl(g)?
Using the standard enthalpy of formation data in Appendix G, show how the standard enthalpy of formation of HCl(g) can be used to determine the bond energy.
\(\ce{HCl}(g)⟶\dfrac{1}{2}\ce{H2}(g)+\dfrac{1}{2}\ce{Cl2}(g)\hspace{20px}ΔH^\circ_1=−ΔH^\circ_{\ce f[\ce{HCl}(g)]}\\
\dfrac{1}{2}\ce{H2}(g)⟶\ce{H}(g)\hspace{105px}ΔH^\circ_2=ΔH^\circ_{\ce f[\ce H(g)]}\\
\underline{\dfrac{1}{2}\ce{Cl2}(g)⟶\ce{Cl}(g)\hspace{99px}ΔH^\circ_3=ΔH^\circ_{\ce f[\ce{Cl}(g)]}}\\
\ce{HCl}(g)⟶\ce{H}(g)+\ce{Cl}(g)\hspace{58px}ΔH^\circ_{298}=ΔH^\circ_1+ΔH^\circ_2+ΔH^\circ_3\)
\(\begin{align}
D_\ce{HCl}=ΔH^\circ_{298}&=ΔH^\circ_{\ce f[\ce{HCl}(g)]}+ΔH^\circ_{\ce f[\ce H(g)]}+ΔH^\circ_{\ce f[\ce{Cl}(g)]}\\
&=\mathrm{−(−92.307\:kJ)+217.97\:kJ+121.3\:kJ}\\
&=\mathrm{431.6\:kJ}
\end{align}\)
Using the standard enthalpy of formation data in Appendix G, calculate the bond energy of the carbon-sulfur double bond in CS2.
Using the standard enthalpy of formation data in Appendix G, determine which bond is stronger: the S–F bond in SF4(g) or in SF6(g)?
The S–F bond in SF4 is stronger.
Using the standard enthalpy of formation data in Appendix G, determine which bond is stronger: the P–Cl bond in PCl3(g) or in PCl5(g)?
Complete the following Lewis structure by adding bonds (not atoms), and then indicate the longest bond:


The C–C single bonds are longest.
Use the bond energy to calculate an approximate value of ΔH for the following reaction. Which is the more stable form of FNO2?

Use principles of atomic structure to answer each of the following:1
- The radius of the Ca atom is 197 pm; the radius of the Ca2+ ion is 99 pm. Account for the difference.
- The lattice energy of CaO(s) is –3460 kJ/mol; the lattice energy of K2O is –2240 kJ/mol. Account for the difference.
- (c) Given these ionization values, explain the difference between Ca and K with regard to their first and second ionization energies.
| Element | First Ionization Energy (kJ/mol) | Second Ionization Energy (kJ/mol) |
|---|---|---|
| K | 419 | 3050 |
| Ca | 590 | 1140 |
The first ionization energy of Mg is 738 kJ/mol and that of Al is 578 kJ/mol. Account for this difference.
When two electrons are removed from the valence shell, the Ca radius loses the outermost energy level and reverts to the lower n = 3 level, which is much smaller in radius. The +2 charge on calcium pulls the oxygen much closer compared with K, thereby increasing the lattice energy relative to a less charged ion. (c) Removal of the 4s electron in Ca requires more energy than removal of the 4s electron in K because of the stronger attraction of the nucleus and the extra energy required to break the pairing of the electrons. The second ionization energy for K requires that an electron be removed from a lower energy level, where the attraction is much stronger from the nucleus for the electron. In addition, energy is required to unpair two electrons in a full orbital. For Ca, the second ionization potential requires removing only a lone electron in the exposed outer energy level. In Al, the removed electron is relatively unprotected and unpaired in a p orbital. The higher energy for Mg mainly reflects the unpairing of the 2s electron.
The lattice energy of LiF is 1023 kJ/mol, and the Li–F distance is 200.8 pm. NaF crystallizes in the same structure as LiF but with a Na–F distance of 231 pm. Which of the following values most closely approximates the lattice energy of NaF: 510, 890, 1023, 1175, or 4090 kJ/mol? Explain your choice.
For which of the following substances is the least energy required to convert one mole of the solid into separate ions?
- MgO
- SrO
- (c) KF
- CsF
- MgF2
(d)
The reaction of a metal, M, with a halogen, X2, proceeds by an exothermic reaction as indicated by this equation: \(\ce{M}(s)+\ce{X2}(g)⟶\ce{MX2}(s)\). For each of the following, indicate which option will make the reaction more exothermic. Explain your answers.
- a large radius vs. a small radius for M+2
- a high ionization energy vs. a low ionization energy for M
- (c) an increasing bond energy for the halogen
- a decreasing electron affinity for the halogen
- an increasing size of the anion formed by the halogen
The lattice energy of LiF is 1023 kJ/mol, and the Li–F distance is 201 pm. MgO crystallizes in the same structure as LiF but with a Mg–O distance of 205 pm. Which of the following values most closely approximates the lattice energy of MgO: 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol, or 4008 kJ/mol? Explain your choice.
4008 kJ/mol; both ions in MgO have twice the charge of the ions in LiF; the bond length is very similar and both have the same structure; a quadrupling of the energy is expected based on the equation for lattice energy
Which compound in each of the following pairs has the larger lattice energy? Note: Mg2+ and Li+ have similar radii; O2– and F– have similar radii. Explain your choices.
- MgO or MgSe
- LiF or MgO
- (c) Li2O or LiCl
- Li2Se or MgO
Which compound in each of the following pairs has the larger lattice energy? Note: Ba2+ and
K+ have similar radii; S2– and Cl– have similar radii. Explain your choices.
- K2O or Na2O
- K2S or BaS
- (c) KCl or BaS
- BaS or BaCl2
Na2O; Na+ has a smaller radius than K+; BaS; Ba has a larger charge than K; (c) BaS; Ba and S have larger charges; BaS; S has a larger charge
Which of the following compounds requires the most energy to convert one mole of the solid into separate ions?
- MgO
- SrO
- (c) KF
- CsF
- MgF2
Which of the following compounds requires the most energy to convert one mole of the solid into separate ions?
- K2S
- K2O
- (c) CaS
- Cs2S
- CaO
(e)
The lattice energy of KF is 794 kJ/mol, and the interionic distance is 269 pm. The Na–F
distance in NaF, which has the same structure as KF, is 231 pm. Which of the following values is the closest approximation of the lattice energy of NaF: 682 kJ/mol, 794 kJ/mol, 924 kJ/mol, 1588 kJ/mol, or 3175 kJ/mol? Explain your answer.
7.7: Molecular Structure and Polarity
Explain why the HOH molecule is bent, whereas the HBeH molecule is linear.
The placement of the two sets of unpaired electrons in water forces the bonds to assume a tetrahedral arrangement, and the resulting HOH molecule is bent. The HBeH molecule (in which Be has only two electrons to bond with the two electrons from the hydrogens) must have the electron pairs as far from one another as possible and is therefore linear.
What feature of a Lewis structure can be used to tell if a molecule’s (or ion’s) electron-pair geometry and molecular structure will be identical?
Explain the difference between electron-pair geometry and molecular structure.
Space must be provided for each pair of electrons whether they are in a bond or are present as lone pairs. Electron-pair geometry considers the placement of all electrons. Molecular structure considers only the bonding-pair geometry.
Why is the H–N–H angle in NH3 smaller than the H–C–H bond angle in CH4? Why is the H–N–H angle in \(\ce{NH4+}\) identical to the H–C–H bond angle in CH4?
Explain how a molecule that contains polar bonds can be nonpolar.
As long as the polar bonds are compensated (for example. two identical atoms are found directly across the central atom from one another), the molecule can be nonpolar.
As a general rule, MXn molecules (where M represents a central atom and X represents terminal atoms; n = 2 – 5) are polar if there is one or more lone pairs of electrons on M. NH3 (M = N, X = H, n = 3) is an example. There are two molecular structures with lone pairs that are exceptions to this rule. What are they?
Predict the electron pair geometry and the molecular structure of each of the following molecules or ions:
- SF6
- PCl5
- (c) BeH2
- \(\ce{CH3+}\)
- Both the electron geometry and the molecular structure are octahedral.
- Both the electron geometry and the molecular structure are trigonal bipyramid.
- (c) Both the electron geometry and the molecular structure are linear.
- Both the electron geometry and the molecular structure are trigonal planar.
Identify the electron pair geometry and the molecular structure of each of the following molecules or ions:
- \(\ce{IF6+}\)
- CF4
- (c) BF3
- \(\ce{SiF5-}\)
- BeCl2
What are the electron-pair geometry and the molecular structure of each of the following molecules or ions?
- ClF5
- \(\ce{ClO2-}\)
- (c) \(\ce{TeCl4^2-}\)
- PCl3
- SeF4
- \(\ce{PH2-}\)
electron-pair geometry: octahedral, molecular structure: square pyramidal; electron-pair geometry: tetrahedral, molecular structure: bent; (c) electron-pair geometry: octahedral, molecular structure: square planar; electron-pair geometry: tetrahedral, molecular structure: trigonal pyramidal; electron-pair geometry: trigonal bypyramidal, molecular structure: seesaw; electron-pair geometry: tetrahedral, molecular structure: bent (109°)
Predict the electron pair geometry and the molecular structure of each of the following ions:
- H3O+
- \(\ce{PCl4-}\)
- (c) \(\ce{SnCl3-}\)
- \(\ce{BrCl4-}\)
- ICl3
- XeF4
- (g) SF2
Identify the electron pair geometry and the molecular structure of each of the following molecules:
- ClNO (N is the central atom)
- CS2
- (c) Cl2CO (C is the central atom)
- Cl2SO (S is the central atom)
- SO2F2 (S is the central atom)
- XeO2F2 (Xe is the central atom)
- (g) \(\ce{ClOF2+}\) (Cl is the central atom)
electron-pair geometry: trigonal planar, molecular structure: bent (120°); electron-pair geometry: linear, molecular structure: linear; (c) electron-pair geometry: trigonal planar, molecular structure: trigonal planar; electron-pair geometry: tetrahedral, molecular structure: trigonal pyramidal; electron-pair geometry: tetrahedral, molecular structure: tetrahedral; electron-pair geometry: trigonal bipyramidal, molecular structure: seesaw; (g) electron-pair geometry: tetrahedral, molecular structure: trigonal pyramidal
Predict the electron pair geometry and the molecular structure of each of the following:
- IOF5 (I is the central atom)
- POCl3 (P is the central atom)
- (c) Cl2SeO (Se is the central atom)
- ClSO+ (S is the central atom)
- F2SO (S is the central atom)
- \(\ce{NO2-}\)
- (g) \(\ce{SiO4^4-}\)
Which of the following molecules and ions contain polar bonds? Which of these molecules and ions have dipole moments?
- ClF5
- \(\ce{ClO2-}\)
- (c) \(\ce{TeCl4^2-}\)
- PCl3
- SeF4
- \(\ce{PH2-}\)
- (g) XeF2
All of these molecules and ions contain polar bonds. Only ClF5, \(\ce{ClO2-}\), PCl3, SeF4, and \(\ce{PH2-}\) have dipole moments.
Which of the molecules and ions in Exercise contain polar bonds? Which of these molecules and ions have dipole moments?
- H3O+
- \(\ce{PCl4-}\)
- (c) \(\ce{SnCl3-}\)
- \(\ce{BrCl4-}\)
- ICl3
- XeF4
- (g) SF2
Which of the following molecules have dipole moments?
- CS2
- SeS2
- (c) CCl2F2
- PCl3 (P is the central atom)
- ClNO (N is the central atom)
SeS2, CCl2F2, PCl3, and ClNO all have dipole moments.
Identify the molecules with a dipole moment:
- SF4
- CF4
- (c) Cl2CCBr2
- CH3Cl
- H2CO
The molecule XF3 has a dipole moment. Is X boron or phosphorus?
P
The molecule XCl2 has a dipole moment. Is X beryllium or sulfur?
Is the Cl2BBCl2 molecule polar or nonpolar?
nonpolar
There are three possible structures for PCl2F3 with phosphorus as the central atom. Draw them and discuss how measurements of dipole moments could help distinguish among them.
Describe the molecular structure around the indicated atom or atoms:
- the sulfur atom in sulfuric acid, H2SO4 [(HO)2SO2]
- the chlorine atom in chloric acid, HClO3 [HOClO2]
- (c) the oxygen atom in hydrogen peroxide, HOOH
- the nitrogen atom in nitric acid, HNO3 [HONO2]
- the oxygen atom in the OH group in nitric acid, HNO3 [HONO2]
- the central oxygen atom in the ozone molecule, O3
- (g) each of the carbon atoms in propyne, CH3CCH
- (h) the carbon atom in Freon, CCl2F2
- (i) each of the carbon atoms in allene, H2CCCH2
tetrahedral; trigonal pyramidal; (c) bent (109°); trigonal planar; bent (109°); bent (109°); (g) CH3CCH tetrahedral, CH3CCH linear; (h) tetrahedral; (i) H2CCCH2 linear; H2CCCH2 trigonal planar
Draw the Lewis structures and predict the shape of each compound or ion:
- CO2
- \(\ce{NO2-}\)
- (c) SO3
- \(\ce{SO3^2-}\)
A molecule with the formula AB2, in which A and B represent different atoms, could have one of three different shapes. Sketch and name the three different shapes that this molecule might have. Give an example of a molecule or ion for each shape.

Uma molécula com a fórmula AB 3, na qual A e B representam átomos diferentes, pode ter uma das três formas diferentes. Desenhe e nomeie as três formas diferentes que essa molécula pode ter. Dê um exemplo de uma molécula ou íon que tem cada forma.
Desenhe as estruturas de pontos de elétrons de Lewis para essas moléculas, incluindo estruturas de ressonância, quando apropriado:
- \(\ce{CS3^2-}\)
- CS 2
- (c) CS
preveja as formas moleculares para\(\ce{CS3^2-}\) o CS 2 e explique como você chegou às suas previsões
(uma)
 ;
;
(b)
 ;
;
(c)
 ;
;
\(\ce{CS3^2-}\) includes three regions of electron density (all are bonds with no lone pairs); the shape is trigonal planar; CS2 has only two regions of electron density (all bonds with no lone pairs); the shape is linear
What is the molecular structure of the stable form of FNO2? (N is the central atom.)
A compound with a molar mass of about 42 g/mol contains 85.7% carbon and 14.3% hydrogen. What is its molecular structure?
The Lewis structure is made from three units, but the atoms must be rearranged:

Use a simulação para realizar os seguintes exercícios para uma molécula de dois átomos:
- Ajuste o valor da eletronegatividade para que o dipolo da ligação esteja apontando para B. Em seguida, determine quais devem ser os valores de eletronegatividade para alternar o dipolo de forma que ele aponte para A.
- Com uma carga positiva parcial em A, ligue o campo elétrico e descreva o que acontece.
- (c) Com uma pequena carga negativa parcial em A, ligue o campo elétrico e descreva o que acontece.
- Reinicie tudo e, em seguida, com uma grande carga negativa parcial em A, ligue o campo elétrico e descreva o que acontece.
Use a simulação para realizar os seguintes exercícios para uma molécula real. Talvez seja necessário girar as moléculas em três dimensões para ver certos dipolos.
- Esboce os dipolos de ligação e o dipolo molecular (se houver) para O 3. Explique suas observações.
- Veja os dipolos de ligação do NH 3. Use esses dipolos para prever se N ou H são mais eletronegativos.
- (c) Preveja se deve haver um dipolo molecular para o NH 3 e, em caso afirmativo, em que direção ele apontará. Marque a caixa de dipolo molecular para testar sua hipótese.
O dipolo molecular aponta para longe dos átomos de hidrogênio.
Use o simulador Molecule Shape para construir uma molécula. Começando com o átomo central, clique na ligação dupla para adicionar uma ligação dupla. Em seguida, adicione uma única ligação e um par solitário. Gire a molécula para observar a geometria completa. Nomeie a geometria do grupo de elétrons e a estrutura molecular e preveja o ângulo de ligação. Em seguida, clique nas caixas de seleção na parte inferior e direita do simulador para verificar suas respostas.
Use o simulador Molecule Shape para explorar moléculas reais. Na guia Moléculas reais, selecione H 2 O. Alterne entre os modos “real” e “modelo”. Explique a diferença observada.
As estruturas são muito parecidas. No modo modelo, cada grupo de elétrons ocupa a mesma quantidade de espaço, então o ângulo de ligação é mostrado como 109,5°. No modo “real”, os pares solitários são maiores, fazendo com que os hidrogênios sejam comprimidos. Isso leva a um ângulo menor de 104,5°.
Use o simulador Molecule Shape para explorar moléculas reais. Na guia Moléculas reais, selecione o modo “modelo” e S 2 O. Qual é o ângulo de união do modelo? Explique se o ângulo de aderência “real” deve ser maior ou menor do que o ângulo ideal do modelo.


