7.5: Pontos fortes das ligações iônicas e covalentes
- Page ID
- 185110
- Descreva a energética da formação e quebra de ligações covalentes e iônicas
- Use o ciclo de Born-Haber para calcular energias de rede para compostos iônicos
- Use energias médias de ligação covalente para estimar as entalpias da reação
A força de uma ligação descreve a intensidade com que cada átomo está unido a outro átomo e, portanto, quanta energia é necessária para romper a ligação entre os dois átomos. Nesta seção, você aprenderá sobre a força de união das ligações covalentes e a comparará com a força das ligações iônicas, que está relacionada à energia da rede de um composto.
Força de ligação: ligações covalentes
As moléculas estáveis existem porque as ligações covalentes mantêm os átomos juntos. Medimos a força de uma ligação covalente pela energia necessária para quebrá-la, ou seja, a energia necessária para separar os átomos ligados. Separar qualquer par de átomos ligados requer energia; quanto mais forte a ligação, maior a energia necessária para quebrá-la. A energia necessária para quebrar uma ligação covalente específica em um mol de moléculas gasosas é chamada de energia de ligação ou energia de dissociação da ligação. A energia de ligação para uma molécula diatômica\(D_{X–Y}\),, é definida como a mudança de entalpia padrão para a reação endotérmica:
\[XY_{(g)}⟶X_{(g)}+Y_{(g)}\;\;\; D_{X−Y}=ΔH° \label{7.6.1} \]
Por exemplo, a energia de ligação da ligação covalente H—H pura,\(\Delta_{H–H}\), é de 436 kJ por mol de ligações H-H quebradas:
\[H_{2(g)}⟶2H_{(g)} \;\;\; D_{H−H}=ΔH°=436kJ \label{EQ2} \]
A quebra de uma ligação sempre exige que energia seja adicionada à molécula. Da mesma forma, fazer um vínculo sempre libera energia.
Moléculas com três ou mais átomos têm duas ou mais ligações. A soma de todas as energias de ligação em tal molécula é igual à mudança de entalpia padrão para a reação endotérmica que quebra todas as ligações na molécula. Por exemplo, a soma das quatro energias de ligação C—H em CH 4, 1660 kJ, é igual à mudança de entalpia padrão da reação:
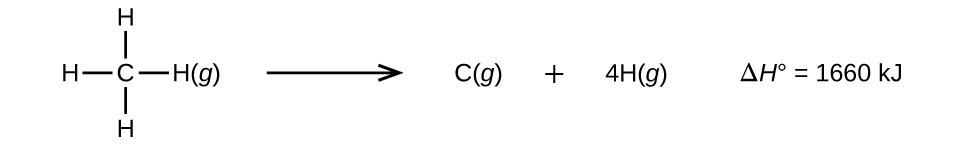
A energia média da ligação C—H\(D_{C–H}\),, é 1660/4 = 415 kJ/mol porque há quatro moles de ligações C—H quebradas por mol da reação. Embora as quatro ligações C—H sejam equivalentes na molécula original, elas não requerem a mesma energia para serem quebradas; uma vez que a primeira ligação é quebrada (o que requer 439 kJ/mol), as ligações restantes são mais fáceis de quebrar. O valor de 415 kJ/mol é a média, não o valor exato necessário para quebrar qualquer vínculo.
A força de uma ligação entre dois átomos aumenta à medida que o número de pares de elétrons na ligação aumenta. Geralmente, à medida que a força de união aumenta, o comprimento da ligação diminui. Assim, descobrimos que as ligações triplas são mais fortes e mais curtas do que as ligações duplas entre os mesmos dois átomos; da mesma forma, as ligações duplas são mais fortes e mais curtas do que as ligações simples entre os mesmos dois átomos. As energias médias dos títulos para alguns títulos comuns aparecem na Tabela\(\PageIndex{2}\), e uma comparação dos comprimentos e das forças dos títulos para alguns títulos comuns aparece na Tabela\(\PageIndex{2}\). Quando um átomo se liga a vários átomos em um grupo, a força de ligação normalmente diminui à medida que descemos no grupo. Por exemplo, C—F é 439 kJ/mol, C—Cl é 330 kJ/mol e C—Br é 275 kJ/mol.
| Bond | Energia de ligação | Bond | Energia de ligação | Bond | Energia de ligação | ||
|---|---|---|---|---|---|---|---|
| H — H | 436 | C—S | 260 | F — Cl | 255 | ||
| H — C | 415 | C—Cl | 330 | F—Br | 235 | ||
| H—N | 390 | C—Br | 275 | Si — Si | 230 | ||
| H—O | 464 | C—I | 240 | Si — P | 215 | ||
| H — F | 569 | N—N | 160 | Si — S | 225 | ||
| H—Si | 395 | \(\mathrm{N=N}\) | 418 | Si — Cl | 359 | ||
| H—P | 320 | \(\mathrm{N≡N}\) | 946 | Si-Br | 290 | ||
| H—S | 340 | N—O | 200 | Si — Eu | 215 | ||
| H — Cl | 432 | N—F | 270 | P—P | 215 | ||
| H—Br | 370 | N—P | 210 | P—S | 230 | ||
| H—I | 295 | N—Cl | 200 | P—Cl | 330 | ||
| C—C | 345 | N—Br | 245 | P—Br | 270 | ||
| \(\mathrm{C=C}\) | 611 | O—O | 140 | P—I | 215 | ||
| \(\mathrm{C≡C}\) | 837 | \(\mathrm{O=O}\) | 498 | —S | 215 | ||
| C—N | 290 | O—F | 160 | S—Cl | 250 | ||
| \(\mathrm{C=N}\) | 615 | O — Si | 370 | S—Br | 215 | ||
| \(\mathrm{C≡N}\) | 891 | O—P | 350 | Cl — Cl | 243 | ||
| C—O | 350 | O — Cl | 205 | Cl—Br | 220 | ||
| \(\mathrm{C=O}\) | 741 | O—I | 200 | Cl — Eu | 210 | ||
| \(\mathrm{C≡O}\) | 1080 | F—F | 160 | Br—Br | 190 | ||
| C—F | 439 | F—Si | 540 | Br—Eu | 180 | ||
| C—Si | 360 | F—P | 489 | EU—EU | 150 | ||
| C—P | 265 | F—S | 285 |
| Bond | Comprimento da ligação (Å) | Energia de ligação (kJ/mol) |
|---|---|---|
| C—C | 1,54 | 345 |
| \(\mathrm{C=C}\) | 1,34 | 611 |
| \(\mathrm{C≡C}\) | 1,20 | 837 |
| C—N | 1,43 | 290 |
| \(\mathrm{C=N}\) | 1,38 | 615 |
| \(\mathrm{C≡N}\) | 1,16 | 891 |
| C—O | 1,43 | 350 |
| \(\mathrm{C=O}\) | 1,23 | 741 |
| \(\mathrm{C≡O}\) | 1,13 | 1080 |
Podemos usar energias de ligação para calcular mudanças aproximadas de entalpia para reações em que as entalpias de formação não estão disponíveis. Cálculos desse tipo também nos dirão se uma reação é exotérmica ou endotérmica.
- Uma reação exotérmica (ΔH negativo, calor produzido) ocorre quando as ligações nos produtos são mais fortes do que as ligações nos reagentes.
- Uma reação endotérmica (ΔH positivo, absorvido pelo calor) ocorre quando as ligações nos produtos são mais fracas do que as dos reagentes.
A mudança de entalpia, ΔH, para uma reação química é aproximadamente igual à soma da energia necessária para quebrar todas as ligações nos reagentes (energia “entrando”, sinal positivo) mais a energia liberada quando todas as ligações são formadas nos produtos (energia “saída”, sinal negativo). Isso pode ser expresso matematicamente da seguinte maneira:
\[\Delta H=\sum D_{\text{bonds broken}}− \sum D_{\text{bonds formed}} \label{EQ3} \]
Nessa expressão, o símbolo\(\Sigma\) significa “a soma de” e D representa a energia de ligação em quilojoules por mol, que é sempre um número positivo. A energia de ligação é obtida de uma tabela e dependerá se a ligação específica é uma ligação simples, dupla ou tripla. Assim, ao calcular as entalpias dessa maneira, é importante considerar a ligação em todos os reagentes e produtos. Como os valores de D são normalmente médias para um tipo de ligação em muitas moléculas diferentes, esse cálculo fornece uma estimativa aproximada, não um valor exato, para a entalpia da reação.
Considere a seguinte reação:
\[\ce{H_{2(g)} + Cl_{2(g)}⟶2HCl_{(g)}} \label{EQ4} \]
ou
\[\ce{H–H_{(g)} + Cl–Cl_{(g)}⟶2H–Cl_{(g)}} \label{\EQ5} \]
Para formar dois moles de HCl, um mol de ligações H-H e um mol de ligações Cl-Cl devem ser quebrados. A energia necessária para romper essas ligações é a soma da energia de ligação da ligação H-H (436 kJ/mol) e da ligação Cl-Cl (243 kJ/mol). Durante a reação, dois moles de ligações H-Cl são formados (energia de ligação = 432 kJ/mol), liberando 2 × 432 kJ; ou 864 kJ. Como as ligações nos produtos são mais fortes do que as dos reagentes, a reação libera mais energia do que consome:
\ [\ begin {align*}
ΔH&=\ sum\ mathrm {D_ {títulos\: quebrados}} −\ sum\ mathrm {D_ {títulos\: formados}}\\ [4pt]
&=\ mathrm {[D_ {H−H} +D_ {Cl-Cl}] −2D_ {H−Cl}}\\ [4pt]
&=\ ma thrm {[436+243] −2 (432) =−185\ :kJ}
\ end {align*}\ nonumber\]
Esse excesso de energia é liberado como calor, então a reação é exotérmica. A tabela T2 fornece um valor para a entalpia molar padrão de formação de HCl (g)\(ΔH^\circ_\ce f\),, de —92,307 kJ/mol. O dobro desse valor é —184,6 kJ, o que concorda bem com a resposta obtida anteriormente para a formação de dois moles de HCl.
O metanol, CH 3 OH, pode ser um excelente combustível alternativo. A reação de alta temperatura de vapor e carbono produz uma mistura dos gases monóxido de carbono, CO e hidrogênio, H 2, dos quais o metanol pode ser produzido. Usando as energias de ligação na Tabela\(\PageIndex{2}\), calcule a variação aproximada da entalpia, ΔH, para a reação aqui:
\[CO_{(g)}+2H2_{(g)}⟶CH_3OH_{(g)} \nonumber \]
Solução
Primeiro, precisamos escrever as estruturas de Lewis dos reagentes e dos produtos:
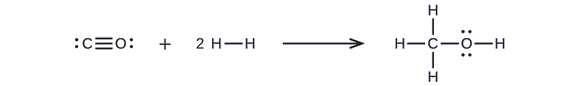
A partir disso, vemos que ΔH para essa reação envolve a energia necessária para quebrar uma ligação tripla C—O e duas ligações simples H—H, bem como a energia produzida pela formação de três ligações simples C—H, uma ligação simples C—O e uma ligação simples O—H. Podemos expressar isso da seguinte forma (via Equation\ ref {EQ3}):
\ [\ begin {align*}
ΔH&=\ sum D_ {títulos\: quebrados} −\ soma D_ {ligações\: formadas}\\
ΔH&=\ mathrm {[D_ {CO} +2 (D_ {H−H})] − [3 (D_ {C−H}) +D_ {C−O} +D_ {O−H}]
\ end {align*}\ nonumber\]
Usando os valores de energia de ligação na Tabela\(\PageIndex{2}\), obtemos:
\ [\ begin {align*}
ΔH&= [1080+2 (436)] − [3 (415) +350+464]\\
&=\ ce {−107\ :kJ}
\ end {align*}\ nonumber\]
Podemos comparar esse valor com o valor calculado com base nos\(ΔH^\circ_\ce f\) dados do Apêndice G:
\ [\ begin {align*}
ΔH&= [ΔH^\ circ_ {\ ce f}\ ce {CH3OH} (g)] − [ΔH^\ circ_ {\ ce f}\ ce {CO} (g) +2×ΔH^\ circ_ {\ ce f}\ ce {H2}]\\
&= [−201,0] − [−110,52+2+2+ × 0]\\
&=\ mathrm {−90,5\ :kJ}
\ end {align*}\ nonumber\]
Observe que há uma lacuna bastante significativa entre os valores calculados usando os dois métodos diferentes. Isso ocorre porque os valores de D são a média de diferentes forças de união; portanto, eles geralmente fornecem apenas uma concordância aproximada com outros dados.
O álcool etílico, CH 3 CH 2 OH, foi um dos primeiros produtos químicos orgânicos deliberadamente sintetizados por humanos. Tem muitos usos na indústria e é o álcool contido nas bebidas alcoólicas. Pode ser obtido pela fermentação do açúcar ou sintetizado pela hidratação do etileno na seguinte reação:

Usando as energias de ligação na Tabela\(\PageIndex{2}\), calcule uma mudança de entalpia aproximada, ΔH, para essa reação.
- Resposta
-
-35 kJ
Força de ligação iônica e energia de rede
Um composto iônico é estável devido à atração eletrostática entre seus íons positivos e negativos. A energia da rede de um composto é uma medida da força dessa atração. A energia da rede (\(ΔH_{lattice}\)) de um composto iônico é definida como a energia necessária para separar um mol do sólido em seus íons gasosos componentes. Para o sólido iônico MX, a energia da rede é a mudança de entalpia do processo:
\[MX_{(s)}⟶Mn^+_{(g)}+X^{n−}_{(g)} \;\;\;\;\; ΔH_{lattice} \label{EQ6} \]
Observe que estamos usando a convenção em que o sólido iônico é separado em íons, então nossas energias de rede serão endotérmicas (valores positivos). Alguns textos usam a convenção equivalente, mas oposta, definindo a energia da rede como a energia liberada quando íons separados se combinam para formar uma rede e fornecem valores negativos (exotérmicos). Portanto, se você estiver procurando energias de rede em outra referência, certifique-se de verificar qual definição está sendo usada. Em ambos os casos, uma magnitude maior para a energia da rede indica um composto iônico mais estável. Para cloreto de sódio, a rede ΔH = 769 kJ. Portanto, são necessários 769 kJ para separar um mol de NaCl sólido em íons Na+ e Cl — gasosos. Quando um mol de cada íon gasoso Na+ e Cl — forma NaCl sólido, 769 kJ de calor são liberados.
A energia\(ΔH_{lattice}\) da rede de um cristal iônico pode ser expressa pela seguinte equação (derivada da lei de Coulomb, que rege as forças entre cargas elétricas):
\[ΔH_{lattice}=\dfrac{C(Z^+)(Z^−)}{R_o} \label{EQ7} \]
em que
- \(\ce{C}\)é uma constante que depende do tipo de estrutura cristalina;
- \(Z^+\)e\(Z^–\) são as cargas sobre os íons; e
- \(R_o\)é a distância interiônica (a soma dos raios dos íons positivos e negativos).
Assim, a energia da rede de um cristal iônico aumenta rapidamente à medida que as cargas dos íons aumentam e os tamanhos dos íons diminuem. Quando todos os outros parâmetros são mantidos constantes, dobrar a carga do cátion e do ânion quadruplica a energia da rede. Por exemplo, a energia da rede de LiF (Z + e Z — = 1) é 1023 kJ/mol, enquanto a de MgO (Z + e Z — = 2) é 3900 kJ/mol (R o é quase o mesmo — cerca de 200pm para ambos os compostos).
Diferentes distâncias interatômicas produzem diferentes energias de rede. Por exemplo, podemos comparar a energia da rede de MgF 2 (2957 kJ/mol) com a de MGi 2 (2327 kJ/mol) para observar o efeito na energia da rede do menor tamanho iônico de F - em comparação com I -.
A gema preciosa de rubi é o óxido de alumínio, Al 2 O 3, contendo traços de Cr 3 +. O composto Al 2 Se 3 é usado na fabricação de alguns dispositivos semicondutores. Qual tem a maior energia da rede, Al 2 O 3 ou Al 2 Se 3?
Solução
Nesses dois compostos iônicos, as cargas Z + e Z - são as mesmas, então a diferença na energia da rede dependerá principalmente de R o. O íon O 2— é menor que o íon Se 2 —. Assim, Al 2 O 3 teria uma distância interiônica menor do que Al 2 Se 3, e Al 2 O 3 teria a maior energia da rede.
O óxido de zinco, ZnO, é um protetor solar muito eficaz. Como a energia da rede do ZnO se compararia à do NaCl?
- Resposta
-
O ZnO teria a maior energia da rede porque os valores Z do cátion e do ânion em ZnO são maiores e a distância interiônica de ZnO é menor que a do NaCl.
O ciclo Born-Haber
Não é possível medir diretamente as energias da rede. No entanto, a energia da rede pode ser calculada usando a equação dada na seção anterior ou usando um ciclo termoquímico. O ciclo de Born-Haber é uma aplicação da lei de Hess que divide a formação de um sólido iônico em uma série de etapas individuais:
- \(ΔH^\circ_\ce f\), a entalpia padrão de formação do composto
- Ou seja, a energia de ionização do metal
- EA, a afinidade eletrônica do não metal
- \(ΔH^\circ_s\), a entalpia da sublimação do metal
- D, a energia de dissociação da ligação do não metal
- Rede ΔH, a energia da rede do composto
A figura\(\PageIndex{1}\) diagrama o ciclo de Born-Haber para a formação de fluoreto de césio sólido.
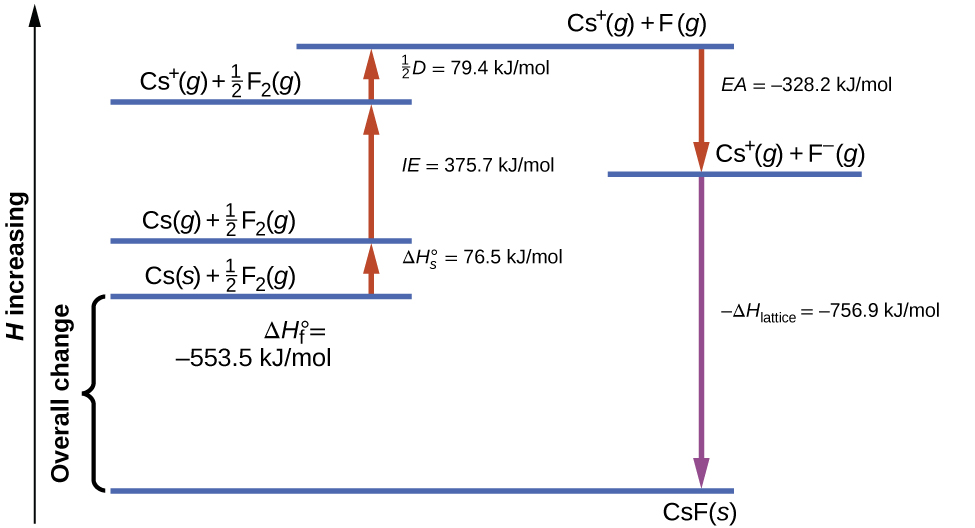
Começamos com os elementos em seus estados mais comuns, Cs (s) e F 2 (g). O\(ΔH^\circ_\ce s\) representa a conversão de césio sólido em gás e, em seguida, a energia de ionização converte os átomos de césio gasoso em cátions. Na próxima etapa, contabilizamos a energia necessária para quebrar a ligação F—F para produzir átomos de flúor. A conversão de um mol de átomos de flúor em íons de flúor é um processo exotérmico, então essa etapa emite energia (a afinidade eletrônica) e é mostrada como decrescente ao longo do eixo y. Agora temos um mol de cátions Cs e um mol de ânions F. Esses íons se combinam para produzir fluoreto de césio sólido. A mudança de entalpia nesta etapa é o negativo da energia da rede, então também é uma quantidade exotérmica. A energia total envolvida nessa conversão é igual à entalpia de formação determinada experimentalmente,\(ΔH^\circ_\ce f\), do composto a partir de seus elementos. Nesse caso, a mudança geral é exotérmica.
A lei de Hess também pode ser usada para mostrar a relação entre as entalpias das etapas individuais e a entalpia da formação. A tabela\(\PageIndex{3}\) mostra isso para fluoreto de césio, CsF.
| Entalpia de sublimação de Cs (s) | \(\ce{Cs}(s)⟶\ce{Cs}(g)\hspace{20px}ΔH=ΔH^\circ_s=\mathrm{77\:kJ/mol}\) |
|---|---|
| Metade da energia de ligação de F 2 | \(\dfrac{1}{2}\ce{F2}(g)⟶\ce{F}(g)\hspace{20px}ΔH=\dfrac{1}{2}D=\mathrm{79\:kJ/mol}\) |
| Energia de ionização de Cs (g) | \(\ce{Cs}(g)⟶\ce{Cs+}(g)+\ce{e-}\hspace{20px}ΔH=IE=\ce{376\:kJ/mol}\) |
| Negativo da afinidade eletrônica de F | \(\ce{F}(g)+\ce{e-}⟶\ce{F-}(g)\hspace{20px}ΔH=−EA=\ce{-328\:kJ/mol}\) |
| Negativo da energia da rede de CsF (s) | \(\ce{Cs+}(g)+\ce{F-}(g)⟶\ce{CsF}(s)\hspace{20px}ΔH=−ΔH_\ce{lattice}=\:?\) |
| Entalpia da formação de CsF (s), adicione as etapas 1—5 |
\(ΔH=ΔH^\circ_f=ΔH^\circ_s+\dfrac{1}{2}D+IE+(−EA)+(−ΔH_\ce{lattice})\) \(\ce{Cs}(s)+\dfrac{1}{2}\ce{F2}(g)⟶\ce{CsF}(s)=\ce{-554\:kJ/mol}\) |
Assim, a energia da rede pode ser calculada a partir de outros valores. Para o cloreto de césio, usando esses dados, a energia da rede é:
\[ΔH_\ce{lattice}=\mathrm{(411+109+122+496+368)\:kJ=770\:kJ} \nonumber \]
O ciclo de Born-Haber também pode ser usado para calcular qualquer uma das outras quantidades na equação da energia da rede, desde que o restante seja conhecido. Por exemplo, se a entalpia relevante de sublimação\(ΔH^\circ_s\), energia de ionização (IE), entalpia de dissociação de ligação (D), energia de rede ΔH, rede e entalpia padrão de formação\(ΔH^\circ_\ce f\) forem conhecidas, o ciclo de Born-Haber pode ser usado para determinar o elétron afinidade de um átomo.
As energias de rede calculadas para compostos iônicos são normalmente muito maiores do que as energias de dissociação de ligações medidas para ligações covalentes. Enquanto as energias da rede normalmente caem na faixa de 600—4000 kJ/mol (algumas ainda mais altas), as energias de dissociação da ligação covalente estão normalmente entre 150 e 400 kJ/mol para ligações simples. Lembre-se, no entanto, de que esses não são valores diretamente comparáveis. Para compostos iônicos, as energias da rede estão associadas a muitas interações, à medida que cátions e ânions se agrupam em uma rede estendida. Para ligações covalentes, a energia de dissociação da ligação está associada à interação de apenas dois átomos.
Resumo
A força de uma ligação covalente é medida pela energia de dissociação da ligação, ou seja, a quantidade de energia necessária para quebrar essa ligação específica em um mol de moléculas. Ligações múltiplas são mais fortes do que ligações simples entre os mesmos átomos. A entalpia de uma reação pode ser estimada com base na entrada de energia necessária para romper ligações e na energia liberada quando novas ligações são formadas. Para ligações iônicas, a energia da rede é a energia necessária para separar um mol de um composto em seus íons da fase gasosa. A energia da rede aumenta para íons com cargas mais altas e distâncias menores entre os íons. As energias da rede são frequentemente calculadas usando o ciclo Born-Haber, um ciclo termoquímico que inclui todas as etapas energéticas envolvidas na conversão de elementos em um composto iônico.
Equações-chave
- Energia de ligação para uma molécula diatômica:\(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Mudança de entalpia: ΔH = ligações D quebradas — ligações D formadas
- Energia de rede para um MX sólido:\(\ce{MX}(s)⟶\ce M^{n+}(g)+\ce X^{n−}(g)\hspace{20px}ΔH_\ce{lattice}\)
- Energia de rede para um cristal iônico:\(ΔH_\ce{lattice}=\mathrm{\dfrac{C(Z^+)(Z^-)}{R_o}}\)
Notas de pé
- Esta pergunta foi retirada do Exame de Colocação Avançada de Química e é usada com a permissão do Educational Testing Service.
Glossário
- energia de ligação
- (também, energia de dissociação da ligação) energia necessária para quebrar uma ligação covalente em uma substância gasosa
- Ciclo Born-Haber
- ciclo termoquímico relacionando as várias etapas energéticas envolvidas na formação de um sólido iônico a partir dos elementos relevantes
- energia da rede (rede ΔH)
- energia necessária para separar um mol de um sólido iônico em seus íons gasosos componentes


