7.4: Acusações formais e ressonância
- Page ID
- 185174
▲
- Calcule cargas formais para átomos em qualquer estrutura de Lewis
- Use cargas formais para identificar a estrutura de Lewis mais razoável para uma determinada molécula
- Explique o conceito de ressonância e desenhe estruturas de Lewis representando formas de ressonância para uma determinada molécula
Anteriormente, discutimos como escrever estruturas de Lewis para moléculas e íons poliatômicos. Em alguns casos, no entanto, aparentemente há mais de uma estrutura válida para uma molécula. Podemos usar o conceito de cobranças formais para nos ajudar a prever a estrutura de Lewis mais apropriada quando mais de uma é razoável.
Calculando a cobrança formal
A carga formal de um átomo em uma molécula é a carga hipotética que o átomo teria se pudéssemos redistribuir os elétrons nas ligações uniformemente entre os átomos. Outra maneira de dizer isso é que a carga formal resulta quando pegamos o número de elétrons de valência de um átomo neutro, subtraímos os elétrons não ligados e, em seguida, subtraímos o número de ligações conectadas a esse átomo na estrutura de Lewis.
Assim, calculamos a cobrança formal da seguinte forma:
\[\textrm{formal charge = # valence shell electrons (free atom) − # lone pair electrons − }\dfrac{1}{2}\textrm{ # bonding electrons} \nonumber \]
Podemos verificar novamente os cálculos formais de cobrança determinando a soma dos encargos formais para toda a estrutura. A soma das cargas formais de todos os átomos em uma molécula deve ser zero; a soma das cargas formais em um íon deve ser igual à carga do íon.
Devemos lembrar que a carga formal calculada para um átomo não é a carga real do átomo na molécula. A cobrança formal é apenas um procedimento contábil útil; não indica a presença de cobranças reais.
Atribua cargas formais a cada átomo no íon interhalogênio\(\ce{ICl4-}\).
Solução SS
Dividimos os pares de elétrons de ligação igualmente para todas as\(\ce{I–Cl}\) ligações:
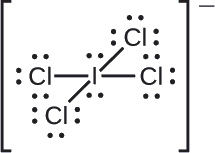
Atribuímos pares solitários de elétrons aos seus átomos. Cada átomo de Cl agora tem sete elétrons atribuídos a ele, e o átomo I tem oito.
Subtraia esse número do número de elétrons de valência para o átomo neutro:
- I: 7 — 8 = —1
- Cl: 7 — 7 = 0
A soma das cargas formais de todos os átomos é igual a —1, que é idêntica à carga do íon (—1).
Calcule a carga formal para cada átomo na molécula de monóxido de carbono:

- Responda
-
C −1, OU +1
Atribua cargas formais a cada átomo na molécula interhalógena\(\ce{BrCl3}\).
Solução
Atribua um dos elétrons em cada ligação Br-Cl ao átomo de Br e um ao átomo de Cl nessa ligação:
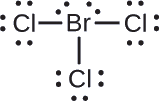
Atribua os pares solitários ao seu átomo. Agora, cada átomo de Cl tem sete elétrons e o átomo de Br tem sete elétrons.
Subtraia esse número do número de elétrons de valência para o átomo neutro. Isso dá a acusação formal:
- Br: 7 — 7 = 0
- Cl: 7 — 7 = 0
Todos os átomos em\(\ce{BrCl3}\) têm uma carga formal de zero, e a soma das cargas formais totaliza zero, como deveria em uma molécula neutra.
Determine a carga formal para cada átomo em\(\ce{NCl3}\).
- Responda
-
N: 0; todos os três átomos de Cl: 0
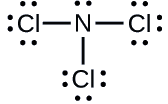
Usando carga formal para prever a estrutura molecular
A disposição dos átomos em uma molécula ou íon é chamada de estrutura molecular. Em muitos casos, seguir as etapas para escrever estruturas de Lewis pode levar a mais de uma estrutura molecular possível - diferentes ligações múltiplas e posicionamentos de elétrons de um par único ou diferentes arranjos de átomos, por exemplo. Algumas diretrizes envolvendo carga formal podem ser úteis para decidir qual das estruturas possíveis é mais provável para uma determinada molécula ou íon.
- Uma estrutura molecular na qual todas as cargas formais são zero é preferível a uma em que algumas cargas formais não sejam zero.
- Se a estrutura de Lewis precisar ter cobranças formais diferentes de zero, o acordo com as menores cobranças formais diferentes de zero é preferível.
- As estruturas de Lewis são preferíveis quando as cobranças formais adjacentes são zero ou do sinal oposto.
- Quando devemos escolher entre várias estruturas de Lewis com distribuições similares de cargas formais, a estrutura com cargas formais negativas nos átomos mais eletronegativos é preferível.
Para ver como essas diretrizes se aplicam, vamos considerar algumas estruturas possíveis para o dióxido de carbono,\(\ce{CO2}\). Sabemos de nossa discussão anterior que o átomo menos eletronegativo normalmente ocupa a posição central, mas cargas formais nos permitem entender por que isso ocorre. Podemos traçar três possibilidades para a estrutura: carbono no centro e ligações duplas, carbono no centro com uma ligação simples e tripla e oxigênio no centro com ligações duplas:
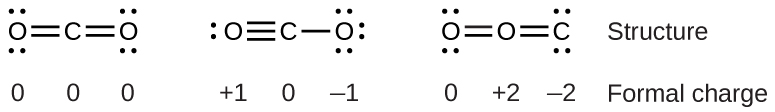
Comparando as três cobranças formais, podemos identificar definitivamente a estrutura à esquerda como preferível porque ela tem apenas cobranças formais de zero (Diretriz 1).
Como outro exemplo, o íon tiocianato, um íon formado por um átomo de carbono, um átomo de nitrogênio e um átomo de enxofre, poderia ter três estruturas moleculares diferentes:\(\ce{CNS^{–}}\),\(\ce{NCS^{–}}\), ou\(\ce{CSN^{–}}\). As cargas formais presentes em cada uma dessas estruturas moleculares podem nos ajudar a escolher o arranjo mais provável de átomos. As possíveis estruturas de Lewis e as cargas formais para cada uma das três estruturas possíveis para o íon tiocianato são mostradas aqui:
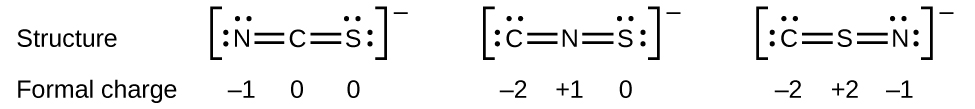
Observe que a soma das cargas formais em cada caso é igual à carga do íon (—1). No entanto, o primeiro arranjo de átomos é preferido porque tem o menor número de átomos com cargas formais diferentes de zero (Diretriz 2). Além disso, coloca o menor átomo eletronegativo no centro e a carga negativa no elemento mais eletronegativo (Diretriz 4).
O óxido nitroso, N 2 O, comumente conhecido como gás do riso, é usado como anestésico em pequenas cirurgias, como a extração rotineira de dentes do siso. Qual é a estrutura provável do óxido nitroso?

Solução A determinação da cobrança formal gera o seguinte:
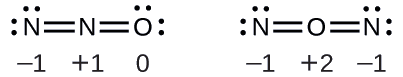
A estrutura com um átomo terminal de oxigênio atende melhor aos critérios para a distribuição mais estável da carga formal:
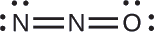
O número de átomos com cargas formais é minimizado (Diretriz 2) e não há carga formal maior que uma (Diretriz 2). Isso é novamente consistente com a preferência por ter o átomo menos eletronegativo na posição central.
Qual é a estrutura molecular mais provável para o íon nitrito (\(\ce{NO2-}\))?
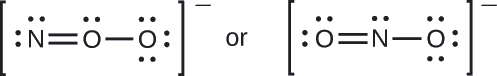
- Responda
-
\(\ce{ONO^{–}}\)
Ressonância
Você deve ter notado que o ânion nitrito em Example\(\PageIndex{3}\) pode ter duas estruturas possíveis com os átomos nas mesmas posições. Os elétrons envolvidos na ligação dupla N—O, no entanto, estão em posições diferentes:
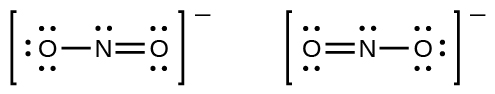
Se os íons nitrito realmente contiverem uma ligação simples e uma dupla, esperaríamos que os dois comprimentos de ligação fossem diferentes. Uma ligação dupla entre dois átomos é mais curta (e mais forte) do que uma ligação simples entre os mesmos dois átomos. Experimentos mostram, no entanto, que ambas as ligações N—O\(\ce{NO2-}\) têm a mesma força e comprimento e são idênticas em todas as outras propriedades.
Não é possível escrever uma única estrutura de Lewis para\(\ce{NO2-}\) a qual o nitrogênio tenha um octeto e ambas as ligações sejam equivalentes. Em vez disso, usamos o conceito de ressonância: se duas ou mais estruturas de Lewis com o mesmo arranjo de átomos podem ser escritas para uma molécula ou íon, a distribuição real dos elétrons é uma média daquela mostrada pelas várias estruturas de Lewis. A distribuição real de elétrons em cada uma das ligações nitrogênio-oxigênio em\(\ce{NO2-}\) é a média de uma ligação dupla e uma ligação única. Chamamos as estruturas individuais de Lewis de formas de ressonância. A estrutura eletrônica real da molécula (a média das formas de ressonância) é chamada de híbrido de ressonância das formas de ressonância individuais. Uma seta de duas pontas entre as estruturas de Lewis indica que elas são formas de ressonância. Assim, a estrutura eletrônica do\(\ce{NO2-}\) íon é mostrada como:
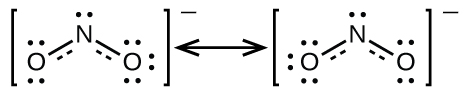
Devemos lembrar que uma molécula descrita como um híbrido de ressonância nunca possui uma estrutura eletrônica descrita por nenhuma das formas de ressonância. Ela não flutua entre as formas de ressonância; em vez disso, a estrutura eletrônica real é sempre a média daquela mostrada por todas as formas de ressonância. George Wheland, um dos pioneiros da teoria da ressonância, usou uma analogia histórica para descrever a relação entre formas de ressonância e híbridos de ressonância. Um viajante medieval, que nunca tinha visto um rinoceronte, descreveu-o como um híbrido de dragão e unicórnio porque tinha muitas propriedades em comum com ambos. Assim como um rinoceronte não é nem um dragão às vezes nem um unicórnio em outras vezes, um híbrido de ressonância não é nenhuma de suas formas de ressonância em um determinado momento. Como um rinoceronte, é uma entidade real que a evidência experimental demonstrou existir. Tem algumas características em comum com suas formas de ressonância, mas as próprias formas de ressonância são imagens convenientes e imaginárias (como o unicórnio e o dragão).
O ânion carbonato\(\ce{CO3^2-}\),, fornece um segundo exemplo de ressonância:
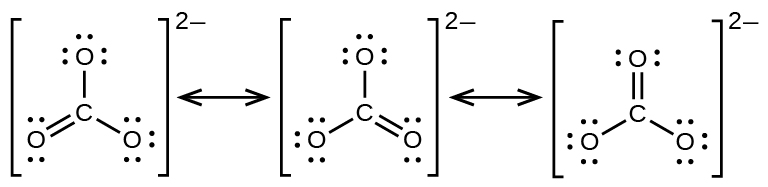
Um átomo de oxigênio deve ter uma ligação dupla com o carbono para completar o octeto no átomo central. Todos os átomos de oxigênio, no entanto, são equivalentes, e a ligação dupla pode se formar a partir de qualquer um dos três átomos. Isso dá origem a três formas de ressonância do íon carbonato. Como podemos escrever três estruturas de ressonância idênticas, sabemos que a disposição real dos elétrons no íon carbonato é a média das três estruturas. Novamente, experimentos mostram que todas as três ligações C—O são exatamente iguais.
Resumo
Em uma estrutura de Lewis, cargas formais podem ser atribuídas a cada átomo tratando cada ligação como se metade dos elétrons estivesse atribuída a cada átomo. Essas acusações formais hipotéticas são um guia para determinar a estrutura de Lewis mais apropriada. É preferível uma estrutura na qual as cobranças formais sejam tão próximas de zero quanto possível. A ressonância ocorre nos casos em que duas ou mais estruturas de Lewis com arranjos idênticos de átomos, mas diferentes distribuições de elétrons podem ser escritas. A distribuição real dos elétrons (o híbrido de ressonância) é uma média da distribuição indicada pelas estruturas individuais de Lewis (as formas de ressonância).
Equações-chave
- \(\textrm{formal charge = # valence shell electrons (free atom) − # one pair electrons − }\dfrac{1}{2}\textrm{ # bonding electrons}\)
Glossário
- acusação formal
- carga que resultaria em um átomo tomando o número de elétrons de valência no átomo neutro e subtraindo os elétrons não ligados e o número de ligações (metade dos elétrons de ligação)
- estrutura molecular
- arranjo de átomos em uma molécula ou íon
- ressonância
- situação em que uma estrutura de Lewis é insuficiente para descrever a ligação em uma molécula e a média de várias estruturas é observada
- formas de ressonância
- duas ou mais estruturas de Lewis que têm o mesmo arranjo de átomos, mas diferentes arranjos de elétrons
- híbrido de ressonância
- média das formas de ressonância mostradas pelas estruturas individuais de Lewis


