7.3: Símbolos e estruturas de Lewis
- Page ID
- 185151
- Escreva símbolos de Lewis para átomos e íons neutros
- Desenhe estruturas de Lewis representando a ligação em moléculas simples
Até agora, discutimos os vários tipos de ligações que se formam entre átomos e/ou íons. Em todos os casos, essas ligações envolvem o compartilhamento ou transferência de elétrons da camada de valência entre os átomos. Nesta seção, exploraremos o método típico para representar elétrons da camada de valência e ligações químicas, ou seja, símbolos de Lewis e estruturas de Lewis.
Símbolos de Lewis
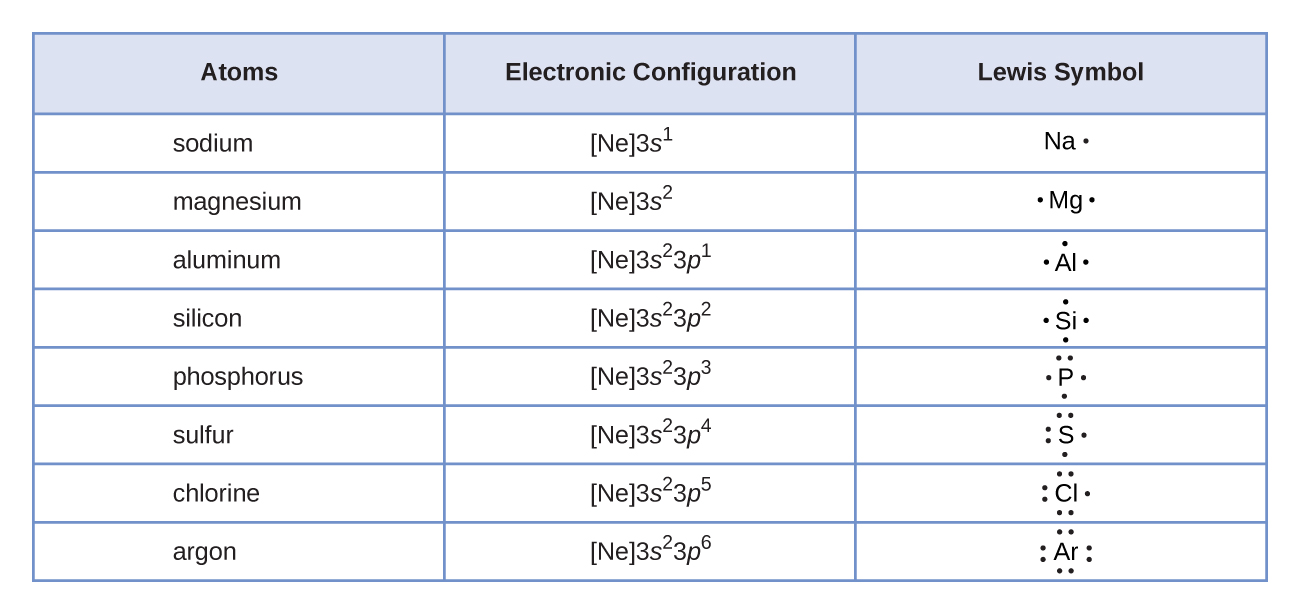
Usamos símbolos de Lewis para descrever as configurações de elétrons de valência de átomos e íons monoatômicos. Um símbolo de Lewis consiste em um símbolo elementar cercado por um ponto para cada um de seus elétrons de valência:
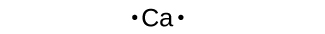
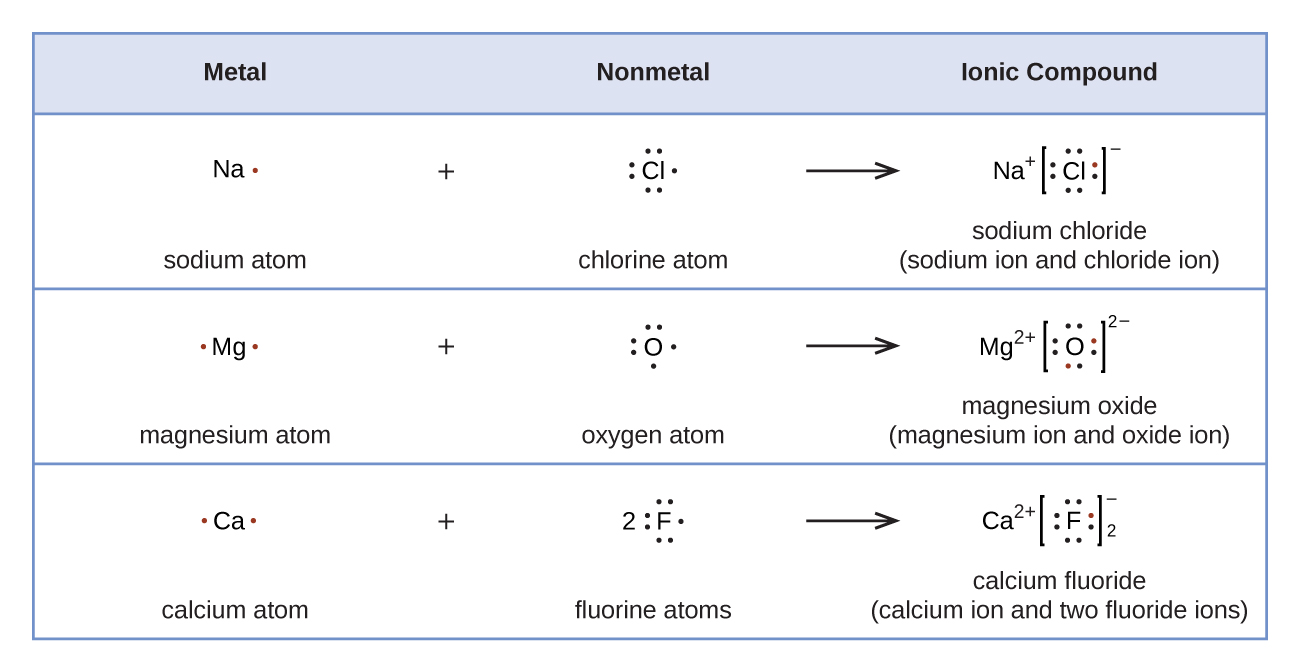
Os símbolos de Lewis podem ser usados para ilustrar a formação de cátions a partir de átomos, conforme mostrado aqui para sódio e cálcio:

Da mesma forma, eles podem ser usados para mostrar a formação de ânions a partir de átomos, conforme mostrado aqui para cloro e enxofre:

Estruturas Lewis
Também usamos símbolos de Lewis para indicar a formação de ligações covalentes, que são mostradas nas estruturas de Lewis, desenhos que descrevem a ligação em moléculas e íons poliatômicos. Por exemplo, quando dois átomos de cloro formam uma molécula de cloro, eles compartilham um par de elétrons:
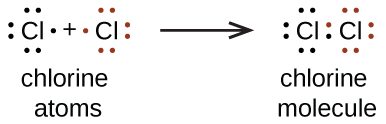
A estrutura de Lewis indica que cada átomo de Cl tem três pares de elétrons que não são usados na ligação (chamados de pares solitários) e um par compartilhado de elétrons (escrito entre os átomos). Um traço (ou linha) geralmente é usado para indicar um par compartilhado de elétrons:
![]()
No modelo de Lewis, um único par compartilhado de elétrons é uma ligação única. Cada átomo de Cl interage com oito elétrons de valência no total: os seis nos pares solitários e os dois na ligação única.
A regra do octeto
As outras moléculas de halogênio (F 2, Br 2, I 2 e At 2) formam ligações como as da molécula de cloro: uma única ligação entre átomos e três pares solitários de elétrons por átomo. Isso permite que cada átomo de halogênio tenha uma configuração eletrônica de gás nobre. A tendência dos átomos do grupo principal de formar ligações suficientes para obter oito elétrons de valência é conhecida como regra do octeto.
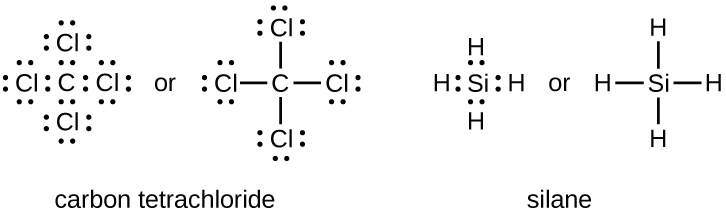
O número de ligações que um átomo pode formar geralmente pode ser previsto a partir do número de elétrons necessários para atingir um octeto (oito elétrons de valência); isso é especialmente verdadeiro para os não metais do segundo período da tabela periódica (C, N, O e F). Por exemplo, cada átomo de um elemento do grupo 14 tem quatro elétrons em sua camada mais externa e, portanto, requer mais quatro elétrons para alcançar um octeto. Esses quatro elétrons podem ser obtidos formando quatro ligações covalentes, conforme ilustrado aqui para carbono em cCl 4 (tetracloreto de carbono) e silício em SiH 4 (silano). Como o hidrogênio só precisa de dois elétrons para preencher sua camada de valência, ele é uma exceção à regra do octeto e só precisa formar uma ligação. Os elementos de transição e os elementos de transição interna também não seguem a regra do octeto, pois têm elétrons d e f envolvidos em suas camadas de valência.
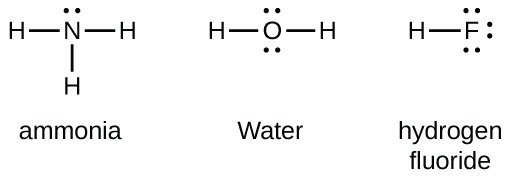
Elementos do grupo 15, como o nitrogênio, têm cinco elétrons de valência no símbolo atômico de Lewis: um par solitário e três elétrons desemparelhados. Para obter um octeto, esses átomos formam três ligações covalentes, como no NH 3 (amônia). O oxigênio e outros átomos do grupo 16 obtêm um octeto formando duas ligações covalentes:
Títulos duplos e tri
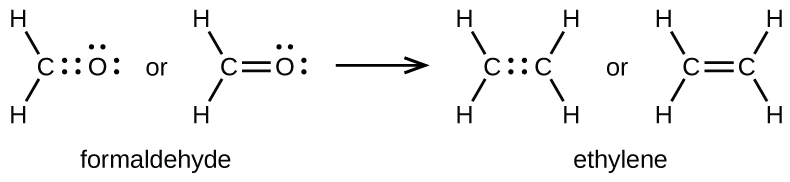
Como mencionado anteriormente, quando um par de átomos compartilha um par de elétrons, chamamos isso de ligação única. No entanto, um par de átomos pode precisar compartilhar mais de um par de elétrons para atingir o octeto necessário. Uma ligação dupla se forma quando dois pares de elétrons são compartilhados entre um par de átomos, como entre os átomos de carbono e oxigênio em CH 2 O (formaldeído) e entre os dois átomos de carbono em C 2 H 4 (etileno):
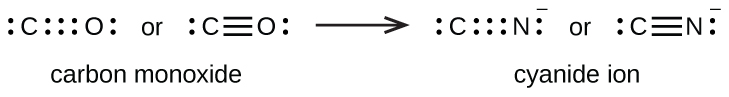
Uma ligação tripla se forma quando três pares de elétrons são compartilhados por um par de átomos, como no monóxido de carbono (CO) e no íon cianeto (CN —):
Escrevendo estruturas de Lewis com a regra do octeto
Para moléculas e íons moleculares muito simples, podemos escrever as estruturas de Lewis simplesmente emparelhando os elétrons desemparelhados nos átomos constituintes. Veja esses exemplos:
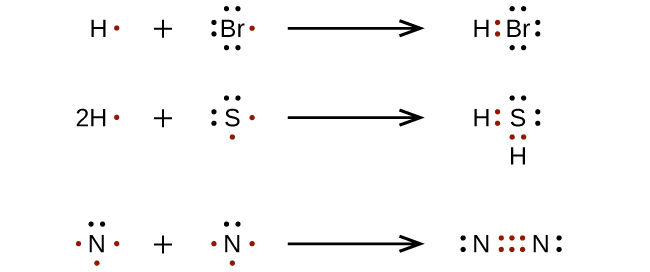
Para moléculas e íons moleculares mais complicados, é útil seguir o procedimento passo a passo descrito aqui:
- Determine o número total de elétrons de valência (camada externa) entre todos os átomos. Para cátions, subtraia um elétron para cada carga positiva. Para ânions, adicione um elétron para cada carga negativa.
- Desenhe uma estrutura esquelética da molécula ou íon, organizando os átomos em torno de um átomo central. (Geralmente, o elemento menos eletronegativo deve ser colocado no centro.) Conecte cada átomo ao átomo central com uma única ligação (um par de elétrons).
- Distribua os elétrons restantes como pares solitários nos átomos terminais (exceto hidrogênio), completando um octeto ao redor de cada átomo.
- Coloque todos os elétrons restantes no átomo central.
- Reorganize os elétrons dos átomos externos para fazer várias ligações com o átomo central, a fim de obter octetos sempre que possível.
Vamos determinar as estruturas de Lewis de SiH 4\(\ce{CHO2-}\), NO + e OF 2 como exemplos ao seguir este procedimento:
- Determine o número total de elétrons de valência (camada externa) na molécula ou íon.
- Para uma molécula, adicionamos o número de elétrons de valência em cada átomo na molécula:
\(\begin{align} &\phantom{+}\ce{SiH4}\\ &\phantom{+}\textrm{Si: 4 valence electrons/atom × 1 atom = 4}\\ &\underline{\textrm{+H: 1 valence electron/atom × 4 atoms = 4}}\\ &\hspace{271px}\textrm{= 8 valence electrons} \end{align}\)
- Para um íon negativo, como\(\ce{CHO2-}\), adicionamos o número de elétrons de valência nos átomos ao número de cargas negativas no íon (um elétron é ganho para cada carga negativa única):
\ (\ ce {CHO2-}\\
\ textrm {C: 4 elétrons de valência/átomo × 1 átomo}\ hspace {6px} =\ phantom {1} 4\
\ textrm {H: 1 elétron/átomo de valência × 1 átomo}\ hspace {12px} =\ phantom {1} 1\
\ textrm {O: 6 valência elétrons/átomo × 2 átomos = 12}\\
\ sublinhado {+\ hspace {100px}\ textrm {1 elétron adicional}\ hspace {9px} =\ phantom {1} 1}\\
\ hspace {264px}\ textrm {= 18 elétrons de valência}\) - Para um íon positivo, como NO +, adicionamos o número de elétrons de valência nos átomos do íon e, em seguida, subtraímos o número de cargas positivas no íon (um elétron é perdido para cada carga positiva única) do número total de elétrons de valência:
\ (\ ce {NO+}\\
\ textrm {N: 5 elétrons/átomo de valência/átomo × 1 átomo} =\ fantasma {−} 5
\\ textrm {O: 6 elétron/átomo de valência × 1 átomo}\ hspace {5px} =\ phantom {−} 6
\\\ underline {\ textrm {+ −1 elétron (carga positiva)}\ hspace {44px} = −1}\\
\ hspace {260px}\ textrm {= 10 elétrons de valência}\) - Como OF 2 é uma molécula neutra, simplesmente adicionamos o número de elétrons de valência:
\ (\ phantom {+}\ ce {OF2}\\
\ phantom {+}\ textrm {O: 6 elétrons de valência/átomo × 1 átomo}\ hspace {10px} = 6\\
\ underline {\ textrm {+ F: 7 elétrons/átomo de valência × 2 átomos} = 14}\
\ hspace {280px}\ textrm {= 20 elétrons de valência}\)
- Para uma molécula, adicionamos o número de elétrons de valência em cada átomo na molécula:
- Desenhe uma estrutura esquelética da molécula ou íon, organizando os átomos em torno de um átomo central e conectando cada átomo ao átomo central com uma única ligação (um par de elétrons). (Observe que indicamos íons com colchetes ao redor da estrutura, indicando a carga fora dos colchetes:)
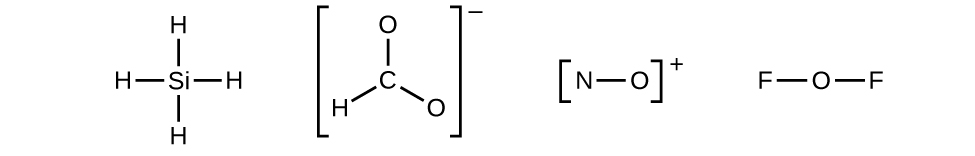
- Quando vários arranjos de átomos são possíveis, por\(\ce{CHO2-}\) exemplo, devemos usar evidências experimentais para escolher a correta. Em geral, os elementos menos eletronegativos têm maior probabilidade de serem átomos centrais. No\(\ce{CHO2-}\), o átomo de carbono menos eletronegativo ocupa a posição central com os átomos de oxigênio e hidrogênio ao seu redor. Outros exemplos incluem P em PoCl 3, S em SO 2 e Cl em\(\ce{ClO4-}\). Uma exceção é que o hidrogênio quase nunca é um átomo central. Como o elemento mais eletronegativo, o flúor também não pode ser um átomo central.
- Distribua os elétrons restantes como pares solitários nos átomos terminais (exceto hidrogênio) para completar suas camadas de valência com um octeto de elétrons.
- Não há elétrons restantes no SiH 4, então ele permanece inalterado:
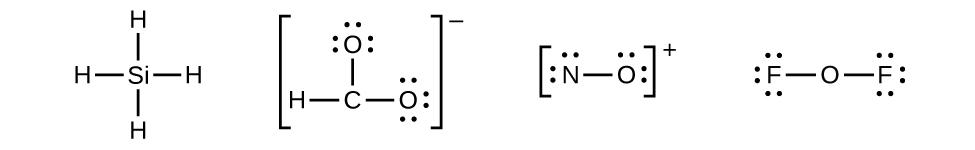
- Coloque todos os elétrons restantes no átomo central.
- Para SiH 4 e NO +, não há elétrons restantes; já colocamos todos os elétrons determinados na Etapa 1.\(\ce{CHO2-}\)
- Para OF 2, tínhamos 16 elétrons restantes na Etapa 3 e colocamos 12, deixando 4 para serem colocados no átomo central:
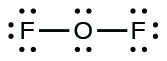
- Reorganize os elétrons dos átomos externos para fazer várias ligações com o átomo central, a fim de obter octetos sempre que possível.
- SiH 4: Si já tem um octeto, então nada precisa ser feito.
- \(\ce{CHO2-}\): We have distributed the valence electrons as lone pairs on the oxygen atoms, but the carbon atom lacks an octet:
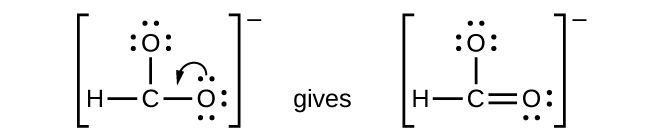
- NO +: Para esse íon, adicionamos oito elétrons externos, mas nenhum átomo tem um octeto. Não podemos adicionar mais elétrons, pois já usamos o total que encontramos na Etapa 1, então devemos mover os elétrons para formar uma ligação múltipla:
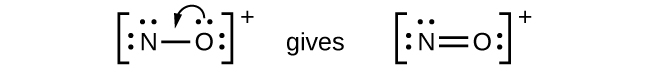
- Isso ainda não produz um octeto, então devemos mover outro par, formando uma ligação tripla:
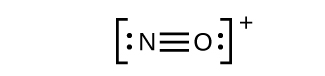
- Em OF 2, cada átomo tem um octeto conforme desenhado, então nada muda.
NASA’s Cassini-Huygens mission detected a large cloud of toxic hydrogen cyanide (HCN) on Titan, one of Saturn’s moons. Titan also contains ethane (H3CCH3), acetylene (HCCH), and ammonia (NH3). What are the Lewis structures of these molecules?
Solution
Calculate the number of valence electrons.
- HCN: (1 × 1) + (4 × 1) + (5 × 1) = 10
- H3CCH3: (1 × 3) + (2 × 4) + (1 × 3) = 14
- HCCH: (1 × 1) + (2 × 4) + (1 × 1) = 10
- NH3: (5 × 1) + (3 × 1) = 8
Draw a skeleton and connect the atoms with single bonds. Remember that H is never a central atom:
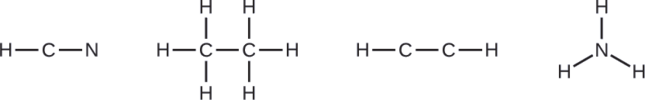
Where needed, distribute electrons to the terminal atoms:
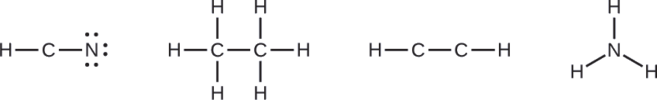
- HCN: six electrons placed on N
- H3CCH3: no electrons remain
- HCCH: no terminal atoms capable of accepting electrons
- NH3: no terminal atoms capable of accepting electrons
Where needed, place remaining electrons on the central atom:
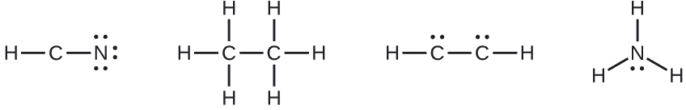
- HCN: no electrons remain
- H3CCH3: no electrons remain
- HCCH: four electrons placed on carbon
- NH3: two electrons placed on nitrogen
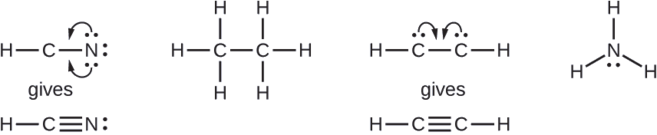
Where needed, rearrange electrons to form multiple bonds in order to obtain an octet on each atom:
- HCN: form two more C–N bonds
- H3CCH3: all atoms have the correct number of electrons
- HCCH: form a triple bond between the two carbon atoms
- NH3: all atoms have the correct number of electrons
Both carbon monoxide, CO, and carbon dioxide, CO2, are products of the combustion of fossil fuels. Both of these gases also cause problems: CO is toxic and CO2 has been implicated in global climate change. What are the Lewis structures of these two molecules?
- Answer
-
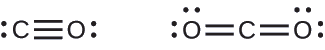
Carbon soot has been known to man since prehistoric times, but it was not until fairly recently that the molecular structure of the main component of soot was discovered. In 1996, the Nobel Prize in Chemistry was awarded to Richard Smalley, Robert Curl, and Harold Kroto for their work in discovering a new form of carbon, the C60 buckminsterfullerene molecule. An entire class of compounds, including spheres and tubes of various shapes, were discovered based on C60. This type of molecule, called a fullerene, consists of a complex network of single- and double-bonded carbon atoms arranged in such a way that each carbon atom obtains a full octet of electrons. Because of their size and shape, fullerenes can encapsulate other molecules, so they have shown potential in various applications from hydrogen storage to targeted drug delivery systems. They also possess unique electronic and optical properties that have been put to good use in solar powered devices and chemical sensors.
Exceptions to the Octet Rule
Many covalent molecules have central atoms that do not have eight electrons in their Lewis structures. These molecules fall into three categories:
- Odd-electron molecules have an odd number of valence electrons, and therefore have an unpaired electron.
- Electron-deficient molecules have a central atom that has fewer electrons than needed for a noble gas configuration.
- Hypervalent molecules have a central atom that has more electrons than needed for a noble gas configuration.
Odd-electron Molecules
We call molecules that contain an odd number of electrons free radicals. Nitric oxide, NO, is an example of an odd-electron molecule; it is produced in internal combustion engines when oxygen and nitrogen react at high temperatures.
To draw the Lewis structure for an odd-electron molecule like NO, we follow the same five steps we would for other molecules, but with a few minor changes:
- Determine the total number of valence (outer shell) electrons. The sum of the valence electrons is 5 (from N) + 6 (from O) = 11. The odd number immediately tells us that we have a free radical, so we know that not every atom can have eight electrons in its valence shell.
- Draw a skeleton structure of the molecule. We can easily draw a skeleton with an N–O single bond: N–O
- Distribute the remaining electrons as lone pairs on the terminal atoms. In this case, there is no central atom, so we distribute the electrons around both atoms. We give eight electrons to the more electronegative atom in these situations; thus oxygen has the filled valence shell:
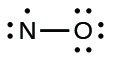
- Coloque todos os elétrons restantes no átomo central. Como não há elétrons restantes, essa etapa não se aplica.
- Reorganize os elétrons para fazer várias ligações com o átomo central, a fim de obter octetos sempre que possível. Sabemos que uma molécula de elétron ímpar não pode ter um octeto para cada átomo, mas queremos que cada átomo fique o mais próximo possível de um octeto. Nesse caso, o nitrogênio tem apenas cinco elétrons ao redor. Para nos aproximarmos de um octeto de nitrogênio, pegamos um dos pares solitários do oxigênio e o usamos para formar uma ligação dupla de NO. (Não podemos pegar outro par solitário de elétrons no oxigênio e formar uma ligação tripla porque o nitrogênio teria então nove elétrons:)
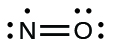
Moléculas com deficiência de elétrons
Também encontraremos algumas moléculas que contêm átomos centrais que não têm uma camada de valência preenchida. Geralmente, são moléculas com átomos centrais dos grupos 2 e 13 e átomos externos que são hidrogênio ou outros átomos que não formam ligações múltiplas. Por exemplo, nas estruturas de Lewis de dihidreto de berílio, BeH 2 e trifluoreto de boro, BF 3, cada átomo de berílio e boro tem apenas quatro e seis elétrons, respectivamente. É possível desenhar uma estrutura com uma ligação dupla entre um átomo de boro e um átomo de flúor em BF 3, satisfazendo a regra do octeto, mas evidências experimentais indicam que os comprimentos de ligação estão mais próximos dos esperados para ligações simples B-F. Isso sugere que a melhor estrutura de Lewis tem três ligações simples B-F e um boro deficiente em elétrons. A reatividade do composto também é consistente com um boro deficiente em elétrons. No entanto, as ligações B-F são um pouco mais curtas do que o que é realmente esperado para as ligações simples B—F, indicando que algum caráter de ligação dupla é encontrado na molécula real.
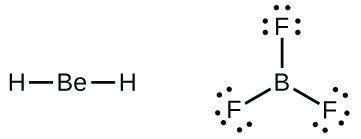
Um átomo como o átomo de boro em BF 3, que não tem oito elétrons, é muito reativo. Ele se combina facilmente com uma molécula contendo um átomo com um único par de elétrons. Por exemplo, o NH 3 reage com o BF 3 porque o par solitário de nitrogênio pode ser compartilhado com o átomo de boro:
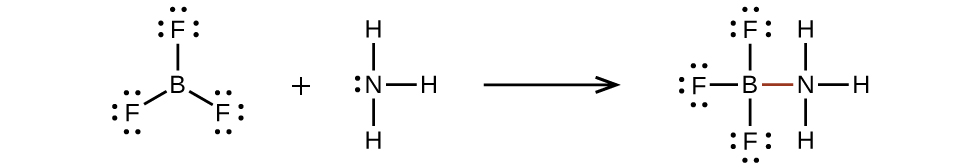
Moléculas hipervalentes
Elementos no segundo período da tabela periódica (n = 2) podem acomodar apenas oito elétrons em seus orbitais de camada de valência porque têm apenas quatro orbitais de valência (um orbitais de 2 s e três de 2 p). Elementos no terceiro período e no período superior (n ≥ 3) têm mais de quatro orbitais de valência e podem compartilhar mais de quatro pares de elétrons com outros átomos porque têm orbitais d vazios na mesma camada. As moléculas formadas a partir desses elementos às vezes são chamadas de moléculas hipervalentes. A tabela\(\PageIndex{5}\) mostra as estruturas de Lewis para duas moléculas hipervalentes, pCl 5 e SF 6.
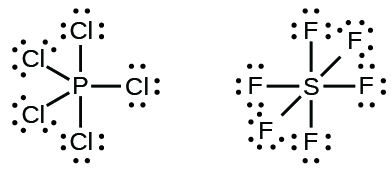
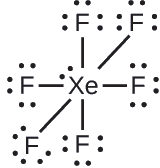
Em algumas moléculas hipervalentes, como IF 5 e XeF 4, alguns dos elétrons na camada externa do átomo central são pares solitários:
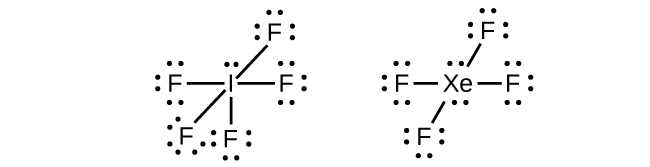
Quando escrevemos as estruturas de Lewis para essas moléculas, descobrimos que temos elétrons sobrando depois de preencher as camadas de valência dos átomos externos com oito elétrons. Esses elétrons adicionais devem ser atribuídos ao átomo central.
O xenônio é um gás nobre, mas forma vários compostos estáveis. Examinamos\(\ce{XeF4}\) anteriormente. Quais são as estruturas de Lewis de\(\ce{XeF2}\) e\(\ce{XeF6}\)?
Solução
Podemos desenhar a estrutura de Lewis de qualquer molécula covalente seguindo as seis etapas discutidas anteriormente. Nesse caso, podemos condensar as últimas etapas, pois nem todas se aplicam.
Etapa 1: Calcule o número de elétrons de valência:
\(\ce{XeF6}\): 8 + (6 × 7) = 50
Etapa 2: Desenhe um esqueleto unindo os átomos por ligações simples. O xenônio será o átomo central porque o flúor não pode ser um átomo central:
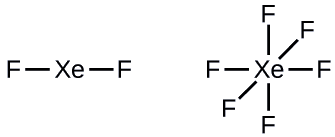
Etapa 3: Distribua os elétrons restantes.
XeF 2: Colocamos três pares solitários de elétrons ao redor de cada átomo F, representando 12 elétrons e dando a cada átomo F 8 elétrons. Assim, seis elétrons (três pares solitários) permanecem. Esses pares solitários devem ser colocados no átomo de Xe. Isso é aceitável porque os átomos de Xe têm orbitais de camada de valência d vazios e podem acomodar mais de oito elétrons. A estrutura de Lewis do XeF 2 mostra dois pares de ligações e três pares solitários de elétrons ao redor do átomo de Xe:
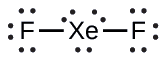
XeF 6: Colocamos três pares solitários de elétrons ao redor de cada átomo F, representando 36 elétrons. Dois elétrons permanecem e esse par solitário é colocado no átomo de Xe:
Os halogênios formam uma classe de compostos chamados interhalogênios, na qual os átomos de halogênio se ligam covalentemente uns aos outros. Escreva as estruturas de Lewis para os interhalogênios\(\ce{BrCl3}\)\(\ce{ICl4-}\) e.
- Responda
-
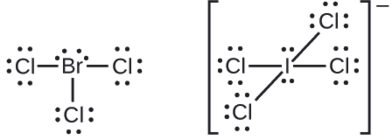
Resumo
As estruturas eletrônicas de valência podem ser visualizadas desenhando símbolos de Lewis (para átomos e íons monoatômicos) e estruturas de Lewis (para moléculas e íons poliatômicos). Pares solitários, elétrons não pareados e ligações simples, duplas ou triplas são usados para indicar onde os elétrons de valência estão localizados ao redor de cada átomo em uma estrutura de Lewis. A maioria das estruturas, especialmente aquelas que contêm elementos da segunda fila, obedece à regra do octeto, na qual cada átomo (exceto H) é cercado por oito elétrons. Exceções à regra do octeto ocorrem para moléculas de elétrons ímpares (radicais livres), moléculas deficientes em elétrons e moléculas hipervalentes.
Glossário
- ligação dupla
- ligação covalente na qual dois pares de elétrons são compartilhados entre dois átomos
- radicais livres
- molécula que contém um número ímpar de elétrons
- molécula hipervalente
- molécula contendo pelo menos um elemento do grupo principal que tem mais de oito elétrons em sua camada de valência
- Estrutura de Lewis
- diagrama mostrando pares solitários e pares de elétrons de ligação em uma molécula ou um íon
- Símbolo de Lewis
- símbolo para um elemento ou íon monoatômico que usa um ponto para representar cada elétron de valência no elemento ou íon
- par solitário
- dois (um par de) elétrons de valência que não são usados para formar uma ligação covalente
- regra do octeto
- diretriz que afirma que os átomos do grupo principal formarão estruturas nas quais oito elétrons de valência interagem com cada núcleo, contando os elétrons de ligação como interagindo com os dois átomos conectados pela ligação
- ligação única
- ligação na qual um único par de elétrons é compartilhado entre dois átomos
- ligação tripla
- ligação na qual três pares de elétrons são compartilhados entre dois átomos


