7.2: Ligação covalente
- Page ID
- 185132
- Descreva a formação de ligações covalentes
- Defina a eletronegatividade e avalie a polaridade das ligações covalentes
Em compostos iônicos, elétrons são transferidos entre átomos de diferentes elementos para formar íons. Mas essa não é a única maneira pela qual os compostos podem ser formados. Os átomos também podem criar ligações químicas compartilhando elétrons entre si. Essas ligações são chamadas de ligações covalentes. Ligações covalentes são formadas entre dois átomos quando ambos têm tendências semelhantes de atrair elétrons para si mesmos (ou seja, quando ambos os átomos têm energias de ionização e afinidades eletrônicas idênticas ou bastante semelhantes). Por exemplo, dois átomos de hidrogênio se ligam covalentemente para formar uma molécula de H 2; cada átomo de hidrogênio na molécula H 2 tem dois elétrons estabilizando-o, dando a cada átomo o mesmo número de elétrons de valência que o gás nobre He.
Compostos que contêm ligações covalentes exibem propriedades físicas diferentes dos compostos iônicos. Como a atração entre moléculas, que são eletricamente neutras, é mais fraca do que entre íons carregados eletricamente, os compostos covalentes geralmente têm pontos de fusão e ebulição muito mais baixos do que os compostos iônicos. Na verdade, muitos compostos covalentes são líquidos ou gases à temperatura ambiente e, em seus estados sólidos, são normalmente muito mais macios que os sólidos iônicos. Além disso, enquanto os compostos iônicos são bons condutores de eletricidade quando dissolvidos na água, a maioria dos compostos covalentes, sendo eletricamente neutros, são maus condutores de eletricidade em qualquer estado.
Formação de ligações covalentes
Átomos não metálicos freqüentemente formam ligações covalentes com outros átomos não metálicos. Por exemplo, a molécula de hidrogênio, H 2, contém uma ligação covalente entre seus dois átomos de hidrogênio. A figura\(\PageIndex{1}\) ilustra por que essa ligação é formada. Começando na extrema direita, temos dois átomos de hidrogênio separados com uma energia potencial específica, indicada pela linha vermelha. Ao longo do eixo x está a distância entre os dois átomos. À medida que os dois átomos se aproximam (movendo-se para a esquerda ao longo do eixo x), seus orbitais de valência (1 s) começam a se sobrepor. Os elétrons únicos em cada átomo de hidrogênio então interagem com os dois núcleos atômicos, ocupando o espaço ao redor dos dois átomos. A forte atração de cada elétron compartilhado por ambos os núcleos estabiliza o sistema, e a energia potencial diminui à medida que a distância da ligação diminui. Se os átomos continuarem se aproximando, as cargas positivas nos dois núcleos começam a se repelir e a energia potencial aumenta. O comprimento da ligação é determinado pela distância na qual a menor energia potencial é alcançada.
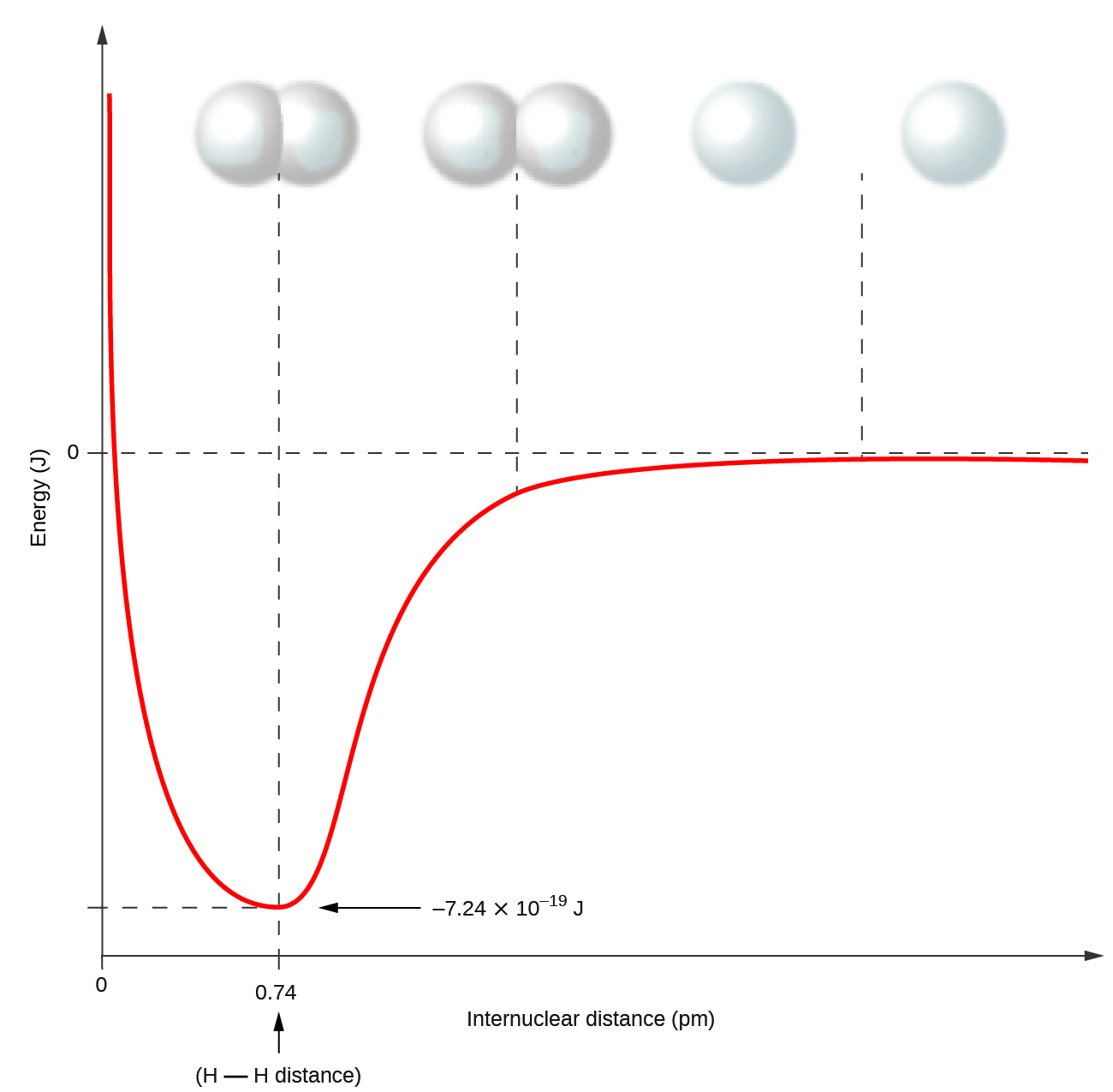
É essencial lembrar que a energia deve ser adicionada para quebrar as ligações químicas (um processo endotérmico), enquanto a formação de ligações químicas libera energia (um processo exotérmico). No caso do H 2, a ligação covalente é muito forte; uma grande quantidade de energia, 436 kJ, deve ser adicionada para quebrar as ligações em um mol de moléculas de hidrogênio e fazer com que os átomos se separem:
\[\ce{H2}(g)⟶\ce{2H}(g)\hspace{20px}ΔH=\mathrm{436\:kJ} \nonumber \]
Por outro lado, a mesma quantidade de energia é liberada quando um mol de moléculas de H 2 se forma a partir de dois moles de átomos de H:
\[\ce{2H}(g)⟶\ce{H2}(g)\hspace{20px}ΔH=\mathrm{−436\:kJ} \nonumber \]
Ligações covalentes puras versus polares
Se os átomos que formam uma ligação covalente são idênticos, como em H 2, Cl 2 e outras moléculas diatômicas, então os elétrons na ligação devem ser compartilhados igualmente. Nós nos referimos a isso como uma ligação covalente pura. Elétrons compartilhados em ligações covalentes puras têm a mesma probabilidade de estarem próximos a cada núcleo. No caso do Cl 2, cada átomo começa com sete elétrons de valência, e cada Cl compartilha um elétron com o outro, formando uma ligação covalente:
\[\ce{Cl + Cl⟶Cl2} \nonumber \]
O número total de elétrons ao redor de cada átomo individual consiste em seis elétrons não ligados e dois elétrons compartilhados (ou seja, de ligação) para oito elétrons no total, correspondendo ao número de elétrons de valência no gás nobre argônio. Como os átomos de ligação são idênticos, o Cl 2 também apresenta uma ligação covalente pura.
Quando os átomos ligados por uma ligação covalente são diferentes, os elétrons de ligação são compartilhados, mas não mais igualmente. Em vez disso, os elétrons de ligação são mais atraídos por um átomo do que por outro, dando origem a uma mudança da densidade eletrônica em direção a esse átomo. Essa distribuição desigual de elétrons é conhecida como ligação polar covalente, caracterizada por uma carga positiva parcial em um átomo e uma carga negativa parcial no outro. O átomo que atrai os elétrons com mais força adquire a carga negativa parcial e vice-versa. Por exemplo, os elétrons na ligação H-Cl de uma molécula de cloreto de hidrogênio passam mais tempo perto do átomo de cloro do que perto do átomo de hidrogênio. Assim, em uma molécula de HCl, o átomo de cloro carrega uma carga negativa parcial e o átomo de hidrogênio tem uma carga positiva parcial. A figura\(\PageIndex{2}\) mostra a distribuição de elétrons na ligação H-Cl. Observe que a área sombreada ao redor de Cl é muito maior do que em torno de H. Compare isso com a Figura\(\PageIndex{1}\), que mostra a distribuição uniforme dos elétrons na ligação não polar H 2.
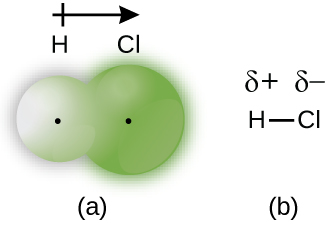
Às vezes, designamos os átomos positivos e negativos em uma ligação polar covalente usando uma letra grega minúscula “delta”, δ, com um sinal de mais ou menos para indicar se o átomo tem uma carga positiva parcial (δ+) ou uma carga negativa parcial (δ—). Esse simbolismo é mostrado para a molécula H-Cl na Figura\(\PageIndex{2b}\).
Eletronegatividade
Se uma ligação é apolar ou polar covalente é determinada por uma propriedade dos átomos de ligação chamada eletronegatividade. A eletronegatividade é uma medida da tendência de um átomo de atrair elétrons (ou densidade de elétrons) para si mesmo. Ele determina como os elétrons compartilhados são distribuídos entre os dois átomos em uma ligação. Quanto mais fortemente um átomo atrai os elétrons em suas ligações, maior sua eletronegatividade. Os elétrons em uma ligação polar covalente são deslocados em direção ao átomo mais eletronegativo; portanto, quanto mais átomo eletronegativo é aquele com a carga negativa parcial. Quanto maior a diferença na eletronegatividade, mais polarizada é a distribuição de elétrons e maiores as cargas parciais dos átomos.
A figura\(\PageIndex{3}\) mostra os valores de eletronegatividade dos elementos, conforme proposto por um dos químicos mais famosos do século XX: Linus Pauling. Em geral, a eletronegatividade aumenta da esquerda para a direita ao longo de um período na tabela periódica e diminui em um grupo. Assim, os não metais, que se encontram no canto superior direito, tendem a ter as maiores eletronegatividades, com o flúor o elemento mais eletronegativo de todos (EN = 4,0). Os metais tendem a ser menos elementos eletronegativos, e os metais do grupo 1 têm as menores eletronegatividades. Observe que gases nobres são excluídos desta figura porque esses átomos geralmente não compartilham elétrons com outros átomos, pois têm uma camada de valência completa. (Embora existam compostos de gases nobres como o XeO 2, eles só podem ser formados em condições extremas e, portanto, não se encaixam perfeitamente no modelo geral de eletronegatividade.)
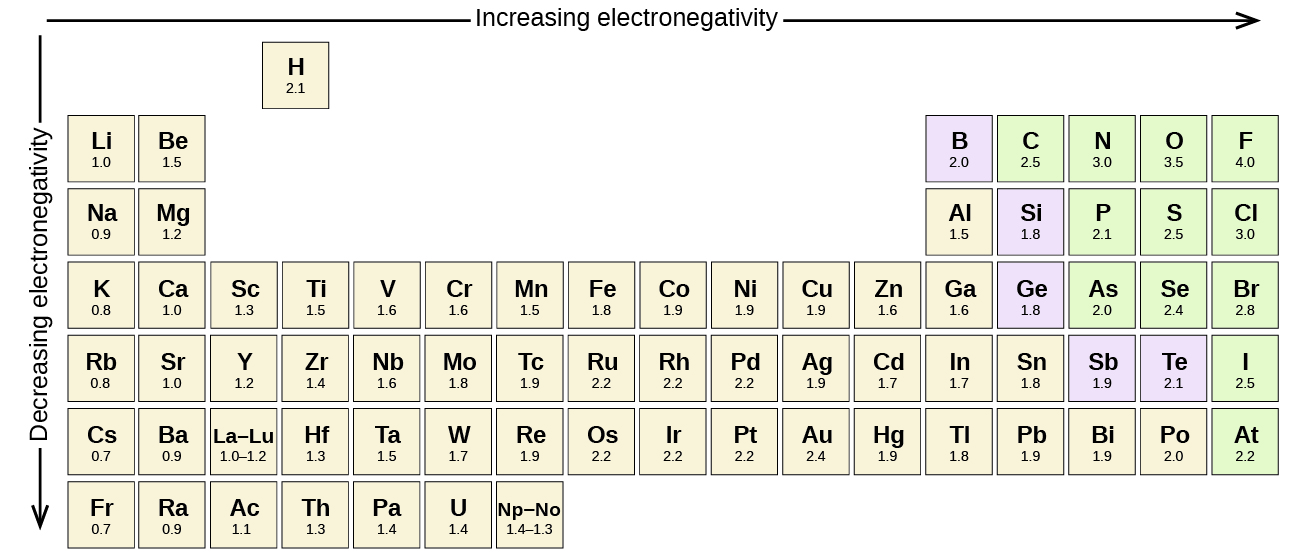
Linus Pauling é a única pessoa que recebeu dois prêmios Nobel não compartilhados (individuais): um de química em 1954 por seu trabalho sobre a natureza das ligações químicas e outro pela paz em 1962 por sua oposição às armas de destruição em massa. Ele desenvolveu muitas das teorias e conceitos que são fundamentais para nossa compreensão atual da química, incluindo estruturas de eletronegatividade e ressonância.

Pauling também contribuiu para muitos outros campos além da química. Sua pesquisa sobre a anemia falciforme revelou a causa da doença — a presença de uma proteína anormal herdada geneticamente no sangue — e abriu o caminho para o campo da genética molecular. Seu trabalho também foi fundamental para conter os testes de armas nucleares; ele provou que a precipitação radioativa de testes nucleares representava um risco à saúde pública.
Eletronegatividade versus afinidade eletrônica
Devemos ter cuidado para não confundir eletronegatividade e afinidade eletrônica. A afinidade eletrônica de um elemento é uma quantidade física mensurável, ou seja, a energia liberada ou absorvida quando um átomo isolado da fase gasosa adquire um elétron, medida em kJ/mol. A eletronegatividade, por outro lado, descreve a intensidade com que um átomo atrai elétrons em uma ligação. É uma quantidade adimensional que é calculada, não medida. Pauling derivou os primeiros valores de eletronegatividade comparando as quantidades de energia necessárias para quebrar diferentes tipos de ligações. Ele escolheu uma escala relativa arbitrária que varia de 0 a 4.
Eletronegatividade e tipo de ligação
O valor absoluto da diferença na eletronegatividade (ΔEN) de dois átomos ligados fornece uma medida aproximada da polaridade esperada na ligação e, portanto, no tipo de ligação. Quando a diferença é muito pequena ou zero, a ligação é covalente e não polar. Quando é grande, a ligação é polar covalente ou iônica. Os valores absolutos das diferenças de eletronegatividade entre os átomos nas ligações H—H, H—Cl e Na—Cl são 0 (não polar), 0,9 (polar covalente) e 2,1 (iônico), respectivamente. O grau em que os elétrons são compartilhados entre os átomos varia de completamente igual (ligação covalente pura) a nada (ligação iônica). A figura\(\PageIndex{4}\) mostra a relação entre a diferença de eletronegatividade e o tipo de ligação.

Uma aproximação aproximada das diferenças de eletronegatividade associadas às ligações covalentes, covalentes polares e iônicas é mostrada na Figura\(\PageIndex{4}\). No entanto, esta tabela é apenas um guia geral, com muitas exceções. Por exemplo, os átomos H e F em HF têm uma diferença de eletronegatividade de 1,9, e os átomos N e H em NH 3 uma diferença de 0,9, mas ambos os compostos formam ligações que são consideradas covalentes polares. Da mesma forma, os átomos de Na e Cl no NaCl têm uma diferença de eletronegatividade de 2,1, e os átomos de Mn e I no MnI 2 têm uma diferença de 1,0, mas ambas as substâncias formam compostos iônicos.
O melhor guia para o caráter covalente ou iônico de uma ligação é considerar os tipos de átomos envolvidos e suas posições relativas na tabela periódica. As ligações entre dois não metais são geralmente covalentes; a ligação entre um metal e um não metal geralmente é iônica.
Alguns compostos contêm ligações covalentes e iônicas. Os átomos em íons poliatômicos, como OH —\(\ce{NO3-}\), e\(\ce{NH4+}\), são mantidos juntos por ligações polares covalentes. No entanto, esses íons poliatômicos formam compostos iônicos ao se combinarem com íons de carga oposta. Por exemplo, o nitrato de potássio, KNO 3, contém o cátion K + e o\(\ce{NO3-}\) ânion poliatômico. Assim, a ligação em nitrato de potássio é iônica, resultante da atração eletrostática entre os íons K + e\(\ce{NO3-}\), bem como covalente entre os átomos de nitrogênio e oxigênio em\(\ce{NO3-}\).
As polaridades das ligações desempenham um papel importante na determinação da estrutura das proteínas. Usando os valores de eletronegatividade na Tabela A2, organize as seguintes ligações covalentes - todas comumente encontradas em aminoácidos - em ordem crescente de polaridade. Em seguida, designe os átomos positivos e negativos usando os símbolos δ+ e δ—:
C—H, C—N, C—O, N—H, O—H, S—H
Solução
A polaridade dessas ligações aumenta à medida que o valor absoluto da diferença de eletronegatividade aumenta. O átomo com a designação δ— é o mais eletronegativo dos dois. A tabela\(\PageIndex{1}\) mostra essas ligações em ordem crescente de polaridade.
| Bond | ΔEN | Polaridade |
|---|---|---|
| C—H | 0,4 | \(\overset{δ−}{\ce C}−\overset{δ+}{\ce H}\) |
| —H | 0,4 | \(\overset{δ−}{\ce S}−\overset{δ+}{\ce H}\) |
| C—N | 0,5 | \(\overset{δ+}{\ce C}−\overset{δ−}{\ce N}\) |
| N—H | 0,9 | \(\overset{δ−}{\ce N}−\overset{δ+}{\ce H}\) |
| C—O | 1,0 | \(\overset{δ+}{\ce C}−\overset{δ−}{\ce O}\) |
| O—H | 1.4 | \(\overset{δ−}{\ce O}−\overset{δ+}{\ce H}\) |
Os silicones são compostos poliméricos que contêm, entre outros, os seguintes tipos de ligações covalentes: Si—O, Si—C, C—H e C—C. Usando os valores de eletronegatividade na Figura\(\PageIndex{3}\), organize as ligações em ordem crescente de polaridade e designe os átomos positivos e negativos usando os símbolos δ+ e δ—.
Resposta
| Bond | Diferença de eletronegatividade | Polaridade |
|---|---|---|
| C—C | 0,0 | apolar |
| C—H | 0,4 | \(\overset{δ−}{\ce C}−\overset{δ+}{\ce H}\) |
| Si — C | 0.7 | \(\overset{δ+}{\ce{Si}}−\overset{δ−}{\ce C}\) |
| Si—O | 1.7 | \(\overset{δ+}{\ce{Si}}−\overset{δ−}{\ce O}\) |
Resumo
Ligações covalentes se formam quando os elétrons são compartilhados entre os átomos e são atraídos pelos núcleos de ambos os átomos. Em ligações covalentes puras, os elétrons são compartilhados igualmente. Nas ligações covalentes polares, os elétrons são compartilhados de forma desigual, pois um átomo exerce uma força de atração mais forte sobre os elétrons do que o outro. A capacidade de um átomo de atrair um par de elétrons em uma ligação química é chamada de eletronegatividade. A diferença na eletronegatividade entre dois átomos determina o quão polar será uma ligação. Em uma molécula diatômica com dois átomos idênticos, não há diferença na eletronegatividade, então a ligação é não polar ou covalente pura. Quando a diferença de eletronegatividade é muito grande, como é o caso entre metais e não metais, a ligação é caracterizada como iônica.
Glossário
- comprimento da ligação
- distância entre os núcleos de dois átomos ligados nos quais a menor energia potencial é alcançada
- ligação covalente
- ligação formada quando elétrons são compartilhados entre átomos
- eletronegatividade
- tendência de um átomo de atrair elétrons em uma ligação a si mesmo
- ligação covalente polar
- ligação covalente entre átomos de diferentes eletronegatividades; uma ligação covalente com uma extremidade positiva e uma extremidade negativa
- ligação covalente pura
- (também, ligação covalente não polar) ligação covalente entre átomos de eletronegatividades idênticas


