4.5: Análise Química Quantitativa
- Page ID
- 185504
- Descreva os aspectos fundamentais das titulações e da análise gravimétrica.
- Execute cálculos estequiométricos usando titulação típica e dados gravimétricos.
No século XVIII, a força (na verdade, a concentração) das amostras de vinagre foi determinada pela observação da quantidade de carbonato de potássio, K 2 CO 3, que teve que ser adicionada, pouco de cada vez, antes que a borbulhação cessasse. Quanto maior o peso do carbonato de potássio adicionado para chegar ao ponto em que o borbulhamento terminou, mais concentrado é o vinagre.
Agora sabemos que a efervescência que ocorreu durante esse processo foi devida à reação com o ácido acético, CH 3 CO 2 H, o composto principal responsável pelo odor e sabor do vinagre. O ácido acético reage com o carbonato de potássio de acordo com a seguinte equação:
\[\ce{2CH3CO2H}(aq)+\ce{K2CO3}(s)\rightarrow 2 \ce{KCH3CO3}(aq)+\ce{CO2}(g)+\ce{H2O}(l) \nonumber \]
O borbulhamento foi devido à produção de CO 2.
O teste do vinagre com carbonato de potássio é um tipo de análise quantitativa - a determinação da quantidade ou concentração de uma substância em uma amostra. Na análise do vinagre, a concentração do soluto (ácido acético) foi determinada a partir da quantidade de reagente combinada com o soluto presente em um volume conhecido da solução. Em outros tipos de análises químicas, a quantidade de uma substância presente em uma amostra é determinada medindo a quantidade de produto resultante.
Titulação
A abordagem descrita para medir a força do vinagre foi uma versão inicial da técnica analítica conhecida como análise de titulação. Uma análise de titulação típica envolve o uso de uma bureta (Figura\(\PageIndex{1}\)) para fazer adições incrementais de uma solução contendo uma concentração conhecida de alguma substância (o titulante) a uma solução de amostra contendo a substância cuja concentração deve ser medida (o analito). O titulante e o analito sofrem uma reação química de estequiometria conhecida e, portanto, medir o volume de solução titulante necessário para a reação completa com o analito (o ponto de equivalência da titulação) permite o cálculo da concentração do analito. O ponto de equivalência de uma titulação pode ser detectado visualmente se uma mudança distinta na aparência da solução da amostra acompanhar a conclusão da reação. A interrupção da formação de bolhas na análise clássica do vinagre é um exemplo, embora, mais comumente, corantes especiais chamados indicadores sejam adicionados às soluções da amostra para transmitir uma mudança na cor no ponto de equivalência da titulação ou muito perto dele. Os pontos de equivalência também podem ser detectados medindo alguma propriedade da solução que muda de forma previsível durante o curso da titulação. Independentemente da abordagem adotada para detectar o ponto de equivalência de uma titulação, o volume de titulante realmente medido é chamado de ponto final. Os métodos de titulação adequadamente projetados normalmente garantem que a diferença entre a equivalência e os pontos finais seja insignificante. Embora qualquer tipo de reação química possa servir como base para uma análise de titulação, as três descritas neste capítulo (precipitação, ácido-base e redox) são as mais comuns. Detalhes adicionais sobre a análise de titulação são fornecidos no capítulo sobre equilíbrio ácido-base.

O ponto final em uma titulação de uma amostra de 50,00 mL de HCl aquoso foi alcançado pela adição de 35,23 mL de titulante NaOH 0,250 M. A reação de titulação é:
\[\ce{HCl}(aq)+\ce{NaOH}(aq)\rightarrow \ce{NaCl}(aq)+\ce{H2O}(l) \nonumber \]
Qual é a molaridade do HCl?
Solução
Como em todos os cálculos de estequiometria de reação, a questão principal é a relação entre as quantidades molares da espécie química de interesse, conforme descrito na equação química balanceada. A abordagem descrita nos módulos anteriores deste capítulo é seguida, com considerações adicionais necessárias, uma vez que as quantidades de reagentes fornecidas e solicitadas são expressas como concentrações da solução.
Para este exercício, o cálculo seguirá as seguintes etapas descritas:
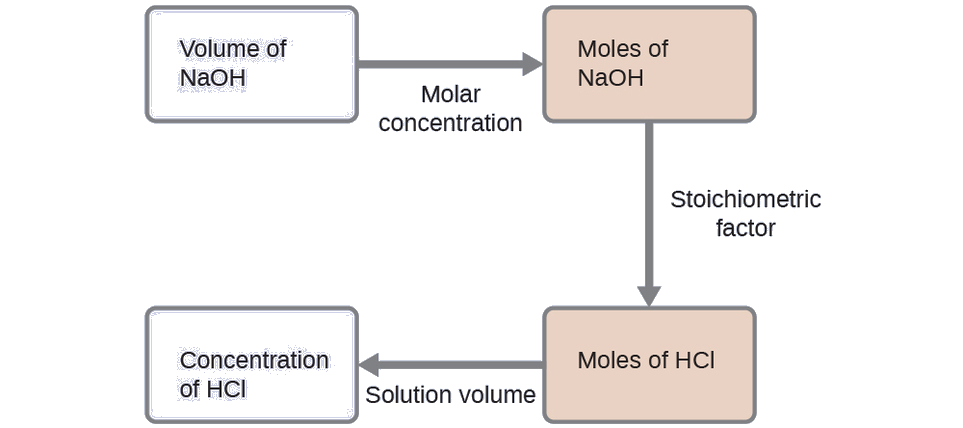
A quantidade molar de HCl é calculada para ser:
\[\mathrm{35.23\:\cancel{mL\: NaOH}\times \dfrac{1\:\cancel{L}}{1000\:\cancel{mL}}\times \dfrac{0.250\:\cancel{mol\: NaOH}}{1\:\cancel{L}}\times \dfrac{1\: mol\: HCl}{1\:\cancel{mol\: NaOH}}=8.81\times 10^{-3}\:mol\: HCl} \nonumber \]
Usando o volume fornecido de solução de HCl e a definição de molaridade, a concentração de HCl é:
\ [\ begin {align*}
M&=\ mathrm {\ dfrac {mol\: HCl} {L\: solução}}\\
M&=\ mathrm {\ dfrac {8,81\ times 10^ {-3}\ :mol\: HCl} {50,00\: mL\ times\ dfrac {1\: L} {1000\: mL}}\\
M&=0,176\ :M
\ end {align*}\ nonumber\]
Nota: Para esses tipos de cálculos de titulação, é conveniente reconhecer que a molaridade da solução também é igual ao número de mili moles de soluto por mili de litro de solução:
\[M=\mathrm{\dfrac{mol\: solute}{L\: solution}\times \dfrac{\dfrac{10^3\:mmol}{mol}}{\dfrac{10^3\:mL}{L}}=\dfrac{mmol\: solute}{mL\: solution}} \nonumber \]
O uso dessa versão da unidade de molaridade reduzirá o cálculo eliminando dois fatores de conversão:
\[\mathrm{\dfrac{35.23\:mL\: NaOH\times \dfrac{0.250\:mmol\: NaOH}{mL\: NaOH}\times \dfrac{1\:mmol\: HCl}{1\:mmol\: NaOH}}{50.00\:mL\: solution}=0.176\: \mathit M\: HCl} \nonumber \]
Uma amostra de 20,00 mL de ácido oxálico aquoso, H 2 C 2 O 4, foi titulada com uma solução 0,09113-M de permanganato de potássio, KMnO 4.
\[\ce{2MnO4-}(aq)+\ce{5H2C2O4}(aq)+\ce{6H+}(aq)\rightarrow \ce{10CO2}(g)+\ce{2Mn^2+}(aq)+\ce{8H2O}(l) \nonumber \]
Foi necessário um volume de 23,24 mL para atingir o ponto final. Qual é a molaridade do ácido oxálico?
- Responda
-
0,2648 MM
Análise gravimétrica
Uma análise gravimétrica é aquela em que uma amostra é submetida a algum tratamento que causa uma mudança no estado físico do analito que permite sua separação dos outros componentes da amostra. As medições de massa da amostra, do analito isolado ou de algum outro componente do sistema de análise, usado junto com a conhecida estequiometria dos compostos envolvidos, permitem o cálculo da concentração do analito. Os métodos gravimétricos foram as primeiras técnicas usadas para análise química quantitativa e continuam sendo ferramentas importantes no laboratório de química moderno.
A mudança de estado necessária em uma análise gravimétrica pode ser alcançada por vários processos físicos e químicos. Por exemplo, o teor de umidade (água) de uma amostra é determinado rotineiramente medindo a massa de uma amostra antes e depois de ela ser submetida a um processo de aquecimento controlado que evapora a água. Também são comuns as técnicas gravimétricas nas quais o analito é submetido a uma reação de precipitação do tipo descrito anteriormente neste capítulo. O precipitado é normalmente isolado da mistura de reação por filtração, cuidadosamente seco e depois pesado (Figura\(\PageIndex{2}\)). A massa do precipitado pode então ser usada, junto com as relações estequiométricas relevantes, para calcular a concentração do analito.

Uma mistura sólida de 0,4550 g contendo MgSO 4 é dissolvida em água e tratada com um excesso de Ba (NO 3) 2, resultando na precipitação de 0,6168 g de BaSO 4.
\[\ce{MgSO4}(aq)+\ce{Ba(NO3)2}(aq)\rightarrow \ce{BaSO4}(s)+\ce{Mg(NO3)2}(aq) \nonumber \]
Qual é a concentração (porcentagem) de MgSO 4 na mistura?
Solução
O plano para esse cálculo é semelhante aos outros usados em cálculos estequiométricos, sendo a etapa central a conexão entre os moles de BaSO 4 e MgSO 4 por meio de seu fator estequiométrico. Uma vez calculada a massa de MgSO 4, ela pode ser usada junto com a massa da mistura da amostra para calcular a concentração percentual solicitada.
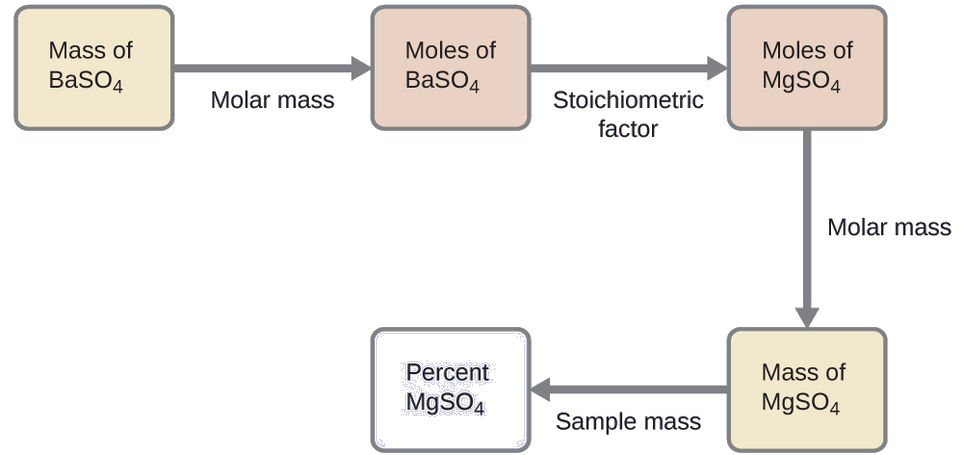
A massa de MgSO 4 que produziria a massa precipitada fornecida é
\[\mathrm{0.6168\:\cancel{g\: BaSO_4}\times \dfrac{1\:\cancel{mol\: BaSO_4}}{233.43\:\cancel{g\: BaSO_4}}\times \dfrac{1\:\cancel{mol\: MgSO_4}}{1\:\cancel{mol\: BaSO_4}}\times \dfrac{120.37\:g\: MgSO_4}{1\:\cancel{mol\: MgSO_4}}=0.3181\:g\: MgSO_4} \nonumber \]
A concentração de MgSO 4 na mistura da amostra é então calculada para ser
\ [\ begin {align*}
\ ce {percent\: MgSO4} &=\ ce {\ dfrac {mass\: MgSO4} {massa\: amostra}}\ times100\%
\\ mathrm {\ dfrac {0,3181\: g} {0,4550\: g}}\ times100\ %&=69,91\%
\ end {align*}\ nonumber\]
Qual é a porcentagem de íon cloreto em uma amostra se 1,1324 g da amostra produz 1,0881 g de AgCl quando tratada com excesso de Ag +?
\[\ce{Ag+}(aq)+\ce{Cl-}(aq)\rightarrow \ce{AgCl}(s) \nonumber \]
- Responda
-
23,76%
Análise de combustão
A composição elementar dos hidrocarbonetos e compostos relacionados pode ser determinada por meio de um método gravimétrico conhecido como análise de combustão. Em uma análise de combustão, uma amostra pesada do composto é aquecida a uma alta temperatura sob uma corrente de gás oxigênio, resultando em sua combustão completa para produzir produtos gasosos de identidades conhecidas. A combustão completa de hidrocarbonetos, por exemplo, produzirá dióxido de carbono e água como os únicos produtos. Os produtos de combustão gasosa são varridos por dispositivos de coleta separados e pré-pesados, contendo compostos que absorvem seletivamente cada produto (Figura\(\PageIndex{3}\)). O aumento de massa de cada dispositivo corresponde à massa do produto absorvido e pode ser usado em um cálculo estequiométrico apropriado para derivar a massa do elemento relevante.
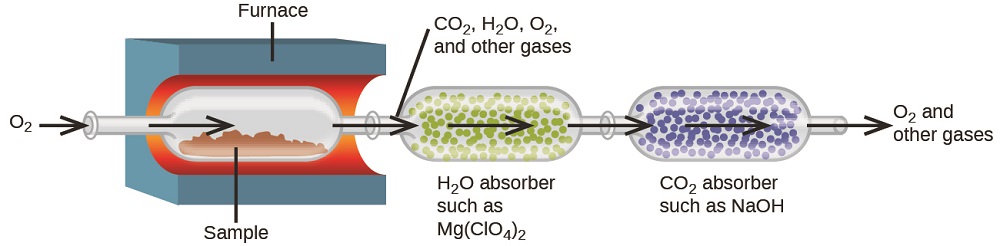
O polietileno é um polímero de hidrocarboneto usado para produzir sacos de armazenamento de alimentos e muitos outros itens plásticos flexíveis. Uma análise da combustão de uma amostra de 0,00126 g de polietileno produz 0,00394 g de CO 2 e 0,00161 g de H 2 O. Qual é a fórmula empírica do polietileno?
Solução
A principal suposição neste exercício é que todo o carbono na amostra queimada é convertido em dióxido de carbono e todo o hidrogênio da amostra é convertido em água:
\[\mathrm{C_xH_y}(s)+\ce{excess\: O2}(g)\rightarrow x\ce{CO2}(g)+ \dfrac{y}{2} \ce{H2O}(g) \nonumber \]
Observe que uma equação balanceada não é necessária para a tarefa em questão. Para derivar a fórmula empírica do composto, somente os subscritos x e y são necessários.
Primeiro, calcule as quantidades molares de carbono e hidrogênio na amostra, usando as massas fornecidas de dióxido de carbono e água, respectivamente. Com essas quantidades molares, a fórmula empírica do composto pode ser escrita conforme descrito no capítulo anterior deste texto. Um esboço dessa abordagem é fornecido no seguinte fluxograma:
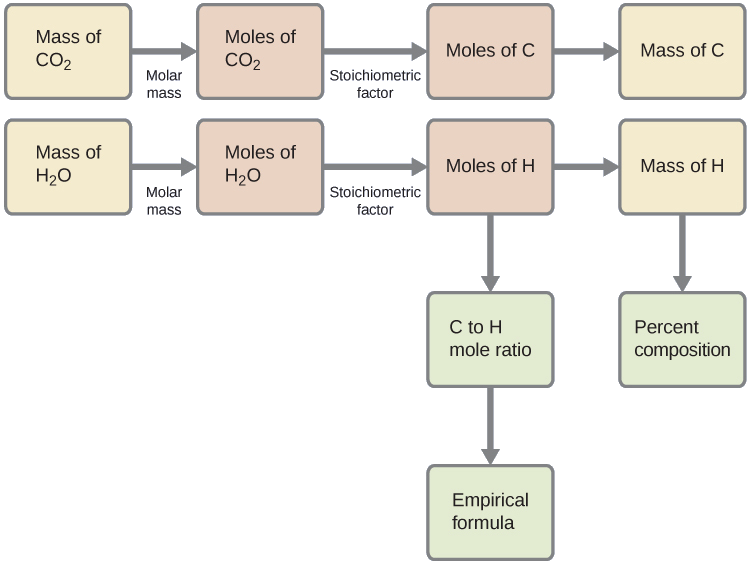
\[\mathrm{mol\: C=0.00394\:g\: CO_2\times\dfrac{1\:mol\: CO_2}{44.01\: g/mol}\times\dfrac{1\:mol\: C}{1\:mol\: CO_2}=8.95\times10^{-5}\:mol\: C} \nonumber \]
\[\mathrm{mol\: H=0.00161\:g\: H_2O\times\dfrac{1\:mol\: H_2O}{18.02\:g/mol}\times\dfrac{2\:mol\: H}{1\:mol\: H_2O}=1.79\times10^{-4}\:mol\: H} \nonumber \]
A fórmula empírica do composto é então derivada da identificação dos menores múltiplos de número inteiro para essas quantidades molares. A razão molar H-to-C é
\[\mathrm{\dfrac{mol\: H}{mol\: C}=\dfrac{1.79\times10^{-4}\:mol\: H}{8.95\times10^{-5}\:mol\: C}=\dfrac{2\:mol\: H}{1\:mol\: C}} \nonumber \]
e a fórmula empírica para o polietileno é CH 2.
Uma amostra de 0,00215 g de poliestireno, um polímero composto de carbono e hidrogênio, produziu 0,00726 g de CO 2 e 0,00148 g de H 2 O em uma análise de combustão. Qual é a fórmula empírica do poliestireno?
- Responda
-
CH
Resumo
A estequiometria das reações químicas pode servir como base para métodos de análise química quantitativa. As titulações envolvem a medição do volume de uma solução titulante necessária para reagir completamente com uma solução de amostra. Esse volume é então usado para calcular a concentração do analito na amostra usando a estequiometria da reação de titulação. A análise gravimétrica envolve separar o analito da amostra por um processo físico ou químico, determinar sua massa e, em seguida, calcular sua concentração na amostra com base na estequiometria do processo relevante. A análise de combustão é um método gravimétrico usado para determinar a composição elementar de um composto coletando e pesando os produtos gasosos de sua combustão.
Glossário
- analito
- espécies químicas de interesse
- bureta
- dispositivo usado para a entrega precisa de volumes variáveis de líquido, como em uma análise de titulação
- análise de combustão
- técnica gravimétrica usada para determinar a composição elementar de um composto por meio da coleta e pesagem de seus produtos gasosos de combustão
- ponto final
- volume medido da solução titulante que produz a mudança na aparência da solução da amostra ou outra propriedade esperada para a equivalência estequiométrica (consulte o ponto de equivalência)
- ponto de equivalência
- volume de solução titulante necessário para reagir completamente com o analito em uma análise de titulação; fornece uma quantidade estequiométrica de titulante para o analito da amostra de acordo com a reação de titulação
- análise gravimétrica
- método de análise química quantitativa envolvendo a separação de um analito de uma amostra por um processo físico ou químico e subsequentes medições de massa do analito, produto da reação e/ou amostra
- indicadora
- substância adicionada à amostra em uma análise de titulação para permitir a detecção visual do ponto final
- análise quantitativa
- a determinação da quantidade ou concentração de uma substância em uma amostra
- titulante
- solução contendo uma concentração conhecida de substância que reagirá com o analito em uma análise de titulação
- análise de titulação
- método de análise química quantitativa que envolve a medição do volume de uma solução reagente necessária para reagir completamente com o analito em uma amostra


