4.4: Rendimentos da reação
- Page ID
- 185526
- Explique os conceitos de rendimento teórico e reagentes/reagentes limitantes.
- Derive o rendimento teórico de uma reação sob condições especificadas.
- Calcule o rendimento percentual de uma reação.
As quantidades relativas de reagentes e produtos representados em uma equação química balanceada são frequentemente chamadas de quantidades estequiométricas. Todos os exercícios do módulo anterior envolveram quantidades estequiométricas de reagentes. Por exemplo, ao calcular a quantidade de produto gerada a partir de uma determinada quantidade de reagente, assumiu-se que quaisquer outros reagentes necessários estavam disponíveis em quantidades estequiométricas (ou maiores). Neste módulo, são consideradas situações mais realistas, nas quais os reagentes não estão presentes em quantidades estequiométricas.
Reagente limitador
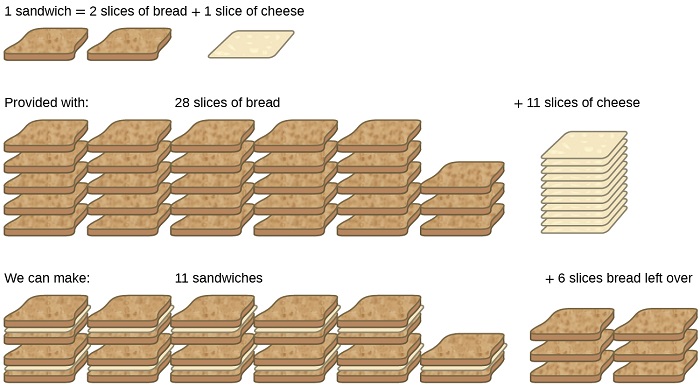
Considere outra analogia alimentar, fazendo sanduíches de queijo grelhado (Figura\(\PageIndex{1}\)):
\[\text{1 slice of cheese} + \text{2 slices of bread} \rightarrow \text{1 sandwich} \label{4.5.A} \]
As quantidades estequiométricas dos ingredientes do sanduíche para esta receita são fatias de pão e queijo na proporção de 2:1. Fornecido com 28 fatias de pão e 11 fatias de queijo, pode-se preparar 11 sanduíches de acordo com a receita fornecida, usando todo o queijo fornecido e sobrando seis fatias de pão. Nesse cenário, o número de sanduíches preparados foi limitado pelo número de fatias de queijo, e as fatias de pão foram fornecidas em excesso.
Considere esse conceito agora em relação a um processo químico, a reação do hidrogênio com o cloro para produzir cloreto de hidrogênio:
\[\ce{H2}(g) + \ce{Cl2}(g)\rightarrow \ce{2HCl}(g) \nonumber \]
A equação balanceada mostra que o hidrogênio e o cloro reagem em uma proporção estequiométrica de 1:1. Se esses reagentes forem fornecidos em qualquer outra quantidade, um dos reagentes quase sempre será totalmente consumido, limitando assim a quantidade de produto que pode ser gerada. Essa substância é o reagente limitante e a outra substância é o reagente em excesso. Identificar os reagentes limitantes e em excesso para uma determinada situação requer o cálculo das quantidades molares de cada reagente fornecido e a comparação com as quantidades estequiométricas representadas na equação química balanceada.
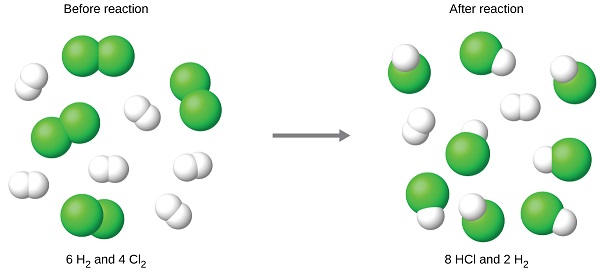
Por exemplo, imagine combinar 6 moles de H 2 e 4 moles de Cl 2. Identificar o reagente limitante envolve comparar a quantidade de produto esperada para a reação completa de cada reagente. Cada quantidade de reagente é usada para calcular separadamente a quantidade de produto que seria formada de acordo com a estequiometria da reação. O reagente que produz a menor quantidade de produto é o reagente limitante.
Para o exemplo do parágrafo anterior, a reação completa do hidrogênio produziria
\[\mathrm{mol\: HCl\: produced=6\: mol\:H_2\times \dfrac{2\: mol\: HCl}{1\: mol\:H_2}=12\: mol\: HCl} \nonumber \]
A reação completa do cloro fornecido produziria
\[\mathrm{mol\: HCl\: produced=4\: mol\:Cl_2\times \dfrac{2\: mol\: HCl}{1\: mol\:Cl_2}=8\: mol\: HCl} \nonumber \]
O cloro será completamente consumido assim que 8 moles de HCl forem produzidos. Como foi fornecido hidrogênio suficiente para produzir 12 moles de HCl, haverá hidrogênio não reagido restante quando a reação for concluída. O cloro, portanto, é o reagente limitante e o hidrogênio é o reagente em excesso (Figura\(\PageIndex{2}\)). Para determinar a quantidade de reagente em excesso que permanece, a quantidade de hidrogênio consumida na reação pode ser subtraída da quantidade inicial de hidrogênio.
A quantidade de hidrogênio consumida é
\[\mathrm{mol\: H_2\: produced=8\: mol\:HCl\times \dfrac{1\: mol\: H_2}{2\: mol\:HCl}=4\: mol\: H_2} \nonumber \]
Subtraia o hidrogênio consumido da quantidade inicial
\[\mathrm{mole\: of\: excess\:H_{2}=6\:mol\:H_{2}\:starting\:-\:4\:mol\:H_{2}\:consumed\:=\:2\:mol\:H_{2}\; excess} \nonumber \]
O nitreto de silício é uma cerâmica muito dura e resistente a altas temperaturas usada como componente de pás de turbinas em motores a jato. É preparado de acordo com a seguinte equação:
\[\ce{3Si}(s)+\ce{2N2}(g)\rightarrow \ce{Si3N4}(s) \nonumber \]
Qual é o reagente limitante quando 2,00 g de Si e 1,50 g de N 2 reagem?
Solução
Calcule as quantidades molares de reagentes fornecidas e, em seguida, compare essas quantidades com a equação balanceada para identificar o reagente limitante.
\[\mathrm{mol\: Si=2.00\:\cancel{g\: Si}\times \dfrac{1\: mol\: Si}{28.09\:\cancel{g\: Si}}=0.0712\: mol\: Si} \nonumber \]
\[\mathrm{mol\:N_2=1.50\:\cancel{g\:N_2}\times \dfrac{1\: mol\:N_2}{28.02\:\cancel{g\:N_2}}=0.0535\: mol\:N_2} \nonumber \]
A razão molar Si:N 2 fornecida é:
\[\mathrm{\dfrac{0.0712\: mol\: Si}{0.0535\: mol\:N_2}=\dfrac{1.33\: mol\: Si}{1\: mol\:N_2}} \nonumber \]
A relação estequiométrica Si:N 2 é:
\[\mathrm{\dfrac{3\: mol\: Si}{2\: mol\:N_2}=\dfrac{1.5\: mol\: Si}{1\: mol\:N_2}} \nonumber \]
A comparação dessas proporções mostra que o Si é fornecido em uma quantidade menor que a estequiométrica, assim como o reagente limitante.
Como alternativa, calcule a quantidade de produto esperada para a reação completa de cada um dos reagentes fornecidos. Os 0,0712 moles de silício produziriam
\[\mathrm{mol\:Si_3N_4\:produced=0.0712\: mol\: Si\times \dfrac{1\:mol\:Si_3N_4}{3\: mol\: Si}=0.0237\: mol\:Si_3N_4} \nonumber \]
enquanto os 0,0535 moles de nitrogênio produziriam
\[\mathrm{mol\:Si_3N_4\:produced=0.0535\: mol\:N_2\times \dfrac{1\: mol\:Si_3N_4}{2\: mol\:N_2}=0.0268\: mol\:Si_3N_4} \nonumber \]
Como o silício produz a menor quantidade de produto, ele é o reagente limitante.
Qual é o reagente limitante quando 5,00 g de H 2 e 10,0 g de O 2 reagem e formam água?
- Responda
-
OU 2
Rendimento percentual
A quantidade de produto que pode ser produzida por uma reação sob condições especificadas, calculada pela estequiometria de uma equação química balanceada apropriada, é chamada de rendimento teórico da reação. Na prática, a quantidade de produto obtida é chamada de rendimento real e geralmente é menor do que o rendimento teórico por vários motivos. Algumas reações são inerentemente ineficientes, sendo acompanhadas por reações colaterais que geram outros produtos. Outros são, por natureza, incompletos (considere as reações parciais de ácidos e bases fracos discutidas anteriormente neste texto). Alguns produtos são difíceis de coletar sem alguma perda e, portanto, uma recuperação menos do que perfeita reduzirá o rendimento real. A extensão em que o rendimento teórico de uma reação é alcançado é comumente expressa como seu rendimento percentual:
\[\mathrm{percent\: yield=\dfrac{actual\: yield}{theoretical\: yield}\times 100\%} \nonumber \]
Os rendimentos reais e teóricos podem ser expressos como massas ou quantidades molares (ou qualquer outra propriedade apropriada; por exemplo, volume, se o produto for um gás). Desde que os dois rendimentos sejam expressos usando as mesmas unidades, essas unidades serão canceladas quando o rendimento percentual for calculado.
Após a reação de 1,274 g de sulfato de cobre com excesso de zinco metálico, 0,392 g de metal de cobre foi obtido de acordo com a equação:
\[\ce{CuSO4}(aq)+\ce{Zn}(s)\rightarrow \ce{Cu}(s)+\ce{ZnSO4}(aq) \nonumber \]
Qual é o rendimento percentual?
Solução
As informações fornecidas identificam o sulfato de cobre como o reagente limitante e, portanto, o rendimento teórico é encontrado pela abordagem ilustrada no módulo anterior, conforme mostrado aqui:
\[\mathrm{1.274\:\cancel{g\:Cu_SO_4}\times \dfrac{1\:\cancel{mol\:CuSO_4}}{159.62\:\cancel{g\:CuSO_4}}\times \dfrac{1\:\cancel{mol\: Cu}}{1\:\cancel{mol\:CuSO_4}}\times \dfrac{63.55\:g\: Cu}{1\:\cancel{mol\: Cu}}=0.5072\: g\: Cu} \nonumber \]
Usando esse rendimento teórico e o valor fornecido para o rendimento real, o rendimento percentual é calculado para ser
\[\mathrm{percent\: yield=\left(\dfrac{actual\: yield}{theoretical\: yield}\right)\times 100} \nonumber \]
\ [\ begin {align*}
\ mathrm {percent\: rendimento} &=\ mathrm {\ left (\ dfrac {0,392\: g\: Cu} {0,5072\: g\: Cu}\ direita)\ times 100}\\
&=77,3\%
\ end {align*}\ nonumber\]
Qual é o rendimento percentual de uma reação que produz 12,5 g do gás Freon CF 2 Cl 2 de 32,9 g de cCl 4 e excesso de HF?
\[\ce{CCl4 + 2HF \rightarrow CF2Cl2 + 2HCl} \nonumber \]
- Responda
-
48,3%
O design intencional de produtos e processos químicos que minimizam o uso de substâncias ambientalmente perigosas e a geração de resíduos é conhecido como química verde. A química verde é uma abordagem filosófica que está sendo aplicada a muitas áreas da ciência e tecnologia, e sua prática é resumida por diretrizes conhecidas como “Doze Princípios da Química Verde”. Um dos 12 princípios visa especificamente maximizar a eficiência dos processos de síntese de produtos químicos. A economia atômica de um processo é uma medida dessa eficiência, definida como a porcentagem em massa do produto final de uma síntese em relação às massas de todos os reagentes usados:
\[\mathrm{atom\: economy=\dfrac{mass\: of\: product}{mass\: of\: reactants}\times 100\%} \nonumber \]
Embora a definição de economia atômica à primeira vista pareça muito semelhante à de rendimento percentual, esteja ciente de que essa propriedade representa uma diferença nas eficiências teóricas de diferentes processos químicos. O rendimento percentual de um determinado processo químico, por outro lado, avalia a eficiência de um processo comparando o rendimento do produto realmente obtido com o rendimento máximo previsto pela estequiometria.
A síntese do analgésico comum sem receita médica, o ibuprofeno, ilustra bem o sucesso de uma abordagem química verde (Figura\(\PageIndex{3}\)). Comercializado pela primeira vez no início dos anos 1960, o ibuprofeno foi produzido usando uma síntese de seis etapas que exigiu 514 g de reagentes para gerar cada mol (206 g) de ibuprofeno, uma economia atômica de 40%. Na década de 1990, um processo alternativo foi desenvolvido pela BHC Company (agora BASF Corporation) que requer apenas três etapas e tem uma economia atômica de ~ 80%, quase o dobro do processo original. O processo BHC gera significativamente menos resíduos químicos; usa materiais menos perigosos e recicláveis; e proporciona uma economia significativa de custos para o fabricante (e, posteriormente, para o consumidor). Em reconhecimento ao impacto ambiental positivo do processo BHC, a empresa recebeu o Prêmio Greener Synthetic Pathways da Agência de Proteção Ambiental em 1997.

Resumo
Quando as reações são realizadas usando quantidades menores que estequiométricas de reagentes, a quantidade de produto gerado será determinada pelo reagente limitante. A quantidade de produto gerada por uma reação química é seu rendimento real. Esse rendimento geralmente é menor do que a quantidade de produto prevista pela estequiometria da equação química balanceada que representa a reação (seu rendimento teórico). A medida em que uma reação gera a quantidade teórica de produto é expressa como seu rendimento percentual.
Equações-chave
- \(\mathrm{percent\: yield=\left(\dfrac{actual\: yield}{theoretical\: yield}\right)\times 100}\)
Glossário
- rendimento real
- quantidade de produto formada em uma reação
- excesso de reagente
- reagente presente em uma quantidade maior do que a exigida pela estequiometria de reação
- reagente limitador
- reagente presente em uma quantidade menor do que a exigida pela estequiometria da reação, limitando assim a quantidade de produto gerado
- rendimento percentual
- medida da eficiência de uma reação, expressa como uma porcentagem do rendimento teórico
- rendimento teórico
- quantidade de produto que pode ser produzida a partir de uma determinada quantidade de reagente (s) de acordo com a estequiometria da reação


