4.3: Estequiometria de reação
- Page ID
- 185505
- Explicar o conceito de estequiometria no que se refere às reações químicas
- Use equações químicas balanceadas para derivar fatores estequiométricos que relacionam quantidades de reagentes e produtos
- Execute cálculos estequiométricos envolvendo massa, moles e molaridade da solução
Uma equação química balanceada fornece uma grande quantidade de informações em um formato muito sucinto. As fórmulas químicas fornecem as identidades dos reagentes e produtos envolvidos na mudança química, permitindo a classificação da reação. Os coeficientes fornecem os números relativos dessas espécies químicas, permitindo uma avaliação quantitativa das relações entre as quantidades de substâncias consumidas e produzidas pela reação. Essas relações quantitativas são conhecidas como estequiometria da reação, um termo derivado das palavras gregas estoicheion (que significa “elemento”) e metron (que significa “medida”). Neste módulo, o uso de equações químicas balanceadas para várias aplicações estequiométricas é explorado.
A abordagem geral do uso de relações estequiométricas é semelhante em conceito à maneira como as pessoas realizam muitas atividades comuns. Cozinhar, por exemplo, oferece uma comparação adequada. Suponha que uma receita para fazer oito panquecas exija 1 xícara de mistura para panquecas,\(\dfrac{3}{4}\) xícara de leite e um ovo. A “equação” que representa a preparação de panquecas de acordo com esta receita é
\[\mathrm{1\:cup\: mix+\dfrac{3}{4}\:cup\: milk+1\: egg \rightarrow 8\: pancakes} \label{4.4.1} \]
Se forem necessárias duas dúzias de panquecas para um grande café da manhã em família, as quantidades de ingredientes devem ser aumentadas proporcionalmente de acordo com as quantidades fornecidas na receita. Por exemplo, o número de ovos necessários para fazer 24 panquecas é
\[\mathrm{24\: \cancel{pancakes} \times \dfrac{1\: egg}{8\: \cancel{pancakes}}=3\: eggs} \label{4.4.2} \]
Equações químicas balanceadas são usadas da mesma forma para determinar a quantidade de um reagente necessária para reagir com uma determinada quantidade de outro reagente, ou para produzir uma determinada quantidade de produto, e assim por diante. Os coeficientes na equação balanceada são usados para derivar fatores estequiométricos que permitem o cálculo da quantidade desejada. Para ilustrar essa ideia, considere a produção de amônia por reação de hidrogênio e nitrogênio:
\[\ce{N2}(g)+\ce{3H2}(g)\rightarrow \ce{2NH3}(g) \label{4.4.3} \]
Essa equação mostra que as moléculas de amônia são produzidas a partir de moléculas de hidrogênio na proporção de 2:3, e os fatores estequiométricos podem ser derivados usando qualquer unidade de quantidade (número):
\[\ce{\dfrac{2NH3 \: molecules}{3H2 \: molecules}\: or \: \dfrac{2 \: doz \: NH3\: molecules}{3\: doz\:H2 \:molecules} \: or \: \dfrac{2\: mol\: NH3\: molecules}{3\: mol\: H2\: molecules}} \label{4.4.4} \]
Esses fatores estequiométricos podem ser usados para calcular o número de moléculas de amônia produzidas a partir de um determinado número de moléculas de hidrogênio ou o número de moléculas de hidrogênio necessárias para produzir um determinado número de moléculas de amônia. Fatores similares podem ser derivados para qualquer par de substâncias em qualquer equação química.
Quantos moles de I 2 são necessários para reagir com 0,429 mol de Al de acordo com a seguinte equação (veja a Figura\(\PageIndex{2}\))?
\[\ce{2Al + 3I2 \rightarrow 2AlI3} \label{4.4.5} \]

Solução
Referindo-se à equação química balanceada, o fator estequiométrico que relaciona as duas substâncias de interesse é\(\ce{\dfrac{3\: mol\: I2}{2\: mol\: Al}}\). A quantidade molar de iodo é derivada multiplicando a quantidade molar fornecida de alumínio por esse fator:

\[\begin{align*} \mathrm{mol\: I_2} &=\mathrm{0.429\: \cancel{mol\: Al}\times \dfrac{3\: mol\: I_2}{2\:\cancel{mol\: Al}}} \\[4pt] &=\mathrm{0.644\: mol\: I_2} \end{align*} \nonumber \]
Quantos moles de Ca (OH) 2 são necessários para reagir com 1,36 mol de H 3 PO 4 para produzir Ca 3 (PO 4) 2 de acordo com a equação\(\ce{3Ca(OH)2 + 2H3PO4 \rightarrow Ca3(PO4)2 + 6H2O}\)?
- Resposta
-
2,04 ml
Quantas moléculas de dióxido de carbono são produzidas quando 0,75 mol de propano é queimado de acordo com essa equação?
\[\ce{C3H8 + 5O2 \rightarrow 3CO2 + 4H2O} \label{4.4.6} \]
Solução SS
A abordagem aqui é a mesma de Example\(\PageIndex{1}\), embora o número absoluto de moléculas seja solicitado, não o número de moles de moléculas. Isso simplesmente exigirá o uso do fator de conversão de moles em números, o número de Avogadro.
A equação balanceada mostra que o dióxido de carbono é produzido a partir do propano na proporção de 3:1:
\[\ce{\dfrac{3\: mol\: CO2}{1\: mol\: C3H8}} \label{4.4.7} \]
Usando esse fator estequiométrico, a quantidade molar fornecida de propano e o número de Avogadro,

\[\mathrm{0.75\: \cancel{mol\: C_3H_8}\times \dfrac{3\: \cancel{mol\: CO_2}}{1\:\cancel{mol\:C_3H_8}}\times \dfrac{6.022\times 10^{23}\:CO_2\:molecules}{\cancel{mol\:CO_2}}=1.4\times 10^{24}\:CO_2\:molecules} \label{4.4.8} \]
Quantas moléculas de NH 3 são produzidas pela reação de 4,0 mol de Ca (OH) 2 de acordo com a seguinte equação:
\[\ce{(NH4)2SO4 + Ca(OH)2 \rightarrow 2NH3 + CaSO4 + 2H2O} \label{4.4.9} \]
- Resposta
-
4,8 × 10 24 NH 3 moléculas
Esses exemplos ilustram a facilidade com que as quantidades de substâncias envolvidas em uma reação química de estequiometria conhecida podem estar relacionadas. Medir diretamente o número de átomos e moléculas, no entanto, não é uma tarefa fácil, e a aplicação prática da estequiometria requer que usemos a propriedade de massa mais facilmente medida.
Qual massa de hidróxido de sódio, NaOH, seria necessária para produzir 16 g do leite antiácido de magnésia [hidróxido de magnésio, Mg (OH) 2] pela seguinte reação?
Solução SS
A abordagem usada anteriormente em Exemplos\(\PageIndex{1}\) e também\(\PageIndex{2}\) é usada aqui; ou seja, devemos derivar um fator estequiométrico apropriado da equação química balanceada e usá-lo para relacionar as quantidades das duas substâncias de interesse. Nesse caso, no entanto, massas (não quantidades molares) são fornecidas e solicitadas, portanto, etapas adicionais do tipo aprendido no capítulo anterior são necessárias. Os cálculos necessários estão descritos neste fluxograma:
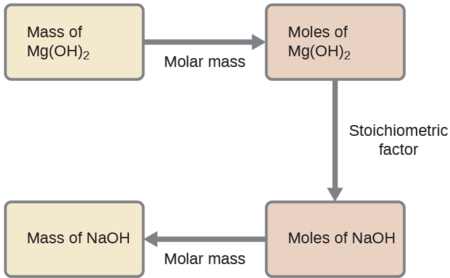
\[\mathrm{16\:\cancel{g\: Mg(OH)_2} \times \dfrac{1\:\cancel{mol\: Mg(OH)_2}}{58.3\:\cancel{g\: Mg(OH)_2}}\times \dfrac{2\:\cancel{mol\: NaOH}}{1\:\cancel{mol\: Mg(OH)_2}}\times \dfrac{40.0\: g\: NaOH}{\cancel{mol\: NaOH}}=22\: g\: NaOH} \nonumber \]
Que massa de óxido de gálio, Ga 2 O 3, pode ser preparada a partir de 29,0 g de metal de gálio? A equação para a reação é\(\ce{4Ga + 3O2 \rightarrow 2Ga2O3}\).
- Resposta
-
39,0 g
Qual massa de gás oxigênio, O 2, do ar é consumida na combustão de 702 g de octano, C 8 H 18, um dos principais componentes da gasolina?
\[\ce{2C8H18 + 25O2 \rightarrow 16CO2 + 18H2O} \nonumber \]
Solução SS
A abordagem exigida aqui é a mesma do Exemplo\(\PageIndex{3}\), diferindo apenas porque as massas fornecidas e solicitadas são ambas para espécies reagentes.
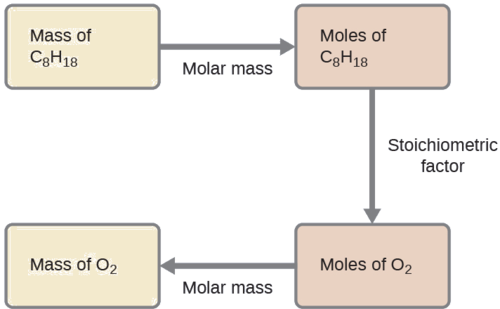
\(\mathrm{702\:\cancel{g\:\ce{C8H18}}\times \dfrac{1\:\cancel{mol\:\ce{C8H18}}}{114.23\:\cancel{g\:\ce{C8H18}}}\times \dfrac{25\:\cancel{mol\:\ce{O2}}}{2\:\cancel{mol\:\ce{C8H18}}}\times \dfrac{32.00\: g\:\ce{O2}}{\cancel{mol\:\ce{O2}}}=2.46\times 10^3\:g\:\ce{O2}}\)
Qual massa de CO é necessária para reagir com 25,13 g de Fe 2 O 3 de acordo com a equação\(\ce{Fe2O3 + 3CO \rightarrow 2Fe + 3CO2}\)?
- Resposta
-
13,22 g
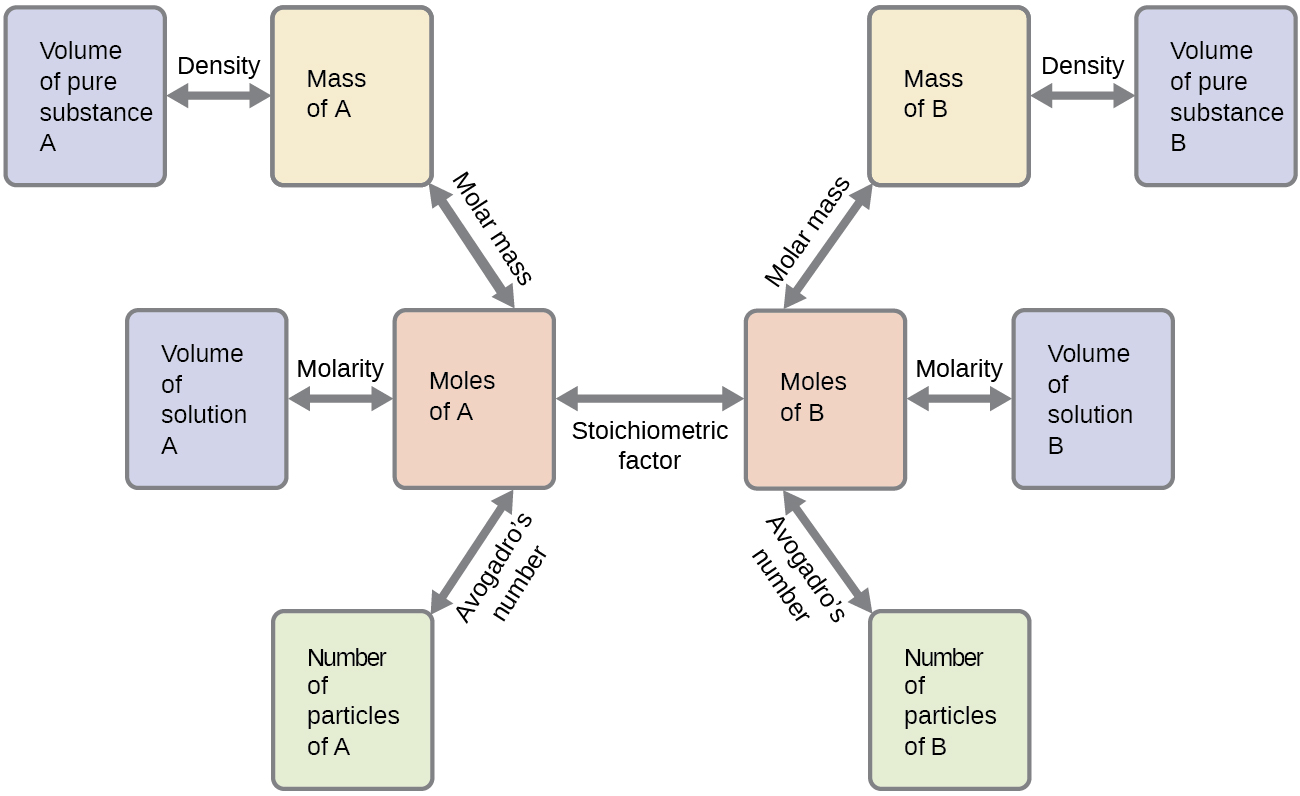
Esses exemplos ilustram apenas alguns exemplos de cálculos de estequiometria de reação. Inúmeras variações nas etapas computacionais iniciais e finais são possíveis, dependendo de quais quantidades específicas são fornecidas e buscadas (volumes, concentrações de soluções e assim por diante). Independentemente dos detalhes, todos esses cálculos compartilham um componente essencial comum: o uso de fatores estequiométricos derivados de equações químicas balanceadas. \(\PageIndex{2}\)A Figura fornece um esboço geral das várias etapas computacionais associadas a muitos cálculos de estequiometria de reação.
Os airbags (Figura\(\PageIndex{3}\)) são um recurso de segurança fornecido na maioria dos automóveis desde a década de 1990. A operação eficaz de um airbag exige que ele seja rapidamente inflado com uma quantidade (volume) adequada de gás quando o veículo estiver envolvido em uma colisão. Esse requisito é atendido em muitos sistemas de airbags automotivos por meio do uso de reações químicas explosivas, uma escolha comum é a decomposição da azida de sódio, NaN 3. Quando sensores no veículo detectam uma colisão, uma corrente elétrica passa por uma quantidade cuidadosamente medida de NaN 3 para iniciar sua decomposição:
\[\ce{2NaN3}(s)\rightarrow \ce{3N2}(g)+\ce{2Na}(s) \nonumber \]
Essa reação é muito rápida, gerando nitrogênio gasoso que pode implantar e inflar totalmente um airbag típico em uma fração de segundo (~0,03—0,1 s). Entre muitas considerações de engenharia, a quantidade de azida de sódio usada deve ser apropriada para gerar gás nitrogênio suficiente para inflar totalmente o airbag e garantir seu funcionamento adequado. Por exemplo, uma pequena massa (~ 100 g) de NaN 3 gerará aproximadamente 50 L de N 2.

Resumo
Uma equação química balanceada pode ser usada para descrever a estequiometria de uma reação (as relações entre quantidades de reagentes e produtos). Os coeficientes da equação são usados para derivar fatores estequiométricos que posteriormente podem ser usados para cálculos relacionados às massas do reagente e do produto, quantidades molares e outras propriedades quantitativas.
Glossário
- fator estequiométrico
- razão de coeficientes em uma equação química balanceada, usada em cálculos que relacionam quantidades de reagentes e produtos
- estequiometria
- relações entre as quantidades de reagentes e produtos de uma reação química


