4.2: Classificando reações químicas
- Page ID
- 185547
- Defina três tipos comuns de reações químicas (precipitação, ácido-base e redução de oxidação)
- Classifique as reações químicas como um desses três tipos, dadas as descrições ou equações químicas apropriadas
- Identifique ácidos e bases comuns
- Preveja a solubilidade de compostos inorgânicos comuns usando regras de solubilidade
- Calcule os estados de oxidação de elementos em compostos
Os humanos interagem uns com os outros de várias e complexas maneiras, e classificamos essas interações de acordo com padrões comuns de comportamento. Quando dois humanos trocam informações, dizemos que eles estão se comunicando. Quando eles trocam golpes com os punhos ou pés, dizemos que estão lutando. Diante de uma ampla gama de interações variadas entre substâncias químicas, os cientistas também acharam conveniente (ou mesmo necessário) classificar as interações químicas identificando padrões comuns de reatividade. Este módulo fornecerá uma introdução a três dos tipos mais comuns de reações químicas: precipitação, ácido-base e redução de oxidação.
Reações de precipitação e regras de solubilidade
Uma reação de precipitação é aquela em que substâncias dissolvidas reagem para formar um (ou mais) produtos sólidos. Muitas reações desse tipo envolvem a troca de íons entre compostos iônicos em solução aquosa e às vezes são chamadas de reações de duplo deslocamento, dupla substituição ou metátese. Essas reações são comuns na natureza e são responsáveis pela formação de recifes de coral nas águas oceânicas e cálculos renais em animais. Eles são amplamente utilizados na indústria para a produção de uma série de produtos químicos básicos e especiais. As reações de precipitação também desempenham um papel central em muitas técnicas de análise química, incluindo testes pontuais usados para identificar íons metálicos e métodos gravimétricos para determinar a composição da matéria (veja o último módulo deste capítulo).
A medida em que uma substância pode ser dissolvida em água, ou em qualquer solvente, é expressa quantitativamente como sua solubilidade, definida como a concentração máxima de uma substância que pode ser alcançada sob condições especificadas. Diz-se que substâncias com solubilidades relativamente grandes são solúveis. Uma substância precipitará quando as condições da solução forem tais que sua concentração exceda sua solubilidade. Diz-se que substâncias com solubilidades relativamente baixas são insolúveis, e essas são as substâncias que se precipitam rapidamente da solução. Mais informações sobre esses conceitos importantes são fornecidas no capítulo de texto sobre soluções. Para fins de previsão das identidades de sólidos formados por reações de precipitação, pode-se simplesmente referir-se aos padrões de solubilidade que foram observados para muitos compostos iônicos (Tabela\(\PageIndex{1}\)).
| Os compostos solúveis contêm | As exceções a essas regras de solubilidade incluem |
|
|
| Compostos insolúveis contêm | As exceções a essas regras de insolubilidade incluem |
|
|
Um exemplo vívido de precipitação é observado quando soluções de iodeto de potássio e nitrato de chumbo são misturadas, resultando na formação de iodeto de chumbo sólido:
\[\ce{2KI}(aq)+\ce{Pb(NO3)2}(aq)\rightarrow \ce{PbI2}(s)+\ce{2KNO3}(aq) \nonumber \]
Essa observação é consistente com as diretrizes de solubilidade: O único composto insolúvel entre todos os envolvidos é o iodeto de chumbo, uma das exceções à solubilidade geral dos sais de iodeto.
A equação iônica líquida que representa essa reação é:
\[\ce{Pb^2+}(aq)+\ce{2I-}(aq)\rightarrow \ce{PbI2}(s) \nonumber \]
O iodeto de chumbo é um sólido amarelo brilhante que foi usado anteriormente como pigmento artístico conhecido como amarelo iodo (Figura\(\PageIndex{1}\)). As propriedades dos cristais puros de PbI 2 os tornam úteis para a fabricação de detectores de raios X e raios gama.

As diretrizes de solubilidade na Tabela\(\PageIndex{1}\) podem ser usadas para prever se uma reação de precipitação ocorrerá quando soluções de compostos iônicos solúveis forem misturadas. Basta identificar todos os íons presentes na solução e, em seguida, considerar se um possível emparelhamento de cátion/ânion poderia resultar em um composto insolúvel. Por exemplo, misturar soluções de nitrato de prata e fluoreto de sódio produzirá uma solução contendo íons Ag +\(\ce{NO3-}\), Na + e F −. Além dos dois compostos iônicos originalmente presentes nas soluções, AgNO 3 e NaF, dois compostos iônicos adicionais podem ser derivados dessa coleção de íons: NaNO 3 e AgF. As diretrizes de solubilidade indicam que todos os sais de nitrato são solúveis, mas que o AgF é uma das exceções à solubilidade geral dos sais de flúor. Prevê-se, portanto, que ocorra uma reação de precipitação, conforme descrito pelas seguintes equações:
\[\ce{NaF}(aq)+\ce{AgNO3}(aq)\rightarrow \ce{AgF}(s)+\ce{NaNO3}(aq)\hspace{20px}\ce{(molecular)} \nonumber \]
\[\ce{Ag+}(aq)+\ce{F-}(aq)\rightarrow \ce{AgF}(s)\hspace{20px}\ce{(net\: ionic)} \nonumber \]
Preveja o resultado da mistura de soluções razoavelmente concentradas dos seguintes compostos iônicos. Se a precipitação for esperada, escreva uma equação iônica líquida balanceada para a reação.
- sulfato de potássio e nitrato de bário
- cloreto de lítio e acetato de prata
- nitrato de chumbo e carbonato de amônio
Solução
(a) Os dois produtos possíveis para essa combinação são KNO 3 e BaSO 4. As diretrizes de solubilidade indicam que o BaSO 4 é insolúvel e, portanto, uma reação de precipitação é esperada. A equação iônica líquida para esta reação, derivada da maneira detalhada no módulo anterior, é
\[\ce{Ba^2+}(aq)+\ce{SO4^2-}(aq)\rightarrow \ce{BaSO4}(s) \nonumber \]
(b) Os dois produtos possíveis para essa combinação são LiC 2 H 3 O 2 e AgCl. As diretrizes de solubilidade indicam que o AgCl é insolúvel e, portanto, uma reação de precipitação é esperada. A equação iônica líquida para esta reação, derivada da maneira detalhada no módulo anterior, é
\[\ce{Ag+}(aq)+\ce{Cl-}(aq)\rightarrow \ce{AgCl}(s) \nonumber \]
(c) Os dois produtos possíveis para essa combinação são PbCO 3 e NH 4 NO 3. As diretrizes de solubilidade indicam que o PbCO 3 é insolúvel e, portanto, uma reação de precipitação é esperada. A equação iônica líquida para esta reação, derivada da maneira detalhada no módulo anterior, é
\[\ce{Pb^2+}(aq)+\ce{CO3^2-}(aq)\rightarrow \ce{PbCO3}(s) \nonumber \]
Qual solução poderia ser usada para precipitar o íon bário, Ba 2 +, em uma amostra de água: cloreto de sódio, hidróxido de sódio ou sulfato de sódio? Qual é a fórmula para o precipitado esperado?
- Resposta
-
sulfato de sódio, BaSO 4
Reações ácido-base
Uma reação ácido-base é aquela em que um íon hidrogênio, H +, é transferido de uma espécie química para outra. Essas reações são de importância central para vários processos naturais e tecnológicos, desde as transformações químicas que ocorrem nas células e nos lagos e oceanos até a produção em escala industrial de fertilizantes, produtos farmacêuticos e outras substâncias essenciais para a sociedade. O assunto da química ácido-base, portanto, é digno de uma discussão completa, e um capítulo completo é dedicado a esse tópico posteriormente no texto.
Para fins desta breve introdução, consideraremos apenas os tipos mais comuns de reações ácido-base que ocorrem em soluções aquosas. Nesse contexto, um ácido é uma substância que se dissolve na água para produzir íons hidrônio, H 3 O +. Como exemplo, considere a equação mostrada aqui:
\[\ce{HCl}(aq)+\ce{H2O}(aq)\rightarrow \ce{Cl-}(aq)+\ce{H3O+}(aq) \nonumber \]
O processo representado por essa equação confirma que o cloreto de hidrogênio é um ácido. Quando dissolvidos em água, os íons H 3 O + são produzidos por uma reação química na qual os íons H + são transferidos das moléculas de HCl para as moléculas de H 2 O (Figura\(\PageIndex{2}\)).
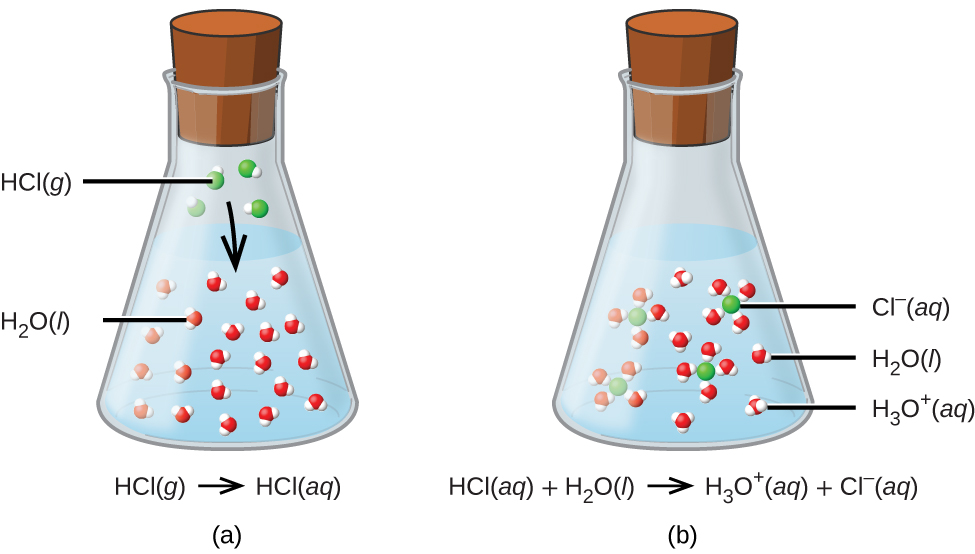
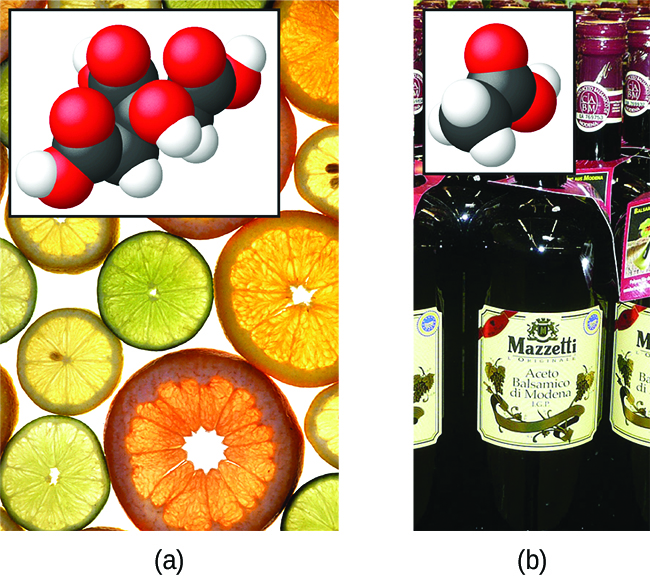
A natureza do HCl é tal que sua reação com a água, conforme descrito, é essencialmente 100% eficiente: praticamente todas as moléculas de HCl que se dissolvem na água sofrerão essa reação. Os ácidos que reagem completamente dessa maneira são chamados de ácidos fortes, e o HCl é um dos poucos compostos ácidos comuns que são classificados como fortes (Tabela\(\PageIndex{1}\)). Um número muito maior de compostos se comporta como ácidos fracos e reage apenas parcialmente com a água, deixando a grande maioria das moléculas dissolvidas em sua forma original e gerando uma quantidade relativamente pequena de íons hidrônio. Os ácidos fracos são comumente encontrados na natureza, sendo as substâncias parcialmente responsáveis pelo sabor picante das frutas cítricas, pela sensação de picadas de insetos e pelos cheiros desagradáveis associados ao odor corporal. Um exemplo familiar de ácido fraco é o ácido acético, o principal ingrediente dos vinagres alimentares:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{CH3CO2-}(aq)+\ce{H3O+}(aq) \nonumber \]
Quando dissolvidas em água em condições típicas, apenas cerca de 1% das moléculas de ácido acético estão presentes na forma ionizada\(\ce{CH3CO2-}\) (Figura\(\PageIndex{3}\)). (O uso de uma seta dupla na equação acima denota o aspecto de reação parcial desse processo, um conceito abordado totalmente nos capítulos sobre equilíbrio químico.)
| Fórmula composta | Nome em solução aquosa |
|---|---|
| HBr | ácido bromídrico |
| HCl | ácido clorídrico |
| OI | ácido hidroiódico |
| NÃO 3 | ácido nítrico |
| Chlo 4 | ácido perclórico |
| H 2 SO 4 | ácido sulfúrico |
Uma base é uma substância que se dissolve na água para produzir íons hidróxido, OH −. As bases mais comuns são compostos iônicos compostos por cátions de metais alcalinos ou alcalino-terrosos (grupos 1 e 2) combinados com o íon hidróxido—por exemplo, NaOH e Ca (OH) 2. Quando esses compostos se dissolvem na água, os íons hidróxido são liberados diretamente na solução. Por exemplo, KOH e Ba (OH) 2 se dissolvem em água e se dissociam completamente para produzir cátions (K + e Ba 2 +, respectivamente) e íons hidróxido, OH −. Essas bases, junto com outros hidróxidos que se dissociam completamente na água, são consideradas bases fortes.
Considere como exemplo a dissolução da soda cáustica (hidróxido de sódio) na água:
\[\ce{NaOH}(s)\rightarrow \ce{Na+}(aq)+\ce{OH-}(aq) \nonumber \]
Essa equação confirma que o hidróxido de sódio é uma base. Quando dissolvido em água, o NaOH se dissocia para produzir íons Na + e OH −. Isso também é verdade para qualquer outro composto iônico contendo íons hidróxido. Como o processo de dissociação é essencialmente completo quando os compostos iônicos se dissolvem na água sob condições típicas, o NaOH e outros hidróxidos iônicos são todos classificados como bases fortes.
Ao contrário dos hidróxidos iônicos, alguns compostos produzem íons hidróxido quando dissolvidos por reação química com moléculas de água. Em todos os casos, esses compostos reagem apenas parcialmente e, portanto, são classificados como bases fracas. Esses tipos de compostos também são abundantes na natureza e mercadorias importantes em várias tecnologias. Por exemplo, a produção global da amônia de base fraca é normalmente bem superior a 100 toneladas métricas por ano, sendo amplamente utilizada como fertilizante agrícola, matéria-prima para síntese química de outros compostos e ingrediente ativo em produtos de limpeza domésticos (Figura\(\PageIndex{4}\)). Quando dissolvida em água, a amônia reage parcialmente para produzir íons hidróxido, conforme mostrado aqui:
\[\ce{NH3}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{NH4+}(aq)+\ce{OH-}(aq) \nonumber \]
Esta é, por definição, uma reação ácido-base, neste caso envolvendo a transferência de íons H + de moléculas de água para moléculas de amônia. Em condições típicas, apenas cerca de 1% da amônia dissolvida está presente como\(\ce{NH4+}\) íons.

As reações químicas descritas nas quais ácidos e bases dissolvidos na água produzem íons hidrônio e hidróxido, respectivamente, são, por definição, reações ácido-base. Nessas reações, a água serve tanto como solvente quanto como reagente. Uma reação de neutralização é um tipo específico de reação ácido-base em que os reagentes são um ácido e uma base, os produtos geralmente são sal e água e nenhum dos reagentes é a própria água:
\[\mathrm{acid+base\rightarrow salt+water} \nonumber \]
Para ilustrar uma reação de neutralização, considere o que acontece quando um antiácido típico, como leite de magnésia (uma suspensão aquosa de Mg (OH) 2 sólido) é ingerido para aliviar os sintomas associados ao excesso de ácido estomacal (HCl):
\[\ce{Mg(OH)2}(s)+\ce{2HCl}(aq)\rightarrow \ce{MgCl2}(aq)+\ce{2H2O}(l). \nonumber \]
Observe que, além da água, essa reação produz um sal, o cloreto de magnésio.
Escreva equações químicas balanceadas para as reações ácido-base descritas aqui:
- o hipoclorito de hidrogênio de ácido fraco reage com a água
- uma solução de hidróxido de bário é neutralizada com uma solução de ácido nítrico
Solução
(a) Os dois reagentes são fornecidos, HOCl e H 2 O. Uma vez que a substância é relatada como sendo um ácido, sua reação com a água envolverá a transferência de H + de HOCl para H 2 O para gerar íons hidrônio, H 3 O + e íons hipoclorito, OCl − .
\[\ce{HOCl}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{OCl-}(aq)+\ce{H3O+}(aq) \nonumber \]
Uma seta dupla é apropriada nesta equação porque indica que o HOCl é um ácido fraco que não reagiu completamente.
(b) Os dois reagentes são fornecidos, Ba (OH) 2 e HNO 3. Como se trata de uma reação de neutralização, os dois produtos serão água e um sal composto pelo cátion do hidróxido iônico (Ba 2 +) e pelo ânion gerado quando o ácido transfere seu íon hidrogênio\(\ce{(NO3- )}\).
\[\ce{Ba(OH)2}(aq)+\ce{2HNO3}(aq)\rightarrow \ce{Ba(NO3)2}(aq)+\ce{2H2O}(l) \nonumber \]
Escreva a equação iônica líquida representando a neutralização de qualquer ácido forte com um hidróxido iônico. (Dica: considere os íons produzidos quando um ácido forte é dissolvido na água.)
- Resposta
-
\[\ce{H3O+}(aq)+\ce{OH-}(aq)\rightarrow \ce{2H2O}(l) \nonumber \]
Explore a visão microscópica de ácidos e bases fortes e fracos.
Reações de redução de oxidação
A atmosfera da Terra contém cerca de 20% de oxigênio molecular, O 2, um gás quimicamente reativo que desempenha um papel essencial no metabolismo de organismos aeróbios e em muitos processos ambientais que moldam o mundo. O termo oxidação foi originalmente usado para descrever reações químicas envolvendo O 2, mas seu significado evoluiu para se referir a uma ampla e importante classe de reações conhecida como reações de redução de oxidação (redox). Alguns exemplos de tais reações serão usados para desenvolver uma imagem clara dessa classificação.
Algumas reações redox envolvem a transferência de elétrons entre espécies de reagentes para produzir produtos iônicos, como a reação entre sódio e cloro para produzir cloreto de sódio:
\[\ce{2Na}(s)+\ce{Cl2}(g)\rightarrow \ce{2NaCl}(s) \nonumber \]
É útil visualizar o processo em relação a cada reagente individual, ou seja, representar o destino de cada reagente na forma de uma equação chamada meia-reação:
\[ \begin{align*} \ce{2Na}(s) &\rightarrow \ce{2Na+}(s)+\ce{2e-} \\[4pt] \ce{Cl2}(g)+\ce{2e-} &\rightarrow \ce{2Cl-}(s) \end{align*} \nonumber \]
Essas equações mostram que os átomos de Na perdem elétrons enquanto os átomos de Cl (na molécula de Cl 2) ganham elétrons, os subscritos “s” dos íons resultantes significando que eles estão presentes na forma de um composto iônico sólido. Para reações redox desse tipo, a perda e o ganho de elétrons definem os processos complementares que ocorrem:
\ (\ begin {align}
\ textbf {oxidação} &=\ textrm {perda de elétrons}\\
\ textbf {redução} &=\ textrm {ganho de elétrons}
\ end {align}\)
Nessa reação, então, o sódio é oxidado e o cloro sofre redução. Visto de uma perspectiva mais ativa, o sódio funciona como um agente redutor (redutor), pois fornece elétrons para (ou reduz) o cloro. Da mesma forma, o cloro funciona como um agente oxidante (oxidante), pois remove efetivamente os elétrons do (oxida) o sódio.
\ (\ begin {align}
\ textbf {agente redutor} &=\ textrm {espécie que é oxidada}\
\\ textbf {agente oxidante} &=\ textrm {espécie que é reduzida}
\ end {align}\)
Alguns processos redox, entretanto, não envolvem a transferência de elétrons. Considere, por exemplo, uma reação semelhante à que produz\(\ce{NaCl}\):
\[\ce{H2}(g)+\ce{Cl2}(g)\rightarrow \ce{2HCl}(g) \nonumber \]
O produto dessa reação é um composto covalente, portanto, a transferência de elétrons no sentido explícito não está envolvida. Para esclarecer a semelhança dessa reação com a anterior e permitir uma definição inequívoca de reações redox, uma propriedade chamada número de oxidação foi definida. O número de oxidação (ou estado de oxidação) de um elemento em um composto é a carga que seus átomos possuiriam se o composto fosse iônico. As diretrizes a seguir são usadas para atribuir números de oxidação a cada elemento em uma molécula ou íon.
- O número de oxidação de um átomo em uma substância elementar é zero.
- O número de oxidação de um íon monoatômico é igual à carga do íon.
- Os números de oxidação para não metais comuns geralmente são atribuídos da seguinte forma:
- Hidrogênio: +1 quando combinado com não metais, −1 quando combinado com metais
- Oxigênio: −2 na maioria dos compostos, às vezes −1 (os chamados peróxidos\(\ce{O2^2-}\)), muito raramente\(-\dfrac{1}{2}\) (os chamados superóxidos\(\ce{O2-}\)), valores positivos quando combinados com F (os valores variam)
- Halogênios: −1 para F sempre, −1 para outros halogênios, exceto quando combinados com oxigênio ou outros halogênios (números positivos de oxidação nesses casos, valores variáveis)
- A soma dos números de oxidação de todos os átomos em uma molécula ou íon poliatômico é igual à carga na molécula ou íon.
Nota: A convenção adequada para relatar a cobrança é escrever o número primeiro, seguido pelo sinal (por exemplo, 2+), enquanto o número de oxidação é escrito com a sequência invertida, sinal seguido pelo número (por exemplo, +2). Esta convenção visa enfatizar a distinção entre essas duas propriedades relacionadas.
Siga as diretrizes nesta seção do texto para atribuir números de oxidação a todos os elementos nas seguintes espécies:
- H 2 S
- \(\ce{SO3^2-}\)
- Na 2 OS 4
Solução
(a) De acordo com a diretriz 1, o número de oxidação para H é +1.
Usando esse número de oxidação e a fórmula do composto, a diretriz 4 pode então ser usada para calcular o número de oxidação do enxofre:
\(\ce{charge\: on\: H2S}=0=(2\times +1)+(1\times x)\)
\(x=0-(2\times +1)=-2\)
(b) A diretriz 3 sugere que o número de oxidação do oxigênio é −2.
Usando esse número de oxidação e a fórmula do íon, a diretriz 4 pode então ser usada para calcular o número de oxidação do enxofre:
\(\ce{charge\: on\: SO3^2-}=-2=(3\times -2)+(1\times x)\)
\(x=-2-(3\times -2)=+4\)
(c) Para compostos iônicos, é conveniente atribuir números de oxidação para o cátion e o ânion separadamente.
De acordo com a diretriz 2, o número de oxidação do sódio é +1.
Supondo o número de oxidação usual para oxigênio (−2 por diretriz 3), o número de oxidação para enxofre é calculado conforme indicado pela diretriz 4:
\(x=-2-(4\times -2)=+6\)
Atribua estados de oxidação aos elementos cujos átomos estão sublinhados em cada um dos seguintes compostos ou íons:
- K N O 3
- Todos os HP 3
- \(\mathrm{\underline{N}H_4^+}\)
- \(\mathrm{\sideset{ }{_{\large{4}}^{-}}{H_2\underline{P}O}}\)
- Responda a
-
NÃO, +5
- Resposta b
-
Todos, +3
- Resposta c
-
N, −3
- Resposta d
-
P, +5
Usando o conceito de número de oxidação, uma definição completa de reação redox foi estabelecida. As reações de oxidação-redução (redox) são aquelas em que um ou mais elementos envolvidos sofrem uma alteração no número de oxidação. Embora a grande maioria das reações redox envolva mudanças no número de oxidação de dois ou mais elementos, existem algumas exceções interessantes a essa regra, como mostrado abaixo\). As definições para os processos complementares dessa classe de reação são revisadas correspondentemente, conforme mostrado aqui:
\ [\ begin {align}
\ textbf {oxidação} &=\ textrm {aumento no número de oxidação}\\
\ textbf {redução} &=\ textrm {diminuição no número de oxidação}
\ end {align}\ nonumber\]
Voltando às reações usadas para introduzir esse tópico, agora ambas podem ser identificadas como processos redox. Na reação entre sódio e cloro para produzir cloreto de sódio, o sódio é oxidado (seu número de oxidação aumenta de 0 em Na para +1 em NaCl) e o cloro é reduzido (seu número de oxidação diminui de 0 em Cl 2 para −1 em NaCl). Na reação entre hidrogênio molecular e cloro, o hidrogênio é oxidado (seu número de oxidação aumenta de 0 em H 2 para +1 em HCl) e o cloro é reduzido (seu número de oxidação diminui de 0 em Cl 2 para −1 em HCl).
Várias subclasses de reações redox são reconhecidas, incluindo reações de combustão nas quais o redutor (também chamado de combustível) e o oxidante (frequentemente, mas não necessariamente, oxigênio molecular) reagem vigorosamente e produzem quantidades significativas de calor, e muitas vezes luz, na forma de uma chama. As reações sólidas de combustível de foguete, como a mostrada abaixo, são processos de combustão. Uma reação típica do propelente na qual o alumínio sólido é oxidado pelo perclorato de amônio é representada por esta equação:
\[\ce{10Al}(s)+\ce{6NH4ClO4}(s)\rightarrow \ce{4Al2O3}(s)+\ce{2AlCl3}(s)+\ce{12H2O}(g)+\ce{3N2}(g) \nonumber \]
Assista a um breve vídeo mostrando o teste de disparo de um protótipo de motor de foguete híbrido de pequena escala planejado para uso no novo Sistema de Lançamento Espacial que está sendo desenvolvido pela NASA. Os primeiros motores que disparam a 3 s (chama verde) usam uma mistura de combustível líquido/oxidante, e os segundos, motores mais potentes, disparando a 4 s (chama amarela), usam uma mistura sólida.
As reações de deslocamento único (substituição) são reações redox nas quais um íon em solução é deslocado (ou substituído) por meio da oxidação de um elemento metálico. Um exemplo comum desse tipo de reação é a oxidação ácida de certos metais:
\[\ce{Zn}(s)+\ce{2HCl}(aq)\rightarrow \ce{ZnCl2}(aq)+\ce{H2}(g) \nonumber \]
Elementos metálicos também podem ser oxidados por soluções de outros sais metálicos; por exemplo:
\[\ce{Cu}(s)+\ce{2AgNO3}(aq)\rightarrow \ce{Cu(NO3)2}(aq)+\ce{2Ag}(s) \nonumber \]
Essa reação pode ser observada colocando fio de cobre em uma solução contendo um sal de prata dissolvido. Os íons de prata em solução são reduzidos a prata elementar na superfície do fio de cobre, e os íons Cu 2+ resultantes se dissolvem na solução para produzir uma cor azul característica (Figura\(\PageIndex{4}\)).

Identifique quais equações representam reações redox, fornecendo um nome para a reação, se apropriado. Para as reações identificadas como redox, nomeie o oxidante e o redutor.
- \(\ce{ZnCO3}(s)\rightarrow \ce{ZnO}(s)+\ce{CO2}(g)\)
- \(\ce{2Ga}(l)+\ce{3Br2}(l)\rightarrow \ce{2GaBr3}(s)\)
- \(\ce{2H2O2}(aq)\rightarrow \ce{2H2O}(l)+\ce{O2}(g)\)
- \(\ce{BaCl2}(aq)+\ce{K2SO4}(aq)\rightarrow \ce{BaSO4}(s)+\ce{2KCl}(aq)\)
- \(\ce{C2H4}(g)+\ce{3O2}(g)\rightarrow \ce{2CO2}(g)+\ce{2H2O}(l)\)
Solução SS
As reações redox são identificadas por definição se um ou mais elementos sofrerem uma alteração no número de oxidação.
- Esta não é uma reação redox, pois os números de oxidação permanecem inalterados para todos os elementos.
- Essa é uma reação redox. O gálio é oxidado, seu número de oxidação aumenta de 0 em Ga (l) para +3 em GaBr 3 (s). O agente redutor é Ga (l). O bromo é reduzido, seu número de oxidação diminui de 0 em Br 2 (l) para −1 em GabR 3 (s). O agente oxidante é Br 2 (l).
- Essa é uma reação redox. É um processo particularmente interessante, pois envolve o mesmo elemento, o oxigênio, passando por oxidação e redução (a chamada reação de desproporção). O oxigênio é oxidado, seu número de oxidação aumenta de -1 em H 2 O 2 (aq) para 0 em O 2 (g). O oxigênio também é reduzido, seu número de oxidação diminui de -1 em H 2 O 2 (aq) para −2 em H 2 O (l). Para reações de desproporção, a mesma substância funciona como oxidante e redutor.
- Esta não é uma reação redox, pois os números de oxidação permanecem inalterados para todos os elementos.
- Esta é uma reação redox (combustão). O carbono é oxidado, seu número de oxidação aumenta de −2 em C 2 H 4 (g) para +4 em CO 2 (g). O agente redutor (combustível) é C 2 H 4 (g). O oxigênio é reduzido, seu número de oxidação diminui de 0 em O 2 (g) para −2 em H 2 O (l). O agente oxidante é O 2 (g).
Esta equação descreve a produção de cloreto de estanho (II):
\[\ce{Sn}(s)+\ce{2HCl}(g)\rightarrow \ce{SnCl2}(s)+\ce{H2}(g) \nonumber \]
Isso é uma reação redox? Em caso afirmativo, forneça um nome mais específico para a reação, se apropriado, e identifique o oxidante e o redutor.
- Resposta
-
Sim, uma única reação de substituição. Sn (s) é o redutor, HCl (g) é o oxidante.
Balanceamento de reações redox por meio do método de meia-reação
As reações redox que ocorrem em meio aquoso geralmente envolvem água, íons hidrônio e íons hidróxido como reagentes ou produtos. Embora essas espécies não sejam oxidadas ou reduzidas, elas participam da mudança química de outras formas (por exemplo, fornecendo os elementos necessários para formar oxiânions). Às vezes, as equações que representam essas reações são muito difíceis de equilibrar por inspeção, então abordagens sistemáticas foram desenvolvidas para auxiliar no processo. Uma abordagem muito útil é usar o método das meias-reações, que envolve as seguintes etapas:
- Escreva as duas meias-reações que representam o processo redox.
- Equilibre todos os elementos, exceto oxigênio e hidrogênio.
- Equilibre os átomos de oxigênio adicionando moléculas de H 2 O.
- Equilibre os átomos de hidrogênio adicionando íons H +.
- Equilibre a carga 1 adicionando elétrons.
- Se necessário, multiplique os coeficientes de cada meia reação pelos menores números inteiros possíveis para produzir números iguais de elétrons em cada um.
- Adicione as meias-reações balanceadas e simplifique removendo as espécies que aparecem nos dois lados da equação.
- Para reações que ocorrem em meios básicos (excesso de íons hidróxido), execute estas etapas adicionais:
- Adicione íons OH − aos dois lados da equação em números iguais ao número de íons H +.
- No lado da equação contendo íons H + e OH −, combine esses íons para produzir moléculas de água.
- Simplifique a equação removendo todas as moléculas de água redundantes.
- Por fim, verifique se o número de átomos e as cargas totais 2 estão balanceados.
Escreva uma equação balanceada para a reação entre o íon dicromato e o ferro (II) para produzir ferro (III) e cromo (III) em solução ácida.
\[\ce{Cr2O7^2- + Fe^2+ \rightarrow Cr^3+ + Fe^3+} \nonumber \]
Solução SS
Escreva as duas meias-reações.
Cada meia-reação conterá um reagente e um produto com um elemento em comum.
\(\ce{Cr2O7^2- \rightarrow Cr^3+}\)
Equilibre todos os elementos, exceto oxigênio e hidrogênio. A meia-reação de ferro já está equilibrada, mas a meia-reação de cromo mostra dois átomos de Cr à esquerda e um átomo de Cr à direita. Alterar o coeficiente no lado direito da equação para 2 alcança o equilíbrio em relação aos átomos de Cr.
\(\ce{Cr2O7^2- \rightarrow 2Cr^3+}\)
Equilibre os átomos de oxigênio adicionando moléculas de H 2 O. A meia-reação do ferro não contém átomos de O. A meia-reação de cromo mostra sete átomos de O à esquerda e nenhum à direita, então sete moléculas de água são adicionadas ao lado direito.
\(\ce{Cr2O7^2- \rightarrow 2Cr^3+ + 7H2O}\)
Equilibre os átomos de hidrogênio adicionando íons H +. A meia-reação do ferro não contém átomos de H. A meia-reação de cromo mostra 14 átomos de H à direita e nenhum à esquerda, então 14 íons de hidrogênio são adicionados ao lado esquerdo.
\(\ce{Cr2O7^2- + 14H+ \rightarrow 2Cr^3+ + 7H2O}\)
Equilibre a carga adicionando elétrons. A meia-reação do ferro mostra uma carga total de 2+ no lado esquerdo (1 íon Fe 2+) e 3+ no lado direito (1 íon Fe 3+). Adicionar um elétron ao lado direito traz a carga total desse lado para (3+) + (1−) = 2+, e o equilíbrio de carga é alcançado.
A meia-reação de cromo mostra uma carga total de (1 × 2−) + (14 × 1+) = 12+ no lado esquerdo (\(\ce{1 Cr2O7^2-}\)íon e 14 íons H +). A carga total no lado direito é (2 × 3+) = 6 + (2 íons Cr 3 +). Adicionar seis elétrons ao lado esquerdo fará com que a carga total desse lado seja (12+ + 6−) = 6+, e o equilíbrio da carga será alcançado.
\(\ce{Fe^2+ \rightarrow Fe^3+ + e-}\)
\(\ce{Cr2O7^2- + 14H+ + 6e- \rightarrow 2Cr^3+ + 7H2O}\)
Multiplique as duas meias-reações para que o número de elétrons em uma reação seja igual ao número de elétrons na outra reação. Para ser consistente com a conservação de massa e a ideia de que as reações redox envolvem a transferência (não a criação ou destruição) de elétrons, o coeficiente da meia-reação do ferro deve ser multiplicado por 6.
\(\ce{6Fe^2+ \rightarrow 6Fe^3+ + 6e-}\)
\(\ce{Cr2O7^2- + 6e- + 14H+ \rightarrow 2Cr^3+ + 7H2O}\)
Adicione as meias-reações balanceadas e cancele as espécies que aparecem nos dois lados da equação.
\[\ce{6Fe^2+ + Cr2O7^2- + 6e- + 14H+ \rightarrow 6Fe^3+ + 6e- + 2Cr^3+ + 7H2O} \nonumber \]
Somente os seis elétrons são espécies redundantes. Removê-los de cada lado da equação produz a equação simplificada e balanceada aqui:
\[\ce{6Fe^2+ + Cr2O7^2- + 14H+ \rightarrow 6Fe^3+ + 2Cr^3+ + 7H2O} \nonumber \]
Uma verificação final do equilíbrio do átomo e da carga confirma que a equação está balanceada.
| Reagentes | Produtos | |
|---|---|---|
| Fe | 6 | 6 |
| Cr | 2 | 2 |
| O | 7 | 7 |
| H | 14 | 14 |
| cobrar | 24+ | 24+ |
Em solução ácida, o peróxido de hidrogênio reage com Fe 2 + para produzir Fe 3 + e H 2 O. Escreva uma equação balanceada para esta reação.
- Resposta
-
\[\ce{H2O2}(aq)+\ce{2H+}(aq)+\ce{2Fe^2+} \rightarrow \ce{2H2O}(l)+\ce{2Fe^3+} \nonumber \]
Resumo
As reações químicas são classificadas de acordo com padrões similares de comportamento. Um grande número de reações importantes está incluído em três categorias: precipitação, ácido-base e redução de oxidação (redox). As reações de precipitação envolvem a formação de um ou mais produtos insolúveis. As reações ácido-base envolvem a transferência de íons de hidrogênio entre os reagentes. As reações redox envolvem uma mudança no número de oxidação de um ou mais elementos reagentes. Escrever equações balanceadas para algumas reações redox que ocorrem em soluções aquosas é simplificado usando uma abordagem sistemática chamada método de meia reação.
Notas de pé
- 1 O requisito de “equilíbrio de carga” é apenas um tipo específico de “balanço de massa” no qual as espécies em questão são elétrons. Uma equação deve representar números iguais de elétrons nos lados do reagente e do produto e, portanto, tanto os átomos quanto as cargas devem ser balanceados.
- 2 O requisito de “equilíbrio de carga” é apenas um tipo específico de “balanço de massa” no qual as espécies em questão são elétrons. Uma equação deve representar números iguais de elétrons nos lados do reagente e do produto e, portanto, tanto os átomos quanto as cargas devem ser balanceados.
Glossário
- ácido
- substância que produz H 3 O + quando dissolvida em água
- reação ácido-base
- reação envolvendo a transferência de um íon hidrogênio entre espécies reagentes
- base
- substância que produz OH − quando dissolvida em água
- reação de combustão
- reação redox vigorosa produzindo quantidades significativas de energia na forma de calor e, às vezes, luz
- meia reação
- uma equação que mostra se cada reagente perde ou ganha elétrons em uma reação.
- insolúvel
- de solubilidade relativamente baixa; dissolvendo apenas em pequena medida
- reação de neutralização
- reação entre um ácido e uma base para produzir sal e água
- oxidação
- processo no qual o número de oxidação de um elemento é aumentado pela perda de elétrons
- reação de redução de oxidação
- (também, reação redox) reação envolvendo uma mudança no número de oxidação para um ou mais elementos reagentes
- número de oxidação
- (também, estado de oxidação) a carga que cada átomo de um elemento teria em um composto se o composto fosse iônico
- agente oxidante
- (também, oxidante) substância que provoca a oxidação de outra substância e, no processo, se reduz
- precipitado
- produto insolúvel que se forma a partir da reação de reagentes solúveis
- reação de precipitação
- reação que produz um ou mais produtos insolúveis; quando os reagentes são compostos iônicos, às vezes chamados de duplo deslocamento ou metátese
- redução
- processo no qual o número de oxidação de um elemento é diminuído pelo ganho de elétrons
- agente redutor
- substância (também redutora) que provoca a redução de outra substância e, no processo, se oxida
- sal
- composto iônico que pode ser formado pela reação de um ácido com uma base que contém um cátion e um ânion que não seja hidróxido ou óxido
- reação de deslocamento único
- (também, substituição) reação redox envolvendo a oxidação de uma substância elementar por uma espécie iônica
- solúvel
- de solubilidade relativamente alta; dissolução em uma extensão relativamente grande
- solubilidade
- até que ponto uma substância pode ser dissolvida em água ou em qualquer solvente
- ácido forte
- ácido que reage completamente quando dissolvido em água para produzir íons hidrônio
- base forte
- base que reage completamente quando dissolvida em água para produzir íons hidróxido
- ácido fraco
- ácido que reage apenas ligeiramente quando dissolvido em água para produzir íons hidrônio
- base fraca
- base que reage apenas ligeiramente quando dissolvida em água para produzir íons hidróxido

