4.1: Escrevendo e balanceando equações químicas
- Page ID
- 185548
- Derive equações químicas a partir de descrições narrativas de reações químicas.
- Escreva e balanceie equações químicas nos formatos molecular, iônico total e iônico líquido.
O capítulo anterior introduziu o uso de símbolos de elementos para representar átomos individuais. Quando os átomos ganham ou perdem elétrons para produzir íons, ou se combinam com outros átomos para formar moléculas, seus símbolos são modificados ou combinados para gerar fórmulas químicas que representem adequadamente essas espécies. Estender esse simbolismo para representar as identidades e as quantidades relativas de substâncias que sofrem uma mudança química (ou física) envolve escrever e equilibrar uma equação química. Considere como exemplo a reação entre uma molécula de metano (CH 4) e duas moléculas diatômicas de oxigênio (O 2) para produzir uma molécula de dióxido de carbono (CO 2) e duas moléculas de água (H 2 O). A equação química que representa esse processo é fornecida na metade superior da Figura\(\PageIndex{1}\), com modelos moleculares de preenchimento de espaço mostrados na metade inferior da figura.
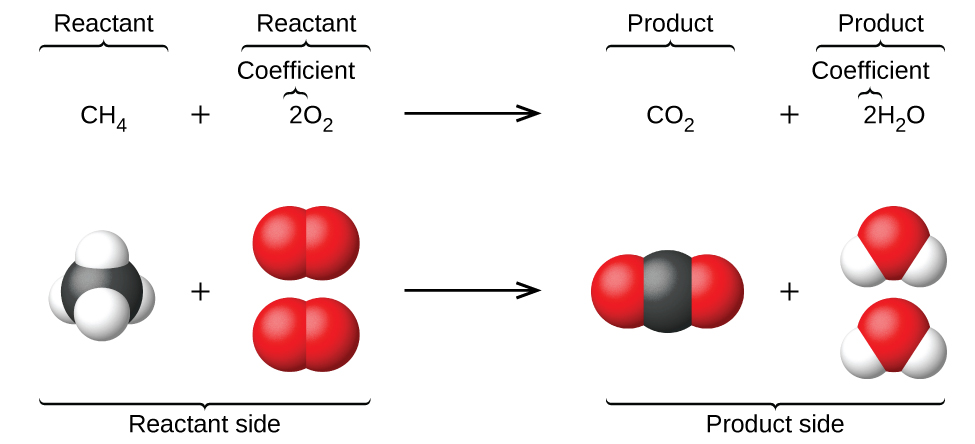
Este exemplo ilustra os aspectos fundamentais de qualquer equação química:
- As substâncias em reação são chamadas de reagentes e suas fórmulas são colocadas no lado esquerdo da equação.
- As substâncias geradas pela reação são chamadas de produtos e suas fórmulas são colocadas à vista correta da equação.
- Os sinais de adição (+) separam as fórmulas individuais do reagente e do produto, e uma seta (⟶) separa os lados do reagente e do produto (esquerdo e direito) da equação.
- Os números relativos de espécies de reagentes e produtos são representados por coeficientes (números colocados imediatamente à esquerda de cada fórmula). Normalmente, um coeficiente de 1 é omitido.
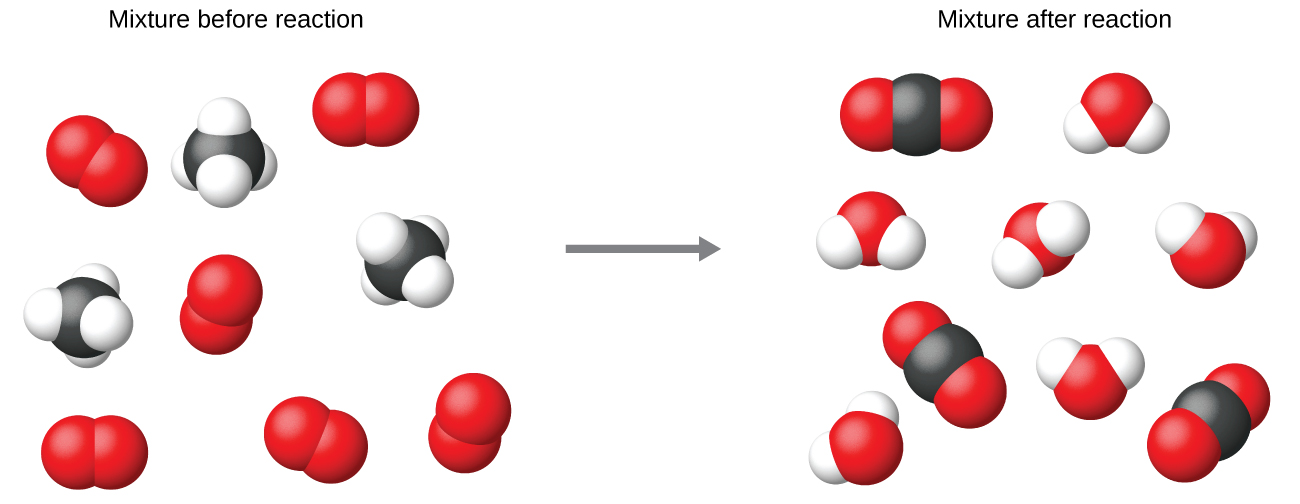
É prática comum usar os menores coeficientes de número inteiro possíveis em uma equação química, como é feito neste exemplo. Perceba, no entanto, que esses coeficientes representam o número relativo de reagentes e produtos e, portanto, podem ser interpretados corretamente como proporções. O metano e o oxigênio reagem para produzir dióxido de carbono e água na proporção de 1:2:1:2. Essa proporção é satisfeita se o número dessas moléculas for, respectivamente, 1-2-1-2, ou 2-4-2-4, ou 3-6-3-6, e assim por diante (Figura\(\PageIndex{2}\)). Da mesma forma, esses coeficientes podem ser interpretados em relação a qualquer unidade de quantidade (número) e, portanto, essa equação pode ser lida corretamente de várias maneiras, incluindo:
- Uma molécula de metano e duas moléculas de oxigênio reagem para produzir uma molécula de dióxido de carbono e duas moléculas de água.
- Uma dúzia de moléculas de metano e duas dezenas de moléculas de oxigênio reagem para produzir uma dúzia de moléculas de dióxido de carbono e duas dúzias de moléculas de água.
- Um mol de moléculas de metano e 2 moles de moléculas de oxigênio reagem para produzir 1 mol de moléculas de dióxido de carbono e 2 moles de moléculas de água.
Equações de balanceamento
Quando uma equação química é balanceada, significa que números iguais de átomos para cada elemento envolvido na reação são representados nos lados do reagente e do produto. Esse é um requisito que a equação deve satisfazer para ser consistente com a lei de conservação da matéria. Isso pode ser confirmado simplesmente somando o número de átomos em cada lado da seta e comparando essas somas para garantir que sejam iguais. Observe que o número de átomos de um determinado elemento é calculado multiplicando o coeficiente de qualquer fórmula que contenha esse elemento pelo subscrito do elemento na fórmula. Se um elemento aparecer em mais de uma fórmula em um determinado lado da equação, o número de átomos representados em cada um deve ser calculado e depois somado. Por exemplo, ambas as espécies de produtos na reação de exemplo\(\ce{CO2}\) e\(\ce{H2O}\), contêm o elemento oxigênio e, portanto, o número de átomos de oxigênio no lado do produto da equação é
\[\left(1\: \cancel{\ce{CO_2} \: \text{molecule}} \times \dfrac{2\: \ce{O} \: \text{atoms}}{ \cancel{\ce{CO_2} \: \text{molecule}}}\right) + \left( \cancel{ \ce{2H_2O} \: \text{molecule} }\times \dfrac{1\: \ce{O}\: \text{atom}}{\cancel{ \ce{H_2O} \: \text{molecule}}}\right)=4\: \ce{O} \: \text{atoms} \nonumber \]
A equação para a reação entre metano e oxigênio para produzir dióxido de carbono e água é confirmada como balanceada por essa abordagem, conforme mostrado aqui:
\[\ce{CH4 +2O2\rightarrow CO2 +2H2O} \nonumber \]
| Elemento | Reagentes | Produtos | Balanceado? |
|---|---|---|---|
| C | 1 × 1 = 1 | 1 × 1 = 1 | 1 = 1, sim |
| H | 4 × 1 = 4 | 2 × 2 = 4 | 4 = 4, sim |
| O | 2 × 2 = 4 | (1 × 2) + (2 × 1) = 4 | 4 = 4, sim |
Uma equação química balanceada geralmente pode ser derivada de uma descrição qualitativa de alguma reação química por uma abordagem bastante simples conhecida como balanceamento por inspeção. Considere como exemplo a decomposição da água para produzir hidrogênio e oxigênio moleculares. Esse processo é representado qualitativamente por uma equação química desequilibrada:
\[\ce{H2O \rightarrow H2 + O2} \tag{unbalanced} \]
Comparar o número de átomos de H e O em ambos os lados dessa equação confirma seu desequilíbrio:
| Elemento | Reagentes | Produtos | Balanceado? |
|---|---|---|---|
| H | 1 × 2 = 2 | 1 × 2 = 2 | 2 = 2, sim |
| O | 1 × 1 = 1 | 1 × 2 = 2 | 1 ≠ 2, não |
O número de átomos de H nos lados do reagente e do produto da equação é igual, mas o número de átomos O não. Para alcançar o equilíbrio, os coeficientes da equação podem ser alterados conforme necessário. Lembre-se, é claro, de que os subscritos da fórmula definem, em parte, a identidade da substância e, portanto, eles não podem ser alterados sem alterar o significado qualitativo da equação. Por exemplo, mudar a fórmula do reagente de H 2 O para H 2 O 2 produziria equilíbrio no número de átomos, mas isso também altera a identidade do reagente (agora é peróxido de hidrogênio e não água). O equilíbrio do átomo O pode ser alcançado alterando o coeficiente de H 2 O para 2.
\[\ce{2H2O \rightarrow H2 + O2} \tag{unbalanced} \]
| Elemento | Reagentes | Produtos | Balanceado? |
|---|---|---|---|
| H | 2 × 2 = 4 | 1 × 2 = 2 | 4 ≠ 2, não |
| O | 2 × 1 = 2 | 1 × 2 = 2 | 2 = 2, sim |
O equilíbrio do átomo H foi alterado por essa mudança, mas é facilmente restabelecido alterando o coeficiente do produto H 2 para 2.
\[\ce{2H_2O \rightarrow 2H2 + O2} \tag{balanced} \]
| Elemento | Reagentes | Produtos | Balanceado? |
|---|---|---|---|
| H | 2 × 2 = 4 | 2 × 2 = 2 | 4 = 4, sim |
| O | 2 × 1 = 2 | 1 × 2 = 2 | 2 = 2, sim |
Esses coeficientes produzem números iguais de átomos de H e O nos lados do reagente e do produto, e a equação balanceada é, portanto:
\[\ce{2H_2O \rightarrow 2H_2 + O_2} \nonumber \]
Escreva uma equação balanceada para a reação de nitrogênio molecular (N 2) e oxigênio (O 2) para formar pentóxido de dinitrogênio.
Solução
Primeiro, escreva a equação desequilibrada.
\[\ce{N_2 + O_2 \rightarrow N_2O_5} \tag{unbalanced} \]
Em seguida, conte o número de cada tipo de átomo presente na equação desbalanceada.
| Elemento | Reagentes | Produtos | Balanceado? |
|---|---|---|---|
| N | 1 × 2 = 2 | 1 × 2 = 2 | 2 = 2, sim |
| O | 1 × 2 = 2 | 1 × 5 = 5 | 2 ≠ 5, não |
Embora o nitrogênio seja balanceado, mudanças nos coeficientes são necessárias para equilibrar o número de átomos de oxigênio. Para equilibrar o número de átomos de oxigênio, uma primeira tentativa razoável seria alterar os coeficientes de O 2 e N 2 O 5 para números inteiros que produzirão átomos de 10 O (o múltiplo menos comum para os subscritos do átomo O nessas duas fórmulas).
\[\ce{N_2 + 5 O2 \rightarrow 2 N2O5} \tag{unbalanced} \]
| Elemento | Reagentes | Produtos | Balanceado? |
|---|---|---|---|
| N | 1 × 2 = 2 | 2 × 2 = 4 | 2 ≠ 4, não |
| O | 5 × 2 = 10 | 2 × 5 = 10 | 10 = 10, sim |
O equilíbrio do átomo de N foi alterado por essa mudança; ele é restaurado alterando o coeficiente do reagente N 2 para 2.
\[\ce{2N_2 + 5O_2\rightarrow 2N_2O_5} \nonumber \]
| Elemento | Reagentes | Produtos | Balanceado? |
|---|---|---|---|
| N | 2 × 2 = 4 | 2 × 2 = 4 | 4 = 4, sim |
| O | 5 × 2 = 10 | 2 × 5 = 10 | 10 = 10, sim |
Os números dos átomos N e O em cada lado da equação agora são iguais e, portanto, a equação está balanceada.
Escreva uma equação balanceada para a decomposição do nitrato de amônio para formar nitrogênio molecular, oxigênio molecular e água. (Dica: equilibre o oxigênio por último, pois ele está presente em mais de uma molécula no lado direito da equação.)
- Responda
-
\[\ce{2NH4NO3 \rightarrow 2N2 + O2 + 4H2O} \nonumber \]
Reações de equilíbrio que contêm poliatômica: reações de equilíbrio que contêm poliatômica (abre em nova janela) [youtu.be]
Às vezes, é conveniente usar frações em vez de números inteiros como coeficientes intermediários no processo de balanceamento de uma equação química. Quando o equilíbrio é alcançado, todos os coeficientes da equação podem então ser multiplicados por um número inteiro para converter os coeficientes fracionários em números inteiros sem alterar o equilíbrio atômico. Por exemplo, considere a reação do etano (C 2 H 6) com o oxigênio para produzir H 2 O e CO 2, representada pela equação desbalanceada:
\[\ce{C_2H_6 + O_2 \rightarrow H_2O + CO_2} \tag{unbalanced} \]
Seguindo a abordagem usual de inspeção, pode-se primeiro equilibrar os átomos C e H alterando os coeficientes das duas espécies de produtos, conforme mostrado:
\[\ce{C_2H_6 + O_2 \rightarrow 3H_2O + 2CO_2} \tag{unbalanced} \]
Isso resulta em sete átomos O no lado do produto da equação, um número ímpar — nenhum coeficiente inteiro pode ser usado com o reagente O 2 para produzir um número ímpar, então um coeficiente fracionário,\(\ce{7/2}\), é usado para produzir uma equação balanceada provisória:
\[\ce{C2H6 + 7/2 O2\rightarrow 3H2O + 2CO2} \nonumber \]
Uma equação balanceada convencional com coeficientes somente de números inteiros é derivada multiplicando cada coeficiente por 2:
\[\ce{2C2H6 +7O2\rightarrow 6H2O + 4CO2} \nonumber \]
Finalmente, com relação às equações balanceadas, lembre-se de que a convenção determina o uso dos menores coeficientes de número inteiro. Embora a equação para a reação entre nitrogênio molecular e hidrogênio molecular para produzir amônia seja, de fato, equilibrada,
\[\ce{3N2 +9H2\rightarrow 6NH3} \nonumber \]
os coeficientes não são os menores números inteiros possíveis representando os números relativos das moléculas do reagente e do produto. Dividindo cada coeficiente pelo maior fator comum, 3, dá a equação preferida:
\[\ce{N2 + 3H2\rightarrow 2NH3} \nonumber \]
Use este tutorial interativo para praticar equações adicionais de balanceamento.
Informações adicionais sobre equações químicas
Os estados físicos dos reagentes e produtos nas equações químicas muitas vezes são indicados com uma abreviatura entre parênteses após as fórmulas. As abreviações comuns incluem s para sólidos, l para líquidos, g para gases e aq para substâncias dissolvidas em água (soluções aquosas, conforme apresentado no capítulo anterior). Essas notações são ilustradas na equação de exemplo aqui:
\[\ce{2Na (s) + 2H2O (l) \rightarrow 2NaOH (aq) + H2(g)} \nonumber \]
Essa equação representa a reação que ocorre quando o metal de sódio é colocado na água. O sódio sólido reage com a água líquida para produzir gás hidrogênio molecular e o composto iônico hidróxido de sódio (um sólido na forma pura, mas prontamente dissolvido em água).
Às vezes, as condições especiais necessárias para uma reação são designadas escrevendo uma palavra ou símbolo acima ou abaixo da seta da equação. Por exemplo, uma reação realizada por aquecimento pode ser indicada pela letra maiúscula grega delta (Δ) sobre a seta.
\[\ce{CaCO3}(s)\xrightarrow{\:\Delta\:} \ce{CaO}(s)+\ce{CO2}(g) \nonumber \]
Outros exemplos dessas condições especiais serão encontrados com mais profundidade nos capítulos posteriores.
Equações para reações iônicas
Dada a abundância de água na Terra, é lógico que muitas reações químicas ocorram em meio aquoso. Quando os íons estão envolvidos nessas reações, as equações químicas podem ser escritas com vários níveis de detalhes apropriados ao uso pretendido. Para ilustrar isso, considere uma reação entre compostos iônicos ocorrendo em uma solução aquosa. Quando soluções aquosas de\(\ce{CaCl2}\) e\(\ce{AgNO3}\) são misturadas, ocorre uma reação produzindo água\(\ce{Ca(NO3)2}\) e sólido\(\ce{AgCl}\):
\[\ce{CaCl2}(aq)+\ce{2AgNO3}(aq)\rightarrow \ce{Ca(NO3)2}(aq)+\ce{2AgCl}(s) \nonumber \]
Essa equação balanceada, derivada da maneira usual, é chamada de equação molecular porque não representa explicitamente as espécies iônicas presentes na solução. Quando os compostos iônicos se dissolvem na água, eles podem se dissociar em seus íons constituintes, que são posteriormente dispersos homogeneamente por toda a solução resultante (uma discussão completa desse importante processo é fornecida no capítulo sobre soluções). Os compostos iônicos dissolvidos em água são, portanto, representados de forma mais realista como íons dissociados, neste caso:
\[\ce{CaCl2}(aq)\rightarrow \ce{Ca^2+}(aq)+\ce{2Cl-}(aq) \nonumber \]
\[\ce{2AgNO3}(aq)\rightarrow \ce{2Ag+}(aq)+\ce{2NO3-}(aq) \nonumber \]
\[\ce{Ca(NO3)2}(aq)\rightarrow \ce{Ca^2+}(aq)+\ce{2NO3-}(aq) \nonumber \]
Ao contrário desses três compostos iônicos, o AgCl não se dissolve na água em uma extensão significativa, conforme significa sua notação de estado físico, (s).
Representar explicitamente todos os íons dissolvidos resulta em uma equação iônica completa. Nesse caso específico, as fórmulas para os compostos iônicos dissolvidos são substituídas por fórmulas para seus íons dissociados:
\[\ce{Ca^2+}(aq)+\ce{2Cl-}(aq)+\ce{2Ag+}(aq)+\ce{2NO3-}(aq)\rightarrow \ce{Ca^2+}(aq)+\ce{2NO3-}(aq)+\ce{2AgCl}(s) \nonumber \]
O exame dessa equação mostra que duas espécies químicas estão presentes de forma idêntica em ambos os lados da flecha,\(\ce{Ca^{2+}(aq)}\)\(\ce{NO3-}(aq)\) e. Esses íons espectadores - íons cuja presença é necessária para manter a neutralidade da carga - não são alterados química nem fisicamente pelo processo e, portanto, podem ser eliminados da equação para produzir uma representação mais sucinta chamada equação iônica líquida:
\[\cancel{\ce{Ca^2+}(aq)}+\ce{2Cl-}(aq)+\ce{2Ag+}(aq)+\cancel{\ce{2NO3-}(aq)}\rightarrow \cancel{\ce{Ca^2+}(aq)}+\cancel{\ce{2NO3-}(aq)}+\ce{2AgCl}(s) \nonumber \]
\[\ce{2Cl-}(aq)+\ce{2Ag+}(aq)\rightarrow \ce{2AgCl}(s) \nonumber \]
Seguindo a convenção de usar os menores números inteiros possíveis como coeficientes, essa equação é então escrita:
\[\ce{Cl-}(aq)+\ce{Ag+}(aq)\rightarrow \ce{AgCl}(s) \nonumber \]
Essa equação iônica líquida indica que o cloreto de prata sólido pode ser produzido a partir de cloreto dissolvido e íons de prata (I), independentemente da fonte desses íons. Essas equações iônicas moleculares e completas fornecem informações adicionais, nomeadamente, os compostos iônicos usados como fontes de\(\ce{Cl^{−}}\)\(\ce{Ag+}\) e.
Quando o dióxido de carbono é dissolvido em uma solução aquosa de hidróxido de sódio, a mistura reage para produzir carbonato de sódio aquoso e água líquida. Escreva equações moleculares balanceadas, iônicas completas e iônicas líquidas para esse processo.
Solução
Comece identificando fórmulas para os reagentes e produtos e organizando-as adequadamente na forma de equações químicas:
\[\ce{CO2(aq) + NaOH(aq) \rightarrow Na2CO3(aq) + H2O(l)} \tag{unbalanced} \]
O equilíbrio é alcançado facilmente neste caso alterando o coeficiente de NaOH para 2, resultando na equação molecular para esta reação:
\[\ce{CO2(aq)+2NaOH(aq)\rightarrow Na2CO3(aq) + H2O}(l) \nonumber \]
Os dois compostos iônicos dissolvidos, NaOH e Na 2 CO 3, podem ser representados como íons dissociados para produzir a equação iônica completa:
\[\ce{CO2 (aq) + 2Na+ (aq) + 2OH- (aq) \rightarrow 2Na+ (aq) + CO3^{2-} (aq) + H2O (l)} \nonumber \]
Finalmente, identifique o (s) íon (s) espectador (s), neste caso Na + (aq), e remova-o de cada lado da equação para gerar a equação iônica líquida:
\ [\ begin {align*}
\ ce {CO2} (aq) +\ cancel {\ ce {2Na+} (aq)} +\ ce {2OH-} (aq) e\ rightarrow\ cancel {\ ce {2Na+} (aq)} +\ ce {CO3^2-} (aq) +\ ce {H2O} (l)\\\ ce {H2O} (l)\\
\ ce {H2O} (l)\\\ ce {CO2} (aq) +\ ce {2OH-} (aq) &\ rightarrow\ ce {CO3^2-} (aq) +\ ce {H2O} (l)
\ end {align*}\ nonumber\]
O cloro diatômico e o hidróxido de sódio (soda cáustica) são produtos químicos básicos produzidos em grandes quantidades, junto com o hidrogênio diatômico, por meio da eletrólise da salmoura, de acordo com a seguinte equação desequilibrada:
\[\ce{NaCl(aq) + H2O(l) ->[ electricity] NaOH(aq) + H2(g) + Cl2(g)} \nonumber \]
Escreva equações moleculares balanceadas, iônicas completas e iônicas líquidas para esse processo.
- Responda
-
Equação molecular balanceada:\[\ce{2NaCl(aq) + 2H2O(l) -> 2NaOH(aq) + H2(g) + Cl2(g)} \nonumber \]
Equação iônica balanceada:\[\ce{2Na^{+}(aq) + 2Cl^{-}(aq) + 2H2O (l) -> 2Na^{+}(aq) + 2OH^{-}(aq) + H2(g) + Cl2(g)} \nonumber \]
Equação iônica líquida balanceada:\[\ce{2Cl^{-}(aq) + 2H2O(l) -> 2OH^{-}(aq) + H2(g) + Cl2(g) } \nonumber \]
Conceitos principais e resumo
As equações químicas são representações simbólicas de mudanças químicas e físicas. As fórmulas para as substâncias que sofrem a mudança (reagentes) e as substâncias geradas pela mudança (produtos) são separadas por uma seta e precedidas por coeficientes inteiros indicando seus números relativos. Equações balanceadas são aquelas cujos coeficientes resultam em números iguais de átomos para cada elemento nos reagentes e produtos. As reações químicas em solução aquosa que envolvem reagentes ou produtos iônicos podem ser representadas de forma mais realista por equações iônicas completas e, mais sucintamente, por equações iônicas líquidas.
Glossário
- equação balanceada
- equação química com números iguais de átomos para cada elemento no reagente e no produto
- equação química
- representação simbólica de uma reação química
- coeficiente
- número colocado na frente de símbolos ou fórmulas em uma equação química para indicar sua quantidade relativa
- equação iônica completa
- equação química na qual todos os reagentes e produtos iônicos dissolvidos, incluindo íons espectadores, são explicitamente representados por fórmulas para seus íons dissociados
- equação molecular
- equação química na qual todos os reagentes e produtos são representados como substâncias neutras
- equação iônica líquida
- equação química na qual somente os reagentes iônicos dissolvidos e os produtos que sofrem uma alteração química ou física são representados (exclui íons espectadores)
- produto
- substância formada por uma mudança química ou física; mostrada no lado direito da seta em uma equação química
- reagente
- substância passando por uma alteração química ou física; mostrada no lado esquerdo da seta em uma equação química
- ícone do espectador
- íon que não sofre alterações químicas ou físicas durante uma reação, mas sua presença é necessária para manter a neutralidade da carga


