4.E: Estequiometria de reações químicas (exercícios)
- Page ID
- 185527
4.1: Escrevendo e balanceando equações químicas
Q4.1.1
O que significa dizer que uma equação é balanceada? Por que é importante que uma equação seja balanceada?
S4.1.1
Uma equação é balanceada quando o mesmo número de cada elemento é representado nos lados do reagente e do produto. As equações devem ser balanceadas para refletir com precisão a lei de conservação da matéria.
Q4.1.2
Considere equações moleculares, iônicas completas e iônicas líquidas.
- Qual é a diferença entre esses tipos de equações?
- Em que circunstância as equações iônicas completas e líquidas de uma reação seriam idênticas?
Q4.1.3
Equilibre as seguintes equações:
- \(\ce{PCl5}(s)+\ce{H2O}(l)\rightarrow \ce{POCl3}(l)+\ce{HCl}(aq)\)
- \(\ce{Cu}(s)+\ce{HNO3}(aq)\rightarrow \ce{Cu(NO3)2}(aq)+\ce{H2O}(l)+\ce{NO}(g)\)
- \(\ce{H2}(g)+\ce{I2}(s)\rightarrow \ce{HI}(s)\)
- \(\ce{Fe}(s)+\ce{O2}(g)\rightarrow \ce{Fe2O3}(s)\)
- \(\ce{Na}(s)+\ce{H2O}(l)\rightarrow \ce{NaOH}(aq)+\ce{H2}(g)\)
- \(\ce{(NH4)2Cr2O7}(s)\rightarrow \ce{Cr2O3}(s)+\ce{N2}(g)+\ce{H2O}(g)\)
- \(\ce{P4}(s)+\ce{Cl2}(g)\rightarrow \ce{PCl3}(l)\)
- \(\ce{PtCl4}(s)\rightarrow \ce{Pt}(s)+\ce{Cl2}(g)\)
S4.1.3
- \(\ce{PCl5}(s)+\ce{H2O}(l)\rightarrow \ce{POCl3}(l)+\ce{2HCl}(aq)\);
- \(\ce{3Cu}(s)+\ce{8HNO3}(aq)\rightarrow \ce{3Cu(NO3)2}(aq)+\ce{4H2O}(l)+\ce{2NO}(g)\);
- \(\ce{H2}(g)+\ce{I2}(s)\rightarrow \ce{2HI}(s)\);
- \(\ce{4Fe}(s)+\ce{3O2}(g)\rightarrow \ce{2Fe2O3}(s)\);
- \(\ce{2Na}(s)+\ce{2H2O}(l)\rightarrow \ce{2NaOH}(aq)+\ce{H2}(g)\);
- \(\ce{(NH4)2Cr52O7}(s)\rightarrow \ce{Cr2O3}(s)+\ce{N2}(g)+\ce{4H2O}(g)\);
- \(\ce{P4}(s)+\ce{6Cl2}(g)\rightarrow \ce{4PCl3}(l)\);
- \(\ce{PtCl4}(s)\rightarrow \ce{Pt}(s)+\ce{2Cl2}(g)\)
Q4.1.4
Equilibre as seguintes equações:
- \(\ce{Ag}(s)+\ce{H2S}(g)+\ce{O2}(g)\rightarrow \ce{Ag2S}(s)+\ce{H2O}(l)\)
- \(\ce{P4}(s)+\ce{O2}(g)\rightarrow \ce{P4O10}(s)\)
- \(\ce{Pb}(s)+\ce{H2O}(l)+\ce{O2}(g)\rightarrow \ce{Pb(OH)2}(s)\)
- \(\ce{Fe}(s)+\ce{H2O}(l)\rightarrow \ce{Fe3O4}(s)+\ce{H2}(g)\)
- \(\ce{Sc2O3}(s)+\ce{SO3}(l)\rightarrow \ce{Sc2(SO4)3}(s)\)
- \(\ce{Ca3(PO4)2}(aq)+\ce{H3PO4}(aq)\rightarrow \ce{Ca(H2PO4)2}(aq)\)
- \(\ce{Al}(s)+\ce{H2SO4}(aq)\rightarrow \ce{Al2(SO4)3}(s)+\ce{H2}(g)\)
- \(\ce{TiCl4}(s)+\ce{H2O}(g)\rightarrow \ce{TiO2}(s)+\ce{HCl}(g)\)
S4.1.4
- \(\ce{4Ag}(s)+\ce{2H2S}(g)+\ce{O2}(g)\rightarrow \ce{2Ag2S}(s)+\ce{2H2O}(l)\)
- \(\ce{P4}(s)+\ce{5O2}(g)\rightarrow \ce{P4O10}(s)\)
- \(\ce{2Pb}(s)+\ce{2H2O}(l)+\ce{O2}(g)\rightarrow \ce{2Pb(OH)2}(s)\)
- \(\ce{3Fe}(s)+\ce{4H2O}(l)\rightarrow \ce{Fe3O4}(s)+\ce{4H2}(g)\)
- \(\ce{Sc2O3}(s)+\ce{3SO3}(l)\rightarrow \ce{Sc2(SO4)3}(s)\)
- \(\ce{Ca3(PO4)2}(aq)+\ce{4H3PO4}(aq)\rightarrow \ce{3Ca(H2PO4)2}(aq)\)
- \(\ce{2Al}(s)+\ce{3H2SO4}(aq)\rightarrow \ce{Al2(SO4)3}(s)+\ce{3H2}(g)\)
- \(\ce{TiCl4}(s)+\ce{2H2O}(g)\rightarrow \ce{TiO2}(s)+\ce{4HCl}(g)\)
Q4.1.5
Escreva uma equação molecular balanceada descrevendo cada uma das seguintes reações químicas.
- O carbonato de cálcio sólido é aquecido e se decompõe em óxido de cálcio sólido e gás dióxido de carbono.
- O butano gasoso, C 4 H 10, reage com o gás oxigênio diatômico para produzir dióxido de carbono gasoso e vapor de água.
- Soluções aquosas de cloreto de magnésio e hidróxido de sódio reagem para produzir hidróxido de magnésio sólido e cloreto de sódio aquoso.
- O vapor de água reage com o metal sódico para produzir hidróxido de sódio sólido e gás hidrogênio.
S4.1.5
- \(\ce{CaCO3}(s)\rightarrow \ce{CaO}(s)+\ce{CO2}(g)\);
- \(\ce{2C4H10}(g)+\ce{13O2}(g)\rightarrow \ce{8CO2}(g)+\ce{10H2O}(g)\);
- \(\ce{MgCl2}(aq)+\ce{2NaOH}(aq)\rightarrow \ce{Mg(OH)2}(s)+\ce{2NaCl}(aq)\);
- \(\ce{2H2O}(g)+\ce{2Na}(s)\rightarrow \ce{2NaOH}(s)+\ce{H2}(g)\)
Q4.1.6
Escreva uma equação balanceada descrevendo cada uma das seguintes reações químicas.
- O clorato de potássio sólido, KClO 3, se decompõe para formar cloreto de potássio sólido e gás oxigênio diatômico.
- O metal de alumínio sólido reage com o iodo diatômico sólido para formar o sólido Al 2 I 6.
- Quando o cloreto de sódio sólido é adicionado ao ácido sulfúrico aquoso, o gás cloreto de hidrogênio e o sulfato de sódio aquoso são produzidos.
- Soluções aquosas de ácido fosfórico e hidróxido de potássio reagem para produzir dihidrogenofosfato de potássio aquoso e água líquida.
Q4.1.7
Fogos de artifício coloridos geralmente envolvem a decomposição do nitrato de bário e clorato de potássio e a reação dos metais magnésio, alumínio e ferro com o oxigênio.
- Escreva as fórmulas de nitrato de bário e clorato de potássio.
- A decomposição do clorato de potássio sólido leva à formação de cloreto de potássio sólido e gás oxigênio diatômico. Escreva uma equação para a reação.
- A decomposição do nitrato de bário sólido leva à formação de óxido de bário sólido, gás nitrogênio diatômico e gás oxigênio diatômico. Escreva uma equação para a reação.
- Escreva equações separadas para as reações dos metais sólidos magnésio, alumínio e ferro com gás oxigênio diatômico para produzir os óxidos metálicos correspondentes. (Suponha que o óxido de ferro contenha íons Fe 3+.)
Q4.1.7
- Ba (NO 32), KClO 3;
- \(\ce{2KClO3}(s)\rightarrow \ce{2KCl}(s)+\ce{3O2}(g)\);
- \(\ce{2Ba(NO3)2}(s)\rightarrow \ce{2BaO}(s)+\ce{2N2}(g)+\ce{5O2}(g)\);
- \(\ce{2Mg}(s)+\ce{O2}(g)\rightarrow \ce{2MgO}(s)\);\(\ce{4Al}(s)+\ce{3O2}(g)\rightarrow \ce{2Al2O3}(g)\);\(\ce{4Fe}(s)+\ce{3O2}(g)\rightarrow \ce{2Fe2O3}(s)\)
Q4.1.8
Preencha o espaço em branco com uma única fórmula química para um composto covalente que equilibrará a equação:
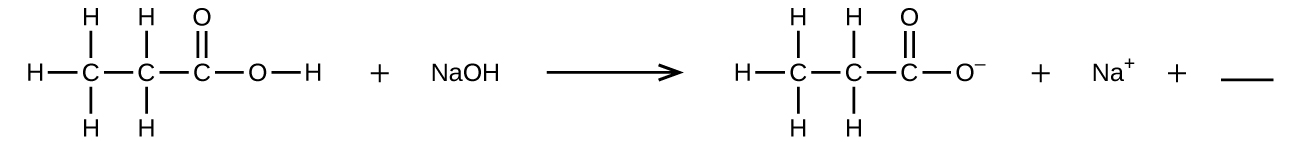
Q4.1.9
O fluoreto de hidrogênio aquoso (ácido fluorídrico) é usado para gravar vidro e analisar minerais quanto ao seu conteúdo de silício. O fluoreto de hidrogênio também reagirá com a areia (dióxido de silício).
- Escreva uma equação para a reação do dióxido de silício sólido com o ácido fluorídrico para produzir tetrafluoreto de silício gasoso e água líquida.
- O mineral fluorita (fluoreto de cálcio) ocorre extensivamente em Illinois. O fluoreto de cálcio sólido também pode ser preparado pela reação de soluções aquosas de cloreto de cálcio e fluoreto de sódio, produzindo cloreto de sódio aquoso como o outro produto. Escreva equações iônicas completas e líquidas para essa reação.
S4.1.9
- \(\ce{4HF}(aq)+\ce{SiO2}(s)\rightarrow \ce{SiF4}(g)+\ce{2H2O}(l)\);
- equação iônica completa:\(\ce{2Na+}(aq)+\ce{2F-}(aq)+\ce{Ca^2+}(aq)+\ce{2Cl-}(aq)\rightarrow \ce{CaF2}(s)+\ce{2Na+}(aq)+\ce{2Cl-}(aq)\), equação iônica líquida:\(\ce{2F-}(aq)+\ce{Ca^2+}(aq)\rightarrow \ce{CaF2}(s)\)
Q4.1.10
Um novo processo para obter magnésio da água do mar envolve várias reações. Escreva uma equação química balanceada para cada etapa do processo.
- O primeiro passo é a decomposição do carbonato de cálcio sólido das conchas marinhas para formar óxido de cálcio sólido e dióxido de carbono gasoso.
- A segunda etapa é a formação do hidróxido de cálcio sólido como único produto da reação do óxido de cálcio sólido com a água líquida.
- O hidróxido de cálcio sólido é então adicionado à água do mar, reagindo com o cloreto de magnésio dissolvido para produzir hidróxido de magnésio sólido e cloreto de cálcio aquoso.
- O hidróxido de magnésio sólido é adicionado a uma solução de ácido clorídrico, produzindo cloreto de magnésio dissolvido e água líquida.
- Finalmente, o cloreto de magnésio é derretido e eletrolisado para produzir magnésio metálico líquido e gás cloro diatômico.
Q4.1.11
A partir das equações moleculares balanceadas, escreva as equações iônicas e líquidas completas para o seguinte:
- \(\ce{K2C2O4}(aq)+\ce{Ba(OH)2}(aq)\rightarrow \ce{2KOH}(aq)+\ce{BaC2O2}(s)\)
- \(\ce{Pb(NO3)2}(aq)+\ce{H2SO4}(aq)\rightarrow \ce{PbSO4}(s)+\ce{2HNO3}(aq)\)
- \(\ce{CaCO3}(s)+\ce{H2SO4}(aq)\rightarrow \ce{CaSO4}(s)+\ce{CO2}(g)+\ce{H2O}(l)\)
S4.1.11
- \[\ce{2K+}(aq)+\ce{C2O4^2-}(aq)+\ce{Ba^2+}(aq)+\ce{2OH-}(aq)\rightarrow \ce{2K+}(aq)+\ce{2OH-}(aq)+\ce{BaC2O4}(s)\hspace{20px}\ce{(complete)}\]\[\ce{Ba^2+}(aq)+\ce{C2O4^2-}(aq)\rightarrow \ce{BaC2O4}(s)\hspace{20px}\ce{(net)}\]
- \[\ce{Pb^2+}(aq)+\ce{2NO3-}(aq)+\ce{2H+}(aq)+\ce{SO4^2-}(aq)\rightarrow \ce{PbSO4}(s)+\ce{2H+}(aq)+\ce{2NO3-}(aq)\hspace{20px}\ce{(complete)}\]\[\ce{Pb^2+}(aq)+\ce{SO4^2-}(aq)\rightarrow \ce{PbSO4}(s)\hspace{20px}\ce{(net)}\]
- \[\ce{CaCO3}(s)+\ce{2H+}(aq)+\ce{SO4^2-}(aq)\rightarrow \ce{CaSO4}(s)+\ce{CO2}(g)+\ce{H2O}(l)\hspace{20px}\ce{(complete)}\]\[\ce{CaCO3}(s)+\ce{2H+}(aq)+\ce{SO4^2-}(aq)\rightarrow \ce{CaSO4}(s)+\ce{CO2}(g)+\ce{H2O}(l)\hspace{20px}\ce{(net)}\]
4.2: Classificando reações químicas
Q4.2.1
Use as equações a seguir para responder às próximas cinco perguntas:
- \(\ce{H2O}(s)\rightarrow \ce{H2O}(l)\)
- \(\ce{Na+}(aq)+\ce{Cl-}(aq)\ce{Ag+}(aq)+\ce{NO3-}(aq) \rightarrow \ce{AgCl}(s)+\ce{Na+}(aq)+\ce{NO3-}(aq)\)
- \(\ce{CH3OH}(g)+\ce{O2}(g)\rightarrow \ce{CO2}(g)+\ce{H2O}(g)\)
- \(\ce{2H2O}(l)\rightarrow \ce{2H2}(g)+\ce{O2}(g)\)
- \(\ce{H+}(aq)+\ce{OH-}(aq)\rightarrow \ce{H2O}(l)\)
- Qual equação descreve uma mudança física?
- Qual equação identifica os reagentes e produtos de uma reação de combustão?
- Qual equação não está balanceada?
- O que é uma equação iônica líquida?
S4.2.1
uma.) eu.\(H_2O (solid) → H_2O(liquid)\)
b.) iii.
c.) iii. \(\ce{2CH3OH}(g)+\ce{3O2}(g)\rightarrow \ce{2CO2}(g)+\ce{4H2O}(g)\)
d.) v.
Q4.2.2
Indique o tipo, ou tipos, de reação que cada um dos itens a seguir representa:
- \(\ce{Ca}(s)+\ce{Br2}(l)\rightarrow \ce{CaBr2}(s)\)
- \(\ce{Ca(OH)2}(aq)+\ce{2HBr}(aq)\rightarrow \ce{CaBr2}(aq)+\ce{2H2O}(l)\)
- \(\ce{C6H12}(l)+\ce{9O2}(g)\rightarrow \ce{6CO2}(g)+\ce{6H2O}(g)\)
S4.2.2
oxidação-redução (adição); ácido-base (neutralização); oxidação-redução (combustão)
<
Q4.2.3
Indique o tipo, ou tipos, de reação que cada um dos itens a seguir representa:
- \(\ce{H2O}(g)+\ce{C}(s)\rightarrow \ce{CO}(g)+\ce{H2}(g)\)
- \(\ce{2KClO3}(s)\rightarrow \ce{2KCl}(s)+\ce{3O2}(g)\)
- \(\ce{Al(OH)3}(aq)+\ce{3HCl}(aq)\rightarrow \ce{AlBr3}(aq)+\ce{3H2O}(l)\)
- \(\ce{Pb(NO3)2}(aq)+\ce{H2SO4}(aq)\rightarrow \ce{PbSO4}(s)+\ce{2HNO3}(aq)\)
Q4.2.4
A prata pode ser separada do ouro porque a prata se dissolve no ácido nítrico, enquanto o ouro não. A dissolução da prata no ácido nítrico é uma reação ácido-base ou uma reação de redução de oxidação? Explique sua resposta.
S4.2.4
É uma reação de redução de oxidação porque o estado de oxidação da prata muda durante a reação.
Q4.2.5
Determine os estados de oxidação dos elementos nos seguintes compostos:
- Ani
- GDCl 3
- Leão 3
- Conjunto H 2
- Mg 2 de Si
- BrO 2, superóxido de rubídio
- HF
Q4.2.6
Determine os estados de oxidação dos elementos nos compostos listados. Nenhum dos compostos que contêm oxigênio são peróxidos ou superóxidos.
- HP 3 PRO 4
- Al (OH) 3
- SeO 2
- CONHEÇA 2
- Em 2 S 3
- ATÉ 4 DE 6
S4.2.6
H +1, P +5, O −2; Al +3, H +1, O −2; Se +4, O −2; K +1, N +3, O −2; Em +3, S −2; P +3, O −2
Q4.2.7
Determine os estados de oxidação dos elementos nos compostos listados. Nenhum dos compostos que contêm oxigênio são peróxidos ou superóxidos.
- H 2 SO 4
- Boné (OH) 2
- BroH
- ClNo 2
- TiCl 4
- Não
S4.2.7
- H 1+, O 2 - S, 6+
- H 1+, O 2 -, Ca +2
- H 1+, O 2 -, Br 1+
- O 2 -, Cl 1-, N 5+
- Cl 1-, Ti 4+
- H 1+, Na -1
Q4.2.8
Classifique o seguinte como reações ácido-base ou reações de redução de oxidação:
- \(\ce{Na2S}(aq)+\ce{2HCl}(aq)\rightarrow \ce{2NaCl}(aq)+\ce{H2S}(g)\)
- \(\ce{2Na}(s)+\ce{2HCl}(aq)\rightarrow \ce{2NaCl}(aq)+\ce{H2}(g)\)
- \(\ce{Mg}(s)+\ce{Cl2}(g)\rightarrow \ce{MgCl2}(s)\)
- \(\ce{MgO}(s)+\ce{2HCl}(aq)\rightarrow \ce{MgCl2}(aq)+\ce{H2O}(l)\)
- \(\ce{K3P}(s)+\ce{2O2}(g)\rightarrow \ce{K3PO4}(s)\)
- \(\ce{3KOH}(aq)+\ce{H3PO4}(aq)\rightarrow \ce{K3PO4}(aq)+\ce{3H2O}(l)\)
S4.2.9
ácido-base; oxidação-redução: Na é oxidado, H + é reduzido; oxidação-redução: Mg é oxidado, Cl 2 é reduzido; ácido-base; redução de oxidação: P 3− é oxidado, O 2 é reduzido; ácido-base
Q4.2.10
Identifique os átomos que são oxidados e reduzidos, a mudança no estado de oxidação de cada um e os agentes oxidantes e redutores em cada uma das seguintes equações:
- \(\ce{Mg}(s)+\ce{NiCl2}(aq)\rightarrow \ce{MgCl2}(aq)+\ce{Ni}(s)\)
- \(\ce{PCl3}(l)+\ce{Cl2}(g)\rightarrow \ce{PCl5}(s)\)
- \(\ce{C2H4}(g)+\ce{3O2}(g)\rightarrow \ce{2CO2}(g)+\ce{2H2O}(g)\)
- \(\ce{Zn}(s)+\ce{H2SO4}(aq)\rightarrow \ce{ZnSO4}(aq)+\ce{H2}(g)\)
- \(\ce{2K2S2O3}(s)+\ce{I2}(s)\rightarrow \ce{K2S4O6}(s)+\ce{2KI}(s)\)
- \(\ce{3Cu}(s)+\ce{8HNO3}(aq)\rightarrow\ce{3Cu(NO3)2}(aq)+\ce{2NO}(g)+\ce{4H2O}(l)\)
Q4.2.11
Complete e balanceie as seguintes equações ácido-base:
- O gás HCl reage com o Ca (OH) 2 (s) sólido.
- Uma solução de Sr (OH) 2 é adicionada a uma solução de HNO 3.
S4.2.11
- \(\ce{2HCl}(g)+\ce{Ca(OH)2}(s)\rightarrow \ce{CaCl2}(s)+\ce{2H2O}(l)\);
- \(\ce{Sr(OH)2}(aq)+\ce{2HNO3}(aq)\rightarrow \ce{Sr(NO3)2}(aq)+\ce{2H2O}(l)\)
Q4.2.12
Complete e balanceie as seguintes equações ácido-base:
- Uma solução de HClO 4 é adicionada a uma solução de LiOH.
- O H 2 SO 4 aquoso reage com o NaOH.
- Ba (OH) 2 reage com o gás HF.
Q4.2.13
Complete e equilibre as seguintes reações de redução de oxidação, que fornecem o estado de oxidação mais alto possível para os átomos oxidados.
- \(\ce{Al}(s)+\ce{F2}(g)\rightarrow\)
- \(\ce{Al}(s)+\ce{CuBr2}(aq)\rightarrow\)(deslocamento único)
- \(\ce{P4}(s)+\ce{O2}(g)\rightarrow \)
- \(\ce{Ca}(s)+\ce{H2O}(l)\rightarrow \)(os produtos são uma base forte e um gás diatômico)
S4.2.13
- \(\ce{2Al}(s)+\ce{3F2}(g)\rightarrow \ce{2AlF3}(s)\);
- \(\ce{2Al}(s)+\ce{3CuBr2}(aq)\rightarrow \ce{3Cu}(s)+\ce{2AlBr3}(aq)\);
- \(\ce{P4}(s)+\ce{5O2}(g)\rightarrow \ce{P4O10}(s)\);\(\ce{Ca}(s)+\ce{2H2O}(l)\rightarrow \ce{Ca(OH)2}(aq)+\ce{H2}(g)\)
Q4.2.14
Complete e equilibre as seguintes reações de redução de oxidação, que fornecem o estado de oxidação mais alto possível para os átomos oxidados.
- \(\ce{K}(s)+\ce{H2O}(l)\rightarrow \)
- \(\ce{Ba}(s)+\ce{HBr}(aq)\rightarrow \)
- \(\ce{Sn}(s)+\ce{I2}(s)\rightarrow \)
Q4.2.15
Complete e equilibre as equações para as seguintes reações de neutralização ácido-base. Se a água for usada como solvente, escreva os reagentes e produtos como íons aquosos. Em alguns casos, pode haver mais de uma resposta correta, dependendo da quantidade de reagentes usados.
- \(\ce{Mg(OH)2}(s)+\ce{HClO4}(aq)\rightarrow \)
- \(\ce{SO3}(g)+\ce{H2O}(l)\rightarrow \)(suponha um excesso de água e que o produto se dissolva)
- \(\ce{SrO}(s)+\ce{H2SO4}(l)\rightarrow \)
S4.2.15
- \(\ce{Mg(OH)2}(s)+\ce{2HClO4}(aq)\rightarrow \ce{Mg^2+}(aq)+\ce{2ClO4-}(aq)+\ce{2H2O}(l)\);
- \(\ce{SO3}(g)+\ce{2H2O}(l)\rightarrow \ce{H3O+}(aq)+\ce{HSO4-}(aq)\), (uma solução de H 2 SO 4);
- \(\ce{SrO}(s)+\ce{H2SO4}(l)\rightarrow \ce{SrSO4}(s)+\ce{H2O}\)
Q4.2.16
Quando aquecidos a 700—800 °C, os diamantes, que são carbono puro, são oxidados pelo oxigênio atmosférico. (Eles queimam!) Escreva a equação balanceada para essa reação.
Q4.2.17
Os militares experimentaram lasers que produzem luz muito intensa quando o flúor se combina explosivamente com o hidrogênio. Qual é a equação balanceada para essa reação?
S4.2.17
\(\ce{H2}(g)+\ce{F2}(g)\rightarrow \ce{2HF}(g)\)
Q4.2.18
Escreva as equações molecular, iônica total e iônica líquida para as seguintes reações:
- \(\ce{Ca(OH)2}(aq)+\ce{HC2H3O2}(aq)\rightarrow \)
- \(\ce{H3PO4}(aq)+\ce{CaCl2}(aq)\rightarrow \)
Q4.2.19
A Great Lakes Chemical Company produz bromo, Br 2, a partir de sais de brometo, como NaBr, na salmoura do Arkansas, tratando a salmoura com gás cloro. Escreva uma equação balanceada para a reação de NaBr com Cl 2.
S4.2.19
\(\ce{2NaBr}(aq)+\ce{Cl2}(g)\rightarrow \ce{2NaCl}(aq)+\ce{Br2}(l)\)
Q4.2.20
Em um experimento comum no laboratório de química geral, o magnésio metálico é aquecido no ar para produzir MgO. O MgO é um sólido branco, mas nesses experimentos geralmente parece cinza, devido às pequenas quantidades de Mg 3 N 2, um composto formado quando parte do magnésio reage com o nitrogênio. Escreva uma equação balanceada para cada reação.
Q4.2.21
O hidróxido de lítio pode ser usado para absorver dióxido de carbono em ambientes fechados, como naves espaciais tripuladas e submarinos. Escreva uma equação para a reação que envolva 2 mol de LiOH por 1 mol de CO 2. (Dica: A água é um dos produtos.)
S4.2.21
\(\ce{2LiOH}(aq)+\ce{CO2}(g)\rightarrow \ce{Li2CO3}(aq)+\ce{H2O}(l)\)
Q4.2.2
Às vezes, o propionato de cálcio é adicionado ao pão para retardar a deterioração. Este composto pode ser preparado pela reação do carbonato de cálcio, CaCO 3, com o ácido propiônico, C 2 H 5 CO 2 H, que tem propriedades semelhantes às do ácido acético. Escreva a equação balanceada para a formação do propionato de cálcio.
Q4.2.23
Complete e equilibre as equações das seguintes reações, cada uma das quais poderia ser usada para remover o sulfeto de hidrogênio do gás natural:
- \(\ce{Ca(OH)2}(s)+\ce{H2S}(g) \rightarrow\)
- \(\ce{Na2CO3}(aq)+\ce{H2S}(g)\rightarrow \)
S4.2.23
- \(\ce{Ca(OH)2}(s)+\ce{H2S}(g)\rightarrow \ce{CaS}(s)+\ce{2H2O}(l)\);
- \(\ce{Na2CO3}(aq)+\ce{H2S}(g)\rightarrow \ce{Na2S}(aq)+\ce{CO2}(g)+\ce{H2O}(l)\)
Q4.2.24
O sulfeto de cobre (II) é oxidado pelo oxigênio molecular para produzir trióxido de enxofre gasoso e óxido de cobre sólido (II). O produto gasoso então reage com a água líquida para produzir sulfato de hidrogênio líquido como único produto. Escreva as duas equações que representam essas reações.
Q4.2.25
Escreva equações químicas balanceadas para as reações usadas para preparar cada um dos seguintes compostos a partir do (s) material (s) inicial (is) fornecido (s). Em alguns casos, reagentes adicionais podem ser necessários.
- nitrato de amônio sólido a partir de nitrogênio molecular gasoso por meio de um processo de duas etapas (primeiro reduza o nitrogênio em amônia e depois neutralize a amônia com um ácido apropriado)
- brometo de hidrogênio gasoso a partir de bromo molecular líquido por meio de uma reação redox de uma etapa
- H 2 S gasoso a partir de Zn e S sólidos por meio de um processo de duas etapas (primeiro uma reação redox entre os materiais de partida e depois a reação do produto com um ácido forte)
S4.2.25
- etapa 1:\(\ce{N2}(g)+\ce{3H2}(g)\rightarrow \ce{2NH3}(g)\), etapa 2:\(\ce{NH3}(g)+\ce{HNO3}(aq)\rightarrow \ce{NH4NO3}(aq)\rightarrow \ce{NH4NO3}(s)\ce{(after\: drying)}\);
- \(\ce{H2}(g)+\ce{Br2}(l)\rightarrow \ce{2HBr}(g)\);
- \(\ce{Zn}(s)+\ce{S}(s)\rightarrow \ce{ZnS}(s)\)e\(\ce{ZnS}(s)+\ce{2HCl}(aq)\rightarrow \ce{ZnCl2}(aq)+\ce{H2S}(g)\)
Q4.2.26
O ciclamato de cálcio Ca (C 6 H 11 NHSO 3) 2 é um adoçante artificial usado em muitos países ao redor do mundo, mas é proibido nos Estados Unidos. Pode ser purificado industrialmente convertendo-o em sal de bário por meio da reação do ácido C 6 H 11 NHSO 3 H com carbonato de bário, tratamento com ácido sulfúrico (o sulfato de bário é muito insolúvel) e depois neutralização com hidróxido de cálcio. Escreva as equações balanceadas para essas reações.
Q4.2.27
Complete e equilibre cada uma das seguintes meias-reações (etapas 2—5 no método de meia-reação):
- \(\ce{Sn^4+}(aq)\rightarrow \ce{Sn^2+}(aq)\)
- \(\ce{[Ag(NH3)2]+}(aq)\rightarrow \ce{Ag}(s)+\ce{NH3}(aq)\)
- \(\ce{Hg2Cl2}(s)\rightarrow \ce{Hg}(l)+\ce{Cl-}(aq)\)
- \(\ce{H2O}(l)\rightarrow \ce{O2}(g)\ce{\:(in\: acidic\: solution)}\)
- \(\ce{IO3-}(aq)\rightarrow \ce{I2}(s)\)
- \(\ce{SO3^2-}(aq)\rightarrow \ce{SO4^2-}(aq)\ce{\:(in\: acidic\: solution)}\)
- \(\ce{MnO4-}(aq)\rightarrow \ce{Mn^2+}(aq)\ce{\:(in\: acidic\: solution)}\)
- \(\ce{Cl-}(aq)\rightarrow \ce{ClO3-}(aq)\ce{\:(in\: basic\: solution)}\)
S4.2.27
- \(\ce{Sn^4+}(aq)+\ce{2e-}\rightarrow \ce{Sn^2+}(aq)\),
- \(\ce{[Ag(NH3)2]+}(aq)+ \ce{e-} \rightarrow \ce{Ag}(s)+\ce{2NH3}(aq)\);
- \(\ce{Hg2Cl2}(s)+ \ce{2e-} \rightarrow \ce{2Hg}(l)+\ce{2Cl-}(aq)\);
- \(\ce{2H2O}(l)\rightarrow \ce{O2}(g)+\ce{4H+}(aq)+\ce{4e-}\);
- \(\ce{6H2O}(l)+\ce{2IO3-}(aq)+\ce{10e-}\rightarrow \ce{I2}(s)+\ce{12OH-}(aq)\);
- \(\ce{H2O}(l)+\ce{SO3^2-}(aq)\rightarrow \ce{SO4^2-}(aq)+\ce{2H+}(aq)+\ce{2e-}\);
- (g)\(\ce{8H+}(aq)+\ce{MnO4-}(aq)+\ce{5e-}\rightarrow \ce{Mn^2+}(aq)+\ce{4H2O}(l)\);
- (h)\(\ce{Cl-}(aq)+\ce{6OH-}(aq)\rightarrow \ce{ClO3-}(aq)+\ce{3H2O}(l)+\ce{6e-}\)
Q4.2.28
Complete e equilibre cada uma das seguintes meias-reações (etapas 2—5 no método de meia-reação):
- \(\ce{Cr^2+}(aq)\rightarrow \ce{Cr^3+}(aq)\)
- \(\ce{Hg}(l)+\ce{Br-}(aq)\rightarrow \ce{HgBr4^2-}(aq)\)
- \(\ce{ZnS}(s)\rightarrow \ce{Zn}(s)+\ce{S^2-}(aq)\)
- \(\ce{H2}(g)\rightarrow \ce{H2O}(l)\ce{\:(in\: basic\: solution)}\)
- \(\ce{H2}(g)\rightarrow \ce{H3O+}(aq)\ce{\:(in\: acidic\: solution)}\)
- \(\ce{NO3-}(aq)\rightarrow \ce{HNO2}(aq)\ce{\:(in\: acidic\: solution)}\)
- \(\ce{MnO2}(s)\rightarrow \ce{MnO4-}(aq)\ce{\:(in\: basic\: solution)}\)
- \(\ce{Cl-}(aq)\rightarrow \ce{ClO3-}(aq)\ce{\:(in\: acidic\: solution)}\)
Q4.2.29
Equilibre cada uma das seguintes equações de acordo com o método da meia-reação:
- \(\ce{Sn^2+}(aq)+\ce{Cu^2+}(aq)\rightarrow \ce{Sn^4+}(aq)+\ce{Cu+}(aq)\)
- \(\ce{H2S}(g)+\ce{Hg2^2+}(aq)\rightarrow \ce{Hg}(l)+\ce{S}(s)\ce{\:(in\: acid)}\)
- \(\ce{CN-}(aq)+\ce{ClO2}(aq)\rightarrow \ce{CNO-}(aq)+\ce{Cl-}(aq)\ce{\:(in\: acid)}\)
- \(\ce{Fe^2+}(aq)+\ce{Ce^4+}(aq)\rightarrow \ce{Fe^3+}(aq)+\ce{Ce^3+}(aq)\)
- \(\ce{HBrO}(aq)\rightarrow \ce{Br-}(aq)+\ce{O2}(g)\ce{\:(in\: acid)}\)
S4.2.29
- \(\ce{Sn^2+}(aq)+\ce{2Cu^2+}(aq)\rightarrow \ce{Sn^4+}(aq)+\ce{2Cu+}(aq)\);
- \(\ce{H2S}(g)+\ce{Hg2^2+}(aq)+\ce{2H2O}(l)\rightarrow \ce{2Hg}(l)+\ce{S}(s)+\ce{2H3O+}(aq)\);
- \(\ce{5CN-}(aq)+\ce{2ClO2}(aq)+\ce{3H2O}(l)\rightarrow \ce{5CNO-}(aq)+\ce{2Cl-}(aq)+\ce{2H3O+}(aq)\);
- \(\ce{Fe^2+}(aq)+\ce{Ce^4+}(aq)\rightarrow \ce{Fe^3+}(aq)+\ce{Ce^3+}(aq)\);
- \(\ce{2HBrO}(aq)+\ce{2H2O}(l)\rightarrow \ce{2H3O+}(aq)+\ce{2Br-}(aq)+\ce{O2}(g)\)
Q4.2.30
Equilibre cada uma das seguintes equações de acordo com o método da meia-reação:
- \(\ce{Zn}(s)+\ce{NO3-}(aq)\rightarrow \ce{Zn^2+}(aq)+\ce{N2}(g)\ce{\:(in\: acid)}\)
- \(\ce{Zn}(s)+\ce{NO3-}(aq)\rightarrow \ce{Zn^2+}(aq)+\ce{NH3}(aq)\ce{\:(in\: base)}\)
- \(\ce{CuS}(s)+\ce{NO3-}(aq)\rightarrow \ce{Cu^2+}(aq)+\ce{S}(s)+\ce{NO}(g)\ce{\:(in\: acid)}\)
- \(\ce{NH3}(aq)+\ce{O2}(g)\rightarrow \ce{NO2}(g)\ce{\:(gas\: phase)}\)
- \(\ce{Cl2}(g)+\ce{OH-}(aq)\rightarrow \ce{Cl-}(aq)+\ce{ClO3-}(aq)\ce{\:(in\: base)}\)
- \(\ce{H2O2}(aq)+\ce{MnO4-}(aq)\rightarrow \ce{Mn^2+}(aq)+\ce{O2}(g)\ce{\:(in\: acid)}\)
- \(\ce{NO2}(g)\rightarrow \ce{NO3-}(aq)+\ce{NO2-}(aq)\ce{\:(in\: base)}\)
- \(\ce{Fe^3+}(aq)+\ce{I-}(aq)\rightarrow \ce{Fe^2+}(aq)+\ce{I2}(aq)\)
Q4.2.31
Equilibre cada uma das seguintes equações de acordo com o método da meia-reação:
- \(\ce{MnO4-}(aq)+\ce{NO2-}(aq)\rightarrow \ce{MnO2}(s)+\ce{NO3-}(aq)\ce{\:(in\: base)}\)
- \(\ce{MnO4^2-}(aq)\rightarrow \ce{MnO4-}(aq)+\ce{MnO2}(s)\ce{\:(in\: base)}\)
- \(\ce{Br2}(l)+\ce{SO2}(g)\rightarrow \ce{Br-}(aq)+\ce{SO4^2-}(aq)\ce{\:(in\: acid)}\)
S4.2.31
- \(\ce{2MnO4-}(aq)+\ce{3NO2-}(aq)+\ce{H2O}(l)\rightarrow \ce{2MnO2}(s)+\ce{3NO3-}(aq)+\ce{2OH-}(aq)\);
- \(\ce{3MnO4^2-}(aq)+\ce{2H2O}(l)\rightarrow \ce{2MnO4-}(aq)+\ce{4OH-}(aq)+\ce{MnO2}(s)\ce{\:(in\: base)}\);
- \(\ce{Br2}(l)+\ce{SO2}(g)+\ce{2H2O}(l)\rightarrow \ce{4H+}(aq)+\ce{2Br-}(aq)+\ce{SO4^2-}(aq)\)
4.3: Estequiometria de reação
Q4.3.1
Escreva a equação balanceada e, em seguida, descreva as etapas necessárias para determinar as informações solicitadas em cada uma das seguintes opções:
- O número de moles e a massa de cloro, Cl 2, necessários para reagir com 10,0 g de metal sódico, Na, para produzir cloreto de sódio, NaCl.
- O número de moles e a massa de oxigênio formada pela decomposição de 1,252 g de óxido de mercúrio (II).
- O número de moles e a massa de nitrato de sódio, NaNO 3, necessários para produzir 128 g de oxigênio. (O NaNO 2 é o outro produto.)
- O número de moles e a massa de dióxido de carbono formada pela combustão de 20,0 kg de carbono em excesso de oxigênio.
- O número de moles e a massa de carbonato de cobre (II) necessários para produzir 1.500 kg de óxido de cobre (II). (CO 2 é o outro produto.)

Q4.3.2
Determine o número de moles e a massa solicitada para cada reação no Exercício.
S4.3.2
0,435 mol Na, 0,217 mol Cl 2, 15,4 g Cl 2; 0,005780 mol HgO, 2,890 × 10 −3 mol O 2, 9,248 × 10 −2 g O 2; 8,00 mol NaNo 3, 6,8 × 10 2 g NaNo 3; 1665 mol CO 2, 73,3 kg CO 2 ; 18,86 mol CuO, 2,330 kg CuCo 3; 0,4580 mol C 2 H 4 Br 2, 86,05 g C 2 H 4 Br 2
Q4.3.3
Escreva a equação balanceada e, em seguida, descreva as etapas necessárias para determinar as informações solicitadas em cada uma das seguintes opções:
- O número de moles e a massa de Mg necessários para reagir com 5,00 g de HCl e produzir MgCl 2 e H 2.
- O número de moles e a massa de oxigênio formada pela decomposição de 1,252 g de óxido de prata (I).
- O número de moles e a massa de carbonato de magnésio, MgCO 3, necessários para produzir 283 g de dióxido de carbono. (O MgO é o outro produto.)
- O número de moles e a massa de água formada pela combustão de 20,0 kg de acetileno, C 2 H 2, em excesso de oxigênio.
- O número de moles e a massa de peróxido de bário, BaO 2, necessários para produzir 2.500 kg de óxido de bário, BaO (O 2 é o outro produto).

Q4.3.4
Determine o número de moles e a massa solicitada para cada reação no Exercício.
S4.3.4
0,0686 mol Mg, 1,67 g Mg; 2,701 × 10 −3 mol O 2, 0,08644 g O 2; 6,43 mol MgCO 3, 542 g MgCO 3 713 mol H 2 O, 12,8 kg H 2 O; 16,31 mol BaO 2, 2762 g BaO 2; 0,207 mol C 2 H 4 , 5,81 g C 2 H 4
Q4.3.5
O H 2 é produzido pela reação de 118,5 mL de uma solução 0,8775-M de H 3 PO 4 de acordo com a seguinte equação:\(\ce{2Cr + 2H3PO4 \rightarrow 3H2 + 2CrPO4}\).
- Outline the steps necessary to determine the number of moles and mass of H2.
- Perform the calculations outlined.
S4.3.5
a.)
- Convert mL to L
- Multiply L by the molarity to determine moles of H3PO4
- Convert moles of H3PO4 to moles of H2
- Multiply moles of H2 by the molar mass of H2 to get the answer in grams
b.)
1. \(118.5\: mL\times \dfrac{1\: L}{1000\: mL} = 0.1185\: L\)
2. \(0.1185\: L \times \dfrac{0.8775\: moles\: \ce{H3PO4}}{1\: L} = 0.1040\: moles\: \ce{H3PO4}\)
3. \(0.1040\: moles\: \ce{H3PO4} \times \dfrac{3\: moles\:\ce{H_2}}{2\: moles\: \ce{H3PO4}} = 0.1560\: moles\: \ce{H2}\)
4. \(0.1560\: moles\: \ce{H2} \times \dfrac{2.02 g}{1\: mole} = 0.3151g\: \ce{H2}\)
Q4.3.6
Gallium chloride is formed by the reaction of 2.6 L of a 1.44 M solution of HCl according to the following equation: \(\ce{2Ga + 6HCl \rightarrow 2GaCl3 + 3H2}\).
- Outline the steps necessary to determine the number of moles and mass of gallium chloride.
- Perform the calculations outlined.
S4.3.6
\(\mathrm{volume\: HCl\: solution \rightarrow mol\: HCl \rightarrow mol\: GaCl_3}\); 1.25 mol GaCl3, 2.2 × 102 g GaCl3
Q4.3.7
I2 is produced by the reaction of 0.4235 mol of CuCl2 according to the following equation: \(\ce{2CuCl2 + 4KI \rightarrow 2CuI + 4KCl + I2}\).
- How many molecules of I2 are produced?
- What mass of I2 is produced?
Q4.3.8
Silver is often extracted from ores as K[Ag(CN)2] and then recovered by the reaction
\(\ce{2K[Ag(CN)2]}(aq)+\ce{Zn}(s)\rightarrow \ce{2Ag}(s)+\ce{Zn(CN)2}(aq)+\ce{2KCN}(aq)\)
- How many molecules of Zn(CN)2 are produced by the reaction of 35.27 g of K[Ag(CN)2]?
- What mass of Zn(CN)2 is produced?
S4.3.8
5.337 × 1022 molecules; 10.41 g Zn(CN)2
Q4.3.9
What mass of silver oxide, Ag2O, is required to produce 25.0 g of silver sulfadiazine, AgC10H9N4SO2, from the reaction of silver oxide and sulfadiazine?
\(\ce{2C10H10N4SO2 + Ag2O \rightarrow 2AgC10H9N4SO2 + H2O}\)
Q4.3.10
Carborundum is silicon carbide, SiC, a very hard material used as an abrasive on sandpaper and in other applications. It is prepared by the reaction of pure sand, SiO2, with carbon at high temperature. Carbon monoxide, CO, is the other product of this reaction. Write the balanced equation for the reaction, and calculate how much SiO2 is required to produce 3.00 kg of SiC.
S4.3.10
\(\ce{SiO2 + 3C \rightarrow SiC + 2CO}\), 4.50 kg SiO2
Q4.3.11
Automotive air bags inflate when a sample of sodium azide, NaN3, is very rapidly decomposed.
\(\ce{2NaN3}(s) \rightarrow \ce{2Na}(s) + \ce{3N2}(g)\)
What mass of sodium azide is required to produce 2.6 ft3 (73.6 L) of nitrogen gas with a density of 1.25 g/L?
S4.3.11
142g NaN3
Q4.3.12
Urea, CO(NH2)2, is manufactured on a large scale for use in producing urea-formaldehyde plastics and as a fertilizer. What is the maximum mass of urea that can be manufactured from the CO2 produced by combustion of 1.00×103 kg of carbon followed by the reaction?
\[\ce{CO2}(g)+\ce{2NH3}(g)\rightarrow \ce{CO(NH2)2}(s)+\ce{H2O}(l)\]
S4.3.12
5.00 × 103 kg
Q4.3.13
In an accident, a solution containing 2.5 kg of nitric acid was spilled. Two kilograms of Na2CO3 was quickly spread on the area and CO2 was released by the reaction. Was sufficient Na2CO3 used to neutralize all of the acid?
Q4.3.14
A compact car gets 37.5 miles per gallon on the highway. If gasoline contains 84.2% carbon by mass and has a density of 0.8205 g/mL, determine the mass of carbon dioxide produced during a 500-mile trip (3.785 liters per gallon).
S4.3.14
1.28 × 105 g CO2
Q4.3.15
What volume of a 0.750 M solution of hydrochloric acid, a solution of HCl, can be prepared from the HCl produced by the reaction of 25.0 g of NaCl with an excess of sulfuric acid?
\[\ce{NaCl}(s)+\ce{H2SO4}(l)\rightarrow \ce{HCl}(g)+\ce{NaHSO4}(s)\]
Q4.3.16
What volume of a 0.2089 M KI solution contains enough KI to react exactly with the Cu(NO3)2 in 43.88 mL of a 0.3842 M solution of Cu(NO3)2?
\[\ce{2Cu(NO3)2 + 4KI \rightarrow 2CuI + I2 + 4KNO3}\]
S4.3.16
161.40 mL KI solution
Q4.3.17
A mordant is a substance that combines with a dye to produce a stable fixed color in a dyed fabric. Calcium acetate is used as a mordant. It is prepared by the reaction of acetic acid with calcium hydroxide.
\[\ce{2CH3CO2H + Ca(OH)2 \rightarrow Ca(CH3CO2)2 + 2H2O}\]
What mass of Ca(OH)2 is required to react with the acetic acid in 25.0 mL of a solution having a density of 1.065 g/mL and containing 58.0% acetic acid by mass?
Q4.3.18
The toxic pigment called white lead, Pb3(OH)2(CO3)2, has been replaced in white paints by rutile, TiO2. How much rutile (g) can be prepared from 379 g of an ore that contains 88.3% ilmenite (FeTiO3) by mass?
\[\ce{2FeTiO3 + 4HCl + Cl2 \rightarrow 2FeCl3 + 2TiO2 + 2H2O}\]
S4.3.18
176 g TiO2
4.4: Reaction Yields
Q4.4.1
The following quantities are placed in a container: 1.5 × 1024 atoms of hydrogen, 1.0 mol of sulfur, and 88.0 g of diatomic oxygen.
- What is the total mass in grams for the collection of all three elements?
- What is the total number of moles of atoms for the three elements?
- If the mixture of the three elements formed a compound with molecules that contain two hydrogen atoms, one sulfur atom, and four oxygen atoms, which substance is consumed first?
- How many atoms of each remaining element would remain unreacted in the change described in ?
Q4.4.2
What is the limiting reactant in a reaction that produces sodium chloride from 8 g of sodium and 8 g of diatomic chlorine?
S4.4.2
The limiting reactant is Cl2.
Q4.4.3
Which of the postulates of Dalton's atomic theory explains why we can calculate a theoretical yield for a chemical reaction?
Q4.4.4
A student isolated 25 g of a compound following a procedure that would theoretically yield 81 g. What was his percent yield?
S4.4.4
\(\mathrm{Percent\: yield = 31\%}\)
Q4.4.5
A sample of 0.53 g of carbon dioxide was obtained by heating 1.31 g of calcium carbonate. What is the percent yield for this reaction?
\[\ce{CaCO3}(s)\rightarrow \ce{CaO}(s)+\ce{CO2}(s)\]
Q4.4.6
Freon-12, CCl2F2, is prepared from CCl4 by reaction with HF. The other product of this reaction is HCl. Outline the steps needed to determine the percent yield of a reaction that produces 12.5 g of CCl2F2 from 32.9 g of CCl4. Freon-12 has been banned and is no longer used as a refrigerant because it catalyzes the decomposition of ozone and has a very long lifetime in the atmosphere. Determine the percent yield.
S4.4.6
\(\ce{g\: CCl4\rightarrow mol\: CCl4\rightarrow mol\: CCl2F2 \rightarrow g\: CCl2F2}, \mathrm{\:percent\: yield=48.3\%}\)
Q4.4.7
Citric acid, C6H8O7, a component of jams, jellies, and fruity soft drinks, is prepared industrially via fermentation of sucrose by the mold Aspergillus niger. The equation representing this reaction is
\[\ce{C12H22O11 + H2O + 3O2 \rightarrow 2C6H8O7 + 4H2O}\]
What mass of citric acid is produced from exactly 1 metric ton (1.000 × 103 kg) of sucrose if the yield is 92.30%?
Q4.4.8
Toluene, C6H5CH3, is oxidized by air under carefully controlled conditions to benzoic acid, C6H5CO2H, which is used to prepare the food preservative sodium benzoate, C6H5CO2Na. What is the percent yield of a reaction that converts 1.000 kg of toluene to 1.21 kg of benzoic acid?
\[\ce{2C6H5CH3 + 3O2 \rightarrow 2C6H5CO2H + 2H2O}\]
S4.4.8
\(\mathrm{percent\: yield=91.3\%}\)
Q4.4.9
In a laboratory experiment, the reaction of 3.0 mol of H2 with 2.0 mol of I2 produced 1.0 mol of HI. Determine the theoretical yield in grams and the percent yield for this reaction.
Q4.4.10
Outline the steps needed to solve the following problem, then do the calculations. Ether, (C2H5)2O, which was originally used as an anesthetic but has been replaced by safer and more effective medications, is prepared by the reaction of ethanol with sulfuric acid.
2C2H5OH + H2SO4 ⟶ (C2H5)2 + H2SO4·H2O
Q4.4.11
What is the percent yield of ether if 1.17 L (d = 0.7134 g/mL) is isolated from the reaction of 1.500 L of C2H5OH (d = 0.7894 g/mL)?
S4.4.11
Convert mass of ethanol to moles of ethanol; relate the moles of ethanol to the moles of ether produced using the stoichiometry of the balanced equation. Convert moles of ether to grams; divide the actual grams of ether (determined through the density) by the theoretical mass to determine the percent yield; 87.6%
Q4.4.12
Outline the steps needed to determine the limiting reactant when 30.0 g of propane, C3H8, is burned with 75.0 g of oxygen.
\[\mathrm{percent\: yield=\dfrac{0.8347\:\cancel{g}}{0.9525\:\cancel{g}}\times 100\%=87.6\%}\]
Determine the limiting reactant.
Q4.4.13
Outline the steps needed to determine the limiting reactant when 0.50 g of Cr and 0.75 g of H3PO4 react according to the following chemical equation?
\[\ce{2Cr + 2H3PO4 \rightarrow 2CrPO4 + 3H2}\]
Determine the limiting reactant.
S4.4.13
The conversion needed is \(\ce{mol\: Cr \rightarrow mol\: H2PO4}\). Then compare the amount of Cr to the amount of acid present. Cr is the limiting reactant.
Q4.4.14
What is the limiting reactant when 1.50 g of lithium and 1.50 g of nitrogen combine to form lithium nitride, a component of advanced batteries, according to the following unbalanced equation?
\[\ce{Li + N2 \rightarrow Li3N}\]
S4.4.14
\[\ce{6Li} + \ce{N2} \rightarrow \: \ce{2Li3N}\]
\[1.50g\: \ce{Li} \times \dfrac{1\: mole\: \ce{Li}}{6.94g\: \ce{Li}} \times\dfrac{2\: mole\: \ce{Li3N}}{6\:mole\: \ce{Li}} = 0.0720\: moles\: \ce{Li3N}\]
\[1.50g\: \ce{N2} \times \dfrac{1\: mole\: \ce{N2}}{28.02g\: \ce{N2}} \times\dfrac{2\: mole\: \ce{Li3N}}{1\:mole\: \ce{N2}} = 0.107\: moles\: \ce{Li3N}\]
\(\ce{Li}\) is the limiting reactant
Q4.4.15
Uranium can be isolated from its ores by dissolving it as UO2(NO3)2, then separating it as solid UO2(C2O4)·3H2O. Addition of 0.4031 g of sodium oxalate, Na2C2O4, to a solution containing 1.481 g of uranyl nitrate, UO2(NO2)2, yields 1.073 g of solid UO2(C2O4)·3H2O.
\[\ce{Na2C2O4 + UO2(NO3)2 + 3H2O ⟶ UO2(C2O4)·3H2O + 2NaNO3}\]
Determine the limiting reactant and the percent yield of this reaction.
S4.4.15
Na2C2O4 is the limiting reactant. percent yield = 86.6%
Q4.4.16
How many molecules of C2H4Cl2 can be prepared from 15 C2H4 molecules and 8 Cl2 molecules?
Q4.4.17
How many molecules of the sweetener saccharin can be prepared from 30 C atoms, 25 H atoms, 12 O atoms, 8 S atoms, and 14 N atoms?
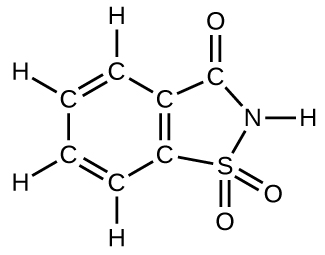
S4.4.17
Only four molecules can be made.
Q4.4.18
The phosphorus pentoxide used to produce phosphoric acid for cola soft drinks is prepared by burning phosphorus in oxygen.
- What is the limiting reactant when 0.200 mol of P4 and 0.200 mol of O2 react according to \[\ce{P4 + 5O2 \rightarrow P4O10}\]
- Calculate the percent yield if 10.0 g of P4O10 is isolated from the reaction.
Q4.4.19
Would you agree to buy 1 trillion (1,000,000,000,000) gold atoms for $5? Explain why or why not. Find the current price of gold at http://money.cnn.com/data/commodities/ \(\mathrm{(1\: troy\: ounce=31.1\: g)}\)
S4.4.19
This amount cannot be weighted by ordinary balances and is worthless.
4.5: Quantitative Chemical Analysis
Q4.5.1
What volume of 0.0105-M HBr solution is be required to titrate 125 mL of a 0.0100-M Ca(OH)2 solution?
\[\ce{Ca(OH)2}(aq)+\ce{2HBr}(aq) \rightarrow \ce{CaBr2}(aq)+\ce{2H2O}(l)\]
Q4.5.2
Titration of a 20.0-mL sample of acid rain required 1.7 mL of 0.0811 M NaOH to reach the end point. If we assume that the acidity of the rain is due to the presence of sulfuric acid, what was the concentration of sulfuric acid in this sample of rain?
S4.5.2
3.4 × 10−3 M H2SO4
Q4.5.3
What is the concentration of NaCl in a solution if titration of 15.00 mL of the solution with 0.2503 M AgNO3 requires 20.22 mL of the AgNO3 solution to reach the end point?
\[\ce{AgNO3}(aq)+\ce{NaCl}(aq)\rightarrow \ce{AgCl}(s)+\ce{NaNO3}(aq)\]
Q4.5.4
In a common medical laboratory determination of the concentration of free chloride ion in blood serum, a serum sample is titrated with a Hg(NO3)2 solution.
\[\ce{2Cl-}(aq)+\ce{Hg(NO3)2}(aq)\rightarrow \ce{2NO3-}(aq)+\ce{HgCl2}(s)\]
What is the Cl− concentration in a 0.25-mL sample of normal serum that requires 1.46 mL of 5.25 × 10−4 M Hg(NO3)2(aq) to reach the end point?
S4.5.4
9.6 × 10−3 M Cl−
Q4.5.5
Potatoes can be peeled commercially by soaking them in a 3-M to 6-M solution of sodium hydroxide, then removing the loosened skins by spraying them with water. Does a sodium hydroxide solution have a suitable concentration if titration of 12.00 mL of the solution requires 30.6 mL of 1.65 M HCI to reach the end point?
Q4.5.6
A sample of gallium bromide, GaBr2, weighing 0.165 g was dissolved in water and treated with silver nitrate, AgNO3, resulting in the precipitation of 0.299 g AgBr. Use these data to compute the %Ga (by mass) GaBr2.
S4.5.6
22.4%
Q4.5.7
The principal component of mothballs is naphthalene, a compound with a molecular mass of about 130 amu, containing only carbon and hydrogen. A 3.000-mg sample of naphthalene burns to give 10.3 mg of CO2. Determine its empirical and molecular formulas.
Q4.5.8
A 0.025-g sample of a compound composed of boron and hydrogen, with a molecular mass of ~28 amu, burns spontaneously when exposed to air, producing 0.063 g of B2O3. What are the empirical and molecular formulas of the compound.
S4.5.8
The empirical formula is BH3. The molecular formula is B2H6.
Q4.5.9
Sodium bicarbonate (baking soda), NaHCO3, can be purified by dissolving it in hot water (60 °C), filtering to remove insoluble impurities, cooling to 0 °C to precipitate solid NaHCO3, and then filtering to remove the solid, leaving soluble impurities in solution. Any NaHCO3 that remains in solution is not recovered. The solubility of NaHCO3 in hot water of 60 °C is 164 g L. Its solubility in cold water of 0 °C is 69 g/L. What is the percent yield of NaHCO3 when it is purified by this method?
Q4.5.10
What volume of 0.600 M HCl is required to react completely with 2.50 g of sodium hydrogen carbonate?
\[\ce{NaHCO3}(aq)+\ce{HCl}(aq)\rightarrow \ce{NaCl}(aq)+\ce{CO2}(g)+\ce{H2O}(l)\]
S4.5.10
49.6 mL
Q4.5.11
What volume of 0.08892 M HNO3 is required to react completely with 0.2352 g of potassium hydrogen phosphate?
\[\ce{2HNO3}(aq)+\ce{K2HPO4}(aq)\rightarrow \ce{H2PO4}(aq)+\ce{2KNO3}(aq)\]
Q4.5.12
What volume of a 0.3300-M solution of sodium hydroxide would be required to titrate 15.00 mL of 0.1500 M oxalic acid?
\[\ce{C2O4H2}(aq)+\ce{2NaOH}(aq)\rightarrow \ce{Na2C2O4}(aq)+\ce{2H2O}(l)\]
S4.5.12
13.64 mL
Q4.5.13
What volume of a 0.00945-M solution of potassium hydroxide would be required to titrate 50.00 mL of a sample of acid rain with a H2SO4 concentration of 1.23 × 10−4 M.
\[\ce{H2SO4}(aq)+\ce{2KOH}(aq)\rightarrow \ce{K2SO4}(aq)+\ce{2H2O}(l)\]
S4.5.13
1.30 mL
Q4.5.14
A sample of solid calcium hydroxide, Ca(OH)2, is allowed to stand in water until a saturated solution is formed. A titration of 75.00 mL of this solution with 5.00 × 10−2 M HCl requires 36.6 mL of the acid to reach the end point.
\[\ce{Ca(OH)2}(aq)+\ce{2HCl}(aq)\rightarrow \ce{CaCl2}(aq)+\ce{2H2O}(l)\]
What is the molarity?
S4.5.14
1.22 M
Q4.5.15
What mass of Ca(OH)2 will react with 25.0 g of propionic acid to form the preservative calcium propionate according to the equation?
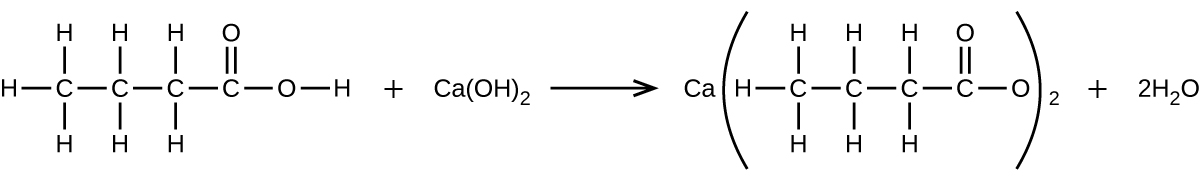
Q4.5.16
How many milliliters of a 0.1500-M solution of KOH will be required to titrate 40.00 mL of a 0.0656-M solution of H3PO4?
\[\ce{H3PO4}(aq)+\ce{2KOH}(aq)\rightarrow \ce{K2HPO4}(aq)+\ce{2H2O}(l)\]
S4.5.16
34.99 mL KOH
Q4.5.17
Potassium acid phthalate, KHC6H4O4, or KHP, is used in many laboratories, including general chemistry laboratories, to standardize solutions of base. KHP is one of only a few stable solid acids that can be dried by warming and weighed. A 0.3420-g sample of KHC6H4O4 reacts with 35.73 mL of a NaOH solution in a titration. What is the molar concentration of the NaOH?
\[\ce{KHC6H4O4}(aq)+\ce{NaOH}(aq)\rightarrow \ce{KNaC6H4O4}(aq)+\ce{H2O}(aq)\]
Q4.5.18
The reaction of WCl6 with Al at ~400 °C gives black crystals of a compound containing only tungsten and chlorine. A sample of this compound, when reduced with hydrogen, gives 0.2232 g of tungsten metal and hydrogen chloride, which is absorbed in water. Titration of the hydrochloric acid thus produced requires 46.2 mL of 0.1051 M NaOH to reach the end point. What is the empirical formula of the black tungsten chloride?
S4.5.19
The empirical formula is WCl4.


