2.2: Evolução da Teoria Atômica
- Page ID
- 184864
- Descreva marcos no desenvolvimento da teoria atômica moderna
- Resuma e interprete os resultados dos experimentos de Thomson, Millikan e Rutherford
- Descreva as três partículas subatômicas que compõem os átomos
- Apresente o termo isótopos
Nos dois séculos desde que Dalton desenvolveu suas ideias, os cientistas fizeram progressos significativos para aprofundar nossa compreensão da teoria atômica. Muito disso veio dos resultados de vários experimentos seminais que revelaram os detalhes da estrutura interna dos átomos. Aqui, discutiremos alguns desses principais desenvolvimentos, com ênfase na aplicação do método científico, bem como na compreensão de como a evidência experimental foi analisada. Embora as pessoas históricas e as datas por trás desses experimentos possam ser bastante interessantes, é muito importante compreender os conceitos resultantes de seu trabalho.
Teoria atômica após o século XIX
Se a matéria fosse composta de átomos, do que os átomos eram compostos? Eles eram as menores partículas ou havia algo menor? No final do século XIX, vários cientistas interessados em questões como essas investigaram as descargas elétricas que poderiam ser produzidas em gases de baixa pressão, com a descoberta mais significativa feita pelo físico inglês J. J. Thomson usando um tubo de raios catódicos. Esse aparelho consistia em um tubo de vidro selado do qual quase todo o ar havia sido removido; o tubo continha dois eletrodos de metal. Quando a alta tensão foi aplicada nos eletrodos, um feixe visível chamado raio catódico apareceu entre eles. Esse feixe foi desviado em direção à carga positiva e afastado da carga negativa, e foi produzido da mesma forma com propriedades idênticas quando metais diferentes foram usados para os eletrodos. Em experimentos semelhantes, o raio foi desviado simultaneamente por um campo magnético aplicado, e as medições da extensão da deflexão e da intensidade do campo magnético permitiram que Thomson calculasse a relação carga/massa das partículas dos raios catódicos. Os resultados dessas medições indicaram que essas partículas eram muito mais leves que os átomos (Figura\(\PageIndex{1}\)).
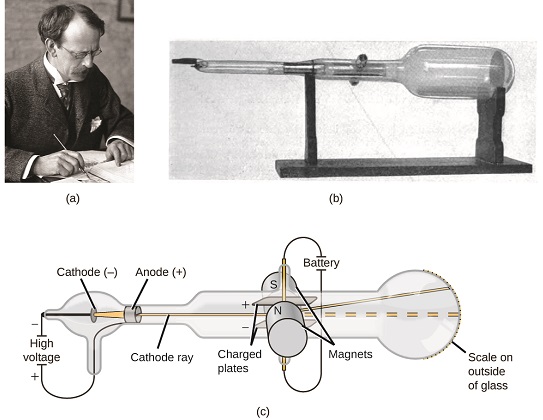
Com base em suas observações, aqui está o que Thomson propôs e por quê: As partículas são atraídas por cargas positivas (+) e repelidas por cargas negativas (−), então elas devem ser carregadas negativamente (como cargas repelem e cargas diferentes atraem); elas são menos massivas que átomos e indistinguíveis, independentemente da material de origem, então eles devem ser constituintes subatômicos fundamentais de todos os átomos. Embora controversa na época, a ideia de Thomson foi gradualmente aceita, e sua partícula de raios catódicos é o que hoje chamamos de elétron, uma partícula subatômica de carga negativa com uma massa mais de mil vezes menor que a de um átomo. O termo “elétron” foi cunhado em 1891 pelo físico irlandês George Stoney, a partir de “electrão é um”.
Em 1909, mais informações sobre o elétron foram descobertas pelo físico americano Robert A. Millikan por meio de seus experimentos de “gota de óleo”. Millikan criou gotículas de óleo microscópicas, que podiam ser carregadas eletricamente por fricção à medida que se formavam ou usando raios-X. Essas gotículas caíram inicialmente devido à gravidade, mas seu progresso descendente poderia ser retardado ou mesmo revertido por um campo elétrico mais abaixo no aparelho. Ao ajustar a intensidade do campo elétrico e fazer medições cuidadosas e cálculos apropriados, Millikan conseguiu determinar a carga em gotas individuais (Figura\(\PageIndex{2}\)).
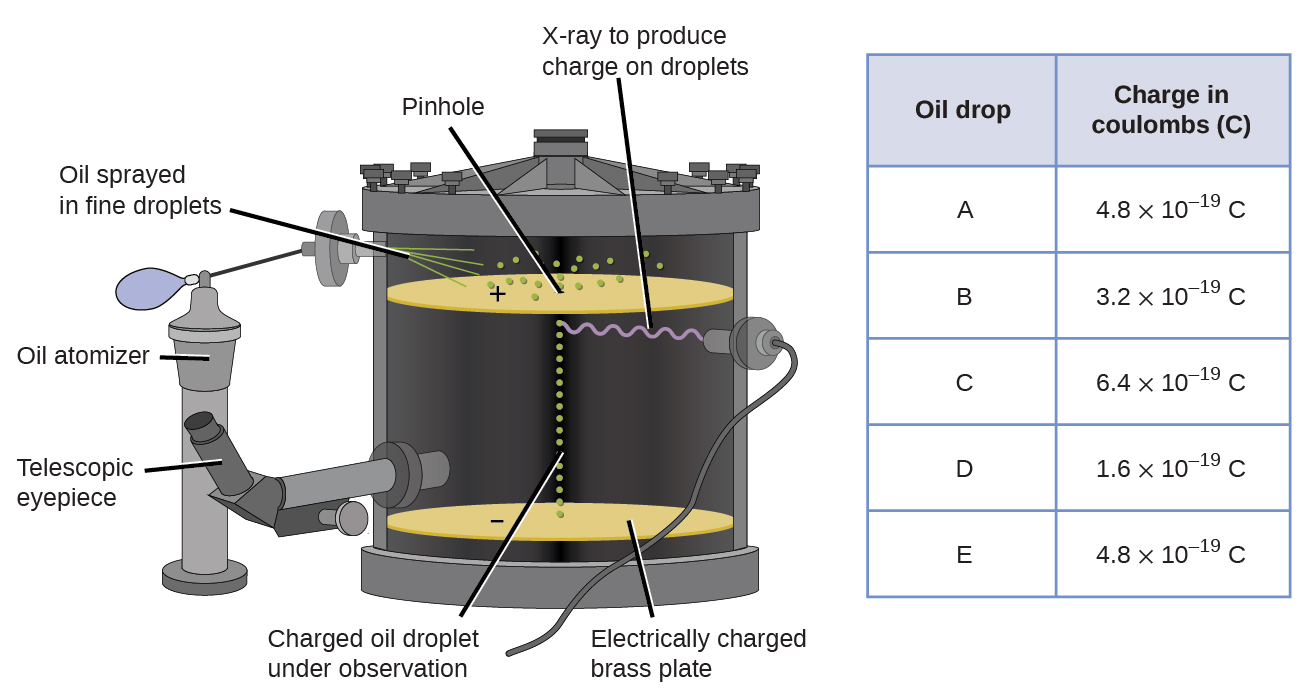
Observando os dados de carga que Millikan coletou, você pode ter reconhecido que a carga de uma gota de óleo é sempre um múltiplo de uma carga específica, 1,6\(\times\) 10 −19 C. Millikan concluiu que esse valor deve, portanto, ser uma carga fundamental — a carga de um único elétro—com sua medida cargas devido a um excesso de um elétron (1 vezes 1,6\(\times\) 10 −19 C), dois elétrons (2 vezes 1,6\(\times\) 10 −19 C), três elétrons (3 vezes 1,6\(\times\) 10 −19 C) e assim por diante, em uma determinada gota de óleo. Como a carga de um elétron agora era conhecida devido à pesquisa de Millikan, e a relação carga/massa já era conhecida devido à pesquisa de Thomson (1,759\(\times\) 10 11 C/kg), era necessário apenas um cálculo simples para determinar também a massa do elétron.
\[\mathrm{Mass\: of\: electron=1.602\times 10^{-19}\:\cancel{C}\times \dfrac{1\: kg}{1.759\times 10^{11}\:\cancel{C}}=9.107\times 10^{-31}\:kg} \tag{2.3.1} \]
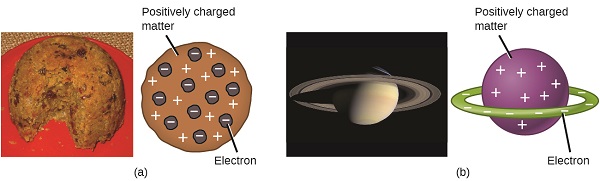
Os cientistas já haviam estabelecido que o átomo não era indivisível como Dalton acreditava e, devido ao trabalho de Thomson, Millikan e outros, a carga e a massa das partículas subatômicas negativas - os elétrons - eram conhecidas. No entanto, a parte carregada positivamente de um átomo ainda não foi bem compreendida. Em 1904, Thomson propôs o modelo de átomos de “pudim de ameixa”, que descrevia uma massa carregada positivamente com uma quantidade igual de carga negativa na forma de elétrons embutidos nela, já que todos os átomos são eletricamente neutros. Um modelo concorrente foi proposto em 1903 por Hantaro Nagaoka, que postulou um átomo semelhante a Saturno, consistindo em uma esfera de carga positiva cercada por um halo de elétrons (Figura\(\PageIndex{3}\)).
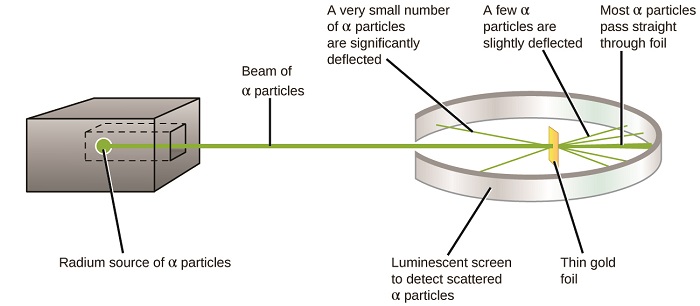
O próximo grande desenvolvimento na compreensão do átomo veio de Ernest Rutherford, um físico da Nova Zelândia que passou em grande parte sua carreira científica no Canadá e na Inglaterra. Ele realizou uma série de experimentos usando um feixe de partículas alfa de alta velocidade e carregadas positivamente (partículas α) que foram produzidas pelo decaimento radioativo do rádio; as partículas α consistem em dois prótons e dois nêutrons (você aprenderá mais sobre decaimento radioativo no capítulo sobre nuclear química). Rutherford e seus colegas Hans Geiger (mais tarde famoso pelo contador Geiger) e Ernest Marsden apontaram um feixe de partículas α, cuja fonte estava embutida em um bloco de chumbo para absorver a maior parte da radiação, em um pedaço muito fino de folha de ouro e examinaram a dispersão resultante de as partículas α usam uma tela luminescente que brilhava brevemente quando atingida por uma partícula α.
O que eles descobriram? A maioria das partículas passou direto pela película sem ser desviada. No entanto, alguns foram ligeiramente desviados e um número muito pequeno foi desviado quase diretamente para a fonte (Figura\(\PageIndex{4}\)). Rutherford descreveu a descoberta desses resultados: “Foi o evento mais incrível que já aconteceu comigo na minha vida. Foi quase tão incrível como se você atirasse um projétil de 15 polegadas contra um pedaço de lenço de papel e ele voltasse e batesse em você” 1 (p. 68).
Aqui está o que Rutherford deduziu: Como a maioria das partículas α de movimento rápido passaram pelos átomos de ouro sem se desviar, elas devem ter viajado por um espaço essencialmente vazio dentro do átomo. As partículas alfa são carregadas positivamente, então as deflexões surgiram quando elas encontraram outra carga positiva (como as cargas se repelem). Como cargas semelhantes se repelem, as poucas partículas α carregadas positivamente que mudaram de caminho abruptamente devem ter atingido, ou se aproximado, de outro corpo que também tinha uma carga positiva altamente concentrada. Como as deflexões ocorreram em uma pequena fração do tempo, essa carga ocupava apenas uma pequena quantidade do espaço na folha de ouro. Analisando uma série desses experimentos em detalhes, Rutherford tirou duas conclusões:
- O volume ocupado por um átomo deve consistir em uma grande quantidade de espaço vazio.
- Um corpo pequeno, relativamente pesado e com carga positiva, o núcleo, deve estar no centro de cada átomo.
Essa análise levou Rutherford a propor um modelo no qual um átomo consiste em um núcleo muito pequeno e com carga positiva, no qual a maior parte da massa do átomo está concentrada, cercado pelos elétrons carregados negativamente, de forma que o átomo seja eletricamente neutro (Figura\(\PageIndex{5}\)).
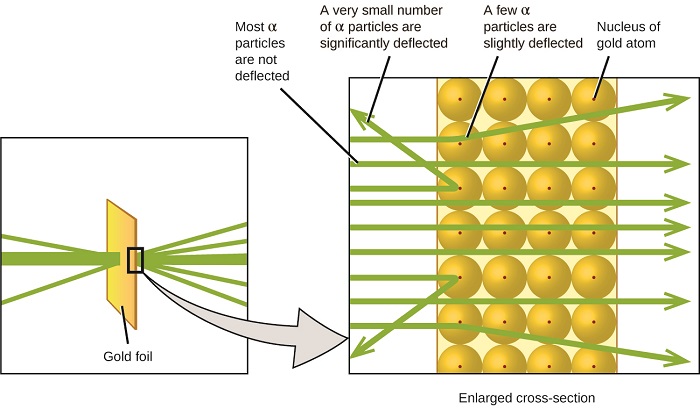
Depois de muitos outros experimentos, Rutherford também descobriu que os núcleos de outros elementos contêm o núcleo de hidrogênio como um “bloco de construção”, e ele chamou essa partícula mais fundamental de próton, a partícula subatômica com carga positiva encontrada no núcleo. Com uma adição, que você aprenderá a seguir, esse modelo nuclear do átomo, proposto há mais de um século, ainda é usado hoje.
Outra descoberta importante foi a descoberta dos isótopos. Durante o início dos anos 1900, os cientistas identificaram várias substâncias que pareciam ser novos elementos, isolando-as dos minérios radioativos. Por exemplo, um “novo elemento” produzido pela decomposição radioativa do tório recebeu inicialmente o nome de mesotório. No entanto, uma análise mais detalhada mostrou que o mesotório era quimicamente idêntico ao rádio (outro produto de decaimento), apesar de ter uma massa atômica diferente. Esse resultado, junto com descobertas semelhantes para outros elementos, levou o químico inglês Frederick Soddy a perceber que um elemento poderia ter tipos de átomos com massas diferentes que eram quimicamente indistinguíveis. Esses diferentes tipos são chamados de isótopos - átomos do mesmo elemento que diferem em massa. Soddy recebeu o Prêmio Nobel de Química em 1921 por essa descoberta.
Um quebra-cabeça permaneceu: o núcleo era conhecido por conter quase toda a massa de um átomo, com o número de prótons fornecendo apenas metade, ou menos, dessa massa. Diferentes propostas foram feitas para explicar o que constituía a massa restante, incluindo a existência de partículas neutras no núcleo. Como era de se esperar, detectar partículas não carregadas é muito desafiador, e foi somente em 1932 que James Chadwick encontrou evidências de nêutrons, partículas subatômicas não carregadas com uma massa aproximadamente igual à dos prótons. A existência do nêutron também explicou os isótopos: eles diferem em massa porque têm números diferentes de nêutrons, mas são quimicamente idênticos porque têm o mesmo número de prótons. Isso será explicado com mais detalhes posteriormente neste capítulo.
Resumo
Embora ninguém tenha realmente visto o interior de um átomo, experimentos demonstraram muito sobre a estrutura atômica. O tubo de raios catódicos de Thomson mostrou que os átomos contêm partículas pequenas e com carga negativa chamadas elétrons. Millikan descobriu que existe uma carga elétrica fundamental — a carga de um elétron. O experimento de folha de ouro de Rutherford mostrou que os átomos têm um núcleo pequeno, denso e com carga positiva; as partículas carregadas positivamente dentro do núcleo são chamadas de prótons. Chadwick descobriu que o núcleo também contém partículas neutras chamadas nêutrons. Soddy demonstrou que átomos do mesmo elemento podem diferir em massa; eles são chamados de isótopos.
Notas de pé
- Ernest Rutherford, “O Desenvolvimento da Teoria da Estrutura Atômica”, ed. J. A. Ratcliffe, em Background to Modern Science, eds. Joseph Needham e Walter Pagel, (Cambridge, Reino Unido: Cambridge University Press, 1938), pp. 61—74. Acessado em 22 de setembro de 2014, https://ia600508.us.archive.org/3/it...e032734mbp.pdf.
Glossário
- partícula alfa (partícula α)
- partícula carregada positivamente consistindo de dois prótons e dois nêutrons
- elétron
- partícula subatômica com carga negativa de massa relativamente baixa localizada fora do núcleo
- isótopos
- átomos que contêm o mesmo número de prótons, mas números diferentes de nêutrons
- nêutron
- partícula subatômica não carregada localizada no núcleo
- próton
- partícula subatômica carregada positivamente localizada no núcleo
- núcleo
- centro massivo e com carga positiva de um átomo composto por prótons e nêutrons


