2.1: Ideias iniciais em teoria atômica
- Page ID
- 184918
Ao final desta seção, você poderá:
- Declare os postulados da teoria atômica de Dalton
- Use postulados da teoria atômica de Dalton para explicar as leis de proporções definidas e múltiplas
A linguagem usada na química é vista e ouvida em muitas disciplinas, desde medicina até engenharia, forense e arte. A linguagem da química inclui seu próprio vocabulário, bem como sua própria forma de taquigrafia. Símbolos químicos são usados para representar átomos e elementos. As fórmulas químicas retratam moléculas, bem como a composição dos compostos. As equações químicas fornecem informações sobre a qualidade e a quantidade das mudanças associadas às reações químicas.
Este capítulo estabelecerá a base para nosso estudo da linguagem da química. Os conceitos dessa fundação incluem a teoria atômica, a composição e a massa de um átomo, a variabilidade da composição dos isótopos, a formação de íons, as ligações químicas em compostos iônicos e covalentes, os tipos de reações químicas e a nomeação dos compostos. Também apresentaremos uma das ferramentas mais poderosas para organizar o conhecimento químico: a tabela periódica.
Teoria atômica ao longo do século XIX
A primeira discussão registrada sobre a estrutura básica da matéria vem de filósofos gregos antigos, cientistas de sua época. No século V aC, Leucipo e Demócrito argumentaram que toda matéria era composta de partículas pequenas e finitas que eles chamavam de átomos, um termo derivado da palavra grega para “indivisível”. Eles pensavam nos átomos como partículas móveis que diferiam em forma e tamanho e que podiam se unir. Mais tarde, Aristóteles e outros chegaram à conclusão de que a matéria consistia em várias combinações dos quatro “elementos” — fogo, terra, ar e água — e poderia ser dividida infinitamente. Curiosamente, esses filósofos pensaram em átomos e “elementos” como conceitos filosóficos, mas aparentemente nunca consideraram realizar experimentos para testar suas ideias.
A visão aristotélica da composição da matéria prevaleceu por mais de dois mil anos, até que o professor de inglês John Dalton ajudou a revolucionar a química com sua hipótese de que o comportamento da matéria poderia ser explicado usando uma teoria atômica. Publicadas pela primeira vez em 1807, muitas das hipóteses de Dalton sobre as características microscópicas da matéria ainda são válidas na teoria atômica moderna. Aqui estão os postulados da teoria atômica de Dalton.
- A matéria é composta por partículas extremamente pequenas chamadas átomos. Um átomo é a menor unidade de um elemento que pode participar de uma mudança química.
- Um elemento consiste em apenas um tipo de átomo, que tem uma massa que é característica do elemento e é a mesma para todos os átomos desse elemento (Figura\(\PageIndex{1}\)). Uma amostra macroscópica de um elemento contém um número incrivelmente grande de átomos, todos com propriedades químicas idênticas.

- Os átomos de um elemento diferem nas propriedades dos átomos de todos os outros elementos.
- Um composto consiste em átomos de dois ou mais elementos combinados em uma pequena proporção de números inteiros. Em um determinado composto, o número de átomos de cada um de seus elementos está sempre presente na mesma proporção (Figura\(\PageIndex{2}\)).

- Os átomos não são criados nem destruídos durante uma mudança química, mas são reorganizados para produzir substâncias diferentes das presentes antes da mudança (Figura\(\PageIndex{3}\)).

A teoria atômica de Dalton fornece uma explicação microscópica das muitas propriedades macroscópicas da matéria sobre as quais você aprendeu. Por exemplo, se um elemento como o cobre consiste em apenas um tipo de átomo, ele não pode ser decomposto em substâncias mais simples, ou seja, em substâncias compostas por menos tipos de átomos. E se os átomos não forem criados nem destruídos durante uma mudança química, a massa total da matéria presente quando a matéria muda de um tipo para outro permanecerá constante (a lei da conservação da matéria).
No desenho a seguir, as esferas verdes representam átomos de um determinado elemento. As esferas roxas representam átomos de outro elemento. Se as esferas se tocarem, elas fazem parte de uma única unidade de um composto. A seguinte mudança química representada por esses símbolos viola alguma das ideias da teoria atômica de Dalton? Em caso afirmativo, qual?
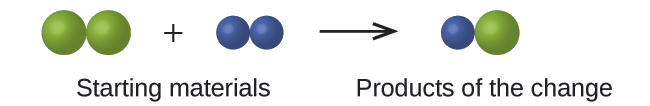
Solução
Os materiais de partida consistem em duas esferas verdes e duas esferas roxas. Os produtos consistem em apenas uma esfera verde e uma esfera roxa. Isso viola o postulado de Dalton de que os átomos não são criados nem destruídos durante uma mudança química, mas são meramente redistribuídos. (Nesse caso, os átomos parecem ter sido destruídos.)
No desenho a seguir, as esferas verdes representam átomos de um determinado elemento. As esferas roxas representam átomos de outro elemento. Se as esferas se tocarem, elas fazem parte de uma única unidade de um composto. A seguinte mudança química representada por esses símbolos viola alguma das ideias da teoria atômica de Dalton? Em caso afirmativo, qual deles?

- Resposta
-
Os materiais de partida consistem em quatro esferas verdes e duas esferas roxas. Os produtos consistem em quatro esferas verdes e duas esferas roxas. Isso não viola nenhum dos postulados de Dalton: os átomos não são criados nem destruídos, mas são redistribuídos em pequenas proporções de números inteiros.
Dalton conhecia os experimentos do químico francês Joseph Proust, que demonstrou que todas as amostras de um composto puro contêm os mesmos elementos na mesma proporção em massa. Essa afirmação é conhecida como lei das proporções definidas ou lei da composição constante. A sugestão de que o número de átomos dos elementos em um determinado composto sempre existe na mesma proporção é consistente com essas observações. Por exemplo, quando diferentes amostras de isooctano (um componente da gasolina e um dos padrões usados no sistema de classificação de octanagem) são analisadas, verifica-se que elas têm uma relação de massa carbono/hidrogênio de 5, 33:1, conforme mostrado na Tabela\(\PageIndex{1}\).
| Amostra | Carbono | Hidrogênio | Razão de massa |
|---|---|---|---|
| UMA | 14,82 g | 2,78 g | \(\mathrm{\dfrac{14.82\: g\: carbon}{2.78\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
| B | 22,33 g | 4,19 g | \(\mathrm{\dfrac{22.33\: g\: carbon}{4.19\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
| C | 19,40 g | 3,64 g | \(\mathrm{\dfrac{19.40\: g\: carbon}{3.63\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
É importante notar que, embora todas as amostras de um determinado composto tenham a mesma proporção de massa, o inverso não é verdadeiro em geral. Ou seja, amostras que têm a mesma proporção de massa não são necessariamente a mesma substância. Por exemplo, existem muitos compostos além do isooctano que também têm uma relação de massa carbono/hidrogênio de 5, 33:1 ,00.
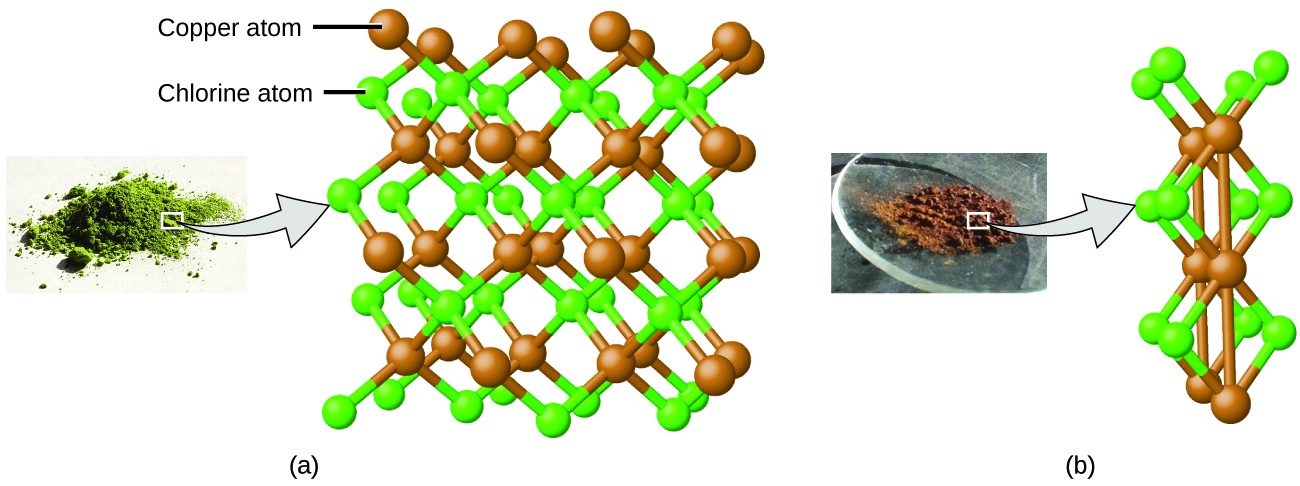
Dalton também usou dados de Proust, bem como resultados de seus próprios experimentos, para formular outra lei interessante. A lei das múltiplas proporções afirma que quando dois elementos reagem para formar mais de um composto, uma massa fixa de um elemento reagirá com as massas do outro elemento em uma proporção de números inteiros pequenos. Por exemplo, cobre e cloro podem formar um sólido cristalino verde com uma proporção de massa de 0,558 g de cloro para 1 g de cobre, bem como um sólido cristalino marrom com uma proporção de massa de 1,116 g de cloro para 1 g de cobre. Essas proporções por si só podem não parecer particularmente interessantes ou informativas; no entanto, se considerarmos uma proporção dessas proporções, obteremos um resultado útil e possivelmente surpreendente: uma pequena proporção de números inteiros.
\[\mathrm{\dfrac{\dfrac{1.116\: g\: Cl}{1\: g\: Cu}}{\dfrac{0.558\: g\: Cl}{1\: g\: Cu}}=\dfrac{2}{1}} \nonumber \]
Essa proporção de 2 para 1 significa que o composto marrom tem o dobro da quantidade de cloro por quantidade de cobre do composto verde.
Isso pode ser explicado pela teoria atômica se a razão cobre/cloro no composto marrom for de 1 átomo de cobre para 2 átomos de cloro e a proporção no composto verde for de 1 átomo de cobre para 1 átomo de cloro. A proporção de átomos de cloro (e, portanto, a proporção de suas massas) é, portanto, de 2 para 1 (Figura\(\PageIndex{4}\)).
Uma amostra do composto A (um gás transparente e incolor) é analisada e descobriu que contém 4,27 g de carbono e 5,69 g de oxigênio. Uma amostra do composto B (também um gás transparente e incolor) é analisada e descobriu que contém 5,19 g de carbono e 13,84 g de oxigênio. Esses dados são um exemplo da lei das proporções definidas, da lei das proporções múltiplas ou nenhuma? O que esses dados dizem sobre as substâncias A e B?
Solução
No composto A, a proporção de massa de carbono para oxigênio é:
\[\mathrm{\dfrac{1.33\: g\: O}{1\: g\: C}} \nonumber \]
No composto B, a proporção de massa de carbono para oxigênio é:
\[\mathrm{\dfrac{2.67\: g\: O}{1\: g\: C}} \nonumber \]
A proporção dessas proporções é:
\[\mathrm{\dfrac{\dfrac{1.33\: g\: O}{1\: g\: C}}{\dfrac{2.67\: g\: O}{1\: g\: C}}=\dfrac{1}{2}} \nonumber \]
Isso apóia a lei de múltiplas proporções. Isso significa que A e B são compostos diferentes, com A tendo metade do carbono por quantidade de oxigênio (ou duas vezes mais oxigênio por quantidade de carbono) do que B. Um possível par de compostos que se encaixaria nessa relação seria A = CO 2 e B = CO.
Uma amostra do composto X (um líquido transparente, incolor e combustível com um odor perceptível) é analisada e descobriu que contém 14,13 g de carbono e 2,96 g de hidrogênio. Uma amostra do composto Y (um líquido transparente, incolor e combustível com um odor perceptível que é ligeiramente diferente do odor de X) é analisada e descobriu que contém 19,91 g de carbono e 3,34 g de hidrogênio. Esses dados são um exemplo da lei das proporções definidas, da lei das proporções múltiplas ou nenhuma? O que esses dados dizem sobre as substâncias X e Y?
- Resposta
-
No composto X, a proporção de massa de carbono para hidrogênio é\(\mathrm{\dfrac{14.13\: g\: C}{2.96\: g\: H}}\).
No composto Y, a proporção de massa de carbono para oxigênio é\(\mathrm{\dfrac{19.91\: g\: C}{3.34\: g\: H}}\).
A proporção dessas proporções é
\[\mathrm{\dfrac{\dfrac{14.13\: g\: C}{2.96\: g\: H}}{\dfrac{19.91\: g\: C}{3.34\: g\: H}}=\dfrac{4.77\: g\: C/g\: H}{5.96\: g\: C/g\: H}=0.800=\dfrac{4}{5}}. \nonumber \]
Essa pequena proporção de números inteiros apóia a lei das múltiplas proporções. Isso significa que X e Y são compostos diferentes.
Resumo
Os antigos gregos propuseram que a matéria consiste em partículas extremamente pequenas chamadas átomos. Dalton postulou que cada elemento tem um tipo característico de átomo que difere em propriedades dos átomos de todos os outros elementos, e que átomos de diferentes elementos podem se combinar em proporções fixas, pequenas e de números inteiros para formar compostos. Todas as amostras de um determinado composto têm as mesmas proporções elementares por massa. Quando dois elementos formam compostos diferentes, uma determinada massa de um elemento se combina com massas do outro elemento em uma pequena proporção de números inteiros. Durante qualquer mudança química, os átomos não são criados nem destruídos.
Glossário
- Teoria atômica de Dalton
- conjunto de postulados que estabeleceram as propriedades fundamentais dos átomos
- lei da composição constante
- (também, lei de proporções definidas) todas as amostras de um composto puro contêm os mesmos elementos nas mesmas proporções por massa
- lei de múltiplas proporções
- quando dois elementos reagem para formar mais de um composto, uma massa fixa de um elemento reagirá com as massas do outro elemento em uma proporção de pequenos números inteiros
- lei das proporções definidas
- (também, lei da composição constante) todas as amostras de um composto puro contêm os mesmos elementos nas mesmas proporções por massa


