2.3: Estrutura atômica e simbolismo
- Page ID
- 184887
- Escreva e interprete símbolos que retratam o número atômico, o número de massa e a carga de um átomo ou íon
- Defina a unidade de massa atômica e a massa atômica média
- Calcule a massa atômica média e a abundância isotópica
O desenvolvimento da teoria atômica moderna revelou muito sobre a estrutura interna dos átomos. Aprendeu-se que um átomo contém um núcleo muito pequeno composto por prótons carregados positivamente e nêutrons não carregados, cercado por um volume muito maior de espaço contendo elétrons carregados negativamente. O núcleo contém a maior parte da massa de um átomo porque prótons e nêutrons são muito mais pesados que elétrons, enquanto os elétrons ocupam quase todo o volume de um átomo. O diâmetro de um átomo é da ordem de 10 −10 m, enquanto o diâmetro do núcleo é aproximadamente 10 −15 m — cerca de 100.000 vezes menor. Para uma perspectiva sobre seus tamanhos relativos, considere o seguinte: se o núcleo fosse do tamanho de um mirtilo, o átomo teria aproximadamente o tamanho de um estádio de futebol (Figura\(\PageIndex{1}\)).

Os átomos — e os prótons, nêutrons e elétrons que os compõem — são extremamente pequenos. Por exemplo, um átomo de carbono pesa menos de 2\(\times\) 10 −23 g e um elétron tem uma carga menor que 2\(\times\) 10 −19 C (coulomb). Ao descrever as propriedades de objetos minúsculos, como átomos, usamos unidades de medida apropriadamente pequenas, como a unidade de massa atômica (amu) e a unidade fundamental de carga (e). O amu foi originalmente definido com base no hidrogênio, o elemento mais leve, e posteriormente em termos de oxigênio. Desde 1961, foi definido em relação ao isótopo de carbono mais abundante, cujos átomos recebem massas de exatamente 12 amu. (Esse isótopo é conhecido como “carbono-12”, como será discutido posteriormente neste módulo.) Assim, um amu tem exatamente\(1/12\) a massa de um átomo de carbono-12:1 amu = 1,6605\(\times\) 10 −24 g. (O Dalton (Da) e a unidade unificada de massa atômica (u) são unidades alternativas que são equivalentes ao amu.) A unidade fundamental de carga (também chamada de carga elementar) é igual à magnitude da carga de um elétron (e) com e = 1,602\(\times\) 10 −19 C.
Um próton tem uma massa de 1.0073 amu e uma carga de 1+. Um nêutron é uma partícula um pouco mais pesada com massa de 1.0087 amu e carga zero; como o nome sugere, é neutra. O elétron tem uma carga de 1− e é uma partícula muito mais leve com uma massa de cerca de 0,00055 amu (seriam necessários cerca de 1800 elétrons para igualar a massa de um próton). As propriedades dessas partículas fundamentais estão resumidas na Tabela\(\PageIndex{1}\). (Um estudante observador pode notar que a soma das partículas subatômicas de um átomo não é igual à massa real do átomo: a massa total de seis prótons, seis nêutrons e seis elétrons é 12.0993 amu, um pouco maior que os 12,00 amu de um átomo real de carbono-12. Essa massa “ausente” é conhecida como defeito de massa e você aprenderá sobre ela no capítulo sobre química nuclear.)
| Nome | Localização | Carga (C) | Carga unitária | Missa (amu) | Massa (g) |
|---|---|---|---|---|---|
| elétron | núcleo externo | \(−1.602 \times 10^{−19}\) | 1− | 0,00055 | \(0.00091 \times 10^{−24}\) |
| próton | núcleo | \(1.602 \times 10^{−19}\) | 1+ | 1,00727 | \(1.67262 \times 10^{−24}\) |
| nêutron | núcleo | 0 | 0 | 1.00866 | \(1.67493 \times10^{−24}\) |
O número de prótons no núcleo de um átomo é seu número atômico (\(Z\)). Essa é a característica definidora de um elemento: seu valor determina a identidade do átomo. Por exemplo, qualquer átomo que contém seis prótons é o elemento carbono e tem o número atômico 6, independentemente de quantos nêutrons ou elétrons ele possa ter. Um átomo neutro deve conter o mesmo número de cargas positivas e negativas, então o número de prótons é igual ao número de elétrons. Portanto, o número atômico também indica o número de elétrons em um átomo. O número total de prótons e nêutrons em um átomo é chamado de número de massa (A). O número de nêutrons é, portanto, a diferença entre o número de massa e o número atômico: A — Z = número de nêutrons.
\ [\ begin {align*}
\ ce {atomic\: número\ :( Z)\: &=\ :número\: de\: prótons\\
massa\: número\ :( A)\: &=\ :número\: de\: prótons + número\: de\: nêutrons\\
A-Z\: &=\ :número\: de\: nêutrons}
\ end {align*}\ nonumber\]
Os átomos são eletricamente neutros se contiverem o mesmo número de prótons carregados positivamente e elétrons carregados negativamente. Quando os números dessas partículas subatômicas não são iguais, o átomo é carregado eletricamente e é chamado de íon. A carga de um átomo é definida da seguinte forma:
Carga atômica = número de prótons − número de elétrons
Como será discutido com mais detalhes posteriormente neste capítulo, átomos (e moléculas) normalmente adquirem carga ganhando ou perdendo elétrons. Um átomo que ganha um ou mais elétrons exibirá uma carga negativa e é chamado de ânion. Átomos carregados positivamente chamados cátions são formados quando um átomo perde um ou mais elétrons. Por exemplo, um átomo de sódio neutro (Z = 11) tem 11 elétrons. Se esse átomo perder um elétron, ele se tornará um cátion com uma carga 1+ (11 − 10 = 1+). Um átomo de oxigênio neutro (Z = 8) tem oito elétrons e, se ganhar dois elétrons, se tornará um ânion com carga 2− (8 − 10 = 2−).
O iodo é um oligoelemento essencial em nossa dieta; é necessário para produzir o hormônio tireoidiano. O iodo insuficiente na dieta pode levar ao desenvolvimento de um bócio, um aumento da glândula tireoidea (Figura\(\PageIndex{2}\)).
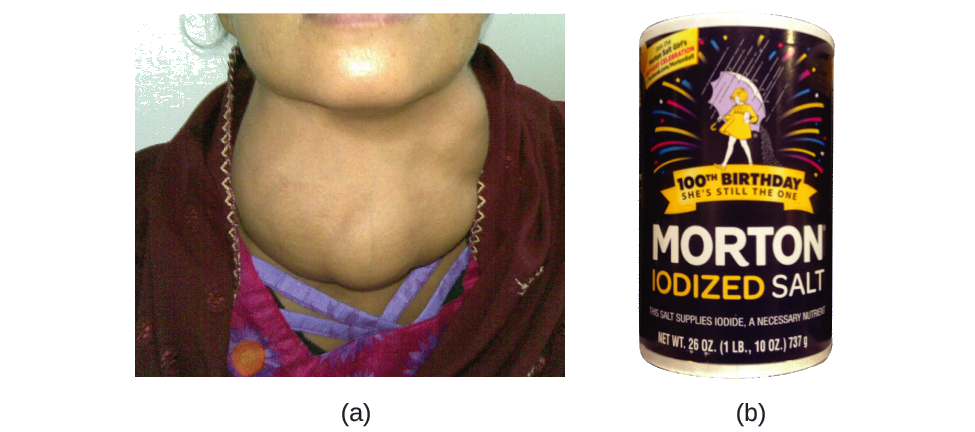
A adição de pequenas quantidades de iodo ao sal de mesa (sal iodado) eliminou essencialmente esse problema de saúde nos Estados Unidos, mas até 40% da população mundial ainda corre o risco de deficiência de iodo. Os átomos de iodo são adicionados como ânions, e cada um tem uma carga de 1 e um número de massa de 127. Determine o número de prótons, nêutrons e elétrons em um desses ânions de iodo.
Solução
O número atômico de iodo (53) nos diz que um átomo de iodo neutro contém 53 prótons em seu núcleo e 53 elétrons fora de seu núcleo. Como a soma dos números de prótons e nêutrons é igual ao número de massa, 127, o número de nêutrons é 74 (127 − 53 = 74). Como o iodo é adicionado como um ânion 1−, o número de elétrons é 54 [53 — (1—) = 54].
Um íon de platina tem um número de massa de 195 e contém 74 elétrons. Quantos prótons e nêutrons ele contém e qual é sua carga?
- Resposta
-
78 prótons; 117 nêutrons; a carga é 4+
Símbolos químicos
Um símbolo químico é uma abreviatura que usamos para indicar um elemento ou átomo de um elemento. Por exemplo, o símbolo do mercúrio é Hg (Figura\(\PageIndex{3}\)). Usamos o mesmo símbolo para indicar um átomo de mercúrio (domínio microscópico) ou para rotular um recipiente de muitos átomos do elemento mercúrio (domínio macroscópico).

Os símbolos de vários elementos comuns e seus átomos estão listados na Tabela\(\PageIndex{2}\). Alguns símbolos são derivados do nome comum do elemento; outros são abreviações do nome em outro idioma. Os símbolos têm uma ou duas letras, por exemplo, H para hidrogênio e Cl para cloro. Para evitar confusão com outras notações, somente a primeira letra de um símbolo é maiúscula. Por exemplo, Co é o símbolo do elemento cobalto, mas CO é a notação para o composto monóxido de carbono, que contém átomos dos elementos carbono (C) e oxigênio (O). Todos os elementos conhecidos e seus símbolos estão na tabela periódica.
| Elemento | Símbolo | Elemento | Símbolo |
|---|---|---|---|
| alumínio | Al | ferro | Fe (de ferrum) |
| bromo | Br | liderar | Pb (de plumbum) |
| cálcio | Ca | magnésio | Mg |
| carbono | C | mercúrio | Hg (de hidrargyrum) |
| cloro | Cl | azoto | N |
| cromo | Cr | oxigênio | O |
| cobalto | Co | potássio | K (de kalium) |
| cobre | Cuprum (de cuprum) | silício | Si |
| flúor | F | prata | Ag (de argentum) |
| ouro | Au (de aurum) | sódio | Na (de satrium) |
| hélio | Ele | enxofre | S |
| hidrogênio | H | estanho | Sn (de stannum) |
| iodo | EU | zinco | Zn |
Tradicionalmente, o descobridor (ou descobridores) de um novo elemento nomeia o elemento. No entanto, até que o nome seja reconhecido pela União Internacional de Química Pura e Aplicada (IUPAC), o nome recomendado do novo elemento é baseado na (s) palavra (s) latina (s) para seu número atômico. Por exemplo, o elemento 106 foi chamado unnilhexium (Unh), o elemento 107 foi chamado unnilseptium (Uns) e o elemento 108 foi chamado unniloctium (Uno) por vários anos. Esses elementos agora têm o nome de cientistas ou locais; por exemplo, o elemento 106 agora é conhecido como seaborgium (Sg) em homenagem a Glenn Seaborg, um ganhador do Prêmio Nobel que foi ativo na descoberta de vários elementos pesados.
Isótopos
O símbolo de um isótopo específico de qualquer elemento é escrito colocando o número da massa como um sobrescrito à esquerda do símbolo do elemento (Figura\(\PageIndex{4}\)). O número atômico às vezes é escrito como um subscrito antes do símbolo, mas como esse número define a identidade do elemento, assim como seu símbolo, ele geralmente é omitido. Por exemplo, o magnésio existe como uma mistura de três isótopos, cada um com um número atômico de 12 e com números de massa de 24, 25 e 26, respectivamente. Esses isótopos podem ser identificados como 24 Mg, 25 Mg e 26 Mg. Esses símbolos de isótopos são lidos como “elemento, número de massa” e podem ser simbolizados de acordo com essa leitura. Por exemplo, 24 Mg é lido como “magnésio 24” e pode ser escrito como “magnésio-24” ou “Mg-24”. 25 Mg é lido como “magnésio 25” e pode ser escrito como “magnésio-25” ou “Mg-25”. Todos os átomos de magnésio têm 12 prótons em seu núcleo. Eles diferem apenas porque um átomo de 24 Mg tem 12 nêutrons em seu núcleo, um átomo de 25 Mg tem 13 nêutrons e um de 26 Mg tem 14 nêutrons.
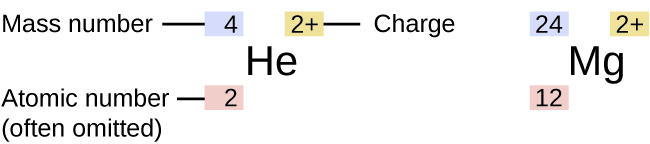
Informações sobre os isótopos naturais de elementos com números atômicos de 1 a 10 são fornecidas na Tabela\(\PageIndex{2}\). Observe que, além dos nomes e símbolos padrão, os isótopos de hidrogênio são frequentemente referidos usando nomes comuns e símbolos associados. O hidrogênio-2, simbolizado 2 H, também é chamado de deutério e às vezes simbolizado D. O hidrogênio-3, simbolizado 3 H, também é chamado de trítio e às vezes simbolizado T.
| Elemento | Símbolo | Número atômico | Número de prótons | Número de nêutrons | Missa (amu) | % Abundância natural |
|---|---|---|---|---|---|---|
| hidrogênio | \(\ce{^1_1H}\) (prócio) |
1 | 1 | 0 | 1.0078 | 99,989 |
| \(\ce{^2_1H}\) (deutério) |
1 | 1 | 1 | 2.0141 | 0,0115 | |
| \(\ce{^3_1H}\) (trítio) |
1 | 1 | 2 | 3.01605 | — (traço) | |
| hélio | \(\ce{^3_2He}\) | 2 | 2 | 1 | 3.01603 | 0,00013 |
| \(\ce{^4_2He}\) | 2 | 2 | 2 | 4.0026 | 100 | |
| lítio | \(\ce{^6_3Li}\) | 3 | 3 | 3 | 6.0151 | 7.59 |
| \(\ce{^7_3Li}\) | 3 | 3 | 4 | 7.0160 | 92,41 | |
| berílio | \(\ce{^9_4Be}\) | 4 | 4 | 5 | 9.0122 | 100 |
| boro | \(\ce{^{10}_5B}\) | 5 | 5 | 5 | 10.0129 | 19,9 |
| \(\ce{^{11}_5B}\) | 5 | 5 | 6 | 11.0093 | 80.1 | |
| carbono | \(\ce{^{12}_6C}\) | 6 | 6 | 6 | 12.000 | 98,89 |
| \(\ce{^{13}_6C}\) | 6 | 6 | 7 | 13.0034 | 1,11 | |
| \(\ce{^{14}_6C}\) | 6 | 6 | 8 | 14.0032 | — (traço) | |
| nitrogênio | \(\ce{^{14}_7N}\) | 7 | 7 | 7 | 14.0031 | 99,63 |
| \(\ce{^{15}_7N}\) | 7 | 7 | 8 | 15.0001 | 0,37 | |
| oxigênio | \(\ce{^{16}_8O}\) | 8 | 8 | 8 | 15.9949 | 99.757 |
| \(\ce{^{17}_8O}\) | 8 | 8 | 9 | 16.991 | 0,038 | |
| \(\ce{^{18}_8O}\) | 8 | 8 | 10 | 17.992 | 0,205 | |
| flúor | \(\ce{^{19}_9F}\) | 9 | 9 | 10 | 18.9984 | 100 |
| néon | \(\ce{^{20}_{10}Ne}\) | 10 | 10 | 10 | 19.9924 | 90,48 |
| \(\ce{^{21}_{10}Ne}\) | 10 | 10 | 11 | 20.9938 | 0,27 | |
| \(\ce{^{22}_{10}Ne}\) | 10 | 10 | 12 | 21.9914 | 9,25 |
Massa atômica
Como cada próton e cada nêutron contribuem com aproximadamente um amu para a massa de um átomo, e cada elétron contribui muito menos, a massa atômica de um único átomo é aproximadamente igual ao seu número de massa (um número inteiro). No entanto, as massas médias dos átomos da maioria dos elementos não são números inteiros porque a maioria dos elementos existe naturalmente como misturas de dois ou mais isótopos.
A massa de um elemento mostrada em uma tabela periódica ou listada em uma tabela de massas atômicas é uma massa média ponderada de todos os isótopos presentes em uma amostra natural desse elemento. Isso é igual à soma da massa de cada isótopo individual multiplicada por sua abundância fracionária.
\[\mathrm{average\: mass}=\sum_{i}(\mathrm{fractional\: abundance\times isotopic\: mass})_i \nonumber \]
Por exemplo, o elemento boro é composto por dois isótopos: cerca de 19,9% de todos os átomos de boro são 10 B com uma massa de 10,0129 amu, e os 80,1% restantes são 11 B com uma massa de 11,0093 amu. A massa atômica média do boro é calculada para ser:
\ [\ begin {align*}
\ textrm {massa média de boro} &=\ mathrm {(0,199\ times10.0129\: amu) + (0,801\ times11.0093\: amu)}\\ &=\ mathrm {1,99\: amu+8,82\: amu}\\
&=\ mathrm {10,81\: amu}\\ &=\ mathrm {10,81\: amu}\\ &=\ mathrm {10,81\: amu}\\
&=\ mathrm {10,81\: amu}
\\ &=}\ end {align*}\ nonumber\]
É importante entender que nenhum átomo de boro pesa exatamente 10,8 amu; 10,8 amu é a massa média de todos os átomos de boro e átomos de boro individuais pesam aproximadamente 10 amu ou 11 amu.
Um meteorito encontrado no centro de Indiana contém traços do gás nobre néon captado do vento solar durante a viagem do meteorito pelo sistema solar. A análise de uma amostra do gás mostrou que ela consistia em 91,84% 20 Ne (massa 19,9924 amu), 0,47% 21 Ne (massa 20,9940 amu) e 7,69% 22 Ne (massa 21,9914 amu). Qual é a massa média do néon no vento solar?
Solução em
\ [\ begin {align*}
\ mathrm {média\: massa} &=\ mathrm {(0,9184\ times19.9924\: amu) + (0,0047\ vezes 20.9940\: amu) + (0,0769\ times21.9914\: amu)}\\
&=\ mathrm {(18,36+0,099+1,69)\ :am u}\\
&=\ mathrm {20.15\: amu}
\ end {align*}\ nonumber\]
A massa média de um átomo de néon no vento solar é 20,15 amu. (A massa média de um átomo de néon terrestre é 20.1796 amu. Esse resultado demonstra que podemos encontrar pequenas diferenças na abundância natural dos isótopos, dependendo de sua origem.)
Verificou-se que uma amostra de magnésio contém 78,70% de átomos de 24 Mg (massa 23,98 amu), 10,13% de átomos de 25 Mg (massa 24,99 amu) e 11,17% de átomos de 26 Mg (massa 25,98 amu). Calcule a massa média de um átomo de Mg.
- Responda
-
24,31 amu
Também podemos fazer variações desse tipo de cálculo, conforme mostrado no próximo exemplo.
O cloro de ocorrência natural consiste em 35 Cl (massa 34,96885 amu) e 37 Cl (massa 36,96590 amu), com uma massa média de 35,453 amu. Qual é a composição percentual do Cl em termos desses dois isótopos?
Solução
A massa média de cloro é a fração que é 35 Cl vezes a massa de 35 Cl mais a fração que é 37 Cl vezes a massa de 37 Cl.
\[\mathrm{average\: mass=(fraction\: of\: ^{35}Cl\times mass\: of\: ^{35}Cl)+(fraction\: of\: ^{37}Cl\times mass\: of\: ^{37}Cl)} \nonumber \]
Se deixarmos x representar a fração que é 35 Cl, então a fração que é 37 Cl é representada por 1,00 − x.
(A fração que é 35 Cl + a fração que é 37 Cl deve somar 1, então a fração de 37 Cl deve ser igual a 1,00 − a fração de 35 Cl.)
Substituindo isso na equação de massa média, temos:
\ [\ begin {align*}
\ mathrm {35.453\: amu} & =( x\ times 34,96885\:\ ce {amu}) + [(1,00-x)\ times 36,96590\:\ ce {amu}]\\
35,453 &=34,96885x+36,96590-36,96590x\\
1,99990x 705x &=1,513\\
x&=\ dfrac {1,513} {1,99705} =0,7576
\ end {alinhamento*}\ número\]
Então, a solução rende: x = 0,7576, o que significa que 1,00 − 0,7576 = 0,2424. Portanto, o cloro consiste em 75,76% 35 Cl e 24,24% 37 Cl.
O cobre de ocorrência natural consiste em 63 Cu (massa 62,9296 amu) e 65 Cu (massa 64,9278 amu), com uma massa média de 63,546 amu. Qual é a composição percentual do Cu em termos desses dois isótopos?
- Responda
-
69,15% Cu-63 e 30,85% Cu-65
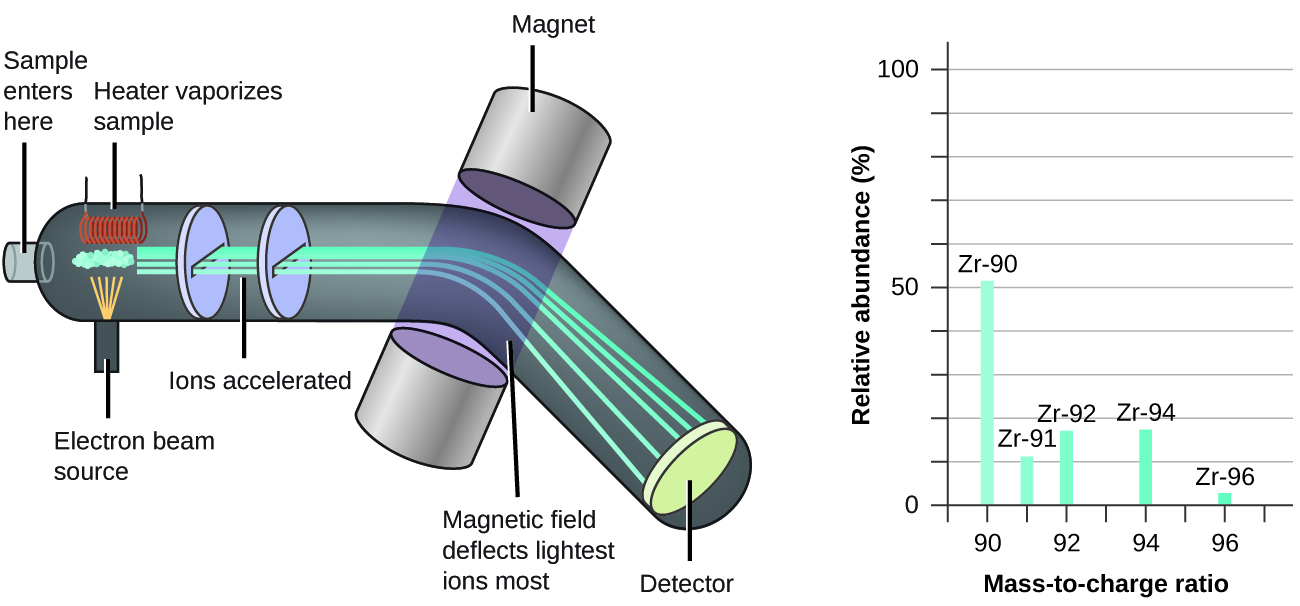
A ocorrência e a abundância natural dos isótopos podem ser determinadas experimentalmente usando um instrumento chamado espectrômetro de massa. A espectrometria de massa (MS) é amplamente usada em química, perícia, medicina, ciências ambientais e muitos outros campos para analisar e ajudar a identificar as substâncias em uma amostra de material. Em um espectrômetro de massa típico (Figura\(\PageIndex{5}\)), a amostra é vaporizada e exposta a um feixe de elétrons de alta energia que faz com que os átomos (ou moléculas) da amostra sejam carregados eletricamente, normalmente perdendo um ou mais elétrons. Esses cátions então passam por um campo elétrico ou magnético (variável) que desvia o caminho de cada cátion em uma extensão que depende de sua massa e carga (semelhante a como o caminho de um grande rolamento de esferas de aço passando por um ímã é desviado em menor grau do que o de um pequeno BB de aço). Os íons são detectados e um gráfico do número relativo de íons gerados versus suas relações massa/carga (um espectro de massa) é feito. A altura de cada feição vertical ou pico em um espectro de massa é proporcional à fração de cátions com a relação massa/carga especificada. Desde seu uso inicial durante o desenvolvimento da teoria atômica moderna, o MS evoluiu para se tornar uma ferramenta poderosa para análise química em uma ampla gama de aplicações.
Vídeo\(\PageIndex{1}\): Assista a este vídeo da Royal Society for Chemistry para uma breve descrição dos rudimentos da espectrometria de massa.
Resumo
Um átomo consiste em um núcleo pequeno, com carga positiva, cercado por elétrons. O núcleo contém prótons e nêutrons; seu diâmetro é cerca de 100.000 vezes menor que o do átomo. A massa de um átomo é geralmente expressa em unidades de massa atômica (amu), chamadas de massa atômica. Um amu é definido exatamente\(1/12\) como a massa de um átomo de carbono-12 e é igual a 1,6605\(\times\) 10 −24 g.
Os prótons são partículas relativamente pesadas com uma carga de 1+ e uma massa de 1.0073 amu. Os nêutrons são partículas relativamente pesadas sem carga e com uma massa de 1.0087 amu. Os elétrons são partículas leves com uma carga de 1− e uma massa de 0,00055 amu. O número de prótons no núcleo é chamado de número atômico (Z) e é a propriedade que define a identidade elementar de um átomo. A soma dos números de prótons e nêutrons no núcleo é chamada de número de massa e, expressa em amu, é aproximadamente igual à massa do átomo. Um átomo é neutro quando contém números iguais de elétrons e prótons.
Isótopos de um elemento são átomos com o mesmo número atômico, mas números de massa diferentes; os isótopos de um elemento, portanto, diferem entre si apenas no número de nêutrons dentro do núcleo. Quando um elemento natural é composto por vários isótopos, a massa atômica do elemento representa a média das massas dos isótopos envolvidos. Um símbolo químico identifica os átomos em uma substância usando símbolos, que são abreviações de uma, duas ou três letras para os átomos.
Equações chave
- \(\mathrm{average\: mass}=\sum_{i}(\mathrm{fractional\: abundance \times isotopic\: mass})_i\)
Glossário
- ânion
- átomo ou molécula carregada negativamente (contém mais elétrons do que prótons)
- massa atômica
- massa média de átomos de um elemento, expressa em amu
- unidade de massa atômica (amu)
- (também, unidade de massa atômica unificada, u ou Dalton, Da) unidade de massa igual à massa\(\dfrac{1}{12}\) de um átomo de 12 C
- número atômico (Z)
- número de prótons no núcleo de um átomo
- catião
- átomo ou molécula com carga positiva (contém menos elétrons do que prótons)
- símbolo químico
- abreviatura de uma, duas ou três letras usada para representar um elemento ou seus átomos
- Dalton (pai)
- unidade alternativa equivalente à unidade de massa atômica
- unidade fundamental de carga
- (também chamada de carga elementar) é igual à magnitude da carga de um elétron (e) com e = 1,602\(\times\) 10 −19 C
- íon
- átomo ou molécula carregada eletricamente (contém números desiguais de prótons e elétrons)
- número de massa (A)
- soma dos números de nêutrons e prótons no núcleo de um átomo
- unidade de massa atômica unificada (u)
- unidade alternativa equivalente à unidade de massa atômica


