1.2: Fases e classificação da matéria
- Page ID
- 185233
- Descreva as propriedades básicas de cada estado físico da matéria: sólido, líquido e gasoso.
- Defina e dê exemplos de átomos e moléculas.
- Classifique a matéria como um elemento, composto, mistura homogênea ou mistura heterogênea em relação ao seu estado físico e composição.
- Use representações simbólicas, particuladas ou macroscópicas para descrever ou classificar os diferentes tipos de matéria.
- Faça a distinção entre massa e peso.
- Aplique a lei de conservação da matéria.
A matéria é definida como qualquer coisa que ocupe espaço e tenha massa, e está ao nosso redor. Sólidos e líquidos são mais obviamente matéria: podemos ver que eles ocupam espaço e seu peso nos diz que eles têm massa. Os gases também são matéria; se os gases não ocupassem espaço, um balão permaneceria colapsado em vez de inflar quando cheio de gás.
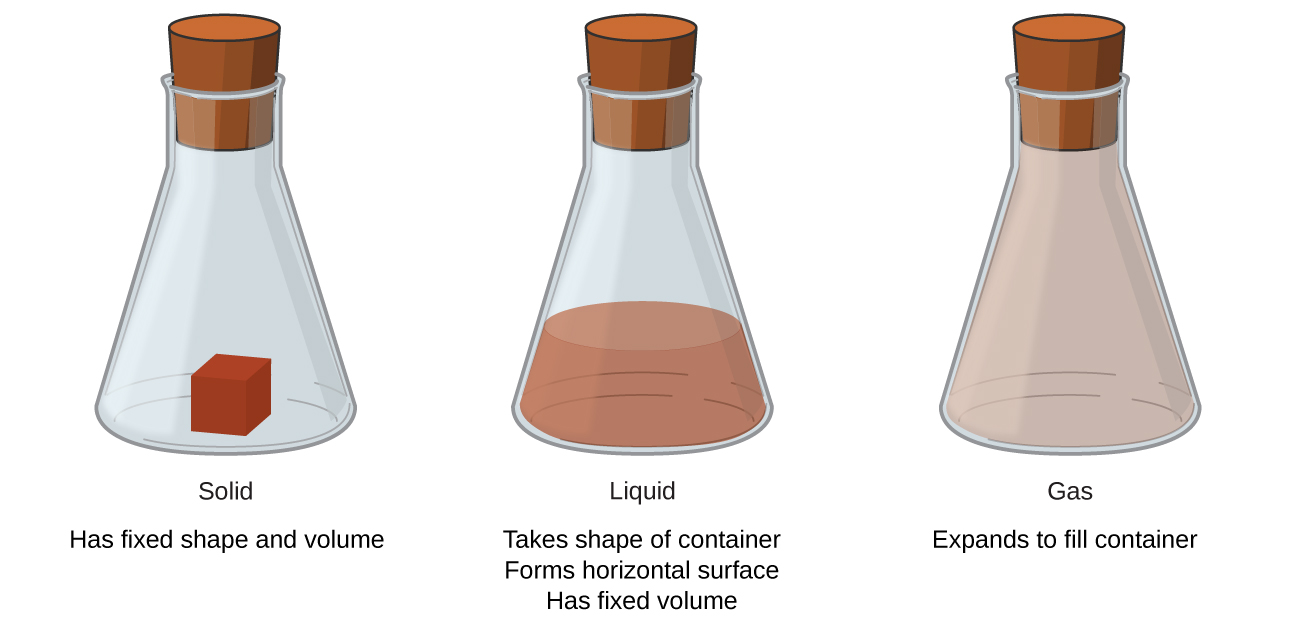
Sólidos, líquidos e gases são os três estados da matéria comumente encontrados na Terra (Figura\(\PageIndex{1}\)). Um sólido é rígido e tem uma forma definida. Um líquido flui e assume a forma de um recipiente, exceto pelo fato de formar uma superfície superior plana ou levemente curva quando acionado pela gravidade. (Em gravidade zero, os líquidos assumem uma forma esférica.) Tanto as amostras líquidas quanto as sólidas têm volumes quase independentes da pressão. Um gás assume a forma e o volume de seu recipiente.
Um quarto estado da matéria, o plasma, ocorre naturalmente no interior das estrelas. Um plasma é um estado gasoso da matéria que contém um número apreciável de partículas eletricamente carregadas (Figura\(\PageIndex{2}\)). A presença dessas partículas carregadas confere propriedades únicas aos plasmas que justificam sua classificação como um estado da matéria distinto dos gases. Além das estrelas, os plasmas são encontrados em alguns outros ambientes de alta temperatura (naturais e artificiais), como raios, certas telas de televisão e instrumentos analíticos especializados usados para detectar quantidades vestigiais de metais.

Vídeo\(\PageIndex{1}\): Em uma célula minúscula em uma televisão de plasma, o plasma emite luz ultravioleta, o que, por sua vez, faz com que a tela naquele local apareça com uma cor específica. A composição desses pequenos pontos de cor compõe a imagem que você vê. Assista a este vídeo para saber mais sobre o plasma e os lugares onde você o encontra.
Algumas amostras de matéria parecem ter propriedades de sólidos, líquidos e/ou gases ao mesmo tempo. Isso pode ocorrer quando a amostra é composta por muitos pedaços pequenos. Por exemplo, podemos despejar areia como se fosse um líquido porque ela é composta por muitos pequenos grãos de areia sólida. A matéria também pode ter propriedades de mais de um estado quando é uma mistura, como nas nuvens. As nuvens parecem se comportar como gases, mas na verdade são misturas de ar (gás) e pequenas partículas de água (líquidas ou sólidas).
A massa de um objeto é uma medida da quantidade de matéria contida nele. Uma forma de medir a massa de um objeto é medir a força necessária para acelerar o objeto. É preciso muito mais força para acelerar um carro do que uma bicicleta, porque o carro tem muito mais massa. Uma forma mais comum de determinar a massa de um objeto é usar uma balança para comparar sua massa com a massa padrão.
Embora o peso esteja relacionado à massa, não é a mesma coisa. O peso se refere à força que a gravidade exerce sobre um objeto. Essa força é diretamente proporcional à massa do objeto. O peso de um objeto muda à medida que a força da gravidade muda, mas sua massa não. A massa de uma astronauta não muda só porque ela vai à lua. Mas seu peso na lua é apenas um sexto do peso terrestre porque a gravidade da lua é apenas um sexto da da Terra. Ela pode se sentir “sem peso” durante sua viagem quando experimenta forças externas insignificantes (gravitacionais ou qualquer outra), embora, é claro, nunca seja “sem massa”.
A lei de conservação da matéria resume muitas observações científicas sobre a matéria: ela afirma que não há mudança detectável na quantidade total de matéria presente quando a matéria se converte de um tipo para outro (uma mudança química) ou mudanças entre os estados sólido, líquido ou gasoso ( uma mudança física). A fabricação de cerveja e a operação de baterias fornecem exemplos da conservação da matéria (Figura\(\PageIndex{4}\)). Durante a fabricação da cerveja, os ingredientes (água, fermento, grãos, malte, lúpulo e açúcar) são convertidos em cerveja (água, álcool, carbonatação e substâncias aromatizantes) sem perda real de substância. Isso é visto com mais clareza durante o processo de engarrafamento, quando a glicose se transforma em etanol e dióxido de carbono e a massa total das substâncias não muda. Isso também pode ser visto em uma bateria de carro de chumbo-ácido: as substâncias originais (chumbo, óxido de chumbo e ácido sulfúrico), capazes de produzir eletricidade, são transformadas em outras substâncias (sulfato de chumbo e água) que não produzem eletricidade, sem alteração na quantidade real de matéria.
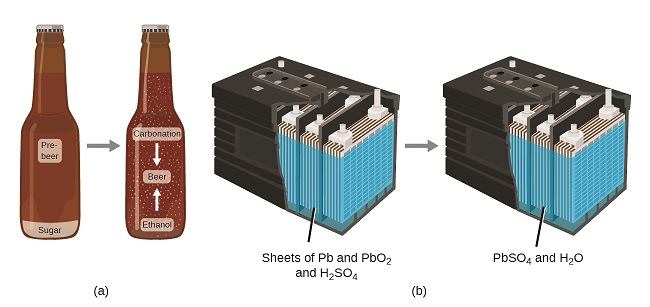
Embora essa lei de conservação seja válida para todas as conversões de matéria, exemplos convincentes são poucos e distantes porque, fora das condições controladas em um laboratório, raramente coletamos todo o material produzido durante uma conversão específica. Por exemplo, quando você come, digere e assimila alimentos, toda a matéria do alimento original é preservada. Mas como parte da matéria é incorporada ao seu corpo e muita é excretada como vários tipos de resíduos, é difícil verificá-la por medição.
Átomos e moléculas
Um átomo é a menor partícula de um elemento que tem as propriedades desse elemento e pode entrar em uma combinação química. Considere o elemento ouro, por exemplo. Imagine cortar uma pepita de ouro ao meio, depois cortar uma das metades ao meio e repetir esse processo até que restasse uma peça de ouro tão pequena que não pudesse ser cortada ao meio (independentemente do tamanho da faca). Esta peça de ouro de tamanho mínimo é um átomo (do grego atomos, que significa “indivisível”) (Figura 1.2.4). Esse átomo não seria mais ouro se fosse dividido ainda mais.

A primeira sugestão de que a matéria é composta de átomos é atribuída aos filósofos gregos Leucipo e Demócrito, que desenvolveram suas ideias no século V aC. No entanto, foi somente no início do século XIX que John Dalton (1766-1844), um professor britânico com grande interesse em ciências, apoiou essa hipótese com medidas quantitativas. Desde aquela época, experimentos repetidos confirmaram muitos aspectos dessa hipótese e ela se tornou uma das teorias centrais da química. Outros aspectos da teoria atômica de Dalton ainda são usados, mas com pequenas revisões (detalhes da teoria de Dalton são fornecidos no capítulo sobre átomos e moléculas).
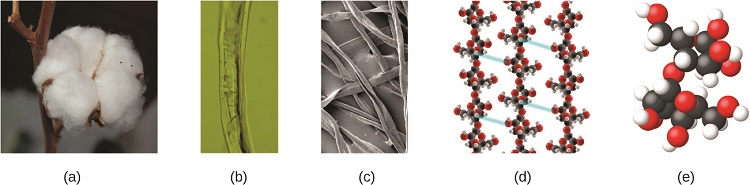
Um átomo é tão pequeno que seu tamanho é difícil de imaginar. Uma das menores coisas que podemos ver a olho nu é um único fio de uma teia de aranha: esses fios têm cerca de 1/10.000 de centímetro (0,0001 cm) de diâmetro. Embora a seção transversal de um fio seja quase impossível de ver sem um microscópio, ela é enorme em escala atômica. Um único átomo de carbono na teia tem um diâmetro de cerca de 0,000000015 centímetros e seriam necessários cerca de 7000 átomos de carbono para abranger o diâmetro do fio. Para colocar isso em perspectiva, se um átomo de carbono fosse do tamanho de uma moeda de dez centavos, a seção transversal de um fio seria maior do que um campo de futebol, o que exigiria cerca de 150 milhões de “moedas” de átomos de carbono para cobri-lo. (Figura\(\PageIndex{5}\)) mostra vistas microscópicas e atômicas cada vez mais próximas do algodão comum.
Um átomo é tão leve que sua massa também é difícil de imaginar. Um bilhão de átomos de chumbo (1.000.000.000 de átomos) pesam cerca de\(3 \times 10^{−13}\) gramas, uma massa muito leve para ser pesada até mesmo nas balanças mais sensíveis do mundo. Exigiria que mais de 300.000.000.000.000 de átomos de chumbo (300 trilhões ou 3 × 10 14) fossem pesados, e eles pesariam apenas 0,0000001 gramas.
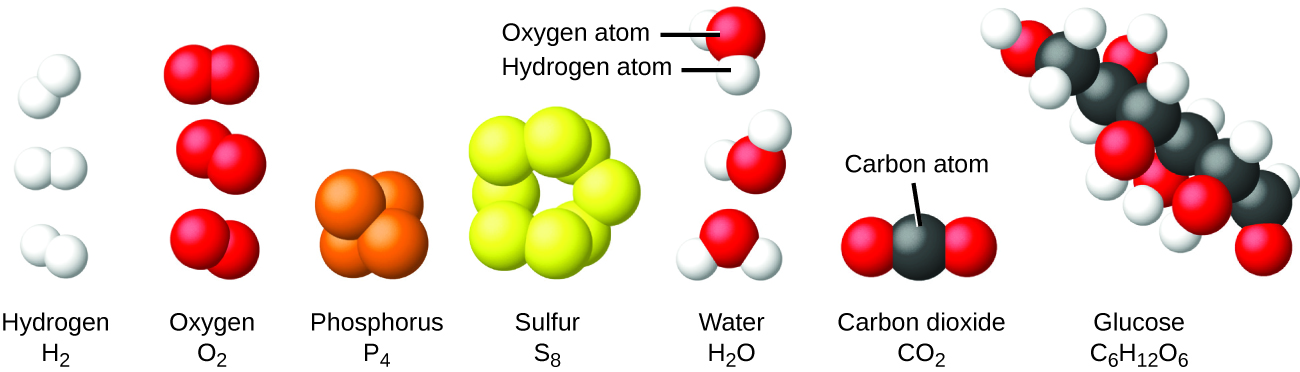
É raro encontrar coleções de átomos individuais. Apenas alguns elementos, como os gases hélio, néon e argônio, consistem em uma coleção de átomos individuais que se movem independentemente uns dos outros. Outros elementos, como os gases hidrogênio, nitrogênio, oxigênio e cloro, são compostos por unidades que consistem em pares de átomos (Figura\(\PageIndex{6}\)). Uma forma do elemento fósforo consiste em unidades compostas por quatro átomos de fósforo. O elemento enxofre existe em várias formas, uma das quais consiste em unidades compostas por oito átomos de enxofre. Essas unidades são chamadas de moléculas. Uma molécula consiste em dois ou mais átomos unidos por fortes forças chamadas ligações químicas. Os átomos de uma molécula se movem como uma unidade, assim como as latas de refrigerante em um pacote de seis ou um monte de chaves unidas em um único chaveiro. Uma molécula pode consistir em dois ou mais átomos idênticos, como nas moléculas encontradas nos elementos hidrogênio, oxigênio e enxofre, ou pode consistir em dois ou mais átomos diferentes, como nas moléculas encontradas na água. Cada molécula de água é uma unidade que contém dois átomos de hidrogênio e um átomo de oxigênio. Cada molécula de glicose é uma unidade que contém 6 átomos de carbono, 12 átomos de hidrogênio e 6 átomos de oxigênio. Como os átomos, as moléculas são incrivelmente pequenas e leves. Se um copo de água comum fosse ampliado até o tamanho da terra, as moléculas de água dentro dele seriam aproximadamente do tamanho de bolas de golfe.
Classificando a matéria
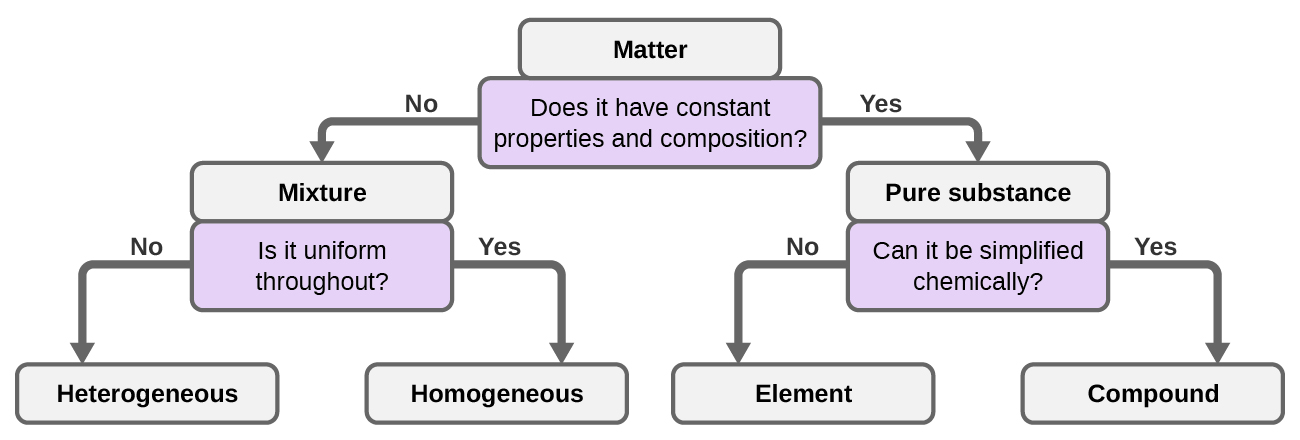
Podemos classificar a matéria em várias categorias. Duas grandes categorias são misturas e substâncias puras. Uma substância pura tem uma composição constante. Todos os espécimes de uma substância pura têm exatamente a mesma composição e propriedades. Qualquer amostra de sacarose (açúcar de mesa) consiste em 42,1% de carbono, 6,5% de hidrogênio e 51,4% de oxigênio em massa. Qualquer amostra de sacarose também tem as mesmas propriedades físicas, como ponto de fusão, cor e doçura, independentemente da fonte da qual seja isolada.
Podemos dividir substâncias puras em duas classes: elementos e compostos. Substâncias puras que não podem ser decompostas em substâncias mais simples por meio de mudanças químicas são chamadas de elementos. Ferro, prata, ouro, alumínio, enxofre, oxigênio e cobre são exemplos familiares dos mais de 100 elementos conhecidos, dos quais cerca de 90 ocorrem naturalmente na Terra, e cerca de duas dúzias foram criadas em laboratórios.
Substâncias puras que podem ser decompostas por mudanças químicas são chamadas de compostos. Essa quebra pode produzir elementos ou outros compostos, ou ambos. O óxido de mercúrio (II), um sólido cristalino laranja, pode ser decomposto pelo calor nos elementos mercúrio e oxigênio (Figura\(\PageIndex{7}\)). Quando aquecido na ausência de ar, o composto sacarose é decomposto no elemento carbono e no composto água. (O estágio inicial desse processo, quando o açúcar fica marrom, é conhecido como caramelização — é isso que confere o sabor característico de doces e nozes às maçãs caramelizadas, cebolas caramelizadas e caramelo). O cloreto de prata (I) é um sólido branco que pode ser decomposto em seus elementos, prata e cloro, por absorção de luz. Essa propriedade é a base para o uso desse composto em filmes fotográficos e óculos fotocrômicos (aqueles com lentes que escurecem quando expostos à luz).

As propriedades dos elementos combinados são diferentes daquelas no estado livre ou não combinado. Por exemplo, o açúcar cristalino branco (sacarose) é um composto resultante da combinação química do elemento carbono, que é um sólido preto em uma de suas formas não combinadas, e dos dois elementos hidrogênio e oxigênio, que são gases incolores quando não combinados. O sódio livre, um elemento que é um sólido metálico macio, brilhante, e o cloro livre, um elemento que é um gás amarelo-esverdeado, se combinam para formar cloreto de sódio (sal de cozinha), um composto que é um sólido branco e cristalino.
Uma mistura é composta por dois ou mais tipos de matéria que podem estar presentes em quantidades variáveis e podem ser separados por mudanças físicas, como evaporação (você aprenderá mais sobre isso posteriormente). Uma mistura com uma composição que varia de ponto a ponto é chamada de mistura heterogênea. O molho italiano é um exemplo de mistura heterogênea (Figura\(\PageIndex{1a}\)). Sua composição pode variar porque podemos fabricá-la com quantidades variadas de óleo, vinagre e ervas. Não é o mesmo de um ponto a outro em toda a mistura — uma gota pode ser principalmente vinagre, enquanto uma gota diferente pode ser principalmente óleo ou ervas porque o azeite e o vinagre se separam e as ervas assentam. Outros exemplos de misturas heterogêneas são biscoitos de chocolate (podemos ver os pedaços separados de chocolate, nozes e massa de biscoito) e granito (podemos ver quartzo, mica, feldspato e muito mais).
Uma mistura homogênea, também chamada de solução, exibe uma composição uniforme e parece visualmente a mesma por toda parte. Um exemplo de solução é uma bebida esportiva, composta por água, açúcar, corante, aromatizante e eletrólitos misturados uniformemente (Figura\(\PageIndex{1b}\)). Cada gota de uma bebida esportiva tem o mesmo sabor porque cada gota contém as mesmas quantidades de água, açúcar e outros componentes. Observe que a composição de uma bebida esportiva pode variar — ela pode ser feita com um pouco mais ou menos de açúcar, aromatizantes ou outros componentes e ainda ser uma bebida esportiva. Outros exemplos de misturas homogêneas incluem ar, xarope de ácer, gasolina e uma solução de sal na água.

Embora existam pouco mais de 100 elementos, dezenas de milhões de compostos químicos resultam de diferentes combinações desses elementos. Cada composto tem uma composição específica e possui propriedades químicas e físicas definidas pelas quais podemos distingui-lo de todos os outros compostos. E, claro, existem inúmeras maneiras de combinar elementos e compostos para formar diferentes misturas. Um resumo de como distinguir entre as várias classificações principais da matéria é mostrado em (Figura 1.2.8).
Onze elementos compõem cerca de 99% da crosta terrestre e da atmosfera (Tabela\(\PageIndex{1}\)). O oxigênio constitui quase a metade e o silício cerca de um quarto da quantidade total desses elementos. A maioria dos elementos na Terra é encontrada em combinações químicas com outros elementos; cerca de um quarto dos elementos também são encontrados no estado livre.
| Elemento | Símbolo | Massa percentual | Elemento | Símbolo | Massa percentual | |
|---|---|---|---|---|---|---|
| oxigênio | O | 49,20 | cloro | Cl | 0,19 | |
| silício | Si | 25,67 | fósforo | P | 0,11 | |
| alumínio | Al | 7,50 | manganês | Mn | 0,09 | |
| ferro | Fe | 4,71 | carbono | C | 0,08 | |
| cálcio | Ca | 3,39 | enxofre | S | 0,06 | |
| sódio | Na | 2,63 | bário | Ba | 0,04 | |
| potássio | K | 2,40 | azoto | N | 0,03 | |
| magnésio | Mg | 1,93 | flúor | F | 0,03 | |
| hidrogênio | H | 0,87 | estrôncio | Sr | 0,02 | |
| titânio | Ti | 0,58 | todos os outros | - | 0,47 |
Decomposição da Água/Produção de Hidrogênio
A água consiste nos elementos hidrogênio e oxigênio combinados na proporção de 2 para 1. A água pode ser decomposta em gases de hidrogênio e oxigênio pela adição de energia. Uma forma de fazer isso é com uma bateria ou fonte de alimentação, conforme mostrado em (Figura\(\PageIndex{9}\)).
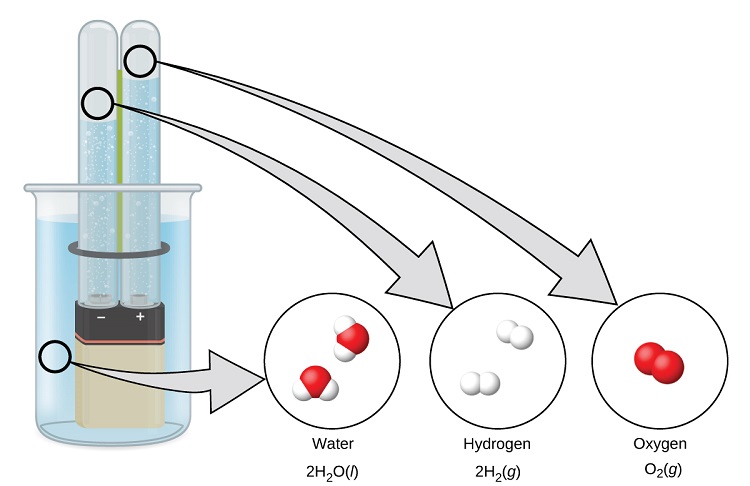
A quebra da água envolve um rearranjo dos átomos das moléculas de água em moléculas diferentes, cada uma composta por dois átomos de hidrogênio e dois átomos de oxigênio, respectivamente. Duas moléculas de água formam uma molécula de oxigênio e duas moléculas de hidrogênio. A representação do que ocorre,\(\ce{2H2O}(l)\rightarrow \ce{2H2}(g)+\ce{O2}(g)\), será explorada com mais profundidade nos capítulos posteriores.
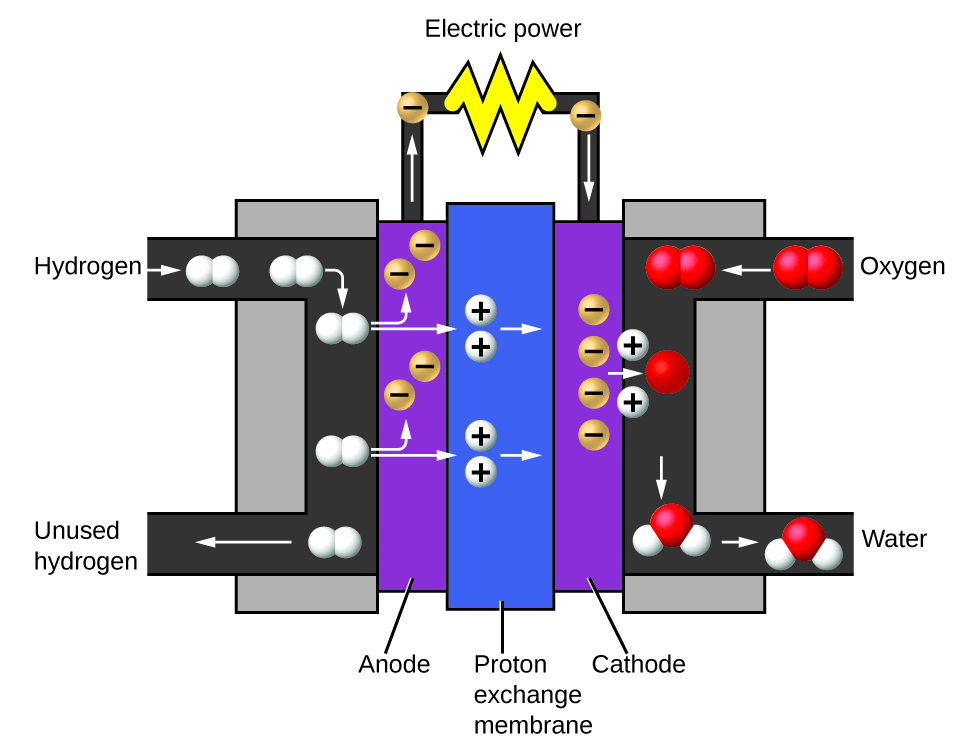
Os dois gases produzidos têm propriedades distintamente diferentes. O oxigênio não é inflamável, mas é necessário para a combustão de um combustível, e o hidrogênio é altamente inflamável e uma fonte de energia potente. Como esse conhecimento pode ser aplicado em nosso mundo? Uma aplicação envolve pesquisas sobre um transporte mais eficiente em termos de combustível. Veículos com células de combustível (FCV) funcionam com hidrogênio em vez de gasolina (Figura\(\PageIndex{10}\)). Eles são mais eficientes do que veículos com motores de combustão interna, não poluem e reduzem as emissões de gases de efeito estufa, tornando-nos menos dependentes de combustíveis fósseis. No entanto, os FCVs ainda não são economicamente viáveis, e a produção atual de hidrogênio depende do gás natural. Se pudermos desenvolver um processo para decompor economicamente a água ou produzir hidrogênio de outra forma ambientalmente correta, os FCVs podem ser o caminho do futuro.
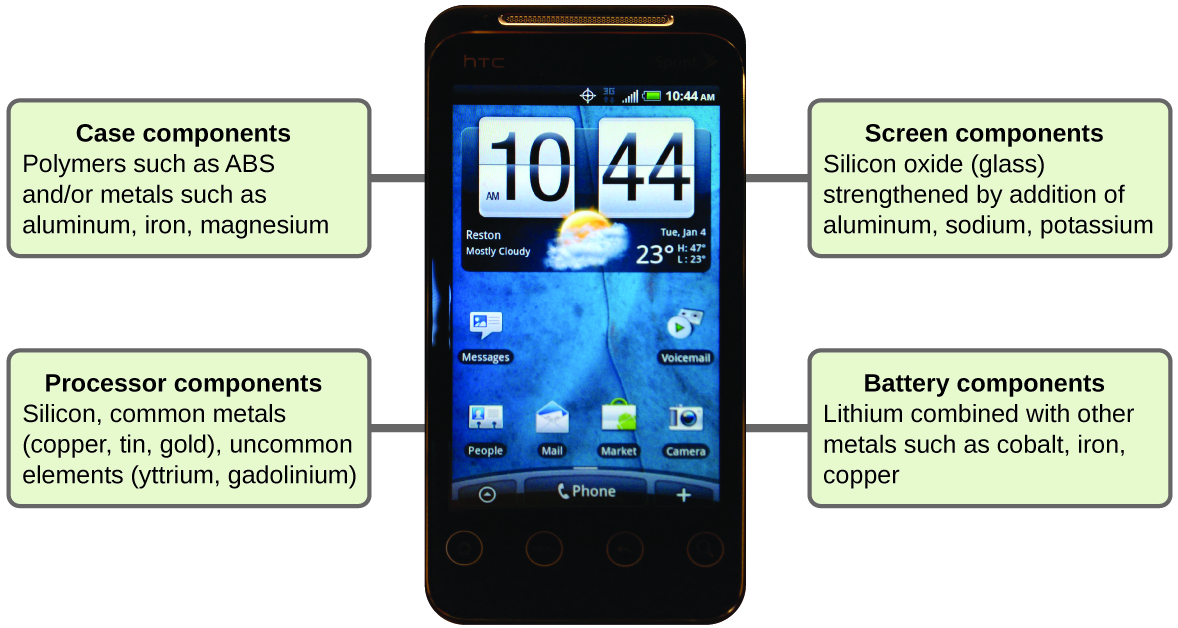
Química dos telefones celulares
Imagine como sua vida seria diferente sem telefones celulares (Figura\(\PageIndex{11}\)) e outros dispositivos inteligentes. Os telefones celulares são feitos de várias substâncias químicas, que são extraídas, refinadas, purificadas e montadas usando uma compreensão extensa e aprofundada dos princípios químicos. Cerca de 30% dos elementos encontrados na natureza são encontrados em um smartphone típico. A caixa/corpo/estrutura consiste em uma combinação de polímeros resistentes e duráveis compostos principalmente de carbono, hidrogênio, oxigênio e nitrogênio [termoplásticos de acrilonitrila butadieno estireno (ABS) e policarbonato] e metais estruturais leves e fortes, como alumínio, magnésio e ferro. A tela é feita de um vidro especialmente temperado (vidro de sílica reforçado pela adição de alumínio, sódio e potássio) e revestida com um material para torná-la condutora (como óxido de índio e estanho). A placa de circuito usa um material semicondutor (geralmente silício); metais comumente usados, como cobre, estanho, prata e ouro; e elementos mais desconhecidos, como ítrio, praseodímio e gadolínio. A bateria depende de íons de lítio e uma variedade de outros materiais, incluindo ferro, cobalto, cobre, óxido de polietileno e poliacrilonitrila.
Resumo
Matéria é qualquer coisa que ocupe espaço e tenha massa. O elemento básico da matéria é o átomo, a menor unidade de um elemento que pode entrar em combinações com átomos do mesmo ou de outros elementos. Em muitas substâncias, os átomos são combinados em moléculas. Na Terra, a matéria geralmente existe em três estados: sólidos, de forma e volume fixos; líquidos, de forma variável, mas de volume fixo; e gases, de forma e volume variáveis. Em condições de alta temperatura, a matéria também pode existir como plasma. A maior parte da matéria é uma mistura: ela é composta por dois ou mais tipos de matéria que podem estar presentes em quantidades variáveis e podem ser separados por meios físicos. As misturas heterogêneas variam em composição de ponto a ponto; misturas homogêneas têm a mesma composição de ponto a ponto. As substâncias puras consistem em apenas um tipo de matéria. Uma substância pura pode ser um elemento, que consiste em apenas um tipo de átomo e não pode ser decomposto por uma mudança química, ou um composto, que consiste em dois ou mais tipos de átomos.
Glossário
- átomo
- menor partícula de um elemento que pode entrar em uma combinação química
- composto
- substância pura que pode ser decomposta em dois ou mais elementos
- elemento
- substância que é composta por um único tipo de átomo; uma substância que não pode ser decomposta por uma mudança química
- gás
- estado em que a matéria não tem volume nem forma definidos
- mistura heterogênea
- combinação de substâncias com uma composição que varia de ponto a ponto
- mistura homogênea
- (também, solução) combinação de substâncias com uma composição uniforme por toda parte
- líquido
- estado da matéria que tem um volume definido, mas uma forma indefinida
- lei de conservação da matéria
- quando a matéria se converte de um tipo para outro ou muda de forma, não há mudança detectável na quantidade total de matéria presente
- massa
- propriedade fundamental indicando quantidade de matéria
- importam
- qualquer coisa que ocupe espaço e tenha massa
- mistura
- matéria que pode ser separada em seus componentes por meios físicos
- molécula
- coleção colada de dois ou mais átomos do mesmo elemento ou de elementos diferentes
- plasma
- estado gasoso da matéria contendo um grande número de átomos e/ou moléculas eletricamente carregadas
- substância pura
- substância homogênea que tem uma composição constante
- sólido
- estado da matéria que é rígido, tem uma forma definida e tem um volume bastante constante
- peso
- força que a gravidade exerce sobre um objeto


