12.4: Engenharia Genética - Riscos, benefícios e percepções
- Page ID
- 181722
Objetivos de
- Resuma os mecanismos, riscos e benefícios potenciais da terapia gênica
- Identifique questões éticas envolvendo a terapia genética e as agências reguladoras que supervisionam os ensaios clínicos
- Compare a terapia genética com células somáticas e germinativas
Muitos tipos de engenharia genética produziram benefícios claros com poucos riscos aparentes. Poucos questionariam, por exemplo, o valor de nosso suprimento agora abundante de insulina humana produzida por bactérias geneticamente modificadas. No entanto, muitas aplicações emergentes da engenharia genética são muito mais controversas, muitas vezes porque seus benefícios potenciais são confrontados com riscos significativos, reais ou percebidos. Esse é certamente o caso da terapia gênica, uma aplicação clínica da engenharia genética que pode um dia fornecer uma cura para muitas doenças, mas ainda é em grande parte uma abordagem experimental do tratamento.
Mecanismos e riscos da terapia gênica
As doenças humanas que resultam de mutações genéticas costumam ser difíceis de tratar com medicamentos ou outras formas tradicionais de terapia porque os sinais e sintomas da doença resultam de anormalidades no genoma do paciente. Por exemplo, um paciente pode ter uma mutação genética que impede a expressão de uma proteína específica necessária para o funcionamento normal de um determinado tipo de célula. É o caso de pacientes com Imunodeficiência Combinada Grave (SCID), uma doença genética que prejudica a função de certos glóbulos brancos essenciais ao sistema imunológico.
A terapia gênica tenta corrigir anormalidades genéticas introduzindo um gene funcional não mutado no genoma do paciente. O gene não mutado codifica uma proteína funcional que, de outra forma, o paciente seria incapaz de produzir. Vetores virais como o adenovírus às vezes são usados para introduzir o gene funcional; parte do genoma viral é removida e substituída pelo gene desejado (Figura\(\PageIndex{1}\)). Formas mais avançadas de terapia gênica tentam corrigir a mutação no local original do genoma, como é o caso do tratamento da SCID.
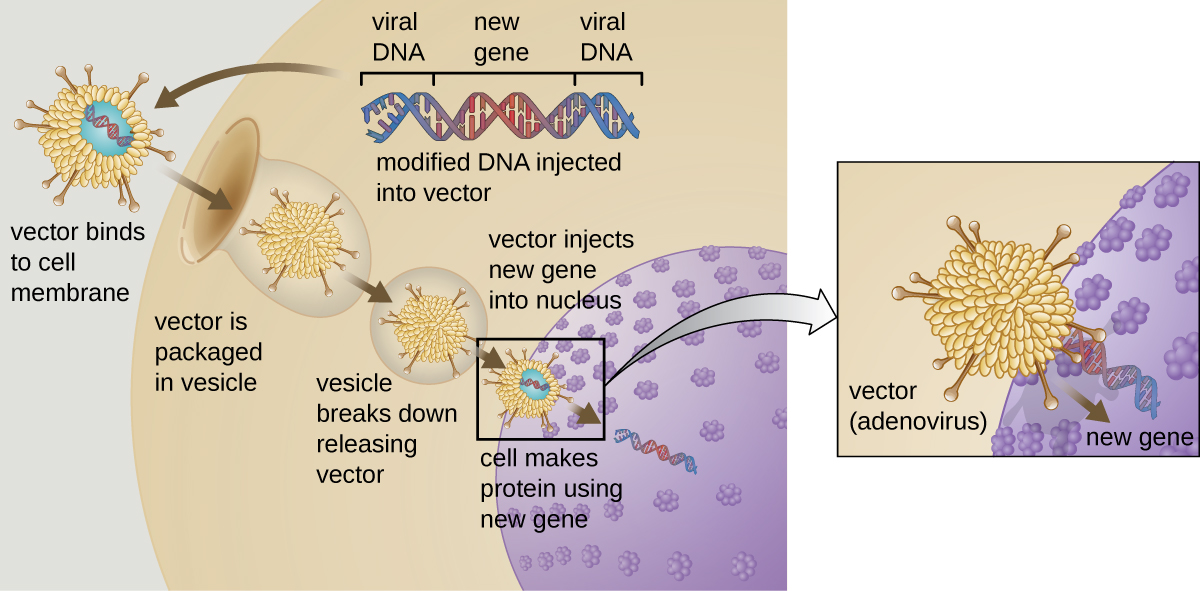
Até o momento, as terapias gênicas têm se mostrado relativamente ineficazes, com as possíveis exceções dos tratamentos para fibrose cística e deficiência de adenosina desaminase, um tipo de SCID. Outros estudos mostraram os riscos claros de tentar manipulação genética em organismos multicelulares complexos, como humanos. Em alguns pacientes, o uso de um vetor de adenovírus pode desencadear uma resposta inflamatória inesperada do sistema imunológico, o que pode levar à falência de órgãos. Além disso, como os vírus geralmente podem atingir vários tipos de células, o vetor do vírus pode infectar células não direcionadas à terapia, danificando essas outras células e possivelmente levando a doenças como câncer. Outro risco potencial é que o vírus modificado possa voltar a ser infeccioso e causar doenças no paciente. Por fim, existe o risco de que o gene inserido possa inativar involuntariamente outro gene importante no genoma do paciente, interrompendo o ciclo celular normal e possivelmente levando à formação de tumores e câncer. Como a terapia genética envolve muitos riscos, os candidatos à terapia genética precisam estar totalmente informados sobre esses riscos antes de fornecer consentimento informado para se submeter à terapia.
Terapia genética que deu errado
Os riscos da terapia genética foram percebidos no caso de 1999 de Jesse Gelsinger, um paciente de 18 anos que recebeu terapia genética como parte de um ensaio clínico na Universidade da Pensilvânia. Jesse recebeu terapia genética para uma condição chamada deficiência de ornitina transcarbamilase (OTC), que leva ao acúmulo de amônia no sangue devido ao processamento deficiente de amônia. Quatro dias após o tratamento, Jesse morreu após uma resposta imune massiva ao vetor do adenovírus. 1
Até aquele momento, os pesquisadores não haviam realmente considerado uma resposta imune ao vetor um risco legítimo, mas, na investigação, parece que os pesquisadores tinham algumas evidências sugerindo que esse era um possível resultado. Antes do tratamento de Jesse, vários outros pacientes humanos sofreram efeitos colaterais do tratamento, e três macacos usados em um estudo morreram como resultado de distúrbios inflamatórios e de coagulação. Apesar dessa informação, parece que nem Jesse nem sua família foram informados desses resultados quando consentiram com a terapia. A morte de Jesse foi a primeira morte do paciente devido a um tratamento de terapia genética e resultou na interrupção imediata do ensaio clínico no qual ele estava envolvido, na interrupção subsequente de todos os outros ensaios de terapia genética na Universidade da Pensilvânia e na investigação de todos os outros ensaios de terapia gênica no Estados Unidos. Como resultado, a regulamentação e a supervisão da terapia genética em geral foram reexaminadas, resultando em novos protocolos regulatórios que ainda estão em vigor hoje.
Exercício\(\PageIndex{1}\)
- Explique como a terapia genética funciona em teoria.
- Identifique alguns riscos da terapia genética.
Supervisão da terapia gênica
Atualmente, há uma supervisão significativa dos ensaios clínicos de terapia gênica. No nível federal, três agências regulam a terapia genética em paralelo: a Food and Drug Administration (FDA), o Office of Human Research Protection (OHRP) e o Recombinant DNA Advisory Committee (RAC) do National Institutes of Health (NIH). Junto com várias agências locais, essas agências federais interagem com o conselho de revisão institucional para garantir que os protocolos estejam em vigor para proteger a segurança do paciente durante os ensaios clínicos. A conformidade com esses protocolos é aplicada principalmente em nível local, em cooperação com as agências federais. Atualmente, as terapias genéticas estão sob a mais extensa revisão federal e local em comparação com outros tipos de terapias, que geralmente estão sob a revisão do FDA. Alguns pesquisadores acreditam que essas regulamentações extensas realmente inibem o progresso na pesquisa em terapia gênica. Em 2013, o Instituto de Medicina (agora Academia Nacional de Medicina) pediu ao NIH que relaxasse sua revisão dos ensaios de terapia genética na maioria dos casos. 2 No entanto, garantir a segurança do paciente continua sendo a maior preocupação.
Preocupações éticas
Além dos riscos à saúde da terapia genética, a capacidade de modificar geneticamente os humanos apresenta uma série de questões éticas relacionadas aos limites dessa “terapia”. Embora a pesquisa atual esteja focada na terapia genética para doenças genéticas, os cientistas podem um dia aplicar esses métodos para manipular outras características genéticas não consideradas desejáveis. Isso levanta questões como:
Exercício\(\PageIndex{2}\)
- Quais características genéticas merecem ser “corrigidas”?
- A terapia genética deve ser usada por motivos cosméticos ou para melhorar as habilidades humanas?
- A manipulação genética deve ser usada para transmitir características desejáveis ao nascituro?
- Todos têm direito à terapia genética ou o custo da terapia genética poderia criar novas formas de desigualdade social?
- Quem deve ser responsável por regular e policiar o uso inadequado de terapias genéticas?
A capacidade de alterar as células reprodutivas usando terapia gênica também pode gerar novos dilemas éticos. Até o momento, os vários tipos de terapias genéticas foram direcionados às células somáticas, as células não reprodutivas do corpo. Como as características das células somáticas não são herdadas, quaisquer alterações genéticas realizadas pela terapia gênica com células somáticas não seriam transmitidas à prole. No entanto, se os cientistas introduzirem com sucesso novos genes nas células germinativas (óvulos ou espermatozóides), as características resultantes poderão ser transmitidas aos filhotes. Essa abordagem, chamada de terapia genética germinativa, poderia potencialmente ser usada para combater doenças hereditárias, mas também pode levar a consequências não intencionais para as gerações futuras. Além disso, há a questão do consentimento informado, porque aqueles afetados pela terapia genética germinativa não nascem e, portanto, não conseguem escolher se recebem a terapia. Por esses motivos, o governo dos EUA atualmente não financia projetos de pesquisa que investiguem terapias genéticas de linhagem germinativa em humanos.
Terapias genéticas arriscadas
Embora atualmente não existam terapias genéticas no mercado nos Estados Unidos, muitas estão em andamento e é provável que algumas venham a ser aprovadas. Com os recentes avanços nas terapias genéticas direcionadas ao p53, um gene cujas mutações de células somáticas foram implicadas em mais de 50% dos cânceres humanos, 3 tratamentos de câncer por meio de terapias genéticas podem se tornar muito mais difundidos quando chegarem ao mercado comercial.
A introdução de qualquer nova terapia no mercado coloca questões éticas que comparam os benefícios esperados aos riscos. Com que rapidez novas terapias devem ser trazidas ao mercado? Como podemos garantir que as novas terapias tenham sido suficientemente testadas quanto à segurança e eficácia antes de serem comercializadas ao público? O processo pelo qual novas terapias são desenvolvidas e aprovadas complica essas questões, pois os envolvidos no processo de aprovação geralmente estão sob pressão significativa para obter a aprovação de uma nova terapia, mesmo diante de riscos significativos.
Para receber a aprovação do FDA para uma nova terapia, os pesquisadores devem coletar dados laboratoriais significativos de testes em animais e enviar uma solicitação de novo medicamento experimental (IND) ao Centro de Avaliação e Pesquisa de Medicamentos (CDER) da FDA. Após um período de espera de 30 dias durante o qual o FDA revisa o IND, ensaios clínicos envolvendo seres humanos podem começar. Se o FDA perceber um problema antes ou durante o ensaio clínico, o FDA pode solicitar uma “suspensão clínica” até que qualquer problema seja resolvido. Durante os ensaios clínicos, os pesquisadores coletam e analisam dados sobre a eficácia e segurança da terapia, incluindo quaisquer efeitos colaterais observados. Uma vez que a terapia atenda aos padrões de eficácia e segurança da FDA, os desenvolvedores podem enviar uma nova aplicação de medicamento (NDA) que detalha como a terapia será fabricada, embalada, monitorada e administrada.
Como as novas terapias genéticas são frequentemente o resultado de muitos anos (até décadas) de pesquisas laboratoriais e clínicas, elas exigem um investimento financeiro significativo. Quando a terapia chega à fase de testes clínicos, os riscos financeiros são altos para as empresas farmacêuticas e seus acionistas. Isso cria potenciais conflitos de interesse que às vezes podem afetar o julgamento objetivo dos pesquisadores, seus financiadores e até mesmo dos participantes do estudo. O caso Jesse Gelsinger (veja Case in Point: Gene Therapy Gone Wrong) é um exemplo clássico. Diante de uma doença fatal e da ausência de tratamentos razoáveis disponíveis, é fácil ver por que um paciente pode estar ansioso para participar de um ensaio clínico, independentemente dos riscos. Também é fácil ver como um pesquisador pode ver os riscos de curto prazo para um pequeno grupo de participantes do estudo como um pequeno preço a pagar pelos benefícios potenciais de um novo tratamento revolucionário.
A morte de Gelsinger levou a um maior escrutínio da terapia genética, e os resultados negativos subsequentes da terapia gênica resultaram na interrupção temporária dos ensaios clínicos, aguardando uma investigação mais aprofundada. Por exemplo, quando crianças na França tratadas com terapia genética para SCID começaram a desenvolver leucemia vários anos após o tratamento, o FDA interrompeu temporariamente os ensaios clínicos de tipos similares de terapia gênica ocorridos nos Estados Unidos. 4 casos como esses destacam a necessidade de pesquisadores e profissionais de saúde não apenas valorizarem o bem-estar humano e os direitos dos pacientes sobre a lucratividade, mas também manterem a objetividade científica ao avaliar os riscos e benefícios de novas terapias.
Exercício\(\PageIndex{3}\)
- Por que a pesquisa em terapia genética é tão rigorosamente regulamentada?
- Qual é a principal preocupação ética associada à terapia gênica germinativa?
Conceitos principais e resumo
- Embora a terapia genética seja muito promissora para o tratamento de doenças genéticas, também há riscos significativos envolvidos.
- Há uma considerável regulamentação federal e local do desenvolvimento de terapias genéticas por empresas farmacêuticas para uso em humanos.
- Antes que o uso da terapia genética possa aumentar dramaticamente, há muitas questões éticas que precisam ser abordadas pelas comunidades médicas e de pesquisa, políticos e pela sociedade em geral.
Notas de pé
- 1 Barbara Sibbald. “Morte, mas uma consequência não intencional do estudo de terapia genética”. Jornal 164 da Associação Médica Canadense nº 11 (2001): 1612—1612.
- 2 Kerry Greens. “Relatório: Ease Gene Therapy Reviews.” The Scientist, 9 de dezembro de 2013. http://www.the-scientist.com/?articl...erapy-Reviews/. Acessado em 27 de maio de 2016.
- 3 Zhen Wang e Yi Sun. “Direcionando o p53 para uma nova terapia anticâncer.” Oncologia translacional 3, nº 1 (2010): 1—12.
- 4 Erika Check. “Terapia gênica: um revés trágico”. Nature 420 nº 6912 (2002): 116—118.


