9.1: Como os micróbios crescem
- Page ID
- 181758
objetivos de aprendizagem
- Defina o tempo de geração para o crescimento com base na fissão binária
- Identificar e descrever as atividades de microrganismos submetidos a fases típicas de fissão binária (divisão celular simples) em uma curva de crescimento
- Explicar vários métodos laboratoriais usados para determinar a contagem total e viável de células em populações em crescimento exponencial
- Descreva exemplos de divisão celular que não envolve fissão binária, como brotamento ou fragmentação
- Descreva a formação e as características dos biofilmes
- Identifique os riscos à saúde associados aos biofilmes e como eles são abordados
- Descreva a detecção de quórum e seu papel na comunicação célula a célula e na coordenação das atividades celulares
Jeni, uma mulher grávida de 24 anos no segundo trimestre, visita uma clínica com queixas de febre alta, 38,9 °C (102 °F), fadiga e dores musculares — sinais e sintomas típicos da gripe. Jeni se exercita regularmente e segue uma dieta nutritiva com ênfase em alimentos orgânicos, incluindo leite cru que ela compra em um mercado agrícola local. Todas as imunizações dela estão em dia. No entanto, o profissional de saúde que atende Jeni está preocupado e solicita que uma amostra de sangue seja enviada para teste pelo laboratório de microbiologia.
Exercício\(\PageIndex{1}\)
Por que o profissional de saúde está preocupado com os sinais e sintomas de Jeni?
O ciclo celular bacteriano envolve a formação de novas células por meio da replicação do DNA e da partição dos componentes celulares em duas células-filhas. Em procariontes, a reprodução é sempre assexuada, embora ocorra uma extensa recombinação genética na forma de transferência horizontal de genes, como será explorado em um capítulo diferente. A maioria das bactérias tem um único cromossomo circular; no entanto, existem algumas exceções. Por exemplo, Borrelia burgdorferi, o agente causador da doença de Lyme, tem um cromossomo linear.
Fissão binária
O mecanismo mais comum de replicação celular em bactérias é um processo chamado fissão binária, que é representado na Figura\(\PageIndex{1}\):. Antes de se dividir, a célula cresce e aumenta seu número de componentes celulares. Em seguida, a replicação do DNA começa em um local no cromossomo circular chamado origem da replicação, onde o cromossomo está ligado à membrana interna da célula. A replicação continua em direções opostas ao longo do cromossomo até que o terminal seja alcançado.
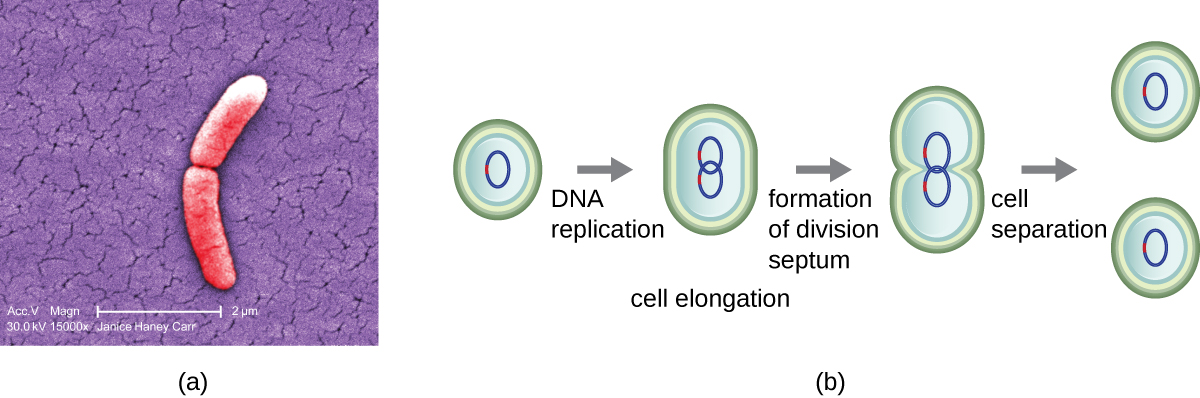
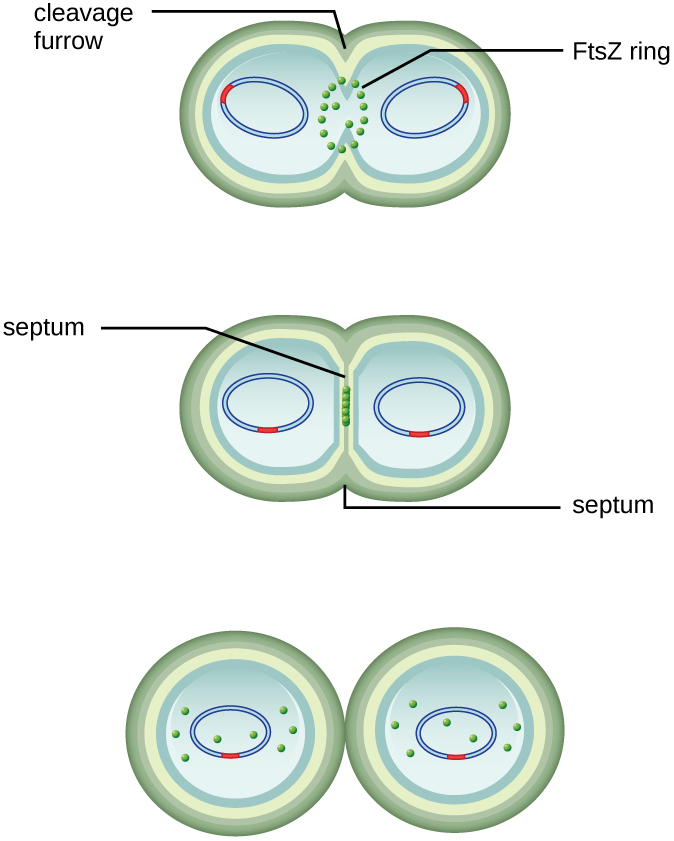
O centro da célula aumentada se contrai até que duas células-filhas sejam formadas, cada prole recebendo uma cópia completa do genoma parental e uma divisão do citoplasma (citocinese). Esse processo de citocinese e divisão celular é dirigido por uma proteína chamada ftSz. O FTsZ se reúne em um anel Z na membrana citoplasmática (Figura\(\PageIndex{2}\)). O anel Z é ancorado por proteínas de ligação ao FTSZ e define o plano de divisão entre as duas células filhas. Proteínas adicionais necessárias para a divisão celular são adicionadas ao anel Z para formar uma estrutura chamada divissoma. O divisoma é ativado para produzir uma parede celular peptidoglicana e construir um septo que divide as duas células-filhas. As células filhas são separadas pelo septo de divisão, onde todas as camadas externas das células (a parede celular e as membranas externas, se presentes) devem ser remodeladas para completar a divisão. Por exemplo, sabemos que enzimas específicas quebram as ligações entre os monômeros nos peptidoglicanos e permitem a adição de novas subunidades ao longo do septo de divisão.
Exercício\(\PageIndex{2}\)
Qual é o nome da proteína que se reúne em um anel Z para iniciar a citocinese e a divisão celular?
Tempo de geração
Em organismos eucarióticos, o tempo de geração é o tempo entre os mesmos pontos do ciclo de vida em duas gerações sucessivas. Por exemplo, o tempo de geração típico para a população humana é de 25 anos. Essa definição não é prática para bactérias, que podem se reproduzir rapidamente ou permanecer inativas por milhares de anos. Em procariontes (bactérias e arqueias), o tempo de geração também é chamado de tempo de duplicação e é definido como o tempo que a população leva para dobrar por meio de uma rodada de fissão binária. Os tempos de duplicação bacteriana variam enormemente. Enquanto a Escherichia coli pode dobrar em apenas 20 minutos em condições ideais de crescimento em laboratório, bactérias da mesma espécie podem precisar de vários dias para dobrar em ambientes especialmente adversos. A maioria dos patógenos cresce rapidamente, como a E. coli, mas há exceções. Por exemplo, o Mycobacterium tuberculosis, o agente causador da tuberculose, tem um tempo de geração entre 15 e 20 horas. Por outro lado, M. leprae, que causa a hanseníase (hanseníase), cresce muito mais lentamente, com um tempo de duplicação de 14 dias.
Calculando o número de células
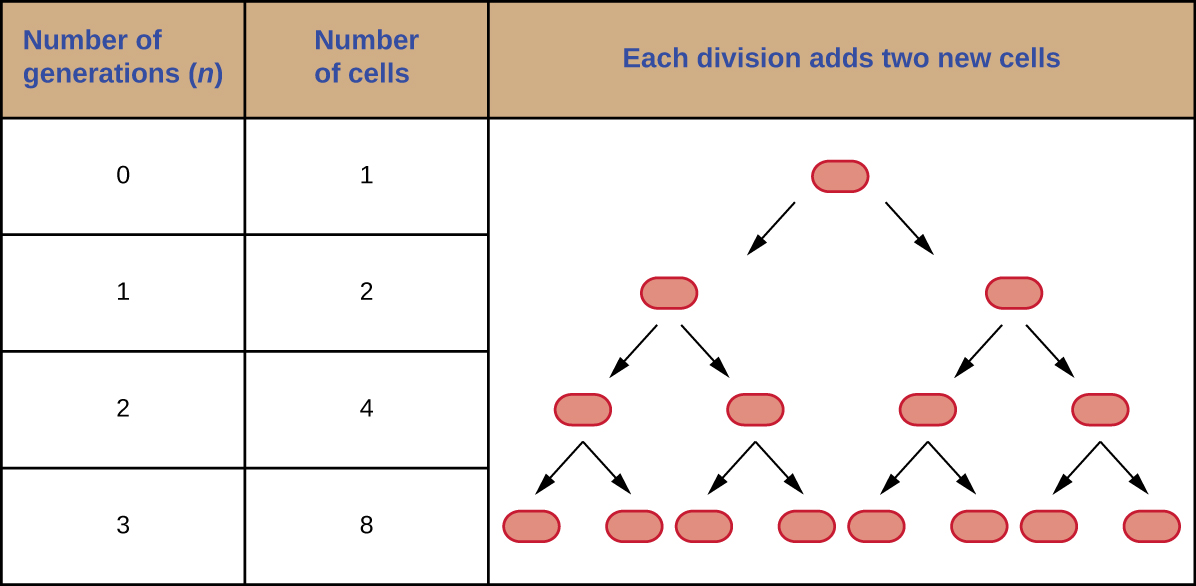
É possível prever o número de células em uma população quando elas se dividem por fissão binária a uma taxa constante. Como exemplo, considere o que acontece se uma única célula se dividir a cada 30 minutos por 24 horas. O diagrama na Figura\(\PageIndex{3}\) mostra o aumento no número de células nas primeiras três gerações.
O número de células aumenta exponencialmente e pode ser expresso como 2 n, onde n é o número de gerações. Se as células se dividirem a cada 30 minutos, após 24 horas, 48 divisões teriam ocorrido. Se aplicarmos a fórmula 2 n, onde n é igual a 48, a célula única daria origem a 2 48 ou 281.474.976.710.656 células em 48 gerações (24 horas). Ao lidar com números tão grandes, é mais prático usar a notação científica. Portanto, expressamos o número de células como 2,8 × 10 14 células.
Em nosso exemplo, usamos uma célula como o número inicial de células. Para qualquer número de células iniciais, a fórmula é adaptada da seguinte forma:
\[N_n = N_02^n\]
N n é o número de células em qualquer geração n, N 0 é o número inicial de células e n é o número de gerações.
Exercício\(\PageIndex{3}\)
Com um tempo de duplicação de 30 minutos e um tamanho populacional inicial de 1 × 10 5 células, quantas células estarão presentes após 2 horas, supondo que não haja morte celular?
A curva de crescimento
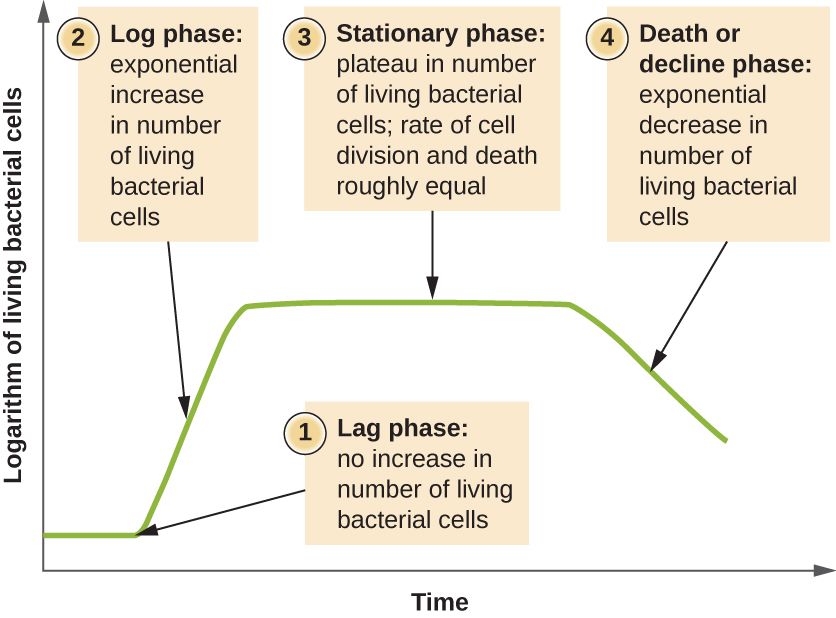
Os microrganismos cultivados em cultura fechada (também conhecida como cultura em lote), em que nenhum nutriente é adicionado e a maioria dos resíduos não é removida, seguem um padrão de crescimento reprodutível conhecido como curva de crescimento. Um exemplo de cultura em lote na natureza é uma lagoa na qual um pequeno número de células cresce em um ambiente fechado. A densidade da cultura é definida como o número de células por unidade de volume. Em um ambiente fechado, a densidade da cultura também é uma medida do número de células na população. As infecções do corpo nem sempre seguem a curva de crescimento, mas podem existir correlações dependendo do local e do tipo de infecção. Quando o número de células vivas é plotado em relação ao tempo, fases distintas podem ser observadas na curva (Figura\(\PageIndex{4}\)).
A fase de atraso
O início da curva de crescimento representa um pequeno número de células, conhecido como inóculo, que são adicionadas a um meio de cultura fresco, um caldo nutricional que apoia o crescimento. A fase inicial da curva de crescimento é chamada de fase de atraso, durante a qual as células estão se preparando para a próxima fase de crescimento. O número de células não muda durante a fase de atraso; no entanto, as células crescem e são metabolicamente ativas, sintetizando as proteínas necessárias para crescer dentro do meio. Se alguma célula foi danificada ou chocada durante a transferência para o novo meio, o reparo ocorre durante a fase de atraso. A duração da fase de defasagem é determinada por muitos fatores, incluindo a espécie e a composição genética das células, a composição do meio e o tamanho do inóculo original.
A fase de registro
Na fase de crescimento logarítmico (log), às vezes chamada de fase de crescimento exponencial, as células estão se dividindo ativamente por fissão binária e seu número aumenta exponencialmente. Para qualquer espécie bacteriana, o tempo de geração sob condições específicas de crescimento (nutrientes, temperatura, pH e assim por diante) é determinado geneticamente, e esse tempo de geração é chamado de taxa de crescimento intrínseca. Durante a fase logarítmica, a relação entre o tempo e o número de células não é linear, mas exponencial; no entanto, a curva de crescimento é frequentemente traçada em um gráfico semilogarítmico, conforme mostrado na Figura\(\PageIndex{5}\), o que dá a aparência de uma relação linear.
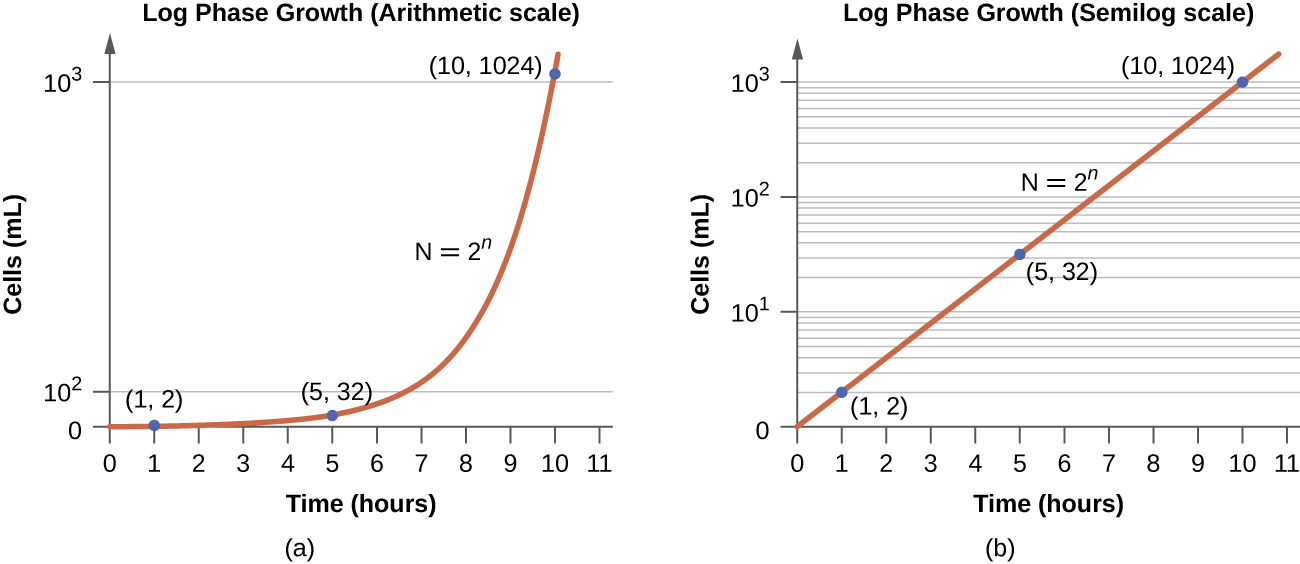
As células na fase logarítmica mostram taxa de crescimento constante e atividade metabólica uniforme. Por esse motivo, as células na fase logarítmica são usadas preferencialmente para aplicações industriais e trabalhos de pesquisa. A fase logarítmica também é a fase em que as bactérias são mais suscetíveis à ação de desinfetantes e antibióticos comuns que afetam a síntese de proteínas, DNA e parede celular.
Fase estacionária
À medida que o número de células aumenta durante a fase logarítmica, vários fatores contribuem para uma desaceleração da taxa de crescimento. Os resíduos se acumulam e os nutrientes são gradualmente esgotados. Além disso, a depleção gradual de oxigênio começa a limitar o crescimento celular aeróbico. Essa combinação de condições desfavoráveis retarda e, finalmente, impede o crescimento populacional. O número total de células vivas atinge um platô conhecido como fase estacionária (Figura\(\PageIndex{4}\)). Nessa fase, o número de novas células criadas pela divisão celular agora é equivalente ao número de células morrendo; portanto, a população total de células vivas está relativamente estagnada. A densidade da cultura em uma cultura estacionária é constante. A capacidade de carga da cultura, ou densidade máxima de cultura, depende dos tipos de microrganismos na cultura e das condições específicas da cultura; no entanto, a capacidade de carga é constante para um determinado organismo cultivado nas mesmas condições.
Durante a fase estacionária, as células mudam para um modo de sobrevivência do metabolismo. À medida que o crescimento diminui, o mesmo acontece com a síntese de peptidoglicanos, proteínas e ácidos nucléicos; portanto, culturas estacionárias são menos suscetíveis a antibióticos que interrompem esses processos. Em bactérias capazes de produzir endosporos, muitas células sofrem esporulação durante a fase estacionária. Metabólitos secundários, incluindo antibióticos, são sintetizados na fase estacionária. Em certas bactérias patogênicas, a fase estacionária também está associada à expressão de fatores de virulência, produtos que contribuem para a capacidade do micróbio de sobreviver, se reproduzir e causar doenças em um organismo hospedeiro. Por exemplo, a detecção de quórum em Staphylococcus aureus inicia a produção de enzimas que podem decompor tecidos humanos e detritos celulares, abrindo caminho para que as bactérias se espalhem para novos tecidos, onde os nutrientes são mais abundantes.
A fase da morte
À medida que um meio de cultura acumula resíduos tóxicos e os nutrientes se esgotam, as células morrem cada vez mais. Em breve, o número de células moribundas excede o número de células em divisão, levando a uma diminuição exponencial no número de células (Figura\(\PageIndex{4}\)). Essa é a fase da morte apropriadamente chamada, às vezes chamada de fase de declínio. Muitas células lisam e liberam nutrientes no meio, permitindo que as células sobreviventes mantenham a viabilidade e formem endosporos. Algumas células, as chamadas persistentes, são caracterizadas por uma taxa metabólica lenta. As células persistentes são clinicamente importantes porque estão associadas a certas infecções crônicas, como a tuberculose, que não respondem ao tratamento com antibióticos.
Sustentando o crescimento microbiano
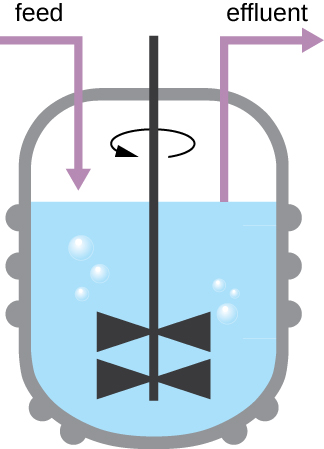
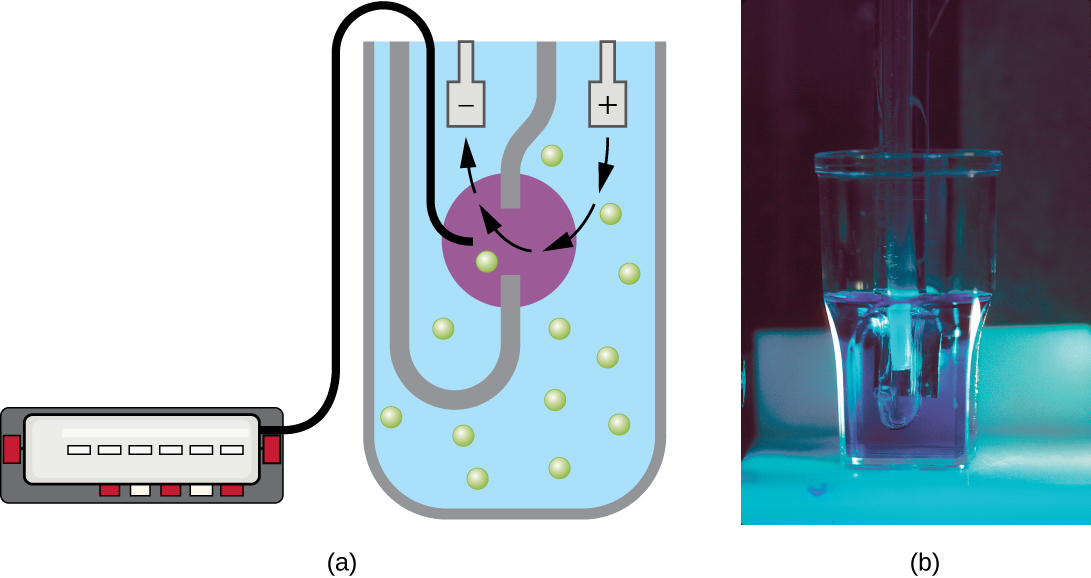
O padrão de crescimento mostrado na Figura\(\PageIndex{4}\) ocorre em um ambiente fechado; os nutrientes não são adicionados e os resíduos e as células mortas não são removidos. Em muitos casos, porém, é vantajoso manter as células na fase logarítmica do crescimento. Um exemplo é em indústrias que coletam produtos microbianos. Um quimiostato (Figura\(\PageIndex{6}\)) é usado para manter uma cultura contínua na qual os nutrientes são fornecidos a uma taxa constante. Uma quantidade controlada de ar é misturada para processos aeróbicos. A suspensão bacteriana é removida na mesma proporção em que os nutrientes fluem para manter um ambiente de crescimento ideal.
Exercício\(\PageIndex{4}\)
- Durante qual fase o crescimento ocorre na taxa mais rápida?
- Cite dois fatores que limitam o crescimento microbiano.
Medição do crescimento bacteriano
Estimar o número de células bacterianas em uma amostra, conhecido como contagem bacteriana, é uma tarefa comum realizada por microbiologistas. O número de bactérias em uma amostra clínica serve como uma indicação da extensão de uma infecção. O controle de qualidade de água potável, alimentos, medicamentos e até mesmo cosméticos depende de estimativas da contagem de bactérias para detectar contaminação e prevenir a propagação de doenças. Duas abordagens principais são usadas para medir o número de células. Os métodos diretos envolvem a contagem de células, enquanto os métodos indiretos dependem da medição da presença ou atividade celular sem realmente contar células individuais. Tanto os métodos diretos quanto os indiretos têm vantagens e desvantagens para aplicações específicas.
Contagem direta de células
A contagem direta de células se refere à contagem de células em uma cultura líquida ou colônias em uma placa. É uma forma direta de estimar quantos organismos estão presentes em uma amostra. Vejamos primeiro um método simples e rápido que requer apenas uma lâmina especializada e um microscópio composto.
A maneira mais simples de contar bactérias é chamada de contagem direta de células microscópicas, que envolve a transferência de um volume conhecido de uma cultura para uma lâmina calibrada e a contagem das células sob um microscópio de luz. A lâmina calibrada é chamada de câmara de Petroff-Hausser (Figura\(\PageIndex{7}\)) e é semelhante a um hemocitômetro usado para contar glóbulos vermelhos. A área central da câmara de contagem é gravada em quadrados de vários tamanhos. Uma amostra da suspensão de cultura é adicionada à câmara sob uma lamela que é colocada a uma altura específica da superfície da grade. É possível estimar a concentração de células na amostra original contando células individuais em vários quadrados e determinando o volume da amostra observada. A área dos quadrados e a altura na qual a lamela está posicionada são especificadas para a câmara. A concentração deve ser corrigida para diluição se a amostra tiver sido diluída antes da enumeração.
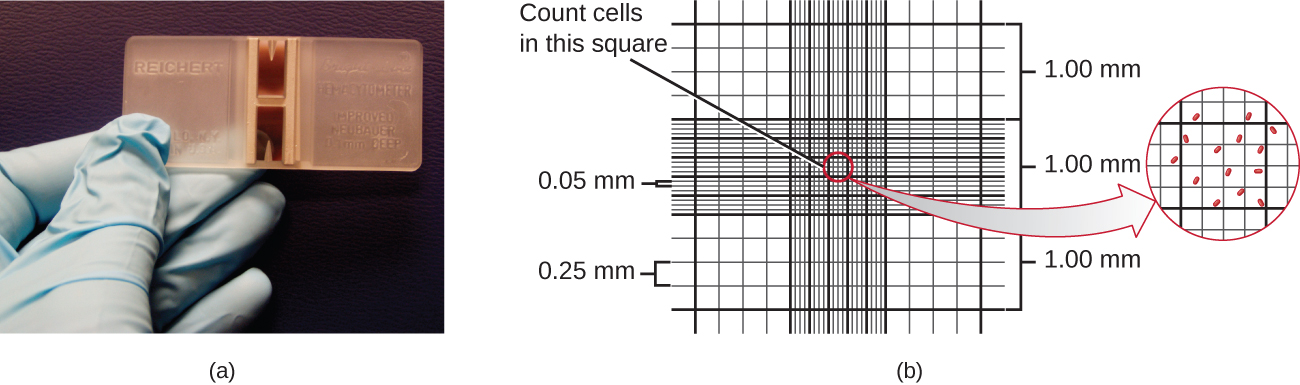
Células em vários quadrados pequenos devem ser contadas e a média obtida para obter uma medição confiável. As vantagens da câmara são que o método é fácil de usar, relativamente rápido e barato. No lado negativo, a câmara de contagem não funciona bem com culturas diluídas porque pode não haver células suficientes para contar.
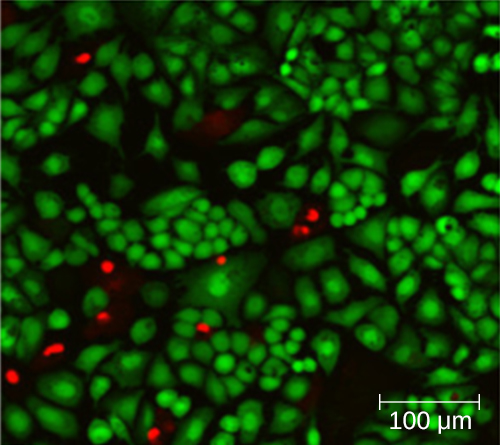
O uso de uma câmara de contagem não necessariamente produz uma contagem precisa do número de células vivas porque nem sempre é possível distinguir entre células vivas, células mortas e detritos do mesmo tamanho sob o microscópio. No entanto, técnicas de coloração por fluorescência recém-desenvolvidas permitem distinguir bactérias viáveis e mortas. Essas manchas de viabilidade (ou manchas vivas) se ligam aos ácidos nucléicos, mas as manchas primárias e secundárias diferem em sua capacidade de atravessar a membrana citoplasmática. A mancha primária, que fluoresce em verde, pode penetrar nas membranas citoplasmáticas intactas, manchando as células vivas e mortas. A mancha secundária, que fluoresce em vermelho, pode manchar uma célula somente se a membrana citoplasmática estiver consideravelmente danificada. Assim, as células vivas apresentam fluorescência verde porque absorvem apenas a mancha verde, enquanto as células mortas aparecem vermelhas porque a mancha vermelha desloca a mancha verde em seus ácidos nucléicos (Figura\(\PageIndex{8}\)).
Outra técnica usa um dispositivo eletrônico de contagem de células (contador Coulter) para detectar e contar as mudanças na resistência elétrica em uma solução salina. Um tubo de vidro com uma pequena abertura é imerso em uma solução eletrolítica. Um primeiro eletrodo é suspenso no tubo de vidro. Um segundo eletrodo está localizado fora do tubo. À medida que as células são puxadas pela pequena abertura no tubo de vidro, elas alteram brevemente a resistência medida entre os dois eletrodos e a mudança é registrada por um sensor eletrônico (Figura\(\PageIndex{9}\)); cada mudança de resistência representa uma célula. O método é rápido e preciso em uma faixa de concentrações; no entanto, se a cultura for muito concentrada, mais de uma célula poderá passar pela abertura a qualquer momento e distorcer os resultados. Esse método também não diferencia entre células vivas e mortas.
As contagens diretas fornecem uma estimativa do número total de células em uma amostra. No entanto, em muitas situações, é importante saber o número de células vivas ou viáveis. A contagem de células vivas é necessária para avaliar a extensão de uma infecção, a eficácia de compostos antimicrobianos e medicamentos ou a contaminação de alimentos e água.
Exercício\(\PageIndex{5}\)
- Por que você contaria o número de células em mais de um quadrado na câmara de Petroff-Hausser para estimar o número de células?
- No método de coloração de viabilidade, por que as células mortas parecem vermelhas?
Contagem de placas
A contagem viável de placas, ou simplesmente contagem de placas, é uma contagem de células viáveis ou vivas. É baseado no princípio de que células viáveis se replicam e dão origem a colônias visíveis quando incubadas em condições adequadas para a amostra. Os resultados geralmente são expressos como unidades formadoras de colônias por mililitro (CFU/ml) em vez de células por mililitro, porque mais de uma célula pode ter pousado no mesmo local para dar origem a uma única colônia. Além disso, amostras de bactérias que crescem em grupos ou cadeias são difíceis de dispersar e uma única colônia pode representar várias células. Algumas células são descritas como viáveis, mas não cultiváveis, e não formarão colônias em meio sólido. Por todas essas razões, a contagem viável de placas é considerada uma estimativa baixa do número real de células vivas. Essas limitações não diminuem a utilidade do método, que fornece estimativas do número de bactérias vivas.
Os microbiologistas normalmente contam placas com 30 a 300 colônias. Amostras com poucas colônias (300 <30) do not give statistically reliable numbers, and overcrowded plates (> colônias) dificultam a contagem precisa de colônias individuais. Além disso, contagens nessa faixa minimizam a ocorrência de mais de uma célula bacteriana formando uma única colônia. Assim, a CFU calculada está mais próxima do número real de bactérias vivas na população.
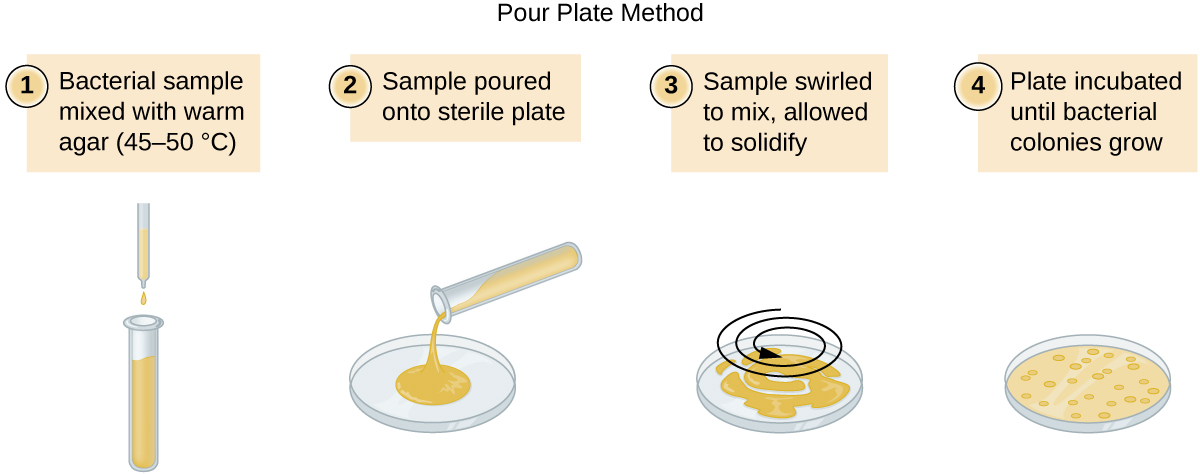
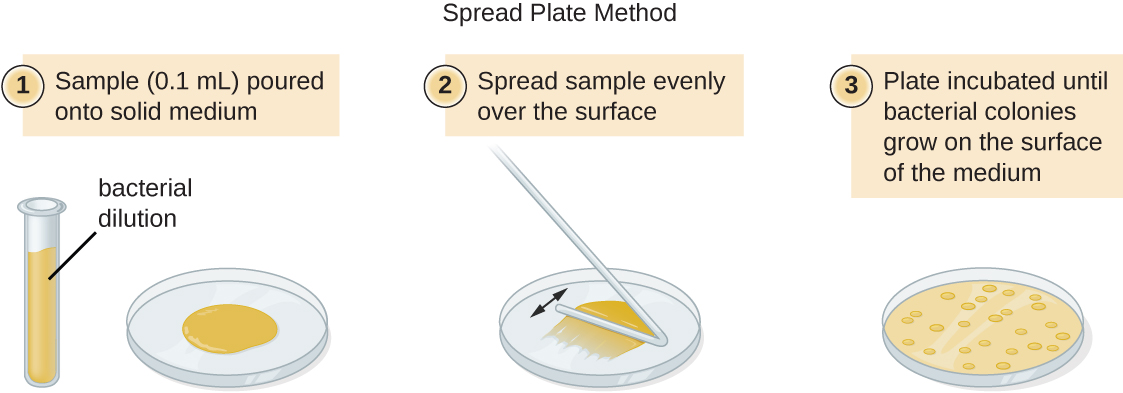
Existem duas abordagens comuns para inocular placas para contagens viáveis: os métodos da placa de vazamento e da placa espalhada. Embora o procedimento final de inoculação seja diferente entre esses dois métodos, ambos começam com uma diluição em série da cultura.
Diluição serial
A diluição em série de uma cultura é uma primeira etapa importante antes de prosseguir com o método da placa de despejo ou da placa espalhada. O objetivo do processo de diluição em série é obter placas com CFUs na faixa de 30 a 300, e o processo geralmente envolve várias diluições em múltiplos de 10 para simplificar o cálculo. O número de diluições seriadas é escolhido de acordo com uma estimativa preliminar da densidade da cultura. A figura\(\PageIndex{10}\) ilustra o método de diluição em série.
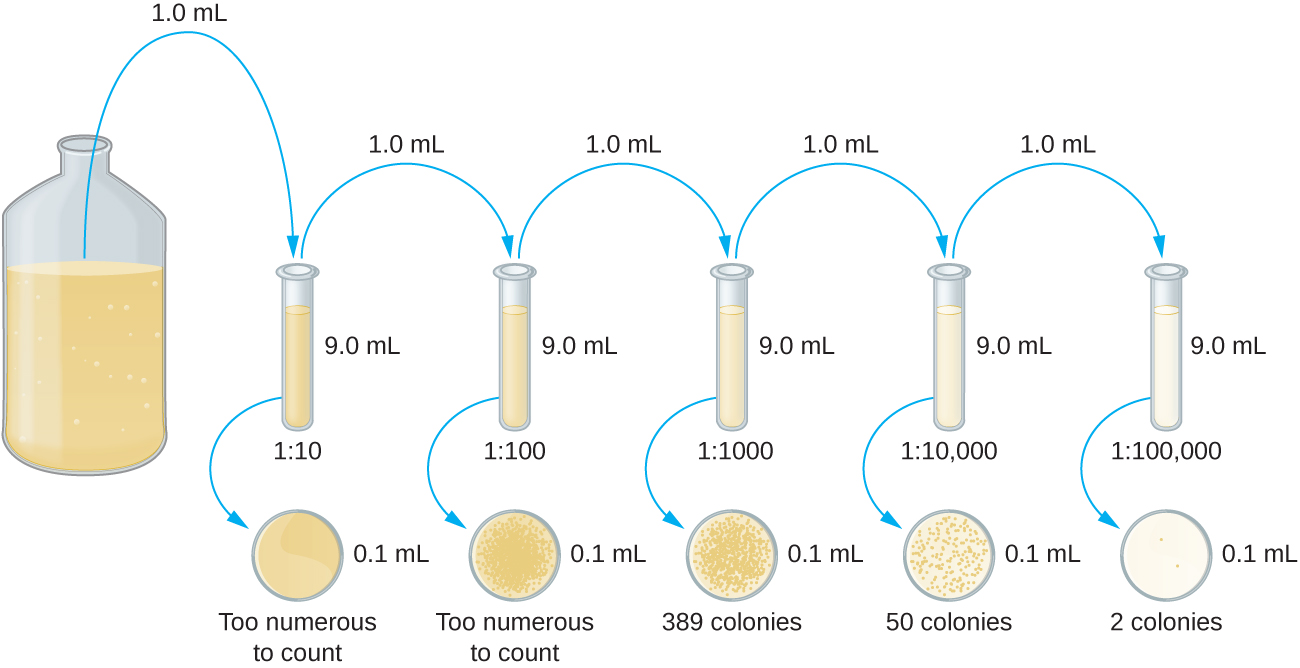
Um volume fixo da cultura original, 1,0 mL, é adicionado e bem misturado com a primeira solução do tubo de diluição, que contém 9,0 mL de caldo estéril. Essa etapa representa um fator de diluição de 10, ou 1:10, em comparação com a cultura original. A partir dessa primeira diluição, o mesmo volume, 1,0 mL, é retirado e misturado com um novo tubo de 9,0 mL de solução de diluição. O fator de diluição agora é de 1:100 em comparação com a cultura original. Esse processo continua até que uma série de diluições seja produzida que incluirá a concentração celular desejada para uma contagem precisa. De cada tubo, uma amostra é revestida em meio sólido usando o método da placa de vazamento (Figura\(\PageIndex{11}\)) ou o método da placa de espalhamento (Figura\(\PageIndex{12}\)). As placas são incubadas até que as colônias apareçam. Geralmente, duas a três placas são preparadas a partir de cada diluição e a média do número de colônias contadas em cada placa é calculada. Em todos os casos, a mistura completa das amostras com o meio de diluição (para garantir que a distribuição da célula no tubo seja aleatória) é fundamental para obter resultados confiáveis.
O fator de diluição é usado para calcular o número de células na cultura celular original. Em nosso exemplo, uma média de 50 colônias foi contada nas placas obtidas a partir da diluição de 1:10 .000. Como apenas 0,1 mL de suspensão foi pipetado na placa, o multiplicador necessário para reconstituir a concentração original é 10 × 10.000. O número de CFU por mL é igual a 50 × 100 × 10.000 = 5.000.000. O número de bactérias na cultura é estimado em 5 milhões de células/mL. A contagem de colônias obtida com a diluição de 1:1000 foi 389, bem abaixo das 500 esperadas para uma diferença de 10 vezes nas diluições. Isso destaca a questão da imprecisão quando a contagem de colônias é maior que 300 e mais de uma célula bacteriana cresce em uma única colônia.
Uma amostra muito diluída — água potável, por exemplo — pode não conter organismos suficientes para usar qualquer um dos métodos de contagem de placas descritos. Nesses casos, a amostra original deve ser concentrada em vez de diluída antes do revestimento. Isso pode ser feito usando uma modificação da técnica de contagem de placas chamada técnica de filtração por membrana. Os volumes conhecidos são filtrados a vácuo de forma asséptica através de uma membrana com um tamanho de poro pequeno o suficiente para capturar microrganismos. A membrana é transferida para uma placa de Petri contendo um meio de crescimento apropriado. As colônias são contadas após a incubação. O cálculo da densidade celular é feito dividindo a contagem de células pelo volume do líquido filtrado.
Assista a este vídeo para demonstrações de diluições em série e técnicas de espalhamento de placas.
O número mais provável
O número de microrganismos em amostras diluídas geralmente é muito baixo para ser detectado pelos métodos de contagem de placas descritos até agora. Para essas amostras, os microbiologistas usam rotineiramente o método do número mais provável (MPN), um procedimento estatístico para estimar o número de microrganismos viáveis em uma amostra. Frequentemente usado para amostras de água e alimentos, o método MPN avalia o crescimento detectável observando mudanças na turbidez ou na cor devido à atividade metabólica.
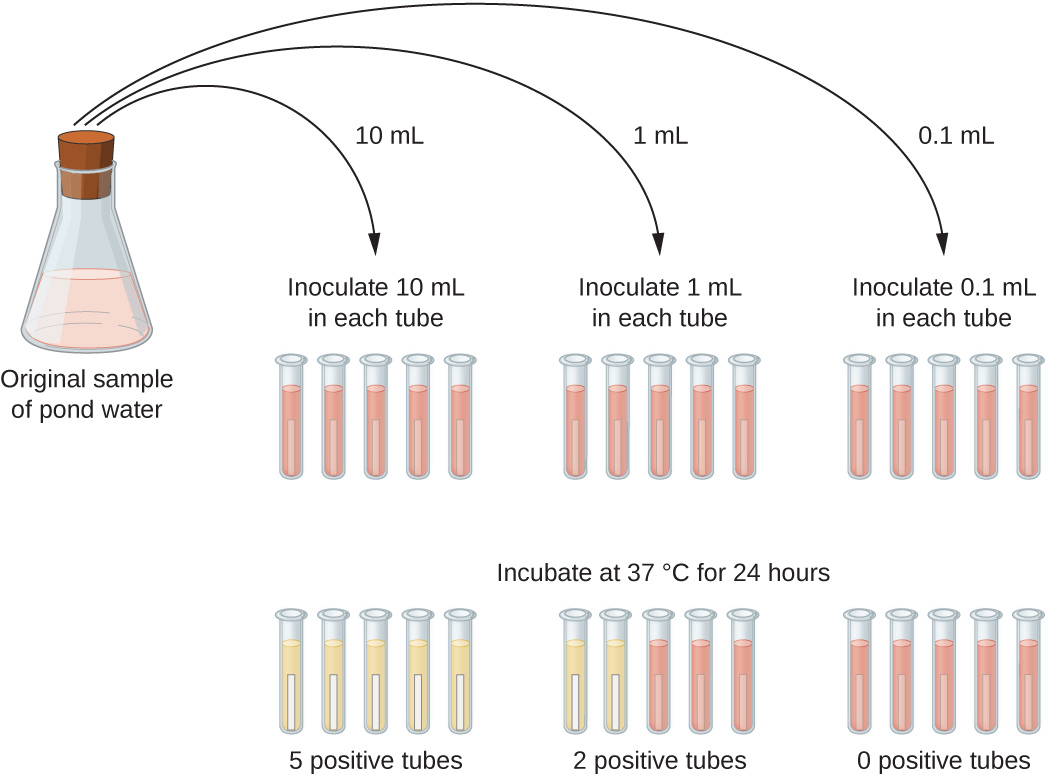
Uma aplicação típica do método MPN é a estimativa do número de coliformes em uma amostra de água de lagoa. Os coliformes são bactérias gram-negativas que fermentam a lactose. A presença de coliformes na água é considerada um sinal de contaminação por matéria fecal. Para o método ilustrado na Figura\(\PageIndex{13}\), uma série de três diluições da amostra de água é testada inoculando cinco tubos de caldo de lactose com 10 mL de amostra, cinco tubos de caldo de lactose com 1 mL de amostra e cinco tubos de caldo de lactose com 0,1 mL de amostra. Os tubos de caldo de lactose contêm um indicador de pH que muda de cor de vermelho para amarelo quando a lactose é fermentada. Após a inoculação e incubação, os tubos são examinados para uma indicação do crescimento de coliformes por uma mudança de cor no meio de vermelho para amarelo. O primeiro conjunto de tubos (amostra de 10 mL) mostrou crescimento em todos os tubos; o segundo conjunto de tubos (1 mL) mostrou crescimento em dois tubos em cinco; no terceiro conjunto de tubos, nenhum crescimento é observado em nenhum dos tubos (diluição de 0,1 mL). Os números 5, 2 e 0 são comparados com a Figura B1 no Apêndice B, que foi construída usando um modelo de probabilidade do procedimento de amostragem. A partir da leitura da tabela, concluímos que 49 é o número mais provável de bactérias por 100 mL de água da lagoa.
Exercício\(\PageIndex{6}\)
- O que é uma unidade formadora de colônias?
- Quais são os dois métodos frequentemente usados para estimar o número de bactérias em amostras de água?
Contagem indireta de células
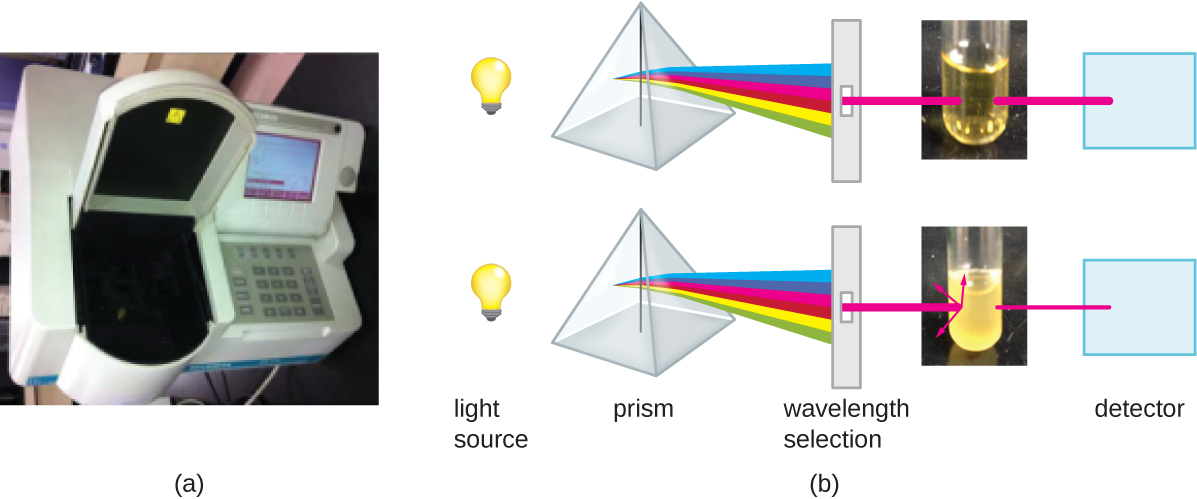
Além dos métodos diretos de contagem de células, outros métodos, baseados na detecção indireta da densidade celular, são comumente usados para estimar e comparar as densidades celulares em uma cultura. A principal abordagem é medir a turbidez (nebulosidade) de uma amostra de bactéria em uma suspensão líquida. O instrumento de laboratório usado para medir a turbidez é chamado de espectrofotômetro (Figura\(\PageIndex{14}\)). Em um espectrofotômetro, um feixe de luz é transmitido através de uma suspensão bacteriana, a luz que passa pela suspensão é medida por um detector e a quantidade de luz que passa pela amostra e chega ao detector é convertida em porcentagem de transmissão ou em um valor logarítmico chamado absorbância (densidade óptica). À medida que o número de bactérias em uma suspensão aumenta, a turbidez também aumenta e faz com que menos luz alcance o detector. A diminuição da luz que passa pela amostra e atinge o detector está associada a uma diminuição na porcentagem de transmissão e aumento na absorbância medida pelo espectrofotômetro.
Medir a turbidez é um método rápido para estimar a densidade celular, desde que haja células suficientes em uma amostra para produzir turbidez. É possível correlacionar as leituras de turbidez com o número real de células realizando uma contagem viável em placas de amostras retiradas de culturas com uma variedade de valores de absorbância. Usando esses valores, uma curva de calibração é gerada traçando a turbidez em função da densidade celular. Uma vez que a curva de calibração tenha sido produzida, ela pode ser usada para estimar a contagem de células para todas as amostras obtidas ou cultivadas em condições semelhantes e com densidades dentro da faixa de valores usada para construir a curva.
Medir o peso seco de uma amostra de cultura é outro método indireto de avaliar a densidade da cultura sem medir diretamente a contagem de células. A suspensão celular usada para pesagem deve ser concentrada por filtração ou centrifugação, lavada e depois seca antes que as medições sejam feitas. O grau de secagem deve ser padronizado para considerar o teor de água residual. Esse método é especialmente útil para microrganismos filamentosos, que são difíceis de enumerar por contagem direta ou viável de placas.
Como vimos, os métodos para estimar o número de células viáveis podem ser trabalhosos e levar tempo, pois as células devem ser cultivadas. Recentemente, foram desenvolvidas formas indiretas de medir células vivas que são rápidas e fáceis de implementar. Esses métodos medem a atividade celular seguindo a produção de produtos metabólicos ou o desaparecimento de reagentes. A formação de trifosfato de adenosina (ATP), a biossíntese de proteínas e ácidos nucléicos e o consumo de oxigênio podem ser monitorados para estimar o número de células.
Exercício\(\PageIndex{7}\)
- Qual é o propósito de uma curva de calibração ao estimar a contagem de células a partir de medições de turbidez?
- Quais são os métodos indiretos mais recentes de contagem de células vivas?
Padrões alternativos de divisão celular
A fissão binária é o padrão mais comum de divisão celular em procariontes, mas não é o único. Outros mecanismos geralmente envolvem divisão assimétrica (como na brotação) ou produção de esporos em filamentos aéreos.
Em algumas cianobactérias, muitos nucleóides podem se acumular em uma célula redonda aumentada ou ao longo de um filamento, levando à geração de muitas células novas ao mesmo tempo. As novas células geralmente se separam do filamento original e flutuam em um processo chamado fragmentação (Figura\(\PageIndex{15}\)). A fragmentação é comumente observada nos Actinomicetes, um grupo de bactérias anaeróbicas gram-positivas comumente encontradas no solo. Outro exemplo curioso de divisão celular em procariontes, que lembra o nascimento vivo em animais, é exibido pela bactéria gigante Epulopiscium. Várias células filhas crescem totalmente na célula-mãe, que eventualmente se desintegra, liberando as novas células para o meio ambiente. Outras espécies podem formar uma extensão longa e estreita em um pólo em um processo chamado brotamento. A ponta da extensão incha e forma uma célula menor, o broto que eventualmente se desprende da célula-mãe. A brotação é mais comum em leveduras (Figura\(\PageIndex{15}\)), mas também é observada em bactérias protéticas e em algumas cianobactérias.

A bactéria do solo Actinomyces cresce em filamentos longos divididos por septos, semelhantes aos micélios observados nos fungos, resultando em células longas com múltiplos nucleóides. Sinais ambientais, provavelmente relacionados à baixa disponibilidade de nutrientes, levam à formação de filamentos aéreos. Dentro desses filamentos aéreos, as células alongadas se dividem simultaneamente. As novas células, que contêm um único nucleóide, se transformam em esporos que dão origem a novas colônias.
Exercício\(\PageIndex{8}\)
Identifique pelo menos uma diferença entre fragmentação e brotamento.
Biofilmes
Na natureza, os microrganismos crescem principalmente em biofilmes, ecossistemas complexos e dinâmicos que se formam em uma variedade de superfícies ambientais, desde conduítes industriais e tubulações de tratamento de água até rochas nos leitos dos rios. No entanto, os biofilmes não estão restritos a substratos de superfície sólida. Quase qualquer superfície em um ambiente líquido contendo alguns nutrientes mínimos acabará por desenvolver um biofilme. Os tapetes microbianos que flutuam na água, por exemplo, são biofilmes que contêm grandes populações de microrganismos fotossintéticos. Os biofilmes encontrados na boca humana podem conter centenas de espécies bacterianas. Independentemente do ambiente em que ocorrem, os biofilmes não são coleções aleatórias de microrganismos; ao contrário, são comunidades altamente estruturadas que fornecem uma vantagem seletiva aos seus microrganismos constituintes.
Estrutura do biofilme
Observações usando microscopia confocal mostraram que as condições ambientais influenciam a estrutura geral dos biofilmes. Biofilmes filamentosos chamados flâmulas se formam em água de fluxo rápido, como riachos de água doce, redemoinhos e células de fluxo de laboratório especialmente projetadas que replicam as condições de crescimento em fluidos de movimento rápido. As serpentinas são ancoradas ao substrato por uma “cabeça” e a “cauda” flutua rio abaixo na corrente. Em águas calmas ou em movimento lento, os biofilmes assumem principalmente a forma de um cogumelo. A estrutura dos biofilmes também pode mudar com outras condições ambientais, como a disponibilidade de nutrientes.
Observações detalhadas de biofilmes sob laser confocal e microscópios eletrônicos de varredura revelam aglomerados de microrganismos embutidos em uma matriz intercalada com canais de água aberta. A matriz extracelular consiste em substâncias poliméricas extracelulares (EPS) secretadas pelos organismos no biofilme. A matriz extracelular representa uma grande fração do biofilme, representando 50% a 90% da massa seca total. As propriedades do EPS variam de acordo com os organismos residentes e as condições ambientais.
O EPS é um gel hidratado composto principalmente por polissacarídeos e contém outras macromoléculas, como proteínas, ácidos nucléicos e lipídios. Ele desempenha um papel fundamental na manutenção da integridade e função do biofilme. Os canais no EPS permitem a movimentação de nutrientes, resíduos e gases por todo o biofilme. Isso mantém as células hidratadas, evitando a dessecação. O EPS também protege os organismos no biofilme da predação por outros micróbios ou células (por exemplo, protozoários, glóbulos brancos no corpo humano).
Formação de biofilme
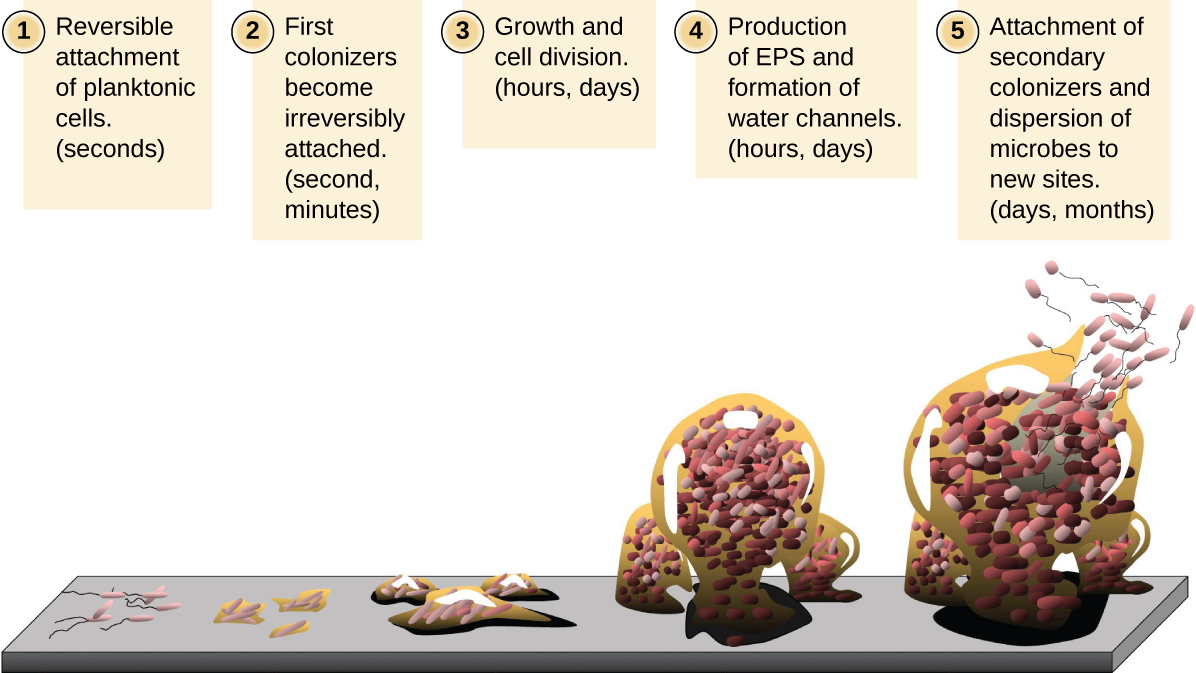
As células microbianas flutuantes que vivem em um ambiente aquático são chamadas de células planctônicas. A formação de um biofilme envolve essencialmente a fixação de células planctônicas a um substrato, onde elas se tornam sésseis (presas a uma superfície). Isso ocorre em etapas, conforme ilustrado na Figura\(\PageIndex{16}\). O primeiro estágio envolve a fixação de células planctônicas a uma superfície revestida com uma película condicionadora de material orgânico. Nesse ponto, a fixação ao substrato é reversível, mas à medida que as células expressam novos fenótipos que facilitam a formação do EPS, elas passam de um estilo de vida planctônico para um estilo de vida séssil. O biofilme desenvolve estruturas características, incluindo uma extensa matriz e canais de água. Apêndices como fímbrias, pili e flagelos interagem com o EPS, e a microscopia e a análise genética sugerem que tais estruturas são necessárias para o estabelecimento de um biofilme maduro. No último estágio do ciclo de vida do biofilme, as células na periferia do biofilme retornam ao estilo de vida planctônico, eliminando o biofilme maduro para colonizar novos locais. Esse estágio é conhecido como dispersão.
Dentro de um biofilme, diferentes espécies de microrganismos estabelecem colaborações metabólicas nas quais o produto residual de um organismo se torna o nutriente para outro. Por exemplo, microrganismos aeróbios consomem oxigênio, criando regiões anaeróbicas que promovem o crescimento de anaeróbios. Isso ocorre em muitas infecções polimicrobianas que envolvem patógenos aeróbicos e anaeróbicos.
O mecanismo pelo qual as células de um biofilme coordenam suas atividades em resposta a estímulos ambientais é chamado de detecção de quórum. A detecção de quórum — que pode ocorrer entre células de diferentes espécies dentro de um biofilme — permite que os microrganismos detectem sua densidade celular por meio da liberação e ligação de moléculas pequenas e difusíveis chamadas autoindutores. Quando a população celular atinge um limite crítico (um quórum), esses autoindutores iniciam uma cascata de reações que ativam genes associados às funções celulares que são benéficos somente quando a população atinge uma densidade crítica. Por exemplo, em alguns patógenos, a síntese de fatores de virulência só começa quando há células suficientes para sobrecarregar as defesas imunológicas do hospedeiro. Embora seja estudada principalmente em populações bacterianas, a detecção de quórum ocorre entre bactérias e eucariotos e entre células eucarióticas, como o fungo Candida albicans, um membro comum da microbiota humana que pode causar infecções em indivíduos imunocomprometidos.
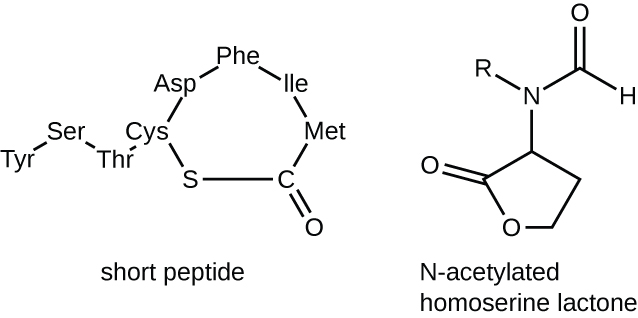
As moléculas de sinalização no sensor de quórum pertencem a duas classes principais. As bactérias gram-negativas se comunicam principalmente usando lactonas homoserinas N-aciladas, enquanto as bactérias gram-positivas usam principalmente pequenos peptídeos (Figura\(\PageIndex{17}\)). Em todos os casos, a primeira etapa na detecção de quórum consiste na ligação do autoindutor ao seu receptor específico somente quando uma concentração limite de moléculas sinalizadoras é atingida. Uma vez que a ligação ao receptor ocorre, uma cascata de eventos de sinalização leva a mudanças na expressão gênica. O resultado é a ativação de respostas biológicas ligadas à detecção de quórum, notadamente um aumento na produção das próprias moléculas de sinalização, daí o termo autoindutor.
Biofilmes e saúde humana
O corpo humano abriga muitos tipos de biofilmes, alguns benéficos e outros prejudiciais. Por exemplo, as camadas de microbiota normal que revestem a mucosa intestinal e respiratória desempenham um papel na prevenção de infecções por patógenos. No entanto, outros biofilmes no corpo podem ter um efeito prejudicial à saúde. Por exemplo, a placa que se forma nos dentes é um biofilme que pode contribuir para doenças dentárias e periodontais. Os biofilmes também podem se formar em feridas, às vezes causando infecções graves que podem se espalhar. A bactéria Pseudomonas aeruginosa frequentemente coloniza biofilmes nas vias aéreas de pacientes com fibrose cística, causando infecções crônicas e às vezes fatais nos pulmões. Os biofilmes também podem se formar em dispositivos médicos usados dentro ou sobre o corpo, causando infecções em pacientes com cateteres internos, articulações artificiais ou lentes de contato.
Os patógenos incorporados em biofilmes exibem uma maior resistência aos antibióticos do que seus equivalentes flutuantes. Várias hipóteses foram propostas para explicar o porquê. As células nas camadas profundas de um biofilme são metabolicamente inativas e podem ser menos suscetíveis à ação de antibióticos que interrompem as atividades metabólicas. O EPS também pode retardar a difusão de antibióticos e antissépticos, impedindo que eles alcancem as células nas camadas mais profundas do biofilme. Alterações fenotípicas também podem contribuir para o aumento da resistência exibida pelas células bacterianas nos biofilmes. Por exemplo, o aumento da produção de bombas de efluxo, proteínas incorporadas na membrana que ativamente extrudam antibióticos das células bacterianas, demonstrou ser um importante mecanismo de resistência a antibióticos entre as bactérias associadas ao biofilme. Finalmente, os biofilmes fornecem um ambiente ideal para a troca de DNA extracromossômico, que geralmente inclui genes que conferem resistência a antibióticos.
Exercício\(\PageIndex{9}\)
- Do que é composta a matriz de um biofilme?
- Qual é o papel do sensor de quórum em um biofilme?
Conceitos principais e resumo
- A maioria das células bacterianas se divide por fissão binária. O tempo de geração no crescimento bacteriano é definido como o tempo de duplicação da população.
- As células em um sistema fechado seguem um padrão de crescimento com quatro fases: atraso, logarítmica (exponencial), estacionária e morte.
- As células podem ser contadas pela contagem direta de células viáveis. Os métodos de placa de despejo e placa de espalhamento são usados para colocar diluições em série em ou sobre, respectivamente, ágar para permitir a contagem de células viáveis que dão origem a unidades formadoras de colônias. A filtração por membrana é usada para contar células vivas em soluções diluídas. O método do número celular mais provável (MPN) permite estimar o número de células em culturas sem usar meios sólidos.
- Métodos indiretos podem ser usados para estimar a densidade da cultura medindo a turbidez de uma cultura ou a densidade de células vivas medindo a atividade metabólica.
- Outros padrões de divisão celular incluem a formação de múltiplos nucleóides nas células; divisão assimétrica, como na brotação; e a formação de hifas e esporos terminais.
- Biofilmes são comunidades de microrganismos enredadas em uma matriz de substância polimérica extracelular. A formação de um biofilme ocorre quando as células planctônicas se ligam a um substrato e se tornam sésseis. As células em biofilmes coordenam suas atividades comunicando-se por meio do sensor de quórum.
- Os biofilmes são comumente encontrados em superfícies na natureza e no corpo humano, onde podem ser benéficos ou causar infecções graves. Os patógenos associados aos biofilmes costumam ser mais resistentes a antibióticos e desinfetantes.


