8.1: Energia, matéria e enzimas
- Page ID
- 181457
Objetivos de
- Definir e descrever o metabolismo
- Compare e contraste autótrofos e heterotróficos
- Descreva a importância das reações de redução da oxidação no metabolismo
- Descreva por que ATP, FAD, NAD + e NADP + são importantes em uma célula
- Identificar a estrutura e os componentes estruturais de uma enzima
- Descreva as diferenças entre inibidores enzimáticos competitivos e não competitivos
Foco clínico: Parte 1
Hannah é uma garota de 15 meses do estado de Washington. Ela está passando o verão na Gâmbia, onde seus pais trabalham para uma organização não governamental. Cerca de 3 semanas após sua chegada à Gâmbia, o apetite de Hannah começou a diminuir e seus pais notaram que ela parecia extraordinariamente lenta, cansada e confusa. Ela também parecia muito irritada quando estava ao ar livre, especialmente durante o dia. Quando ela começou a vomitar, seus pais perceberam que ela havia contraído um vírus de 24 horas, mas quando seus sintomas persistiram, eles a levaram para uma clínica. O médico local percebeu que os reflexos de Hannah pareciam anormalmente lentos e, quando ele examinou os olhos dela com uma luz, ela parecia extraordinariamente sensível à luz. Ela também parecia estar com uma rigidez no pescoço.
Exercício\(\PageIndex{1}\)
Quais são algumas das possíveis causas dos sintomas de Hannah?
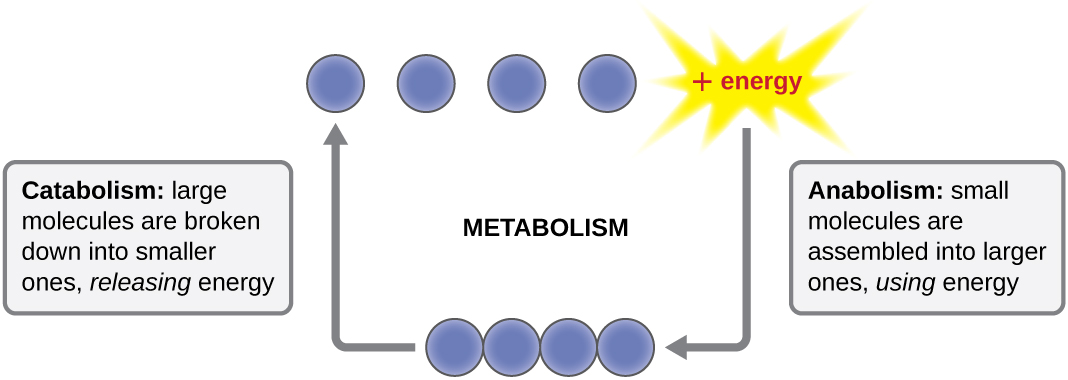
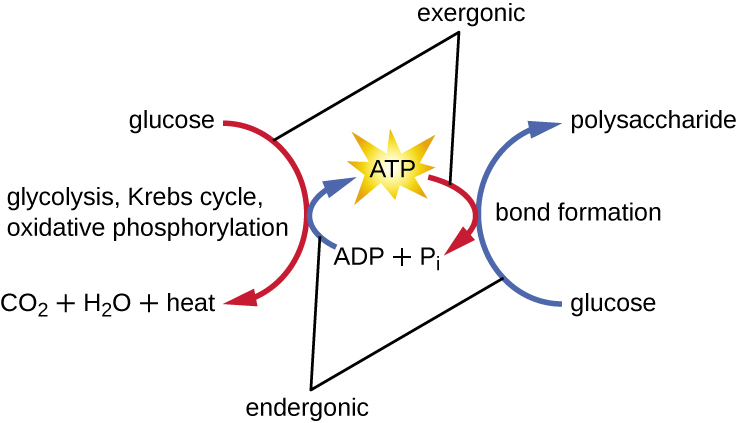
O termo usado para descrever todas as reações químicas dentro de uma célula é metabolismo (Figura\(\PageIndex{1}\)). Processos celulares, como a construção ou decomposição de moléculas complexas, ocorrem por meio de uma série de reações químicas interconectadas e progressivas chamadas vias metabólicas. As reações que são espontâneas e liberam energia são reações exergônicas, enquanto as reações endergônicas requerem energia para prosseguir. O termo anabolismo se refere às vias metabólicas endergônicas envolvidas na biossíntese, convertendo blocos de construção moleculares simples em moléculas mais complexas e alimentadas pelo uso de energia celular. Por outro lado, o termo catabolismo se refere às vias exergônicas que decompõem moléculas complexas em moléculas mais simples. A energia molecular armazenada nas ligações de moléculas complexas é liberada em vias catabólicas e coletada de forma que possa ser usada para produzir moléculas de alta energia, que são usadas para conduzir vias anabólicas. Assim, em termos de energia e moléculas, as células estão continuamente equilibrando o catabolismo com o anabolismo.
Classificação por fonte de carbono e energia
Os organismos podem ser identificados de acordo com a fonte de carbono que usam para o metabolismo, bem como sua fonte de energia. Os prefixos auto- (“eu”) e hetero- (“outro”) referem-se às origens das fontes de carbono que vários organismos podem usar. Organismos que convertem dióxido de carbono inorgânico (CO 2) em compostos de carbono orgânico são autótrofos. Plantas e cianobactérias são exemplos bem conhecidos de autótrofos. Por outro lado, os heterotróficos dependem de compostos orgânicos de carbono mais complexos como nutrientes; estes são fornecidos inicialmente por autotróficos. Muitos organismos, desde humanos até muitos procariontes, incluindo a bem estudada Escherichia coli, são heterotróficos.
Os organismos também podem ser identificados pela fonte de energia que usam. Toda energia é derivada da transferência de elétrons, mas a fonte de elétrons difere entre vários tipos de organismos. Os prefixos foto- (“luz”) e quimioterapia (“química”) referem-se às fontes de energia que vários organismos usam. Aqueles que obtêm sua energia para a transferência de elétrons da luz são os fototróficos, enquanto os quimiotróficos obtêm energia para transferência de elétrons quebrando ligações químicas. Existem dois tipos de quimiotróficos: organotróficos e litotróficos. Organotróficos, incluindo humanos, fungos e muitos procariontes, são quimiotróficos que obtêm energia de compostos orgânicos. Litotróficos (“litotróficos” significa “rocha”) são quimiotróficos que obtêm energia de compostos inorgânicos, incluindo sulfeto de hidrogênio (H 2 S) e ferro reduzido. A litotrofia é exclusiva do mundo microbiano.
As estratégias usadas para obter carbono e energia podem ser combinadas para a classificação dos organismos de acordo com o tipo nutricional. A maioria dos organismos são quimioheterotróficos porque usam moléculas orgânicas como fontes de elétrons e carbono. A tabela\(\PageIndex{1}\) resume essa e as outras classificações.
| Classificações | Fonte de energia | Fonte de carbono | Exemplos | |
|---|---|---|---|---|
| Quimiotróficos | Quimioautotróficos | Químico | Inorgânico | Bactérias oxidantes de hidrogênio, enxofre, ferro, nitrogênio e monóxido de carbono |
| Quimioheterotróficos | Químico | Compostos orgânicos | Todos os animais, a maioria dos fungos, protozoários e bactérias | |
| Fototróficos | Fotoautotróficos | Luz | Inorgânico | Todas as plantas, algas, cianobactérias e bactérias de enxofre verde e roxo |
| Fotoheterotróficos | Luz | Compostos orgânicos | Bactérias verdes e roxas sem enxofre, heliobactérias | |
Exercício\(\PageIndex{2}\)
- Explique a diferença entre catabolismo e anabolismo.
- Explique a diferença entre autótrofos e heterotróficos.
Oxidação e redução do metabolismo
A transferência de elétrons entre moléculas é importante porque a maior parte da energia armazenada nos átomos e usada para alimentar as funções das células está na forma de elétrons de alta energia. A transferência de energia na forma de elétrons permite que a célula transfira e use energia de forma incremental; ou seja, em pacotes pequenos, em vez de uma única explosão destrutiva. As reações que removem elétrons das moléculas doadoras, deixando-as oxidadas, são reações de oxidação; aquelas que adicionam elétrons às moléculas aceitadoras, deixando-as reduzidas, são reações de redução. Como os elétrons podem se mover de uma molécula para outra, a oxidação e a redução ocorrem em conjunto. Esses pares de reações são chamados de reações de redução de oxidação ou reações redox.
Transportadores de energia: NAD +, NADP +, FAD e ATP
A energia liberada pela quebra das ligações químicas dentro dos nutrientes pode ser armazenada por meio da redução de portadores de elétrons ou nas ligações do trifosfato de adenosina (ATP). Em sistemas vivos, uma pequena classe de compostos funciona como portadores de elétrons móveis, moléculas que se ligam e transportam elétrons de alta energia entre compostos em vias. Os principais portadores de elétrons que consideraremos são originários do grupo da vitamina B e são derivados de nucleotídeos; eles são nicotinamida adenina dinucleotídeo, nicotina adenina dinucleotídeo fosfato e dinucleotídeo flavina-adenina. Esses compostos podem ser facilmente reduzidos ou oxidados. O dinucleotídeo de nicotinamida adenina (NAD +/NADH) é o transportador de elétrons móvel mais comum usado no catabolismo. NAD + é a forma oxidada da molécula; NADH é a forma reduzida da molécula. O fosfato de nicotina adenina dinucleotídeo (NADP +), a forma oxidada de uma variante NAD + que contém um grupo fosfato extra, é outro importante transportador de elétrons; ele forma NADPH quando reduzido. A forma oxidada do dinucleotídeo de flavina adenina é FAD e sua forma reduzida é FADH 2. Tanto o NAD +/NADH quanto o FAD/FADH 2 são amplamente utilizados na extração de energia dos açúcares durante o catabolismo em quimioheterotróficos, enquanto o NADP +/NADPH desempenha um papel importante nas reações anabólicas e na fotossíntese. Coletivamente, FADH 2, NADH e NADPH são frequentemente referidos como tendo potência redutora devido à sua capacidade de doar elétrons para várias reações químicas.
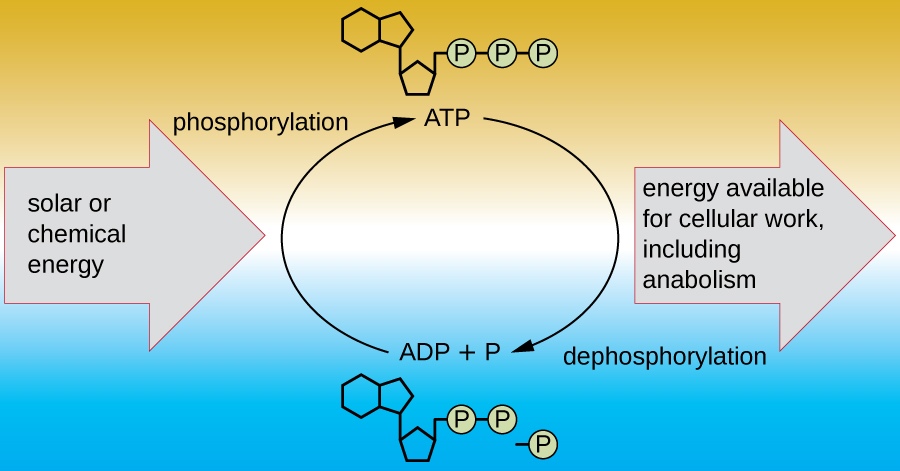
Uma célula viva deve ser capaz de lidar com a energia liberada durante o catabolismo de uma forma que permita que a célula armazene energia com segurança e a libere para uso somente quando necessário. As células vivas conseguem isso usando o composto trifosfato de adenosina (ATP). O ATP é frequentemente chamado de “moeda de energia” da célula e, como a moeda, esse composto versátil pode ser usado para preencher qualquer necessidade de energia da célula. No coração do ATP está uma molécula de monofosfato de adenosina (AMP), que é composta por uma molécula de adenina ligada a uma molécula de ribose e um único grupo fosfato. A ribose é um açúcar de cinco carbonos encontrado no RNA e o AMP é um dos nucleotídeos do RNA. A adição de um segundo grupo fosfato a essa molécula central resulta na formação de adenosina difosfato (ADP); a adição de um terceiro grupo fosfato forma ATP (Figura\(\PageIndex{2}\)). Adicionar um grupo fosfato a uma molécula, um processo chamado fosforilação, requer energia. Os grupos fosfato são carregados negativamente e, portanto, se repelem quando estão dispostos em série, como estão em ADP e ATP. Essa repulsão torna as moléculas de ADP e ATP inerentemente instáveis. Assim, as ligações entre os grupos fosfato (uma no ADP e duas no ATP) são chamadas de ligações de fosfato de alta energia. Quando essas ligações de alta energia são quebradas para liberar um fosfato (chamado fosfato inorgânico [P i]) ou dois grupos fosfato conectados (chamados pirofosfato [PP i]) do ATP por meio de um processo chamado desfosforilação, a energia é liberada para impulsionar reações endergônicas (Figura\(\PageIndex{3}\)).
Exercício\(\PageIndex{3}\)
Qual é a função de um transportador de elétrons?
Estrutura e função enzimáticas
Uma substância que ajuda a acelerar uma reação química é um catalisador. Os catalisadores não são usados ou alterados durante as reações químicas e, portanto, são reutilizáveis. Enquanto as moléculas inorgânicas podem servir como catalisadores para uma ampla gama de reações químicas, as proteínas chamadas enzimas servem como catalisadores para reações bioquímicas dentro das células. As enzimas, portanto, desempenham um papel importante no controle do metabolismo celular.
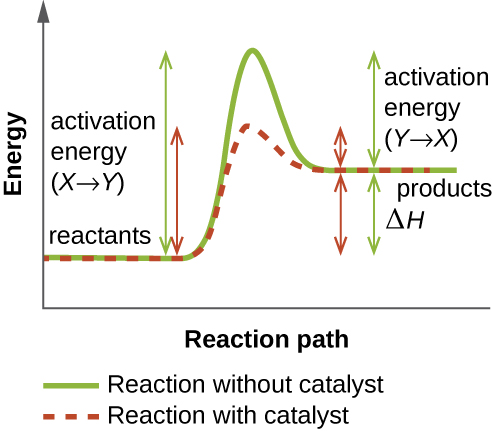
Uma enzima funciona diminuindo a energia de ativação de uma reação química dentro da célula. A energia de ativação é a energia necessária para formar ou romper ligações químicas e converter reagentes em produtos (Figura\(\PageIndex{4}\)). As enzimas diminuem a energia de ativação ligando-se às moléculas reagentes e mantendo-as de forma a acelerar a reação.
Os reagentes químicos aos quais uma enzima se liga são chamados de substratos, e a localização dentro da enzima onde o substrato se liga é chamada de sítio ativo da enzima. As características dos aminoácidos próximos ao sítio ativo criam um ambiente químico muito específico dentro do sítio ativo que induz a adequação à ligação, ainda que brevemente, a um substrato específico (ou substratos). Devido a essa combinação semelhante a um quebra-cabeça entre uma enzima e seus substratos, as enzimas são conhecidas por sua especificidade. Na verdade, à medida que uma enzima se liga ao (s) seu (s) substrato (s), a estrutura da enzima muda ligeiramente para encontrar o melhor ajuste entre o estado de transição (um intermediário estrutural entre o substrato e o produto) e o local ativo, assim como uma luva de borracha se molda a uma mão inserida nela. Essa modificação do local ativo na presença de substrato, juntamente com a formação simultânea do estado de transição, é chamada de ajuste induzido (Figura\(\PageIndex{5}\)). No geral, existe uma enzima específica para cada substrato e, portanto, para cada reação química; no entanto, também há alguma flexibilidade. Algumas enzimas têm a capacidade de atuar em diversos substratos estruturalmente relacionados.
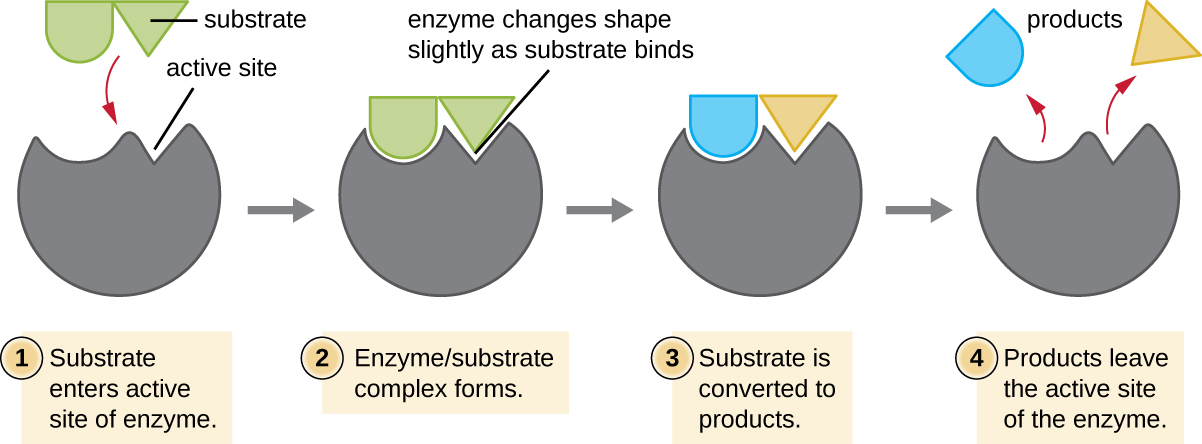
As enzimas estão sujeitas a influências de condições ambientais locais, como pH, concentração do substrato e temperatura. Embora o aumento da temperatura ambiental geralmente aumente as taxas de reação, catalisadas por enzimas ou não, aumentar ou diminuir a temperatura fora de uma faixa ideal pode afetar as ligações químicas dentro do local ativo, tornando-as menos adequadas para ligar substratos. As altas temperaturas acabarão por causar a desnaturação de enzimas, como outras moléculas biológicas, perdendo sua estrutura e função tridimensionais. As enzimas também são adequadas para funcionar melhor dentro de uma determinada faixa de pH e, como acontece com a temperatura, valores extremos de pH ambiental (ácidos ou básicos) podem causar a desnaturação das enzimas. As cadeias laterais de aminoácidos de sítio ativo têm suas próprias propriedades ácidas ou básicas que são ideais para catálise e, portanto, são sensíveis a mudanças no pH.
Outro fator que influencia a atividade enzimática é a concentração do substrato: a atividade enzimática aumenta em concentrações mais altas do substrato até atingir um ponto de saturação no qual a enzima não pode se ligar a nenhum substrato adicional. No geral, as enzimas são otimizadas para funcionar melhor nas condições ambientais em que vivem os organismos que as produzem. Por exemplo, enquanto os micróbios que habitam fontes termais têm enzimas que funcionam melhor em altas temperaturas, os patógenos humanos têm enzimas que funcionam melhor a 37°C. Da mesma forma, enquanto as enzimas produzidas pela maioria dos organismos funcionam melhor em um pH neutro, os micróbios que crescem em ambientes ácidos tornam as enzimas otimizadas para pH baixo condições, permitindo seu crescimento nessas condições.
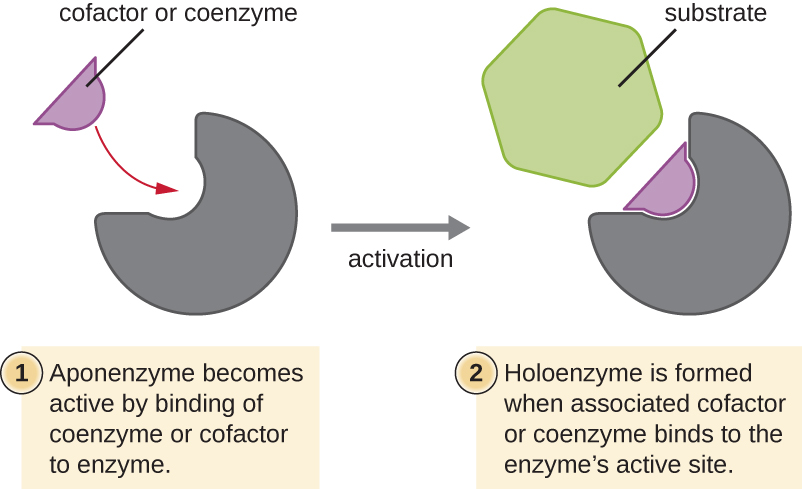
Muitas enzimas não funcionam de forma ideal, ou mesmo de todo, a menos que estejam ligadas a outras moléculas auxiliares não proteicas específicas, seja temporariamente por meio de ligações iônicas ou de hidrogênio ou permanentemente por meio de ligações covalentes mais fortes. A ligação a essas moléculas promove a conformação e a função ideais de suas respectivas enzimas. Dois tipos de moléculas auxiliares são cofatores e coenzimas. Os cofatores são íons inorgânicos, como ferro (Fe 2+) e magnésio (Mg 2+), que ajudam a estabilizar a conformação e a função das enzimas. Um exemplo de uma enzima que requer um íon metálico como cofator é a enzima que constrói moléculas de DNA, a DNA polimerase, que requer um íon zinco ligado (Zn 2+) para funcionar.
As coenzimas são moléculas auxiliares orgânicas que são necessárias para a ação enzimática. Como as enzimas, elas não são consumidas e, portanto, são reutilizáveis. As fontes mais comuns de coenzimas são as vitaminas dietéticas. Algumas vitaminas são precursoras das coenzimas e outras agem diretamente como coenzimas.
Alguns cofatores e coenzimas, como a coenzima A (CoA), geralmente se ligam ao sítio ativo da enzima, auxiliando na química da transição de um substrato para um produto (Figura\(\PageIndex{6}\)). Nesses casos, uma enzima sem um cofator ou coenzima necessário é chamada de apoenzima e é inativa. Por outro lado, uma enzima com o cofator ou coenzima associado necessário é chamada de holoenzima e está ativa. O NADH e o ATP também são exemplos de coenzimas comumente usadas que fornecem elétrons de alta energia ou grupos fosfato, respectivamente, que se ligam às enzimas, ativando-as.
Exercício\(\PageIndex{4}\)
Qual o papel das enzimas em uma reação química?
Inibidores de enzimas
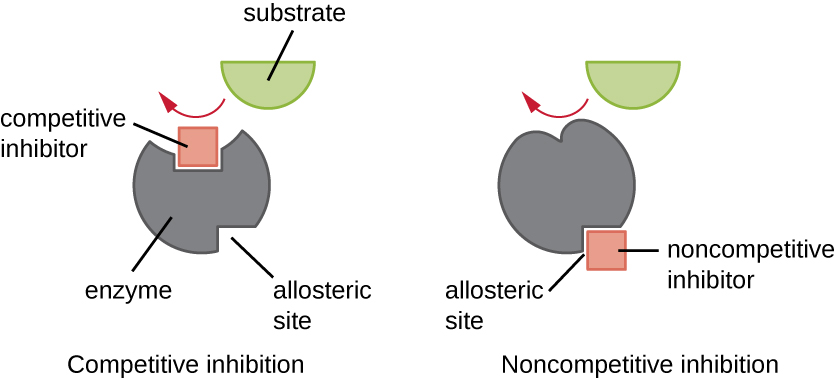
As enzimas podem ser reguladas de forma a promover ou reduzir sua atividade. Existem muitos tipos diferentes de moléculas que inibem ou promovem a função enzimática, e existem vários mecanismos para fazer isso (Figura\(\PageIndex{7}\)). Um inibidor competitivo é uma molécula semelhante o suficiente a um substrato que pode competir com o substrato pela ligação ao sítio ativo simplesmente impedindo a ligação do substrato. Para que um inibidor competitivo seja eficaz, a concentração do inibidor precisa ser aproximadamente igual à concentração do substrato. Os medicamentos sulfa são um bom exemplo de competição competitiva. Eles são usados para tratar infecções bacterianas porque se ligam ao sítio ativo de uma enzima dentro da via de síntese do ácido fólico bacteriano. Quando presente em uma dose suficiente, um fármaco sulfa impede a síntese de ácido fólico e as bactérias são incapazes de crescer porque não conseguem sintetizar DNA, RNA e proteínas. Os seres humanos não são afetados porque obtemos ácido fólico de nossas dietas.
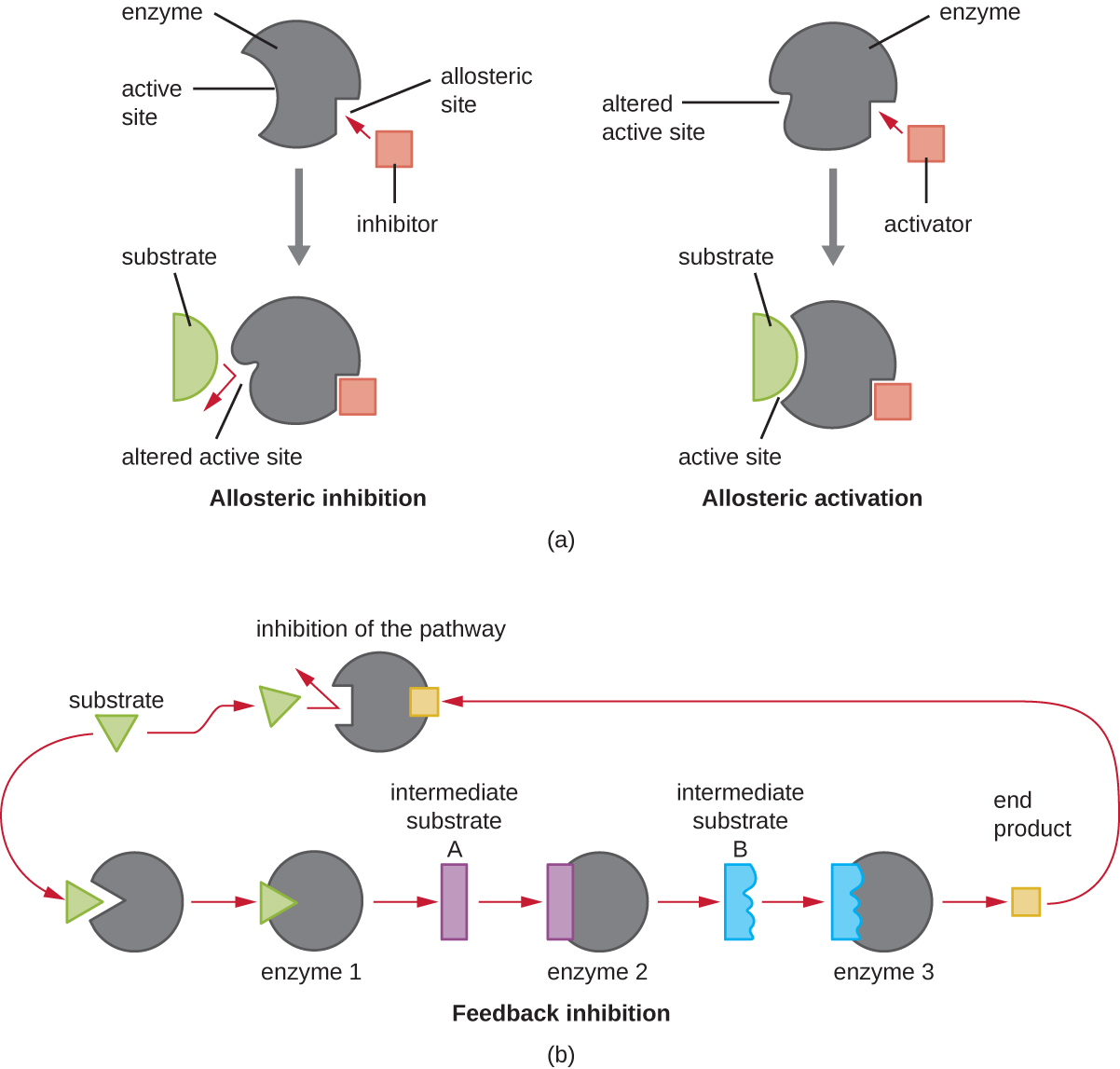
Por outro lado, um inibidor não competitivo (alostérico) se liga à enzima em um sítio alostérico, um local diferente do sítio ativo, e ainda consegue bloquear a ligação do substrato ao sítio ativo, induzindo uma mudança conformacional que reduz a afinidade da enzima por seu substrato (Figura \(\PageIndex{8}\)). Como apenas uma molécula inibidora é necessária por enzima para uma inibição efetiva, a concentração de inibidores necessária para a inibição não competitiva é normalmente muito menor do que a concentração do substrato.
Além dos inibidores alostéricos, existem ativadores alostéricos que se ligam a localizações em uma enzima distantes do sítio ativo, induzindo uma mudança conformacional que aumenta a afinidade do (s) sítio (s) ativo (s) da enzima por seu (s) substrato (s).
O controle alostérico é um importante mecanismo de regulação das vias metabólicas envolvidas tanto no catabolismo quanto no anabolismo. Da maneira mais eficiente e elegante, as células evoluíram também para usar os produtos de suas próprias reações metabólicas para inibição de feedback da atividade enzimática. A inibição do feedback envolve o uso de um produto da Pathway para regular sua própria produção adicional. A célula responde à abundância de produtos específicos diminuindo a produção durante reações anabólicas ou catabólicas (Figura\(\PageIndex{8}\)).
Exercício\(\PageIndex{5}\)
Explique a diferença entre um inibidor competitivo e um inibidor não competitivo.
Conceitos principais e resumo
- O metabolismo inclui reações químicas que quebram moléculas complexas (catabolismo) e aquelas que constroem moléculas complexas (anabolismo).
- Os organismos podem ser classificados de acordo com sua fonte de carbono. Os autotróficos convertem dióxido de carbono inorgânico em carbono orgânico; os heterotróficos usam compostos de carbono orgânico fixo.
- Os organismos também podem ser classificados de acordo com sua fonte de energia. Os fototróficos obtêm sua energia da luz. Os quimiotróficos obtêm sua energia de compostos químicos. Os organotróficos usam moléculas orgânicas e os litotróficos usam produtos químicos inorgânicos.
- Os portadores de elétrons celulares aceitam elétrons de alta energia dos alimentos e, posteriormente, servem como doadores de elétrons nas reações redox subsequentes. FAD/FADH 2, NAD +/NADH e NADP + /NADPH são portadores de elétrons importantes.
- O trifosfato de adenosina (ATP) serve como moeda de energia da célula, armazenando com segurança energia química em suas duas ligações de fosfato de alta energia para uso posterior para conduzir processos que requerem energia.
- As enzimas são catalisadores biológicos que aumentam a taxa de reações químicas dentro das células, diminuindo a energia de ativação necessária para que a reação prossiga.
- Na natureza, as reações exergônicas não requerem energia além da energia de ativação para prosseguir e liberam energia. Eles podem prosseguir sem enzimas, mas em um ritmo lento. Por outro lado, as reações endergônicas requerem energia além da energia de ativação para ocorrer. Nas células, as reações endergônicas são acopladas às reações exergônicas, tornando a combinação energeticamente favorável.
- Os substratos se ligam ao sítio ativo da enzima. Esse processo normalmente altera as estruturas do sítio ativo e do substrato, favorecendo a formação do estado de transição; isso é conhecido como ajuste induzido.
- Os cofatores são íons inorgânicos que estabilizam a conformação e a função das enzimas. As coenzimas são moléculas orgânicas necessárias para o funcionamento adequado das enzimas e geralmente são derivadas de vitaminas. Uma enzima sem um cofator ou coenzima é uma apoenzima; uma enzima com um cofator ou coenzima ligado é uma holoenzima.
- Os inibidores competitivos regulam as enzimas ligando-se ao sítio ativo de uma enzima, impedindo a ligação ao substrato. Inibidores não competitivos (alostéricos) se ligam aos sítios alostéricos, induzindo uma mudança conformacional na enzima que impede seu funcionamento. A inibição do feedback ocorre quando o produto de uma via metabólica se liga de forma não competitiva a uma enzima no início da via, impedindo a síntese do produto.


