7.4: Proteínas
- Page ID
- 181602
Objetivos de
- Descreva a estrutura fundamental de um aminoácido
- Descreva as estruturas químicas das proteínas
- Resuma as características únicas das proteínas
No início deste capítulo, foi descrito um famoso experimento no qual cientistas sintetizaram aminoácidos sob condições que simulavam os presentes na Terra muito antes da evolução da vida como a conhecemos. Esses compostos são capazes de se unir em essencialmente qualquer número, produzindo moléculas de essencialmente qualquer tamanho que possuem uma ampla gama de propriedades físicas e químicas e desempenham inúmeras funções vitais para todos os organismos. As moléculas derivadas de aminoácidos podem funcionar como componentes estruturais das células e entidades subcelulares, como fontes de nutrientes, como reservatórios de armazenamento de átomos e energia e como espécies funcionais, como hormônios, enzimas, receptores e moléculas de transporte.
Aminoácidos e ligações peptídicas
Um aminoácido é uma molécula orgânica na qual um átomo de hidrogênio, um grupo carboxila (—COOH) e um grupo amino (—NH 2) estão todos ligados ao mesmo átomo de carbono, o chamado carbono α. O quarto grupo ligado ao carbono α varia entre os diferentes aminoácidos e é chamado de resíduo ou cadeia lateral, representado em fórmulas estruturais pela letra R. Um resíduo é um monômero que resulta quando dois ou mais aminoácidos se combinam e removem moléculas de água. A estrutura primária de uma proteína, uma cadeia peptídica, é feita de resíduos de aminoácidos. As características únicas dos grupos funcionais e dos grupos R permitem que esses componentes dos aminoácidos formem ligações de hidrogênio, iônico e dissulfeto, juntamente com as interações polares/não polares necessárias para formar estruturas proteicas secundárias, terciárias e quaternárias. Esses grupos são compostos principalmente de carbono, hidrogênio, oxigênio, nitrogênio e enxofre, na forma de hidrocarbonetos, ácidos, amidas, álcoois e aminas. Alguns exemplos que ilustram essas possibilidades são fornecidos na Figura\(\PageIndex{1}\).
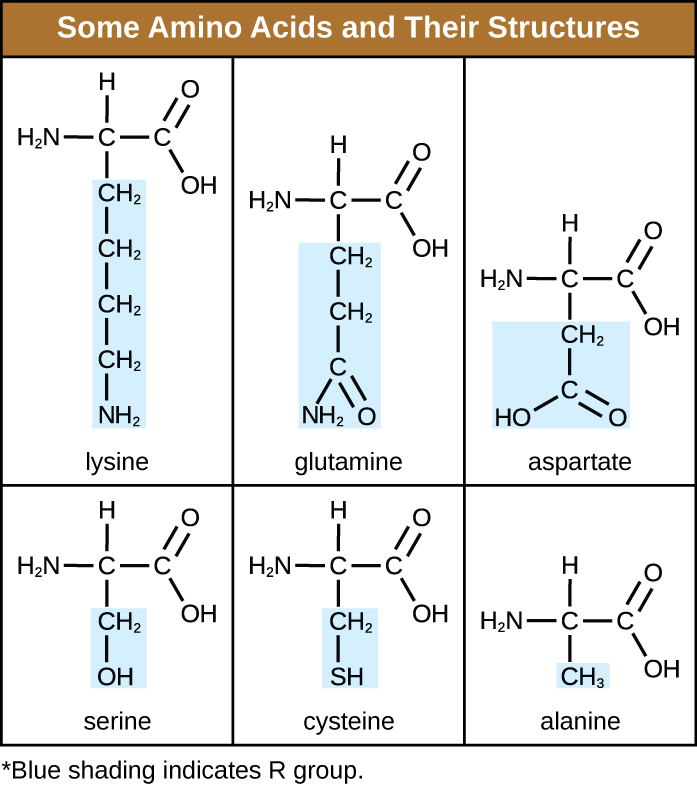
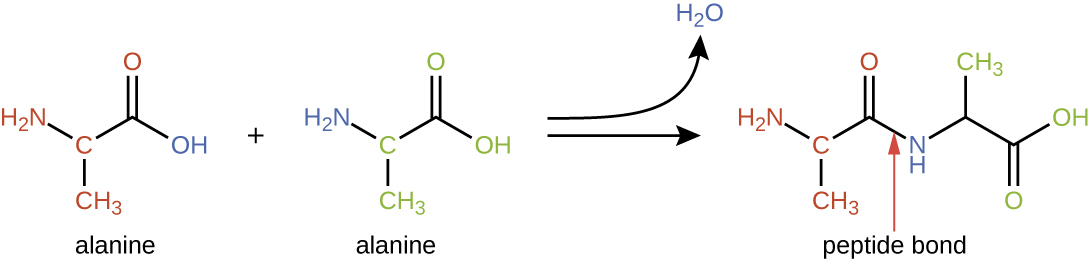
Os aminoácidos podem se unir quimicamente pela reação do grupo de ácido carboxílico de uma molécula com o grupo amina de outra. Essa reação forma uma ligação peptídica e uma molécula de água e é outro exemplo de síntese de desidratação (Figura\(\PageIndex{2}\)). As moléculas formadas pela ligação química de números relativamente modestos de aminoácidos (aproximadamente 50 ou menos) são chamadas de peptídeos, e os prefixos são frequentemente usados para especificar esses números: dipeptídeos (dois aminoácidos), tripeptídeos (três aminoácidos) e assim por diante. De forma mais geral, o número aproximado de aminoácidos é designado: os oligopeptídeos são formados pela união de até aproximadamente 20 aminoácidos, enquanto os polipeptídeos são sintetizados a partir de até aproximadamente 50 aminoácidos. Quando o número de aminoácidos ligados entre si se torna muito grande, ou quando vários polipeptídeos são usados como subunidades de construção, as macromoléculas resultantes são chamadas de proteínas. O comprimento continuamente variável (o número de monômeros) desses biopolímeros, juntamente com a variedade de possíveis grupos R em cada aminoácido, permite uma diversidade quase ilimitada nos tipos de proteínas que podem ser formadas.
Exercício\(\PageIndex{1}\)
Quantos aminoácidos existem nos polipeptídeos?
Estrutura proteica
O tamanho (comprimento) e a sequência específica de aminoácidos de uma proteína são os principais determinantes de sua forma, e a forma de uma proteína é fundamental para sua função. Por exemplo, no processo de fixação biológica de nitrogênio (consulte Ciclos Biogeoquímicos), microrganismos do solo conhecidos coletivamente como rizóbios interagem simbioticamente com raízes de leguminosas, como soja, amendoim ou feijão, para formar uma nova estrutura chamada nódulo nas raízes das plantas. A planta então produz uma proteína transportadora chamada leghemoglobina, uma proteína que transporta nitrogênio ou oxigênio. A leghemoglobina se liga com uma afinidade muito alta ao oxigênio de seu substrato em uma região específica da proteína onde a forma e a sequência de aminoácidos são apropriadas (o sítio ativo). Se a forma ou o ambiente químico do sítio ativo forem alterados, mesmo que ligeiramente, o substrato pode não ser capaz de se ligar com tanta força ou pode não se ligar de forma alguma. Assim, para que a proteína esteja totalmente ativa, ela deve ter o formato adequado para sua função.
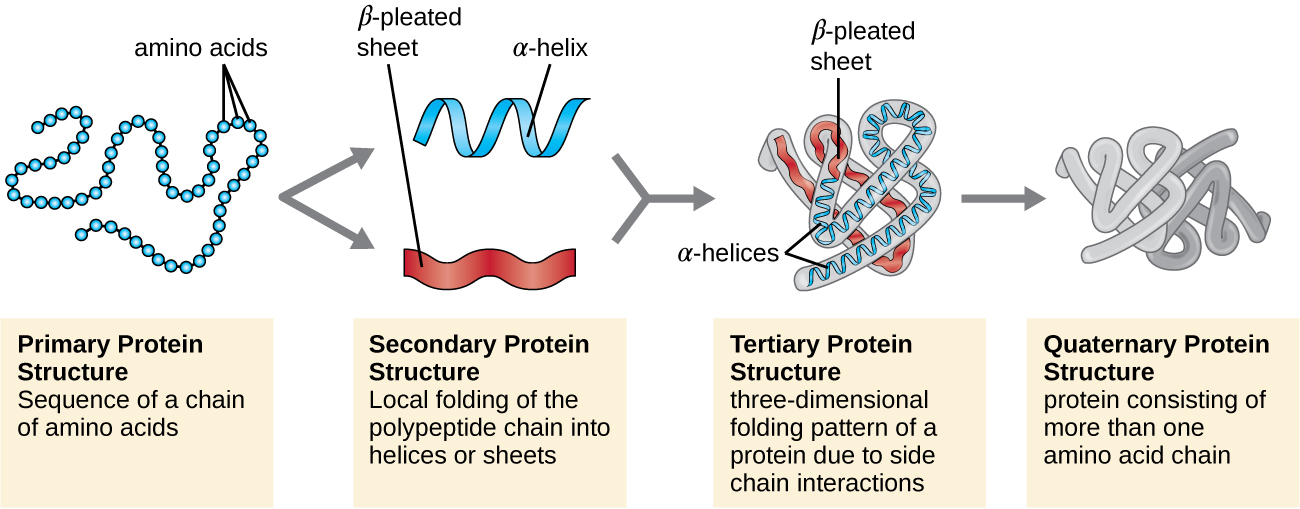
A estrutura da proteína é categorizada em termos de quatro níveis: primário, secundário, terciário e quaternário. A estrutura primária é simplesmente a sequência de aminoácidos que compõem a cadeia polipeptídica. A figura\(\PageIndex{3}\) mostra a estrutura primária de uma proteína.
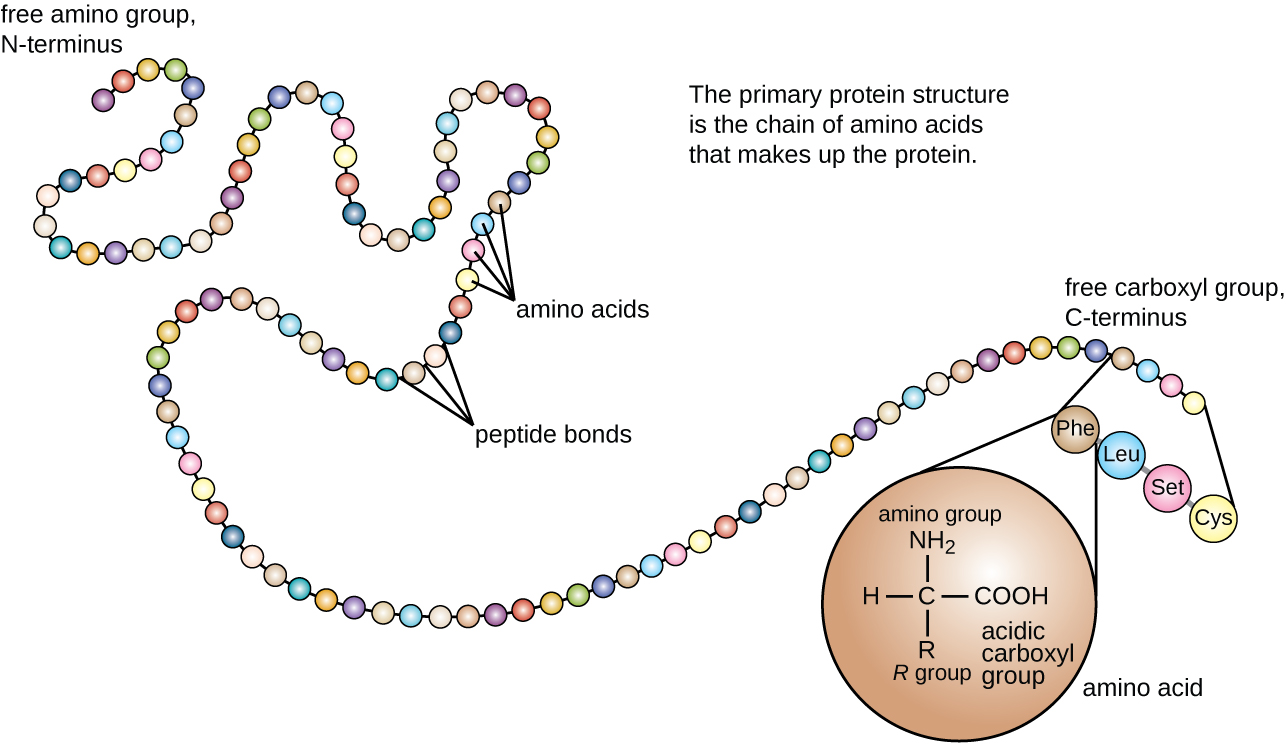
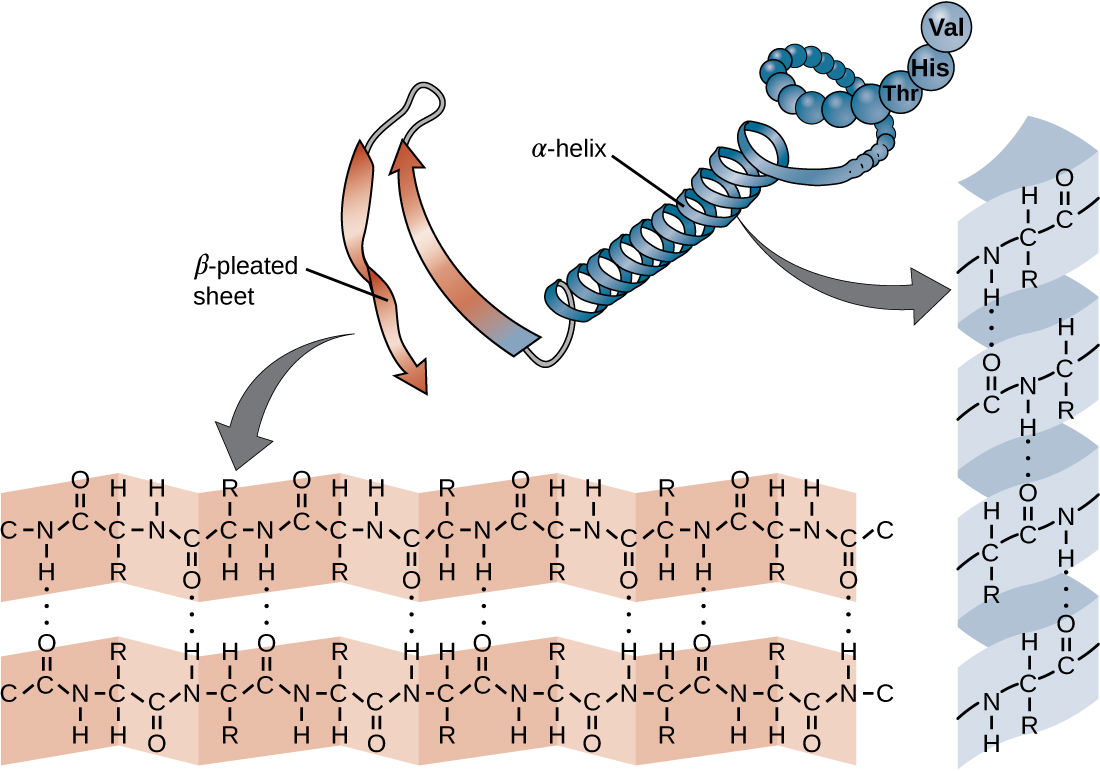
A cadeia de aminoácidos que define a estrutura primária de uma proteína não é rígida, mas é flexível devido à natureza das ligações que mantêm os aminoácidos unidos. Quando a cadeia é suficientemente longa, a ligação de hidrogênio pode ocorrer entre os grupos funcionais amina e carbonila dentro da espinha dorsal do peptídeo (excluindo o grupo do lado R), resultando no dobramento localizado da cadeia polipeptídica em hélices e folhas. Essas formas constituem a estrutura secundária de uma proteína. As estruturas secundárias mais comuns são a hélice α e a chapa plissada β. Na estrutura α-hélice, a hélice é mantida por ligações de hidrogênio entre o átomo de oxigênio em um grupo carbonila de um aminoácido e o átomo de hidrogênio do grupo amino que está apenas quatro unidades de aminoácidos mais distantes ao longo da cadeia. Na folha plissada β, as pregas são formadas por ligações de hidrogênio semelhantes entre sequências contínuas de grupos carbonil e amino que são posteriormente separadas na espinha dorsal da cadeia polipeptídica (Figura\(\PageIndex{4}\)).
O próximo nível de organização de proteínas é a estrutura terciária, que é a forma tridimensional em grande escala de uma única cadeia polipeptídica. A estrutura terciária é determinada pelas interações entre resíduos de aminoácidos que estão distantes na cadeia. Uma variedade de interações dá origem à estrutura terciária da proteína, como pontes de dissulfeto, que são ligações entre os grupos funcionais sulfidril (—SH) em grupos laterais de aminoácidos; ligações de hidrogênio; ligações iônicas; e interações hidrofóbicas entre cadeias laterais não polares. Todas essas interações, fracas e fortes, se combinam para determinar a forma tridimensional final da proteína e sua função (Figura\(\PageIndex{5}\)).
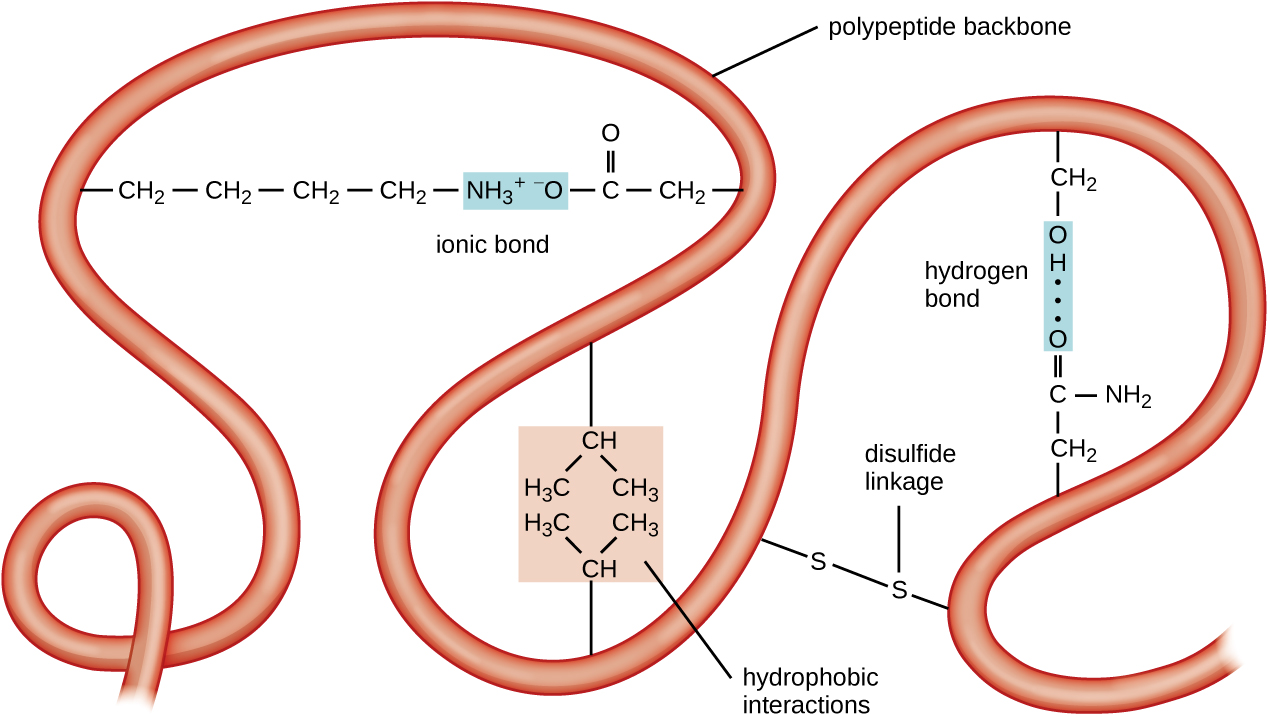
O processo pelo qual uma cadeia polipeptídica assume uma forma tridimensional em grande escala é chamado de dobramento de proteínas. Diz-se que proteínas dobradas que são totalmente funcionais em seu papel biológico normal possuem uma estrutura nativa. Quando uma proteína perde sua forma tridimensional, ela pode não estar mais funcional. Essas proteínas desdobradas são desnaturadas. A desnaturação implica a perda da estrutura secundária e da estrutura terciária (e, se presente, da estrutura quaternária) sem a perda da estrutura primária.
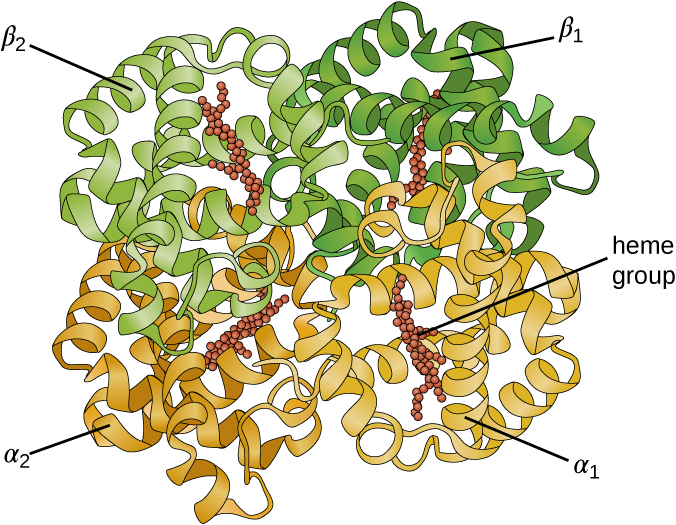
Algumas proteínas são conjuntos de vários polipeptídeos separados, também conhecidos como subunidades proteicas. Essas proteínas funcionam adequadamente somente quando todas as subunidades estão presentes e configuradas adequadamente. As interações que mantêm essas subunidades unidas constituem a estrutura quaternária da proteína. A estrutura quaternária geral é estabilizada por interações relativamente fracas. A hemoglobina, por exemplo, tem uma estrutura quaternária de quatro subunidades proteicas globulares: dois polipeptídeos α e dois β, cada um contendo um heme à base de ferro (Figura\(\PageIndex{6}\)).
Outra classe importante de proteínas são as proteínas conjugadas que têm uma porção não proteica. Se a proteína conjugada tiver um carboidrato ligado, ela é chamada de glicoproteína. Se tiver um lipídio ligado, é chamado de lipoproteína. Essas proteínas são componentes importantes das membranas. A figura\(\PageIndex{7}\) resume os quatro níveis da estrutura da proteína.
Exercício\(\PageIndex{2}\)
O que pode acontecer se a estrutura primária, secundária, terciária ou quaternária de uma proteína for alterada?
Estrutura primária, proteínas disfuncionais e fibrose cística
As proteínas associadas às membranas biológicas são classificadas como extrínsecas ou intrínsecas. As proteínas extrínsecas, também chamadas de proteínas periféricas, estão frouxamente associadas a um lado da membrana. As proteínas intrínsecas, ou proteínas integrais, estão embutidas na membrana e geralmente funcionam como parte dos sistemas de transporte como proteínas transmembranares. A fibrose cística (FC) é uma doença genética humana causada por uma alteração na proteína transmembrana. Afeta principalmente os pulmões, mas também pode afetar o pâncreas, fígado, rins e intestino. A FC é causada pela perda do aminoácido fenilalanina em uma proteína transmembranar de fibrose cística (CFTR). A perda de um aminoácido altera a estrutura primária de uma proteína que normalmente ajuda a transportar sal e água para dentro e para fora das células (Figura\(\PageIndex{8}\)).
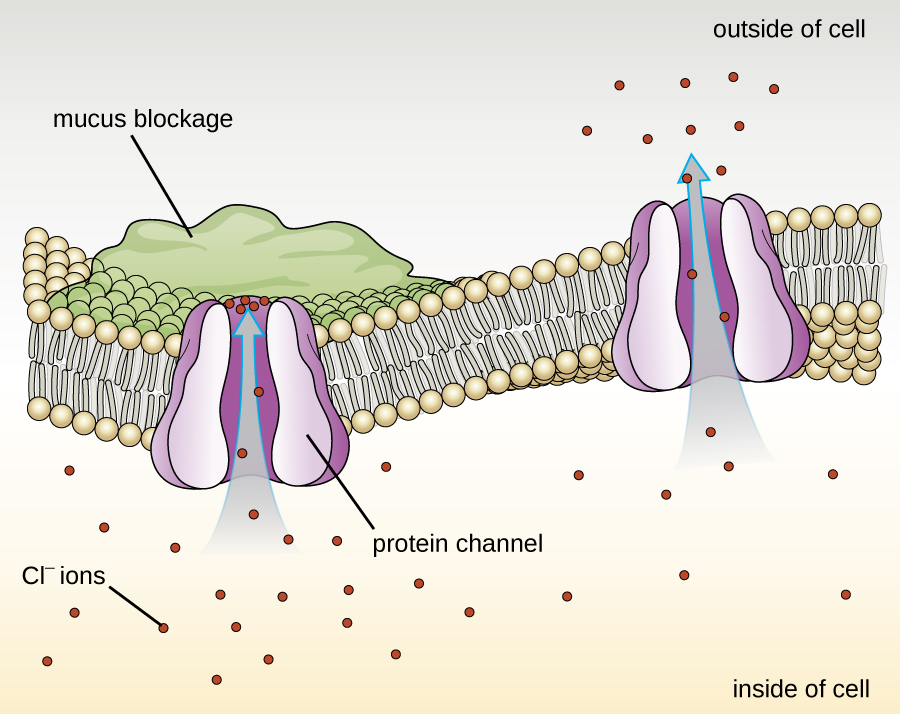
A mudança na estrutura primária impede que a proteína funcione adequadamente, o que faz com que o corpo produza muco invulgarmente espesso que obstrui os pulmões e leva ao acúmulo de muco pegajoso. O muco obstrui o pâncreas e impede que as enzimas naturais ajudem o corpo a decompor os alimentos e a absorver nutrientes vitais.
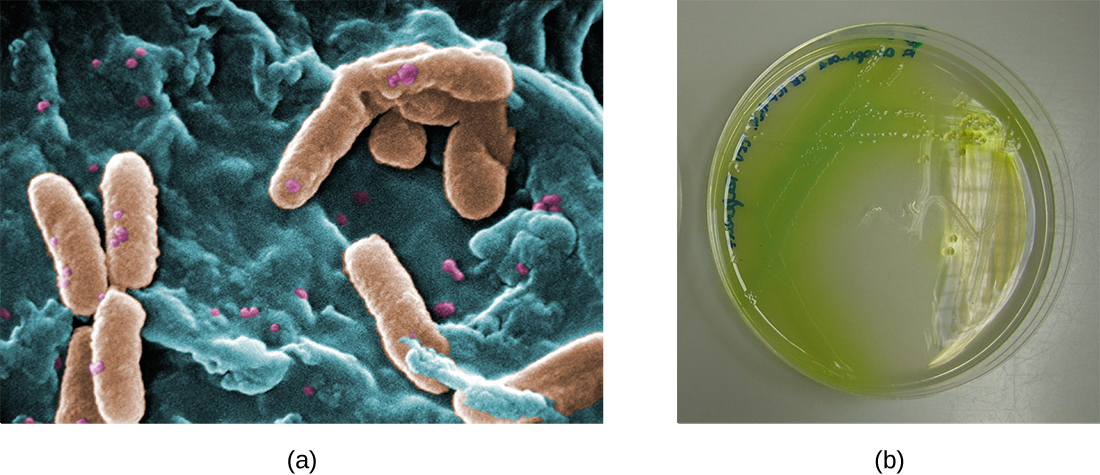
Nos pulmões de indivíduos com fibrose cística, o muco alterado fornece um ambiente onde as bactérias podem se desenvolver. Essa colonização leva à formação de biofilmes nas pequenas vias aéreas dos pulmões. Os patógenos mais comuns encontrados nos pulmões de pacientes com fibrose cística são Pseudomonas aeruginosa (Figura\(\PageIndex{9}\)) e Burkholderia cepacia. Pseudomonas se diferencia dentro do biofilme do pulmão e forma grandes colônias, chamadas de Pseudomonas “mucóides”. As colônias têm uma pigmentação única que aparece em testes de laboratório (Figura\(\PageIndex{9}\)) e fornece aos médicos a primeira pista de que o paciente tem FC (essas colônias são raras em indivíduos saudáveis).
Para obter mais informações sobre fibrose cística, visite o site da Cystic Fibrosis Foundation.
Conceitos principais e resumo
- Os aminoácidos são pequenas moléculas essenciais para toda a vida. Cada um tem um carbono α ao qual um átomo de hidrogênio, grupo carboxila e grupo amina estão ligados. O quarto grupo ligado, representado por R, varia em composição química, tamanho, polaridade e carga entre os diferentes aminoácidos, proporcionando variação nas propriedades.
- Os peptídeos são polímeros formados pela ligação de aminoácidos por meio da síntese de desidratação. As ligações entre os aminoácidos ligados são chamadas de ligações peptídicas. O número de aminoácidos ligados entre si pode variar de alguns para muitos.
- As proteínas são polímeros formados pela ligação de um grande número de aminoácidos. Eles desempenham muitas funções importantes em uma célula, servindo como nutrientes e enzimas; moléculas de armazenamento de carbono, nitrogênio e energia; e componentes estruturais.
- A estrutura de uma proteína é um determinante crítico de sua função e é descrita por uma classificação graduada: primária, secundária, terciária e quaternária. A estrutura nativa de uma proteína pode ser interrompida pela desnaturação, resultando na perda de sua estrutura de ordem superior e de sua função biológica.
- Algumas proteínas são formadas por várias subunidades proteicas separadas, a interação dessas subunidades compondo a estrutura quaternária do complexo proteico.
- As proteínas conjugadas têm uma porção não polipeptídica que pode ser um carboidrato (formando uma glicoproteína) ou uma fração lipídica (formando uma lipoproteína). Essas proteínas são componentes importantes das membranas.


