7.1: Moléculas orgânicas
- Page ID
- 181595
Objetivos de
- Identifique elementos e estruturas comuns encontrados em moléculas orgânicas
- Explicar o conceito de isomerismo
- Identifique exemplos de grupos funcionais
- Descreva o papel dos grupos funcionais na síntese de polímeros
Foco clínico: Parte 1
Penny é uma estudante de 16 anos que visitou seu médico, reclamando de uma erupção cutânea com coceira. Ela tinha um histórico de episódios alérgicos. O médico examinou sua pele bronzeada e perguntou se ela trocou por um protetor solar diferente. Ela disse que sim, então o médico diagnosticou um eczema alérgico. Os sintomas eram leves, então o médico disse a Penny que evitasse usar o protetor solar que causou a reação e prescreveu um creme hidratante sem receita médica para manter a pele hidratada e ajudar na coceira.
Exercício\(\PageIndex{1}\)
- Que tipos de substâncias você esperaria encontrar em um creme hidratante?
- Quais propriedades físicas ou químicas dessas substâncias ajudariam a aliviar a coceira e a inflamação da pele?
A bioquímica é a disciplina que estuda a química da vida e seu objetivo é explicar a forma e a função com base em princípios químicos. A química orgânica é a disciplina dedicada ao estudo da química baseada no carbono, que é a base para o estudo das biomoléculas e a disciplina da bioquímica. Tanto a bioquímica quanto a química orgânica são baseadas nos conceitos de química geral, alguns dos quais são apresentados no Apêndice A.
Elementos em células vivas
O elemento mais abundante nas células é o hidrogênio (H), seguido pelo carbono (C), oxigênio (O), nitrogênio (N), fósforo (P) e enxofre (S). Chamamos esses elementos de macronutrientes e eles representam cerca de 99% do peso seco das células. Alguns elementos, como sódio (Na), potássio (K), magnésio (Mg), zinco (Zn), ferro (Fe), cálcio (Ca), molibdênio (Mo), cobre (Cu), cobalto (Co), manganês (Mn) ou vanádio (Va), são necessários para algumas células em quantidades muito pequenas e são chamados de micronutrientes ou oligoelementos. Todos esses elementos são essenciais para o funcionamento de muitas reações bioquímicas e, portanto, são essenciais para a vida.
Os quatro elementos mais abundantes na matéria viva (C, N, O e H) têm números atômicos baixos e, portanto, são elementos leves capazes de formar fortes ligações com outros átomos para produzir moléculas (Figura\(\PageIndex{1}\)). O carbono forma quatro ligações químicas, enquanto o nitrogênio forma três, o oxigênio forma duas e o hidrogênio forma uma. Quando ligados entre si dentro de moléculas, oxigênio, enxofre e nitrogênio geralmente têm um ou mais “pares solitários” de elétrons que desempenham papéis importantes na determinação de muitas das propriedades físicas e químicas das moléculas (consulte o Apêndice A). Essas características combinadas permitem a formação de um grande número de espécies moleculares diversas necessárias para formar as estruturas e permitir as funções dos organismos vivos.
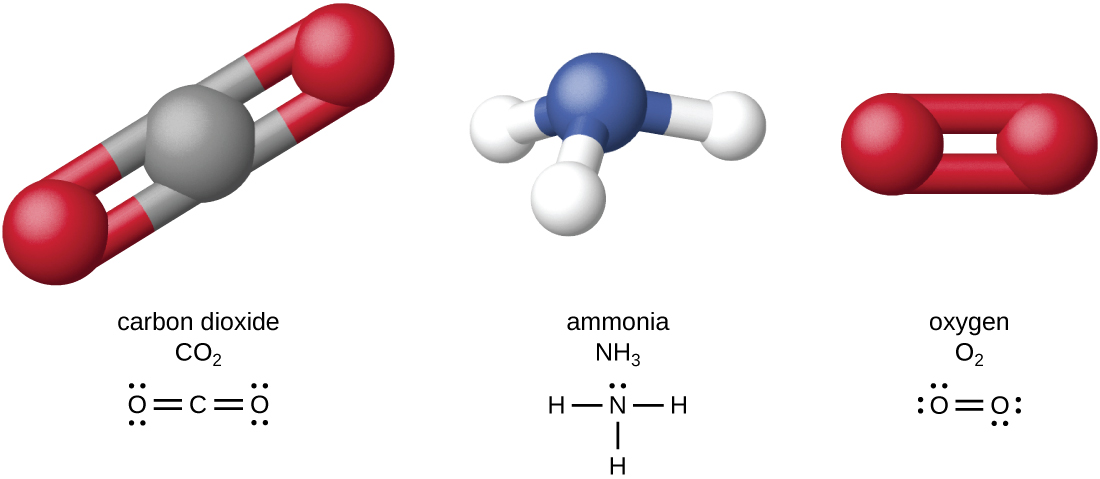
Os organismos vivos contêm compostos inorgânicos (principalmente água e sais; veja o Apêndice A) e moléculas orgânicas. As moléculas orgânicas contêm carbono; os compostos inorgânicos não. Óxidos e carbonatos de carbono são exceções; eles contêm carbono, mas são considerados inorgânicos porque não contêm hidrogênio. Os átomos de uma molécula orgânica são normalmente organizados em torno de cadeias de átomos de carbono.
Os compostos inorgânicos representam 1% a 1,5% da massa de uma célula viva. São compostos pequenos e simples que desempenham papéis importantes na célula, embora não formem estruturas celulares. A maior parte do carbono encontrado nas moléculas orgânicas se origina de fontes de carbono inorgânicas, como o dióxido de carbono capturado por meio da fixação de carbono por microrganismos.
Exercício\(\PageIndex{2}\)
- Descreva os elementos mais abundantes na natureza.
- Quais são as diferenças entre moléculas orgânicas e inorgânicas?
Moléculas orgânicas e isomerismo
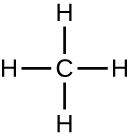
As moléculas orgânicas nos organismos são geralmente maiores e mais complexas do que as moléculas inorgânicas. Seus esqueletos de carbono são mantidos juntos por ligações covalentes. Eles formam as células de um organismo e realizam as reações químicas que facilitam a vida. Todas essas moléculas, chamadas de biomoléculas porque fazem parte da matéria viva, contêm carbono, que é o alicerce da vida. O carbono é um elemento muito único, pois tem quatro elétrons de valência em seus orbitais externos e pode formar quatro ligações covalentes simples com até quatro outros átomos ao mesmo tempo (veja o Apêndice A). Esses átomos geralmente são oxigênio, hidrogênio, nitrogênio, enxofre, fósforo e carbono em si; o composto orgânico mais simples é o metano, no qual o carbono se liga apenas ao hidrogênio (Figura\(\PageIndex{2}\)).
Como resultado da combinação única de tamanho e propriedades de ligação do carbono, os átomos de carbono podem se unir em grande número, produzindo assim uma cadeia ou esqueleto de carbono. O esqueleto de carbono das moléculas orgânicas pode ser reto, ramificado ou em forma de anel (cíclico). As moléculas orgânicas são construídas em cadeias de átomos de carbono de comprimentos variados; a maioria é tipicamente muito longa, o que permite um grande número e variedade de compostos. Nenhum outro elemento tem a capacidade de formar tantas moléculas diferentes de tantos tamanhos e formas diferentes.
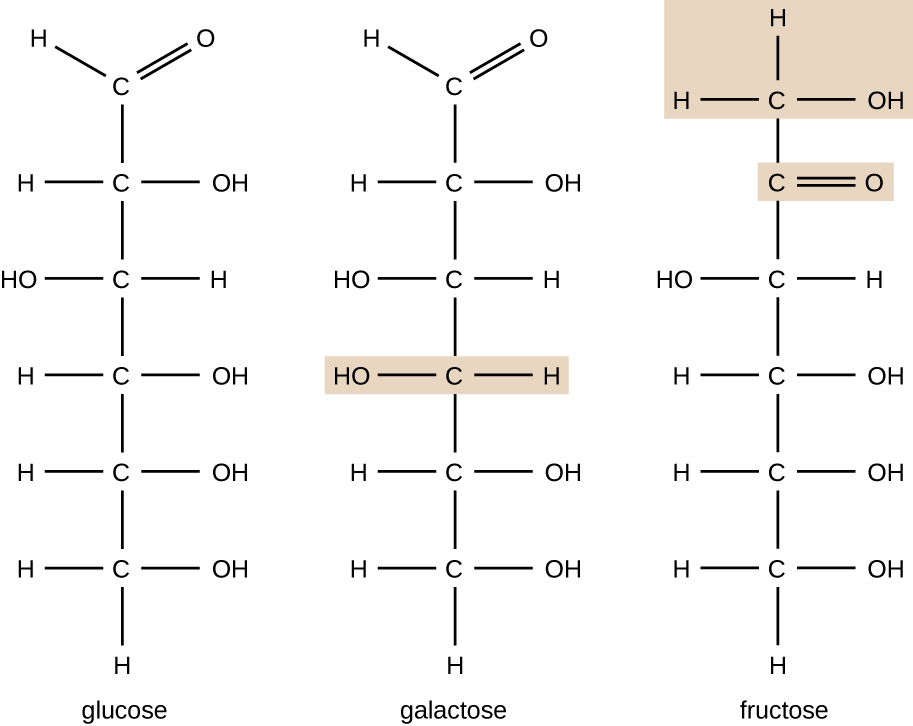
Moléculas com a mesma composição atômica, mas com diferentes arranjos estruturais de átomos, são chamadas de isômeros. O conceito de isomerismo é muito importante em química porque a estrutura de uma molécula está sempre diretamente relacionada à sua função. Pequenas mudanças nos arranjos estruturais dos átomos em uma molécula podem levar a propriedades muito diferentes. Os químicos representam as moléculas por sua fórmula estrutural, que é uma representação gráfica da estrutura molecular, mostrando como os átomos estão dispostos. Compostos que têm fórmulas moleculares idênticas, mas diferem na sequência de ligação dos átomos, são chamados de isômeros estruturais. Os monossacarídeos glicose, galactose e frutose têm a mesma fórmula molecular, C 6 H 12 O 6, mas podemos ver na Figura\(\PageIndex{3}\) que os átomos estão ligados de forma diferente.
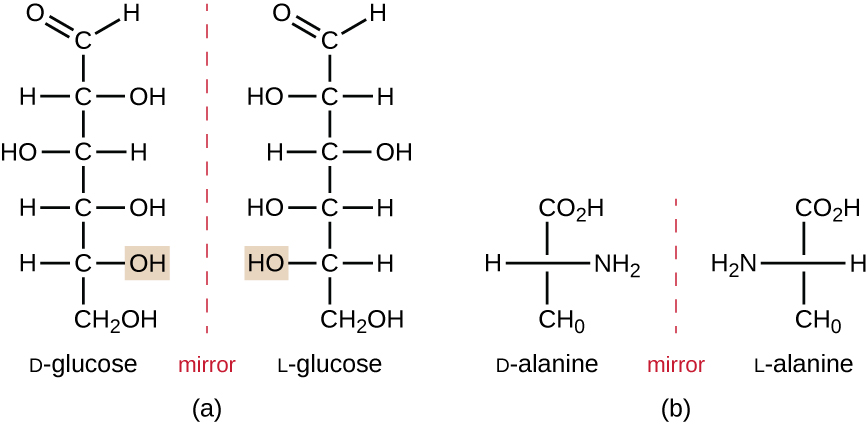
Os isômeros que diferem nos arranjos espaciais dos átomos são chamados de estereoisômeros; um tipo único são os enantiômeros. As propriedades dos enantiômeros foram originalmente descobertas por Louis Pasteur em 1848 ao usar um microscópio para analisar produtos de fermentação cristalizados do vinho. Enantiômeros são moléculas que têm a característica de quiralidade, nas quais suas estruturas são imagens espelhadas não sobrepostas umas das outras. A quiralidade é uma característica importante em muitas moléculas biologicamente importantes, conforme ilustrado pelos exemplos de diferenças estruturais nas formas enantioméricas do monossacarídeo glicose ou do aminoácido alanina (Figura\(\PageIndex{4}\)).
Muitos organismos só são capazes de usar uma forma enantiomérica de certos tipos de moléculas como nutrientes e como blocos de construção para criar estruturas dentro de uma célula. Algumas formas enantioméricas de aminoácidos têm sabores e cheiros distintamente diferentes quando consumidas como alimento. Por exemplo, o L-aspartame, comumente chamado de aspartame, tem um sabor doce, enquanto o D-aspartame não tem sabor. Os enantiômeros de drogas podem ter efeitos farmacológicos muito diferentes. Por exemplo, o composto metorfano existe como dois enantiômeros, um dos quais atua como antitussígeno (dextro metorfano, um supressor da tosse), enquanto o outro atua como analgésico (levo metorfano, um medicamento similar em efeito à codeína).
Os enantiômeros também são chamados de isômeros ópticos porque podem girar o plano da luz polarizada. Alguns dos cristais que Pasteur observou na fermentação do vinho giraram a luz no sentido horário, enquanto outros giraram a luz no sentido anti-horário. Hoje, denotamos enantiômeros que giram a luz polarizada no sentido horário (+) como formas d e a imagem espelhada da mesma molécula que gira a luz polarizada no sentido anti-horário (−) da forma l. Os rótulos d e l são derivados das palavras latinas dexter (à direita) e laevus (à esquerda), respectivamente. Esses dois isômeros ópticos diferentes geralmente têm propriedades e atividades biológicas muito diferentes. Certas espécies de fungos, leveduras e bactérias, como Rhizopus, Yarrowia e Lactobacillus spp., respectivamente, só podem metabolizar um tipo de isômero óptico; o isômero oposto não é adequado como fonte de nutrientes. Outro motivo importante para se conhecer os isômeros ópticos é o uso terapêutico desses tipos de produtos químicos para tratamento medicamentoso, pois alguns microrganismos só podem ser afetados por um isômero óptico específico.
Exercício\(\PageIndex{3}\)
Dizemos que a vida é baseada em carbono. O que torna o carbono tão adequado para fazer parte de todas as macromoléculas dos organismos vivos?
Grupos funcionais biologicamente significativos
Além de conter átomos de carbono, as biomoléculas também contêm grupos funcionais — grupos de átomos dentro das moléculas que são categorizados por sua composição química específica e pelas reações químicas que realizam, independentemente da molécula na qual o grupo seja encontrado. Alguns dos grupos funcionais mais comuns estão listados na Figura\(\PageIndex{5}\). Nas fórmulas, o símbolo R significa “resíduo” e representa o restante da molécula. R pode simbolizar apenas um único átomo de hidrogênio ou pode representar um grupo de muitos átomos. Observe que alguns grupos funcionais são relativamente simples, consistindo de apenas um ou dois átomos, enquanto alguns compreendem dois desses grupos funcionais mais simples. Por exemplo, um grupo carbonila é um grupo funcional composto por um átomo de carbono duplamente ligado a um átomo de oxigênio: C=O. Está presente em várias classes de compostos orgânicos como parte de grupos funcionais maiores, como cetonas, aldeídos, ácidos carboxílicos e amidas. Nas cetonas, o carbonil está presente como um grupo interno, enquanto nos aldeídos é um grupo terminal.
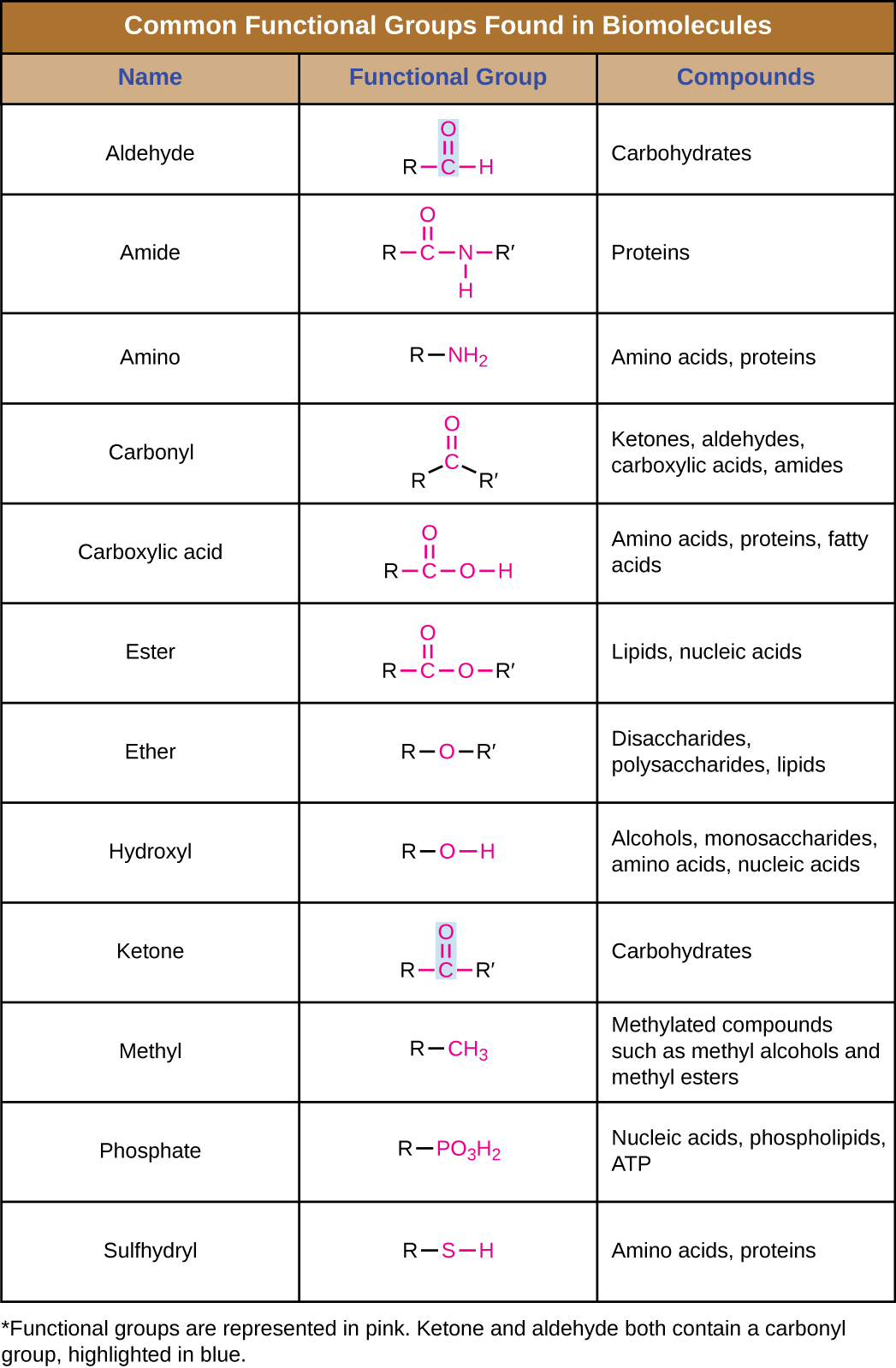
Macromoléculas
As cadeias de carbono formam os esqueletos da maioria das moléculas orgânicas. Grupos funcionais se combinam com a cadeia para formar biomoléculas. Como essas biomoléculas são tipicamente grandes, nós as chamamos de macromoléculas. Muitas macromoléculas biologicamente relevantes são formadas pela ligação de um grande número de moléculas orgânicas menores idênticas ou muito similares. As moléculas menores atuam como blocos de construção e são chamadas de monômeros, e as macromoléculas que resultam de sua ligação são chamadas de polímeros. As células e estruturas celulares incluem quatro grupos principais de macromoléculas contendo carbono: polissacarídeos, proteínas, lipídios e ácidos nucléicos. Os primeiros três grupos de moléculas serão estudados ao longo deste capítulo. A bioquímica dos ácidos nucléicos será discutida em Bioquímica do Genoma.
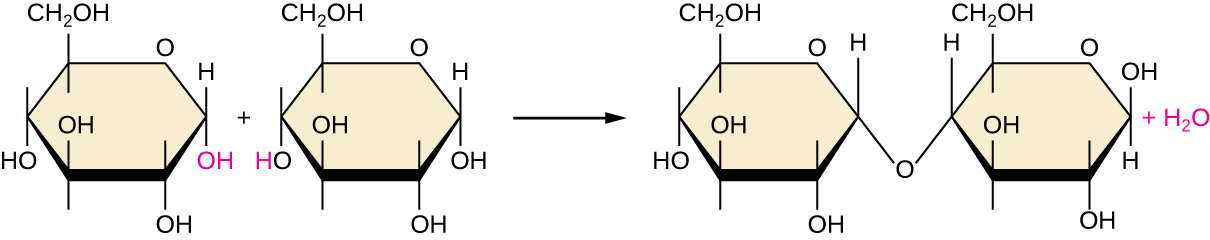
Das muitas maneiras possíveis pelas quais os monômeros podem ser combinados para produzir polímeros, uma abordagem comum encontrada na formação de macromoléculas biológicas é a síntese de desidratação. Nessa reação química, as moléculas de monômero se ligam de ponta a ponta em um processo que resulta na formação de moléculas de água como subproduto:
\[\text{H—monomer—OH} + \text{H—monomer—OH} ⟶ \text{H—monomer—monomer—OH} + \ce{H2O}\]
A figura\(\PageIndex{6}\) mostra a síntese de desidratação da glicose se unindo para formar maltose e uma molécula de água. A tabela\(\PageIndex{1}\) resume as macromoléculas e algumas de suas funções.
| Macromolécula | Funções |
|---|---|
| carboidratos | Armazenamento de energia, receptores, alimentos, papel estrutural nas plantas, paredes celulares fúngicas, exoesqueletos de insetos |
| Lipídios | Armazenamento de energia, estrutura da membrana, isolamento, hormônios, pigmentos |
| Ácidos nucleicos | Armazenamento e transferência de informações genéticas |
| Proteínas | Enzimas, estrutura, receptores, transporte, papel estrutural no citoesqueleto de uma célula e na matriz extracelular |
Exercício\(\PageIndex{4}\)
Qual é o subproduto de uma reação de síntese de desidratação?
Conceitos principais e resumo
- Os elementos mais abundantes nas células são hidrogênio, carbono, oxigênio, nitrogênio, fósforo e enxofre.
- A vida é baseada em carbono. Cada átomo de carbono pode se ligar a outro, produzindo um esqueleto de carbono que pode ser reto, ramificado ou em forma de anel.
- Os mesmos números e tipos de átomos podem se unir de maneiras diferentes para produzir moléculas diferentes chamadas isômeros. Os isômeros podem diferir na sequência de ligação de seus átomos (isômeros estruturais) ou no arranjo espacial de átomos cujas sequências de ligação são as mesmas (estereoisômeros), e suas propriedades físicas e químicas podem variar ligeiramente ou drasticamente.
- Os grupos funcionais conferem propriedades químicas específicas às moléculas que os contêm. Grupos funcionais comuns em biomoléculas são hidroxil, metil, carbonil, carboxil, amino, fosfato e sulfidril.
- Macromoléculas são polímeros montados a partir de unidades individuais, os monômeros, que se unem como blocos de construção. Muitas macromoléculas biologicamente significativas são formadas pela síntese de desidratação, um processo no qual os monômeros se unem combinando seus grupos funcionais e gerando moléculas de água como subprodutos.


