2.4: Coloração de amostras microscópicas
- Page ID
- 181628
Objetivos de
- Diferencie entre manchas simples e diferenciais
- Descreva as características únicas das manchas comumente usadas
- Explique os procedimentos e nomeie as aplicações clínicas para coloração por Gram, endosporos, ácidos resistentes, cápsulas negativas e flagelos
Em seu estado natural, a maioria das células e microrganismos que observamos sob o microscópio carecem de cor e contraste. Isso torna difícil, senão impossível, detectar estruturas celulares importantes e suas características distintivas sem tratar artificialmente as amostras. Já aludimos a certas técnicas que envolvem manchas e corantes fluorescentes e, nesta seção, discutiremos técnicas específicas para preparação de amostras com mais detalhes. De fato, vários métodos foram desenvolvidos para identificar micróbios específicos, estruturas celulares, sequências de DNA ou indicadores de infecção em amostras de tecido, sob o microscópio. Aqui, vamos nos concentrar nas técnicas mais relevantes do ponto de vista clínico.
Preparando amostras para microscopia óptica
Em ambientes clínicos, os microscópios de luz são os microscópios mais usados. Existem dois tipos básicos de preparação usados para visualizar amostras com um microscópio de luz: suportes úmidos e amostras fixas.
O tipo mais simples de preparação é o suporte úmido, no qual a amostra é colocada na lâmina em uma gota de líquido. Algumas amostras, como uma gota de urina, já estão na forma líquida e podem ser depositadas na lâmina usando um conta-gotas. Amostras sólidas, como raspagem de pele, podem ser colocadas na lâmina antes de adicionar uma gota de líquido para preparar o suporte úmido. Às vezes, o líquido usado é simplesmente água, mas geralmente são adicionadas manchas para aumentar o contraste. Depois que o líquido é adicionado à lâmina, uma lamela é colocada na parte superior e a amostra está pronta para ser examinada ao microscópio.
O segundo método de preparação de amostras para microscopia de luz é a fixação. A “fixação” de uma amostra se refere ao processo de fixação de células em uma lâmina. A fixação geralmente é obtida por aquecimento (fixação térmica) ou tratamento químico da amostra. Além de fixar a amostra na lâmina, a fixação também mata os microrganismos na amostra, interrompendo seu movimento e metabolismo, preservando a integridade de seus componentes celulares para observação.
Para fixar uma amostra com calor, uma fina camada da amostra é espalhada na lâmina (chamada de mancha) e a lâmina é então aquecida brevemente sobre uma fonte de calor (Figura\(\PageIndex{1}\)). Os fixadores químicos geralmente são preferíveis ao calor para amostras de tecido. Agentes químicos como ácido acético, etanol, metanol, formaldeído (formalina) e glutaraldeído podem desnaturar proteínas, interromper reações bioquímicas e estabilizar estruturas celulares em amostras de tecido (Figura\(\PageIndex{1}\)).

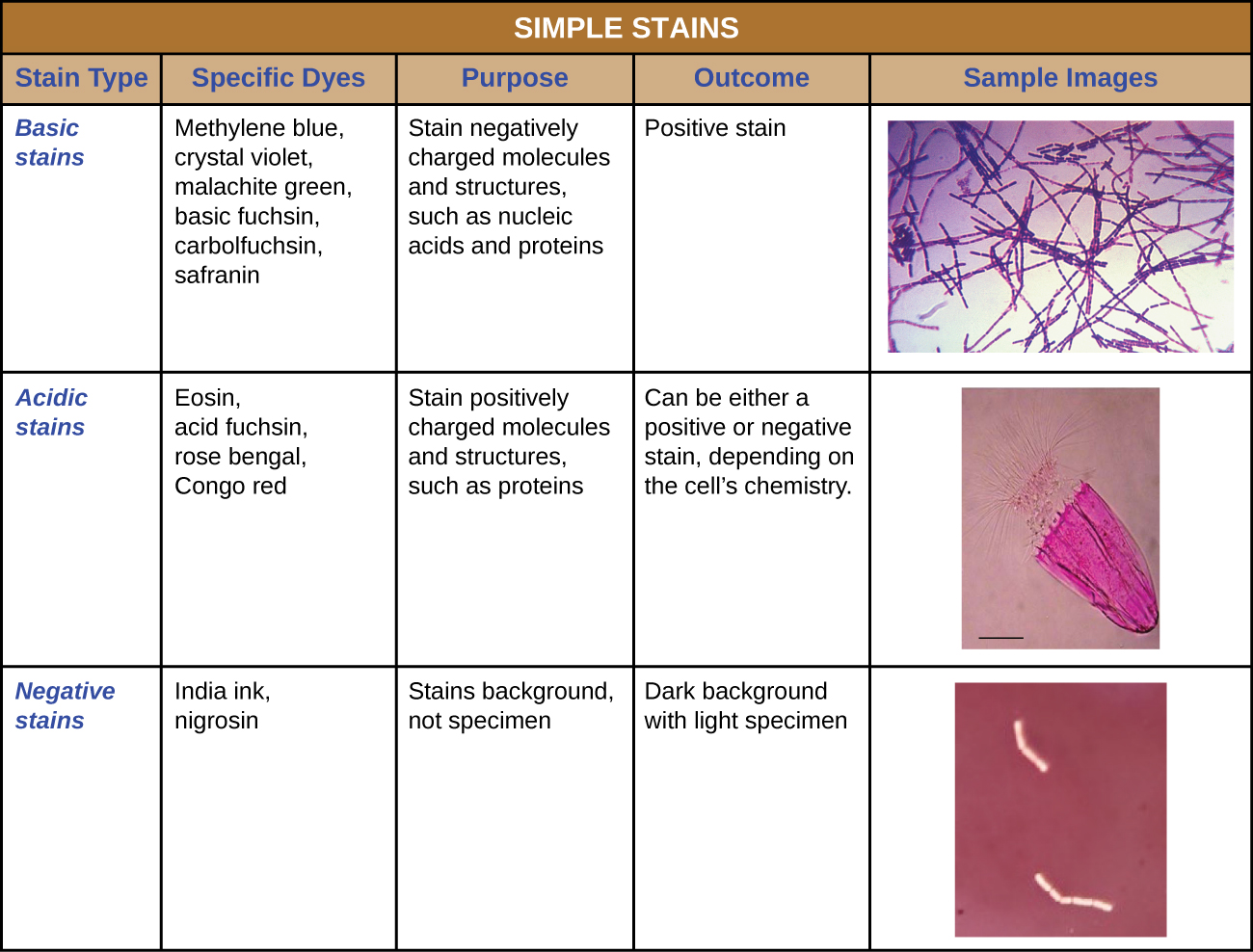
Além da fixação, a coloração quase sempre é aplicada para colorir certas características de uma amostra antes de examiná-la sob um microscópio de luz. As manchas, ou corantes, contêm sais compostos por um íon positivo e um íon negativo. Dependendo do tipo de corante, o íon positivo ou negativo pode ser o cromóforo (o íon colorido); o outro íon incolor é chamado de contra-íon. Se o cromóforo for o íon de carga positiva, a mancha é classificada como corante básico; se o íon negativo for o cromóforo, a mancha é considerada um corante ácido.
Os corantes são selecionados para coloração com base nas propriedades químicas do corante e na amostra a ser observada, que determinam como o corante interagirá com a amostra. Na maioria dos casos, é preferível usar uma coloração positiva, um corante que será absorvido pelas células ou organismos observados, adicionando cor aos objetos de interesse para que se destaquem contra o fundo. No entanto, existem cenários em que é vantajoso usar uma mancha negativa, que é absorvida pelo fundo, mas não pelas células ou organismos da amostra. A coloração negativa produz um contorno ou silhueta dos organismos contra um fundo colorido (Figura\(\PageIndex{2}\)).

Como as células normalmente têm paredes celulares carregadas negativamente, os cromóforos positivos dos corantes básicos tendem a aderir às paredes celulares, tornando-as manchas positivas. Assim, corantes básicos comumente usados, como fucsina básica, violeta cristalino, verde malaquita, azul de metileno e safranina, normalmente servem como manchas positivas. Por outro lado, os cromóforos carregados negativamente em corantes ácidos são repelidos por paredes celulares carregadas negativamente, tornando-os manchas negativas. Os corantes ácidos comumente usados incluem ácido fucsina, eosina e rosa bengala. A figura\(\PageIndex{10}\) fornece mais detalhes.
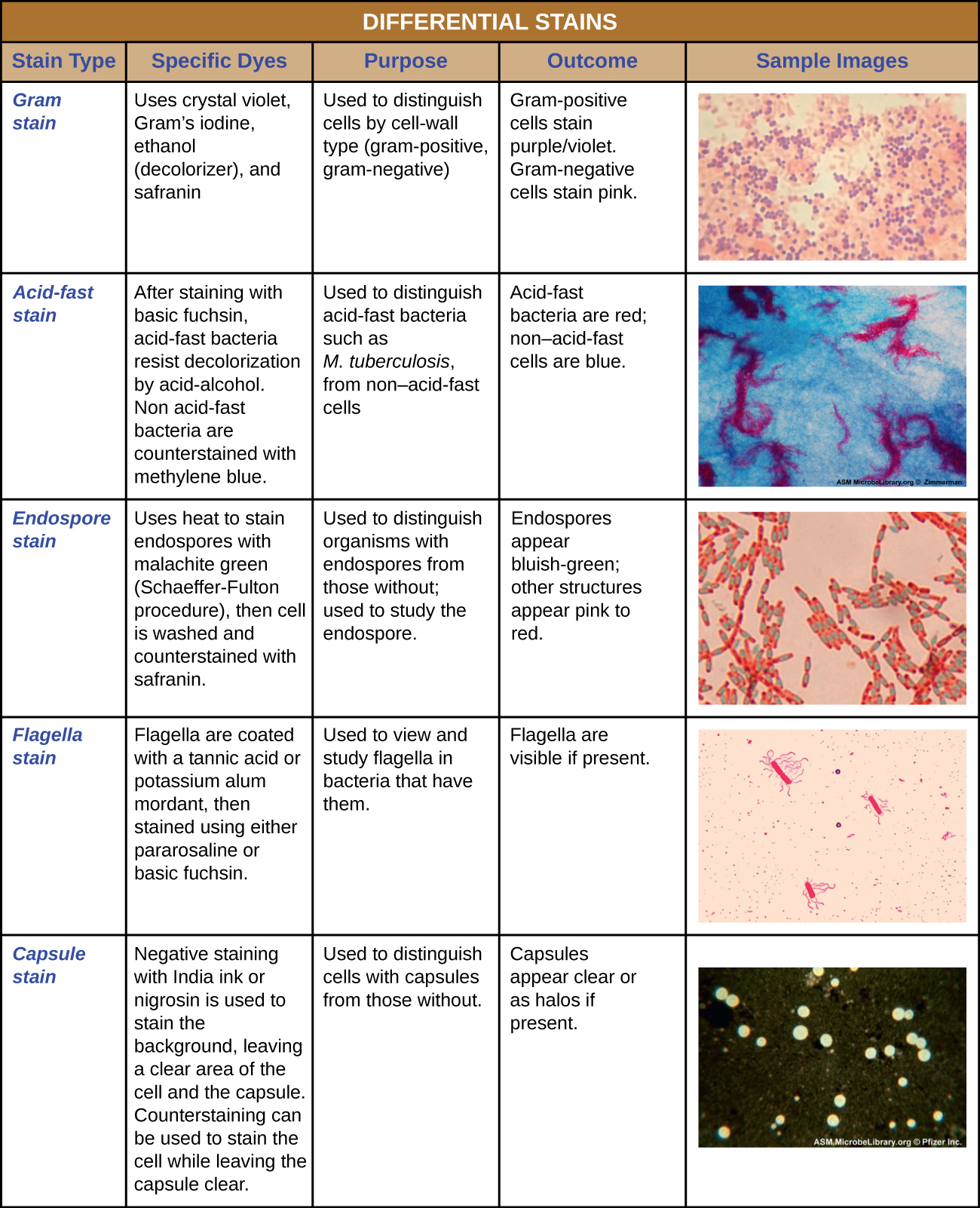
Algumas técnicas de coloração envolvem a aplicação de apenas um corante na amostra; outras requerem mais de um corante. Na coloração simples, um único corante é usado para enfatizar estruturas específicas na amostra. Uma simples mancha geralmente faz com que todos os organismos em uma amostra pareçam ter a mesma cor, mesmo que a amostra contenha mais de um tipo de organismo. Em contraste, a coloração diferencial distingue os organismos com base em suas interações com várias manchas. Em outras palavras, dois organismos em uma amostra com coloração diferencial podem parecer de cores diferentes. As técnicas de coloração diferencial comumente usadas em ambientes clínicos incluem coloração de Gram, coloração ácido-rápida, coloração por endosporos, coloração por flagelos e coloração por cápsula. \(\PageIndex{11}\)A figura fornece mais detalhes sobre essas técnicas de coloração diferencial.
Exercício\(\PageIndex{1}\)
- Explique por que é importante fixar uma amostra antes de visualizá-la sob um microscópio óptico.
- Quais tipos de amostras devem ser fixadas quimicamente em vez de fixadas termicamente?
- Por que um corante ácido pode reagir de forma diferente com uma determinada amostra do que um corante básico?
- Explique a diferença entre uma mancha positiva e uma mancha negativa.
- Explique a diferença entre coloração simples e diferencial.
Coloração de Gram
O procedimento de coloração de Gram é um procedimento de coloração diferencial que envolve várias etapas. Foi desenvolvido pelo microbiologista dinamarquês Hans Christian Gram em 1884 como um método eficaz para distinguir entre bactérias com diferentes tipos de paredes celulares e, até hoje, continua sendo uma das técnicas de coloração mais usadas. As etapas do procedimento de coloração de Gram estão listadas abaixo e ilustradas na Figura\(\PageIndex{3}\).
- Primeiro, o violeta cristalino, uma mancha primária, é aplicado a uma mancha termicamente fixada, dando a todas as células uma cor roxa.
- Em seguida, adiciona-se o iodo de Gram, um mordente. Um mordente é uma substância usada para fixar ou estabilizar manchas ou corantes; nesse caso, o iodo de Gram age como um agente de captura que se complica com o violeta cristalino, fazendo com que o complexo cristal violeta-iodo se aglomere e permaneça contido em espessas camadas de peptidoglicano nas paredes celulares.
- Em seguida, é adicionado um agente descolorante, geralmente etanol ou uma solução de acetona/etanol. As células que têm espessas camadas de peptidoglicanos em suas paredes celulares são muito menos afetadas pelo agente descolorante; elas geralmente retêm o corante violeta cristalino e permanecem roxas. No entanto, o agente descolorante remove mais facilmente o corante das células com camadas mais finas de peptidoglicano, tornando-as novamente incolores.
- Finalmente, uma contra-coloração secundária, geralmente a safranina, é adicionada. Isso mancha as células descoloridas de rosa e é menos perceptível nas células que ainda contêm o corante violeta cristalino.
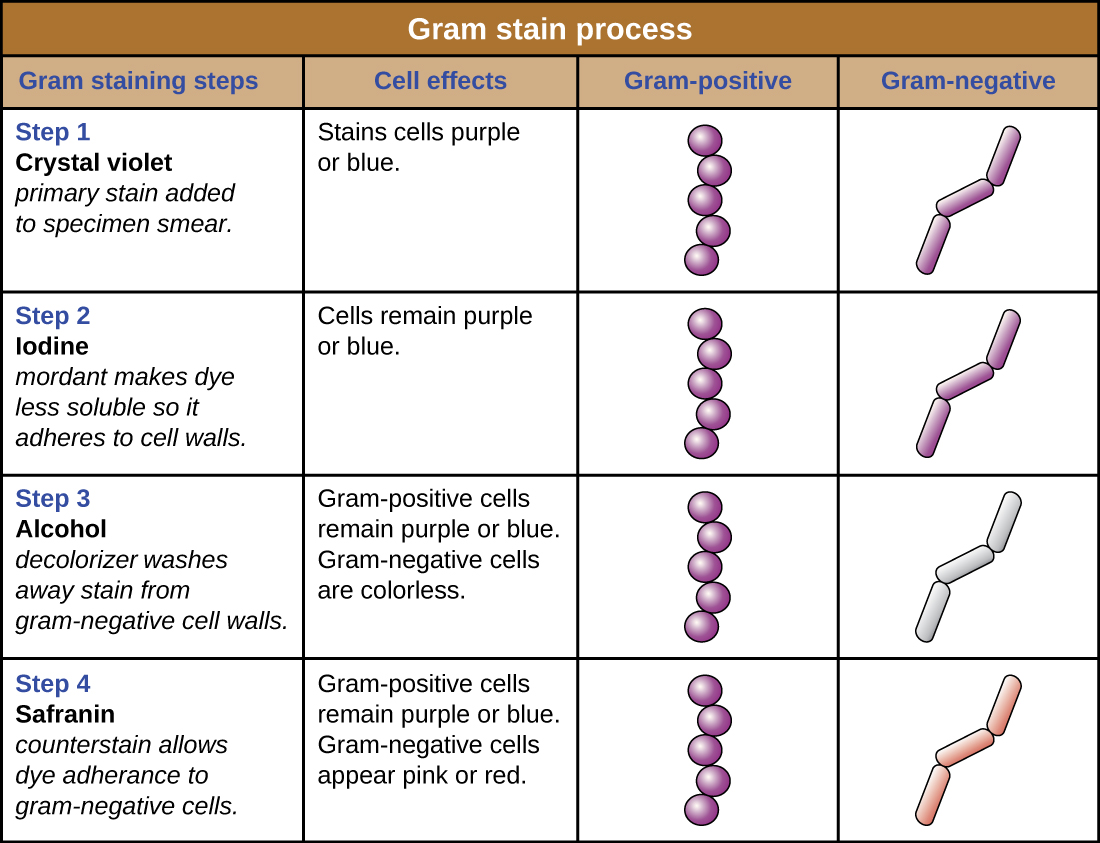
As células coradas de violeta roxo são chamadas de células gram-positivas, enquanto as células vermelhas tingidas com safranina são gram-negativas (Figura\(\PageIndex{4}\)). No entanto, existem várias considerações importantes na interpretação dos resultados de uma coloração de Gram. Primeiro, células bacterianas mais antigas podem ter danos em suas paredes celulares, o que faz com que pareçam gram-negativas, mesmo que a espécie seja gram-positiva. Portanto, é melhor usar culturas bacterianas frescas para a coloração de Gram. Segundo, erros como deixar o descolorador por muito tempo no descolorador podem afetar os resultados. Em alguns casos, a maioria das células parecerá gram-positiva, enquanto algumas parecem gram-negativas (como na Figura\(\PageIndex{4}\)). Isso sugere danos às células individuais ou que o descolorante foi deixado ligado por muito tempo; as células ainda devem ser classificadas como gram-positivas se forem todas da mesma espécie, em vez de uma cultura mista.
Além de suas diferentes interações com corantes e agentes descolorantes, as diferenças químicas entre células gram-positivas e gram-negativas têm outras implicações com relevância clínica. Por exemplo, a coloração de Gram pode ajudar os médicos a classificar patógenos bacterianos em uma amostra em categorias associadas a propriedades específicas. As bactérias gram-negativas tendem a ser mais resistentes a certos antibióticos do que as gram-positivas. Discutiremos essa e outras aplicações da coloração de Gram com mais detalhes nos capítulos posteriores.
Exercício\(\PageIndex{2}\)
- Explique o papel do iodo de Gram no procedimento de coloração de Gram.
- Explique o papel do álcool no procedimento de coloração de Gram.
- De que cor são as células gram-positivas e gram-negativas, respectivamente, após o procedimento de coloração de Gram?
Foco clínico: Parte 3
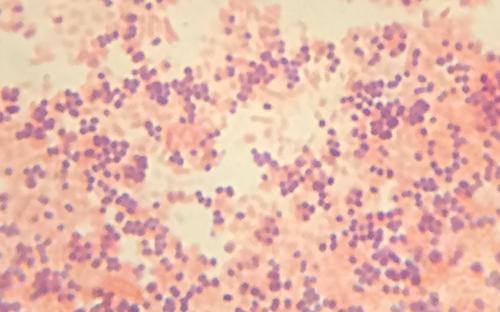
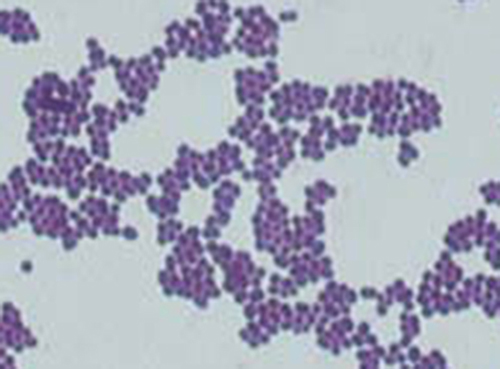
A visualização do espécime de Cindy sob o microscópio de campo escuro forneceu ao técnico algumas pistas importantes sobre a identidade do micróbio que está causando sua infecção. No entanto, são necessárias mais informações para fazer um diagnóstico conclusivo. O técnico decide fazer uma coloração de Gram na amostra. Essa técnica é comumente usada como uma etapa inicial na identificação de bactérias patogênicas. Depois de concluir o procedimento de coloração de Gram, o técnico vê a lâmina sob o microscópio de campo claro e vê aglomerados de células esféricas roxas, semelhantes a uvas (Figura\(\PageIndex{5}\)).
Exercício\(\PageIndex{3}\)
- Essas bactérias são gram-positivas ou gram-negativas?
- O que isso revela sobre suas paredes celulares?
Manchas ácido-resistentes
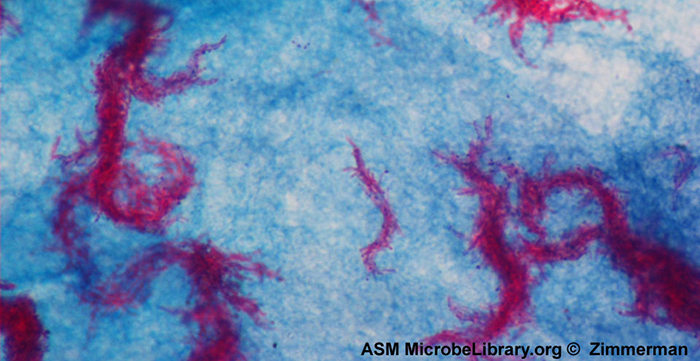
A coloração ácido-rápida é outra técnica de coloração diferencial comumente usada que pode ser uma importante ferramenta de diagnóstico. Uma coloração ácido-resistente é capaz de diferenciar dois tipos de células gram-positivas: aquelas que têm ácidos micólicos cerosos em suas paredes celulares e aquelas que não têm. Dois métodos diferentes para coloração ácido-rápida são a técnica Ziehl-Neelsen e a técnica Kinyoun. Ambos usam carbolfucsina como coloração primária. As células cerosas e resistentes ao ácido retêm a carbolfucsina mesmo após a aplicação de um agente descolorante (uma solução ácido-alcoólica). Uma contra-coloração secundária, azul de metileno, é então aplicada, o que torna azuis as células não resistentes ao ácido.
A diferença fundamental entre os dois métodos baseados em carbolfucsina é se o calor é usado durante o processo de coloração primária. O método Ziehl-Neelsen usa calor para infundir a carbolfucsina nas células resistentes ao ácido, enquanto o método Kinyoun não usa calor. Ambas as técnicas são importantes ferramentas de diagnóstico porque várias doenças específicas são causadas por bactérias ácido-resistentes (BAAR). Se a BAAR estiver presente em uma amostra de tecido, sua cor vermelha ou rosa pode ser vista claramente contra o fundo azul das células do tecido circundante (Figura\(\PageIndex{6}\)).
Exercício\(\PageIndex{4}\)
Por que as manchas ácido-resistentes são úteis?
O Mycobacterium tuberculosis, a bactéria que causa a tuberculose, pode ser detectado em amostras com base na presença de bacilos ácido-resistentes. Freqüentemente, um esfregaço é preparado a partir de uma amostra do escarro do paciente e depois corado usando a técnica de Ziehl-Neelsen (Figura\(\PageIndex{6}\)). Se bactérias ácido-resistentes forem confirmadas, elas geralmente são cultivadas para fazer uma identificação positiva. Variações dessa abordagem podem ser usadas como um primeiro passo para determinar se M. tuberculosis ou outras bactérias resistentes ao ácido estão presentes, embora amostras de outras partes do corpo (como urina) possam conter outras espécies de Mycobacterium.
Uma abordagem alternativa para determinar a presença de M. tuberculosis é a imunofluorescência. Nessa técnica, anticorpos marcados com fluorocromo se ligam ao M. tuberculosis, se presentes. Corantes fluorescentes específicos de anticorpos podem ser usados para visualizar as micobactérias com um microscópio de fluorescência.
Coloração da cápsula
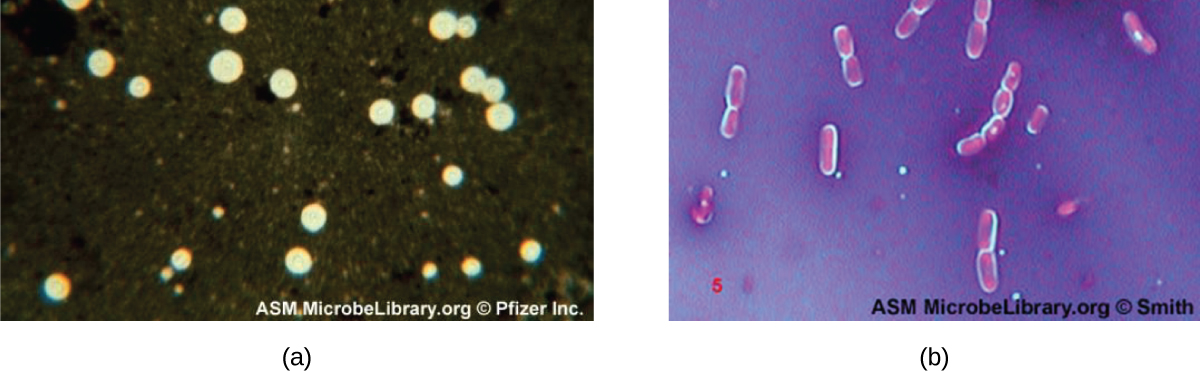
Certas bactérias e leveduras têm uma estrutura externa protetora chamada cápsula. Como a presença de uma cápsula está diretamente relacionada à virulência de um micróbio (sua capacidade de causar doenças), a capacidade de determinar se as células de uma amostra têm cápsulas é uma importante ferramenta de diagnóstico. As cápsulas não absorvem a maioria dos corantes básicos; portanto, uma técnica de coloração negativa (coloração ao redor das células) é normalmente usada para colorir as cápsulas. O corante mancha o fundo, mas não penetra nas cápsulas, que parecem halos ao redor das bordas da célula. A amostra não precisa ser fixada termicamente antes da coloração negativa.
Uma técnica comum de coloração negativa para identificar leveduras e bactérias encapsuladas é adicionar algumas gotas de tinta indiana ou nigrosina a uma amostra. Outras manchas capsulares também podem ser usadas para colorir negativamente as células encapsuladas (Figura\(\PageIndex{7}\)). Como alternativa, técnicas de coloração positiva e negativa podem ser combinadas para visualizar as cápsulas: a mancha positiva colore o corpo da célula e a mancha negativa colore o fundo, mas não a cápsula, deixando um halo ao redor de cada célula.
Exercício\(\PageIndex{5}\)
Como a coloração negativa nos ajuda a visualizar as cápsulas?
Coloração de endosporos
Os endosporos são estruturas produzidas dentro de certas células bacterianas que lhes permitem sobreviver em condições adversas. A coloração de Gram por si só não pode ser usada para visualizar os endosporos, que parecem nítidos quando as células coradas por Gram são vistas. A coloração por endosporos usa duas manchas para diferenciar os endosporos do resto da célula. O método Schaeffer-Fulton (a técnica de coloração de endosporos mais comumente usada) usa calor para empurrar a mancha primária (verde malaquita) para o endosporo. Lavar com água descolora a célula, mas o endosporo retém a mancha verde. A célula é então contrastada de rosa com safranina. A imagem resultante revela a forma e a localização dos endosporos, se estiverem presentes. Os endosporos verdes aparecerão dentro das células vegetativas rosadas ou totalmente separados das células rosadas. Se não houver endosporos presentes, somente as células vegetativas rosadas serão visíveis (Figura\(\PageIndex{8}\)).
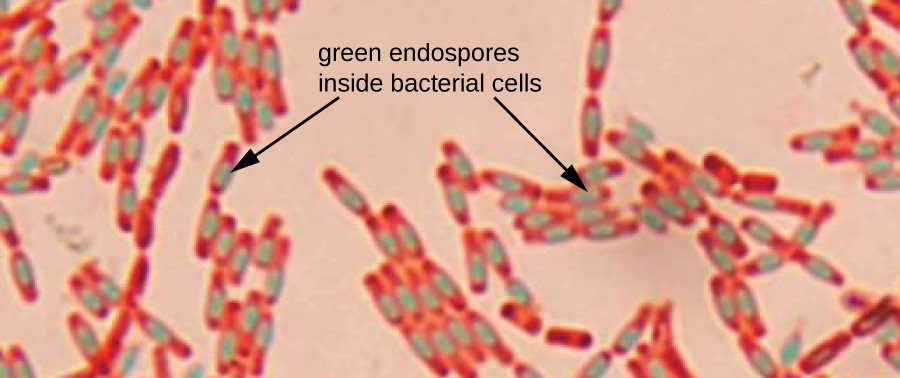
As técnicas de coloração de endosporos são importantes para identificar Bacillus e Clostridium, dois gêneros de bactérias produtoras de endosporos que contêm espécies clinicamente significativas. Entre outros, o B. anthracis (que causa o antraz) tem sido de particular interesse devido à preocupação de que seus esporos possam ser usados como agente bioterrorista. C. difficile é uma espécie particularmente importante responsável pela infecção tipicamente adquirida em hospitais conhecida como “C. diff”.
Exercício\(\PageIndex{6}\)
A coloração de endosporos é um exemplo de coloração positiva, negativa ou diferencial?
Coloração de flagelos
Flagelos (singular: flagelo) são estruturas celulares semelhantes à cauda usadas para locomoção por algumas bactérias, arquéias e eucariotos. Por serem muito finos, os flagelos normalmente não podem ser vistos sob um microscópio óptico sem uma técnica especializada de coloração de flagelos. A coloração dos flagelos engrossa os flagelos aplicando primeiro mordente (geralmente ácido tânico, mas às vezes alúmen de potássio), que reveste os flagelos; em seguida, a amostra é corada com pararosanilina (mais comumente) ou fucsina básica (Figura\(\PageIndex{9}\)).
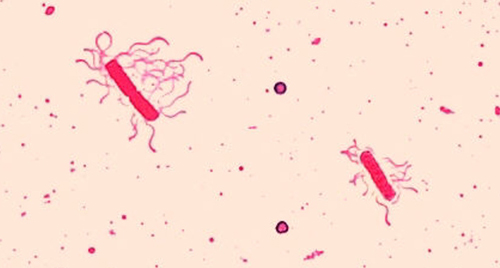
Embora a coloração dos flagelos seja incomum em ambientes clínicos, a técnica é comumente usada por microbiologistas, pois a localização e o número de flagelos podem ser úteis na classificação e identificação de bactérias em uma amostra. Ao usar essa técnica, é importante manusear a amostra com muito cuidado; os flagelos são estruturas delicadas que podem ser facilmente danificadas ou retiradas, comprometendo as tentativas de localizar e contar com precisão o número de flagelos.
Preparando amostras para microscopia eletrônica
As amostras a serem analisadas usando um TEM devem ter seções muito finas. Mas as células são muito macias para serem cortadas finamente, mesmo com facas de diamante. Para cortar as células sem danos, as células devem ser incorporadas em resina plástica e depois desidratadas por meio de uma série de imersões em soluções de etanol (50%, 60%, 70% e assim por diante). O etanol substitui a água nas células, e a resina se dissolve no etanol e entra na célula, onde se solidifica. Em seguida, seções finas são cortadas usando um dispositivo especializado chamado ultramicrótomo (Figura\(\PageIndex{12}\)). Finalmente, as amostras são fixadas em fios finos de cobre ou grades de fibra de carbono e coradas — não com corantes coloridos, mas com substâncias como acetato de uranila ou tetróxido de ósmio, que contêm átomos de metais pesados densos em elétrons.

Quando as amostras são preparadas para visualização usando um SEM, elas também devem ser desidratadas usando uma série de etanol. No entanto, eles devem estar ainda mais secos do que o necessário para um TEM. A secagem em ponto crítico com dióxido de carbono líquido inerte sob pressão é usada para deslocar a água da amostra. Após a secagem, as amostras são revestidas com metal por pulverização catódica, removendo átomos de um alvo de paládio, com partículas energéticas. O revestimento por pulverização catódica evita que as amostras sejam carregadas pelo feixe de elétrons do SEM.
Exercício\(\PageIndex{7}\)
- Por que é importante desidratar as células antes de examiná-las ao microscópio eletrônico?
- Nomeie o dispositivo usado para criar seções finas de amostras para microscopia eletrônica.
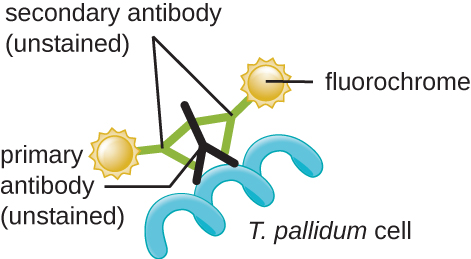
O agente causador da sífilis é o Treponema pallidum, uma célula espiral flexível (espiroqueta) que pode ser muito fina (<0,15 μm) e corresponder ao índice de refração do meio, dificultando a visualização usando microscopia de campo claro. Além disso, esta espécie não foi cultivada com sucesso em laboratório em meio artificial; portanto, o diagnóstico depende da identificação bem-sucedida usando técnicas microscópicas e sorologia (análise de fluidos corporais, muitas vezes procurando anticorpos contra um patógeno). Como a fixação e a coloração matariam as células, a microscopia de campo escuro é normalmente usada para observar espécimes vivos e visualizar seus movimentos. No entanto, outras abordagens também podem ser usadas. Por exemplo, as células podem ser espessadas com partículas de prata (em seções de tecido) e observadas usando um microscópio de luz. Também é possível usar fluorescência ou microscopia eletrônica para visualizar o Treponema (Figura\(\PageIndex{13}\)).

Em ambientes clínicos, a imunofluorescência indireta é frequentemente usada para identificar o Treponema. Um anticorpo primário não corado se liga diretamente à superfície do patógeno, e os anticorpos secundários “marcados” com uma mancha fluorescente se ligam ao anticorpo primário. Vários anticorpos secundários podem se ligar a cada anticorpo primário, amplificando a quantidade de mancha anexada a cada célula de Treponema, facilitando a detecção (Figura\(\PageIndex{14}\)).
Preparação e coloração para outros microscópios
As amostras para fluorescência e microscopia confocal são preparadas de forma semelhante às amostras para microscopia de luz, exceto que os corantes são fluorocromos. As manchas geralmente são diluídas em líquido antes de serem aplicadas na lâmina. Alguns corantes se ligam a um anticorpo para colorir proteínas específicas em tipos específicos de células (imunofluorescência); outros podem se ligar a moléculas de DNA em um processo chamado hibridização fluorescente in situ (FISH), fazendo com que as células sejam coradas com base no fato de terem uma sequência de DNA específica.
A preparação da amostra para microscopia de dois fótons é semelhante à microscopia de fluorescência, exceto pelo uso de corantes infravermelhos. As amostras para STM precisam estar em uma superfície muito limpa e atomicamente lisa. Eles geralmente são revestidos de mica com Au (111). O vapor de tolueno é um fixador comum.
Exercício\(\PageIndex{8}\)
Qual é a principal diferença entre preparar uma amostra para microscopia de fluorescência e microscopia de luz?
Link para o aprendizado
Os estudos de caso em microscopia da Universidade Cornell oferecem uma série de problemas clínicos baseados em eventos da vida real. Cada estudo de caso mostra um problema clínico usando técnicas apropriadas de microscopia em cada etapa.
Foco clínico: Resolução
A partir dos resultados da coloração de Gram, o técnico agora sabe que a infecção de Cindy é causada por bactérias gram-positivas esféricas que formam cachos parecidos com uvas, o que é típico das bactérias estafilocócicas. Depois de alguns testes adicionais, o técnico determina que essas bactérias são a espécie clinicamente importante conhecida como Staphylococcus aureus, uma culpada comum em infecções de feridas. Como algumas cepas de S. aureus são resistentes a muitos antibióticos, as infecções cutâneas podem se espalhar para outras áreas do corpo e se tornar graves, às vezes até resultando em amputações ou morte se os antibióticos corretos não forem usados.
Depois de testar vários antibióticos, o laboratório é capaz de identificar um que seja eficaz contra essa cepa específica de S. aureus. O médico de Cindy prescreve rapidamente o medicamento e enfatiza a importância de tomar todo o ciclo de antibióticos, mesmo que a infecção pareça desaparecer antes da última dose programada. Isso reduz o risco de que qualquer bactéria especialmente resistente sobreviva, causando uma segunda infecção ou se espalhando para outra pessoa.
À medida que o uso de antibióticos proliferou na medicina e na agricultura, os micróbios evoluíram para se tornarem mais resistentes. Cepas de bactérias como o S. aureus resistente à meticilina (MRSA), que desenvolveu um alto nível de resistência a muitos antibióticos, são um problema cada vez mais preocupante, tanto que pesquisas estão em andamento para desenvolver antibióticos novos e mais diversificados.
A microscopia de fluorescência pode ser útil para testar a eficácia de novos antibióticos contra cepas resistentes como o MRSA. Em um teste de um novo antibiótico derivado de uma bactéria marinha, o MC21-A (bromofeno), os pesquisadores usaram o corante fluorescente SYTOX Green para colorir amostras de MRSA. O SYTOX Green é frequentemente usado para distinguir células mortas de células vivas, com microscopia de fluorescência. As células vivas não absorvem o corante, mas as células mortas por um antibiótico absorvem o corante, pois o antibiótico danificou a membrana celular bacteriana. Nesse caso específico, a bactéria MRSA que havia sido exposta ao MC21-A, de fato, parecia verde sob o microscópio de fluorescência, levando os pesquisadores a concluir que é um antibiótico eficaz contra o MRSA.
É claro que alguns argumentam que o desenvolvimento de novos antibióticos só levará a ainda mais micróbios resistentes a antibióticos, os chamados superbactérias, que podem gerar epidemias antes que novos tratamentos possam ser desenvolvidos. Por esse motivo, muitos profissionais de saúde estão começando a exercer mais discrição na prescrição de antibióticos. Enquanto os antibióticos eram prescritos rotineiramente para doenças comuns sem um diagnóstico definitivo, médicos e hospitais têm muito mais probabilidade de realizar testes adicionais para determinar se um antibiótico é necessário e apropriado antes da prescrição.
Um paciente doente pode razoavelmente se opor a essa abordagem mesquinha de prescrever antibióticos. Para o paciente que simplesmente quer se sentir melhor o mais rápido possível, os benefícios potenciais de tomar um antibiótico podem parecer superar quaisquer riscos imediatos à saúde que possam ocorrer se o antibiótico for ineficaz. Mas em que momento os riscos do uso generalizado de antibióticos superam o desejo de usá-los em casos individuais?
Conceitos principais e resumo
- As amostras devem ser devidamente preparadas para microscopia. Isso pode envolver coloração, fixação e/ou corte de seções finas.
- Uma variedade de técnicas de coloração pode ser usada com microscopia de luz, incluindo coloração de Gram, coloração ácido-rápida, coloração de cápsulas, coloração de endosporos e coloração de flagelos.
- As amostras para TEM requerem seções muito finas, enquanto as amostras para SEM requerem revestimento por pulverização catódica.
- A preparação para microscopia de fluorescência é semelhante à da microscopia de luz, exceto que fluorocromos são usados.


