3.5: Variações periódicas nas propriedades do elemento
- Page ID
- 195473
- Descreva e explique as tendências observadas no tamanho atômico, energia de ionização e afinidade eletrônica dos elementos
Os elementos em grupos (colunas verticais) da tabela periódica exibem comportamento químico similar. Essa semelhança ocorre porque os membros de um grupo têm o mesmo número e distribuição de elétrons em suas camadas de valência. No entanto, também existem outros padrões nas propriedades químicas na tabela periódica. Por exemplo, à medida que descemos um grupo, o caráter metálico dos átomos aumenta. O oxigênio, no topo do Grupo 16 (6A), é um gás incolor; no meio do grupo, o selênio é um sólido semicondutor; e, na parte inferior, o polônio é um sólido cinza-prateado que conduz eletricidade.
À medida que atravessamos um período da esquerda para a direita, adicionamos um próton ao núcleo e um elétron à camada de valência com cada elemento sucessivo. À medida que analisamos os elementos em um grupo, o número de elétrons na camada de valência permanece constante, mas o número quântico principal aumenta em um a cada vez. Uma compreensão da estrutura eletrônica dos elementos nos permite examinar algumas das propriedades que governam seu comportamento químico. Essas propriedades variam periodicamente à medida que a estrutura eletrônica dos elementos muda. Eles são (1) tamanho (raio) de átomos e íons, (2) energias de ionização e (3) afinidades eletrônicas.
Variação no raio covalente
A imagem da mecânica quântica dificulta o estabelecimento de um tamanho definido de um átomo. No entanto, existem várias maneiras práticas de definir o raio dos átomos e, portanto, determinar seus tamanhos relativos que fornecem valores aproximadamente semelhantes. Usaremos o raio covalente (Figura\(\PageIndex{1}\)), que é definido como metade da distância entre os núcleos de dois átomos idênticos quando eles são unidos por uma ligação covalente (essa medição é possível porque os átomos dentro das moléculas ainda retêm grande parte de sua identidade atômica).
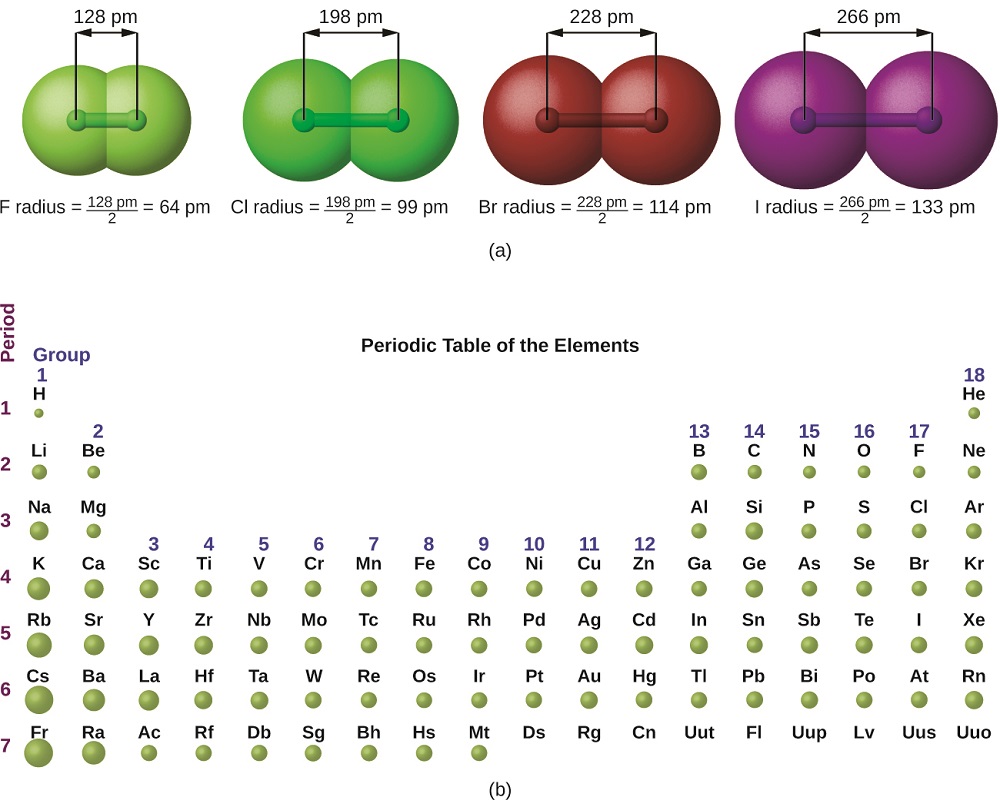
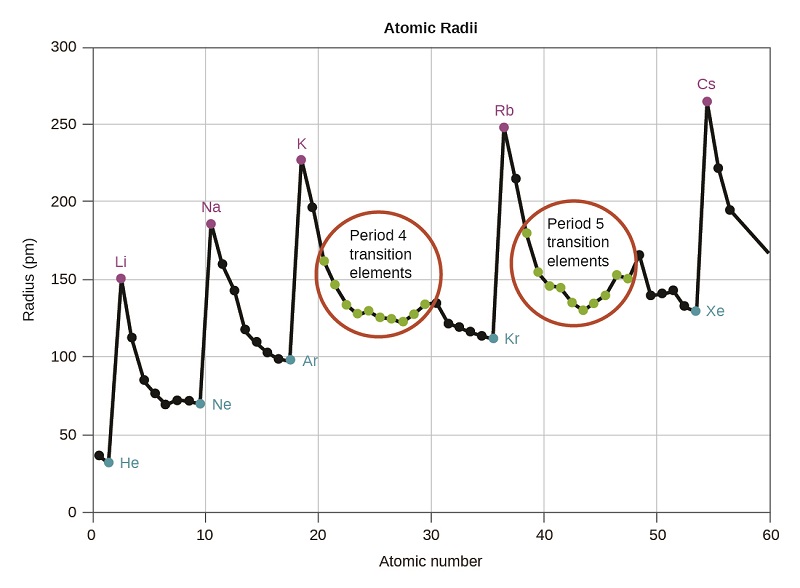
Sabemos que, à medida que examinamos um grupo, o número quântico principal, n, aumenta em um para cada elemento. Assim, os elétrons estão sendo adicionados a uma região do espaço cada vez mais distante do núcleo. Consequentemente, o tamanho do átomo (e seu raio covalente) deve aumentar à medida que aumentamos a distância dos elétrons mais externos do núcleo. Essa tendência é ilustrada para os raios covalentes dos halogênios na Tabela\(\PageIndex{1}\) e na Figura\(\PageIndex{1}\). As tendências de toda a tabela periódica podem ser vistas na Figura\(\PageIndex{2}\).
| Átomo | Raio covalente (pm) | Carga nuclear |
|---|---|---|
| F | 64 | +9 |
| Cl | 99 | +17 |
| Br | 114 | +35 |
| EU | 133 | +53 |
| Em | 148 | +85 |
Conforme mostrado na Figura\(\PageIndex{2}\), à medida que atravessamos um período da esquerda para a direita, geralmente descobrimos que cada elemento tem um raio covalente menor do que o elemento que o precede. Isso pode parecer contra-intuitivo porque implica que átomos com mais elétrons têm um raio atômico menor. Isso pode ser explicado com o conceito de carga nuclear efetiva e,\(Z_{eff}\). Essa é a atração exercida sobre um elétron específico pelo núcleo, levando em consideração qualquer repulsão elétron-elétron. Para o hidrogênio, há apenas um elétron e, portanto, a carga nuclear (Z) e a carga nuclear efetiva (Z eff) são iguais. Para todos os outros átomos, os elétrons internos protegem parcialmente os elétrons externos da atração do núcleo e, portanto:
\[Z_\ce{eff}=Z−shielding \nonumber \]
A blindagem é determinada pela probabilidade de outro elétron estar entre o elétron de interesse e o núcleo, bem como pelas repulsões elétron-elétron que o elétron de interesse encontra. Os elétrons centrais são adeptos da blindagem, enquanto os elétrons na mesma camada de valência não bloqueiam a atração nuclear experimentada um pelo outro com tanta eficiência. Assim, cada vez que passamos de um elemento para o outro ao longo de um período, Z aumenta em um, mas a blindagem aumenta apenas ligeiramente. Assim, o efeito Z aumenta à medida que nos movemos da esquerda para a direita ao longo de um período. A atração mais forte (maior carga nuclear efetiva) experimentada pelos elétrons no lado direito da tabela periódica os aproxima do núcleo, tornando os raios covalentes menores.
Assim, como seria de esperar, os elétrons mais externos ou de valência são mais fáceis de remover porque têm as energias mais altas, estão mais protegidos e estão mais distantes do núcleo. Como regra geral, quando os elementos representativos formam cátions, eles o fazem pela perda dos elétrons ns ou np que foram adicionados por último no processo de Aufbau. Os elementos de transição, por outro lado, perdem os elétrons ns antes de começarem a perder os elétrons (n — 1) d, mesmo que os elétrons ns sejam adicionados primeiro, de acordo com o princípio de Aufbau.
Preveja a ordem de aumento do raio covalente para Ge, Fl, Br, Kr.
Solução
O raio aumenta à medida que descemos um grupo, então Ge < Fl (Nota: Fl é o símbolo do fleróvio, elemento 114, NÃO do flúor). O raio diminui à medida que nos movemos ao longo de um período, então Kr < Br < Ge. Juntando as tendências, obtemos Kr < Br < Ge < Fl.
Dê um exemplo de um átomo cujo tamanho é menor que o flúor.
- Responda
-
Novo ou Ela
Variação nos raios iônicos
O raio iônico é a medida usada para descrever o tamanho de um íon. Um cátion sempre tem menos elétrons e o mesmo número de prótons que o átomo pai; é menor do que o átomo do qual é derivado (Figura\(\PageIndex{3}\)). Por exemplo, o raio covalente de um átomo de alumínio (1 s 2 2 s 2 p 6 3 s 2 3 s 2 3 p 1) é 118pm, enquanto o raio iônico de um Al 3 + (1 s 2 2 s 2 2 p 6) é 68 pm. À medida que os elétrons são removidos da camada externa de valência, os elétrons centrais restantes que ocupam camadas menores experimentam uma maior carga nuclear efetiva Z eff (conforme discutido) e são atraídos ainda mais perto do núcleo.

Cátions com cargas maiores são menores do que cátions com cargas menores (por exemplo, V 2+ tem um raio iônico de 79 pm, enquanto o de V 3+ é 64 pm). Descendo os grupos da tabela periódica, descobrimos que cátions de elementos sucessivos com a mesma carga geralmente têm raios maiores, correspondendo a um aumento no número quântico principal, n.
Um ânion (íon negativo) é formado pela adição de um ou mais elétrons à camada de valência de um átomo. Isso resulta em uma maior repulsão entre os elétrons e uma diminuição\(Z_{eff}\) por elétron. Ambos os efeitos (o aumento do número de elétrons e a diminuição do efeito Z) fazem com que o raio de um ânion seja maior que o do átomo original (Figura\(\PageIndex{3}\)). Por exemplo, um átomo de enxofre ([Ne] 3 s 2 3 p 4) tem um raio covalente de 104pm, enquanto o raio iônico do ânion sulfeto ([Ne] 3 s 2 3 p 6) é 170pm. Para elementos consecutivos descendo por qualquer grupo, os ânions têm números quânticos principais maiores e, portanto, raios maiores.
Diz-se que átomos e íons que têm a mesma configuração eletrônica são isoeletrônicos. Exemplos de espécies isoeletrônicas são N 3—, O 2—, F —, Ne, Na +, Mg 2 + e Al 3 + (1 s 2 2 s 2 p 6). Outra série isoeletrônica é P 3—, S 2—, Cl —, Ar, K +, Ca 2 + e Sc 3 + ([Ne] 3 s 2 3 p 6). Para átomos ou íons isoeletrônicos, o número de prótons determina o tamanho. Quanto maior a carga nuclear, menor o raio em uma série de íons e átomos isoeletrônicos.
Variação nas energias de ionização
A quantidade de energia necessária para remover o elétron mais frouxamente ligado de um átomo gasoso em seu estado fundamental é chamada de primeira energia de ionização (IE 1). A primeira energia de ionização para um elemento, X, é a energia necessária para formar um cátion com +1 carga:
\[\ce{X}(g)⟶\ce{X+}(g)+\ce{e-}\hspace{20px}\ce{IE_1} \nonumber \]
A energia necessária para remover o segundo elétron mais frouxamente ligado é chamada de segunda energia de ionização (IE 2).
\[\ce{X+}(g)⟶\ce{X^2+}(g)+\ce{e-}\hspace{20px}\ce{IE_2} \nonumber \]
A energia necessária para remover o terceiro elétron é a terceira energia de ionização e assim por diante. A energia é sempre necessária para remover elétrons de átomos ou íons, então os processos de ionização são endotérmicos e os valores de IE são sempre positivos. Para átomos maiores, o elétron mais frouxamente ligado está localizado mais longe do núcleo e, portanto, é mais fácil de remover. Assim, à medida que o tamanho (raio atômico) aumenta, a energia de ionização deve diminuir. Relacionando essa lógica com o que acabamos de aprender sobre raios, esperaríamos que as primeiras energias de ionização diminuíssem em um grupo e aumentassem ao longo de um período.
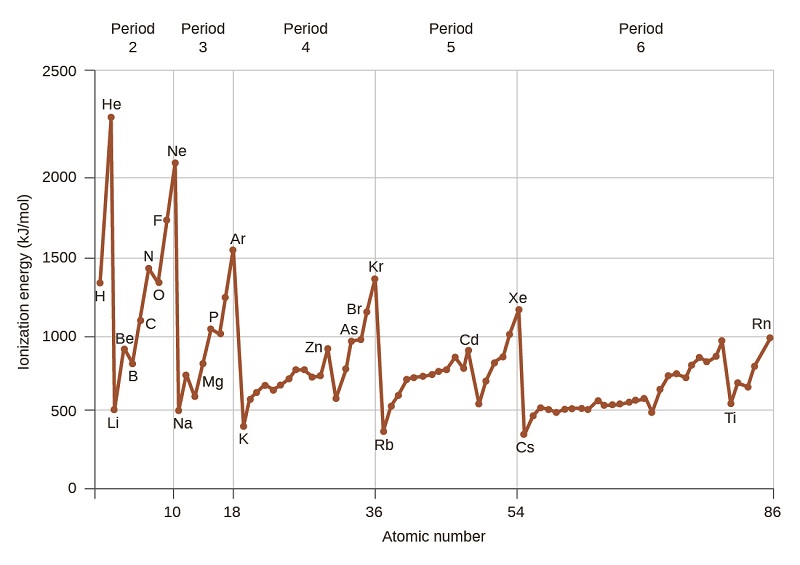
A figura\(\PageIndex{4}\) representa graficamente a relação entre a primeira energia de ionização e o número atômico de vários elementos. Dentro de um período, os valores da primeira energia de ionização para os elementos (IE 1) geralmente aumentam com o aumento de Z. Em um grupo, o valor de IE 1 geralmente diminui com o aumento de Z. No entanto, existem alguns desvios sistemáticos dessa tendência. Observe que a energia de ionização do boro (número atômico 5) é menor que a do berílio (número atômico 4), embora a carga nuclear do boro seja maior em um próton. Isso pode ser explicado porque a energia das subcamadas aumenta à medida que l aumenta, devido à penetração e blindagem (conforme discutido anteriormente neste capítulo). Dentro de qualquer camada, os elétrons s têm menos energia do que os elétrons p. Isso significa que um elétron s é mais difícil de remover de um átomo do que um elétron p na mesma camada. O elétron removido durante a ionização do berílio ([He] 2 s 2) é um elétron s, enquanto o elétron removido durante a ionização do boro ([He] 2 s 2 2 p 1) é um elétron p; isso resulta em um reduz a energia de primeira ionização do boro, mesmo que sua carga nuclear seja maior em um próton. Assim, vemos um pequeno desvio da tendência prevista ocorrendo cada vez que uma nova subcamada começa.
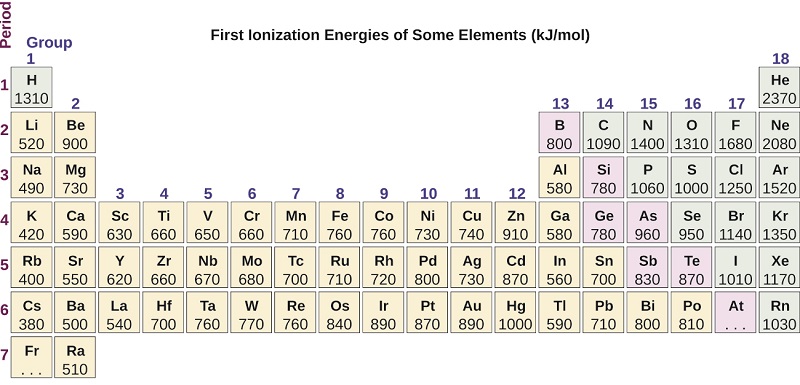
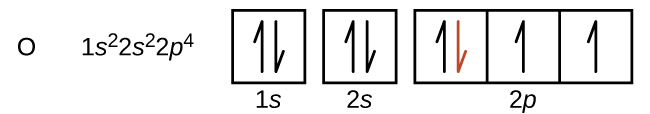
Outro desvio ocorre quando os orbitais ficam mais da metade cheios. A primeira energia de ionização para oxigênio é um pouco menor que a do nitrogênio, apesar da tendência de aumento dos valores de IE 1 ao longo de um período. Observando o diagrama orbital do oxigênio, podemos ver que a remoção de um elétron eliminará a repulsão elétron-elétron causada pelo emparelhamento dos elétrons no orbital 2p e resultará em um orbital meio cheio (o que é energeticamente favorável). Mudanças análogas ocorrem em períodos seguintes (observe a queda de enxofre após o fósforo na Figura)\(\PageIndex{4}\).
Remover um elétron de um cátion é mais difícil do que remover um elétron de um átomo neutro devido à maior atração eletrostática pelo cátion. Da mesma forma, remover um elétron de um cátion com uma carga positiva mais alta é mais difícil do que remover um elétron de um íon com uma carga menor. Assim, as energias sucessivas de ionização de um elemento sempre aumentam. Conforme visto na Tabela\(\PageIndex{2}\), há um grande aumento nas energias de ionização (mudança de cor) para cada elemento. Esse salto corresponde à remoção dos elétrons centrais, que são mais difíceis de remover do que os elétrons de valência. Por exemplo, Sc e Ga têm três elétrons de valência, então o rápido aumento na energia de ionização ocorre após a terceira ionização.
| Elemento | IE 1 | IE 2 | IE 3 | IE 4 | IE 5 | IE 6 | IE 7 |
|---|---|---|---|---|---|---|---|
| K | 418,8 | 3051,8 | 4419,6 | 5876,9 | 7975,5 | 9590,6 | 11343 |
| Ca | 589,8 | 1145,4 | 4912,4 | 6490,6 | 8153,0 | 10495,7 | 12272,9 |
| Sc | 633.1 | 1235,0 | 2388,7 | 7090,6 | 8842,9 | 10679,0 | 13315,0 |
| Ga | 578,8 | 1979.4 | 2964,6 | 6180 | 8298,7 | 10873,9 | 13594,8 |
| Ge | 762,2 | 1537,5 | 3302,1 | 4410.6 | 9021.4 | Não disponível | Não disponível |
| Como | 944,5 | 1793,6 | 2735,5 | 4836,8 | 6042,9 | 12311,5 | Não disponível |
Preveja a ordem de aumento de energia para os seguintes processos: IE 1 para Al, IE 1 para Tl, IE 2 para Na, IE 3 para Al.
Solução
Remover o elétron 6 p 1 de Tl é mais fácil do que remover o elétron 3 p 1 de Al porque o orbital n superior está mais distante do núcleo, então IE 1 (Tl) < IE 1 (Al). Ionizando o terceiro elétron de
\[\ce{Al}\hspace{20px}\ce{(Al^2+⟶Al^3+ + e- )} \nonumber \]
requer mais energia porque o cátion Al 2 + exerce uma atração mais forte sobre o elétron do que o átomo de Al neutro, então IE 1 (Al) < IE 3 (Al). A segunda energia de ionização do sódio remove um elétron central, que é um processo de energia muito maior do que a remoção de elétrons de valência. Juntando tudo isso, obtemos:
IE 1 (Tl) < IE 1 (Al) < IE 3 (Al) < IE 2 (Na).
Qual tem o menor valor para IE 1: O, Po, Pb ou Ba?
- Responda
-
Ba
Variação nas afinidades eletrônicas
A afinidade eletrônica [EA] é a mudança de energia para o processo de adição de um elétron a um átomo gasoso para formar um ânion (íon negativo).
\[\ce{X}(g)+\ce{e-}⟶\ce{X-}(g)\hspace{20px}\ce{EA_1} \nonumber \]
Esse processo pode ser endotérmico ou exotérmico, dependendo do elemento. O EA de alguns dos elementos é dado na Figura\(\PageIndex{6}\). Você pode ver que muitos desses elementos têm valores negativos de EA, o que significa que a energia é liberada quando o átomo gasoso aceita um elétron. No entanto, para alguns elementos, é necessária energia para que o átomo tenha uma carga negativa e o valor de seu EA seja positivo. Assim como com a energia de ionização, os valores subsequentes de EA estão associados à formação de íons com mais carga. O segundo EA é a energia associada à adição de um elétron a um ânion para formar um íon —2 e assim por diante.

Como podemos prever, fica mais fácil adicionar um elétron em uma série de átomos à medida que a carga nuclear efetiva dos átomos aumenta. Descobrimos que, à medida que vamos da esquerda para a direita em um período, os EAs tendem a se tornar mais negativos. As exceções encontradas entre os elementos do grupo 2 (2A), do grupo 15 (5A) e do grupo 18 (8A) podem ser entendidas com base na estrutura eletrônica desses grupos. Os gases nobres, grupo 18 (8A), têm uma camada completamente preenchida e o elétron que entra deve ser adicionado a um nível mais alto de n, o que é mais difícil de fazer. O grupo 2 (2A) tem uma subcamada ns preenchida e, portanto, o próximo elétron adicionado vai para a maior energia np, então, novamente, o valor de EA observado não é o que a tendência preveria. Finalmente, o grupo 15 (5A) tem uma subcamada np parcialmente preenchida e o próximo elétron deve ser emparelhado com um elétron np existente. Em todos esses casos, a estabilidade relativa inicial da configuração eletrônica interrompe a tendência no EA.
Também podemos esperar que o átomo no topo de cada grupo tenha o maior EA; seus primeiros potenciais de ionização sugerem que esses átomos têm as maiores cargas nucleares efetivas. No entanto, à medida que descemos um grupo, vemos que o segundo elemento do grupo geralmente tem o melhor EA. A redução do EA do primeiro membro pode ser atribuída ao pequeno tamanho da camada n = 2 e às grandes repulsões elétron-elétrons resultantes. Por exemplo, o cloro, com um valor de EA de —348 kJ/mol, tem o valor mais alto de qualquer elemento na tabela periódica. O EA do flúor é de —322 kJ/mol. Quando adicionamos um elétron a um átomo de flúor para formar um ânion fluoreto (F —), adicionamos um elétron à camada n = 2. O elétron é atraído pelo núcleo, mas também há uma repulsão significativa dos outros elétrons já presentes nessa pequena camada de valência. O átomo de cloro tem a mesma configuração eletrônica na camada de valência, mas como o elétron entrante está entrando na camada n = 3, ele ocupa uma região consideravelmente maior do espaço e as repulsões elétron-elétron são reduzidas. O elétron de entrada não sofre tanta repulsão e o átomo de cloro aceita um elétron adicional mais facilmente.
As propriedades discutidas nesta seção (tamanho dos átomos e íons, carga nuclear efetiva, energias de ionização e afinidades eletrônicas) são fundamentais para entender a reatividade química. Por exemplo, como o flúor tem um EA energeticamente favorável e uma grande barreira de energia à ionização (IE), é muito mais fácil formar ânions de flúor do que cátions. As propriedades metálicas, incluindo condutividade e maleabilidade (a capacidade de serem formadas em folhas), dependem de elétrons que possam ser removidos facilmente. Assim, o caráter metálico aumenta à medida que descemos um grupo e diminui ao longo de um período na mesma tendência observada para o tamanho atômico, porque é mais fácil remover um elétron que está mais distante do núcleo.
Resumo
As configurações eletrônicas nos permitem entender muitas tendências periódicas. O raio covalente aumenta à medida que descemos um grupo porque o nível n (tamanho orbital) aumenta. O raio covalente diminui principalmente à medida que nos movemos da esquerda para a direita ao longo de um período, porque a carga nuclear efetiva experimentada pelos elétrons aumenta e os elétrons são puxados mais para o núcleo. Os raios aniônicos são maiores que o átomo original, enquanto os raios catiônicos são menores, porque o número de elétrons de valência mudou enquanto a carga nuclear permaneceu constante. A energia de ionização (a energia associada à formação de um cátion) diminui em um grupo e aumenta principalmente ao longo do período porque é mais fácil remover um elétron de um orbital maior e de maior energia. A afinidade eletrônica (a energia associada à formação de um ânion) é mais favorável (exotérmica) quando os elétrons são colocados em orbitais de baixa energia, mais próximos do núcleo. Portanto, a afinidade eletrônica se torna cada vez mais negativa à medida que nos movemos da esquerda para a direita na tabela periódica e diminui à medida que descemos um grupo. Tanto para dados de afinidade eletrônica quanto de IE, há exceções às tendências ao lidar com subcamadas completamente preenchidas ou parcialmente preenchidas.
Glossário
- raio covalente
- metade da distância entre os núcleos de dois átomos idênticos quando eles são unidos por uma ligação covalente
- carga nuclear efetiva
- carga que leva à força de Coulomb exercida pelo núcleo em um elétron, calculada como a carga nuclear menos a blindagem
- afinidade eletrônica
- energia necessária para adicionar um elétron a um átomo gasoso para formar um ânion
- energia de ionização
- energia necessária para remover um elétron de um átomo ou íon gasoso. O número associado (por exemplo, segunda energia de ionização) corresponde à carga do íon produzido (X 2+)
- isoeletrônico
- grupo de íons ou átomos que têm configurações eletrônicas idênticas


