3.4: Estrutura eletrônica dos átomos (configurações eletrônicas)
- Page ID
- 195474
- Derive as configurações eletrônicas preditas dos átomos no estado fundamental
- Identifique e explique exceções às configurações eletrônicas previstas para átomos e íons
- Relacione as configurações eletrônicas às classificações de elementos na tabela periódica
Tendo introduzido os fundamentos da estrutura atômica e da mecânica quântica, podemos usar nossa compreensão dos números quânticos para determinar como os orbitais atômicos se relacionam entre si. Isso nos permite determinar quais orbitais são ocupados por elétrons em cada átomo. O arranjo específico dos elétrons nos orbitais de um átomo determina muitas das propriedades químicas desse átomo.
Energias orbitais e estrutura atômica
A energia dos orbitais atômicos aumenta à medida que o número quântico principal,\(n\), aumenta. Em qualquer átomo com dois ou mais elétrons, a repulsão entre os elétrons faz com que as energias de subcamadas com valores\(l\) diferentes de sejam diferentes, de modo que a energia dos orbitais aumente dentro de uma camada na ordem s < p < d < f. Figura \(\PageIndex{1}\)mostra como essas duas tendências no aumento de energia se relacionam. O orbital de 1 s na parte inferior do diagrama é o orbital com elétrons de menor energia. A energia aumenta à medida que subimos para os orbitais de 2 s e depois 2 p, 3 s e 3 p, mostrando que o aumento do valor n tem mais influência na energia do que o aumento do valor l para átomos pequenos. No entanto, esse padrão não vale para átomos maiores. O orbital 3 d tem maior energia do que o orbital 4 s. Essas sobreposições continuam ocorrendo com frequência à medida que subimos no gráfico.

Elétrons em átomos sucessivos na tabela periódica tendem a preencher primeiro os orbitais de baixa energia. Assim, muitos estudantes acham confuso que, por exemplo, os orbitais de 5 p sejam preenchidos imediatamente após os 4 d e imediatamente antes dos 6 s. A ordem de preenchimento é baseada nos resultados experimentais observados e foi confirmada por cálculos teóricos. À medida que o número quântico principal, n, aumenta, o tamanho do orbital aumenta e os elétrons passam mais tempo longe do núcleo. Assim, a atração pelo núcleo é mais fraca e a energia associada ao orbital é maior (menos estabilizada). Mas esse não é o único efeito que devemos levar em consideração. Dentro de cada camada, à medida que o valor de l aumenta, os elétrons são menos penetrantes (o que significa que há menos densidade eletrônica encontrada perto do núcleo), na ordem s > p > d > f. Os elétrons que estão mais próximos do núcleo repelem levemente os elétrons que estão mais distantes, compensando ligeiramente as atrações elétron-núcleo mais dominantes (lembre-se de que todos os elétrons têm -1 cargas, mas os núcleos têm cargas + Z). Esse fenômeno é chamado de blindagem e será discutido com mais detalhes na próxima seção. Os elétrons em orbitais que experimentam mais blindagem são menos estabilizados e, portanto, têm maior energia. Para orbitais pequenos (1 s a 3 p), o aumento na energia devido a n é mais significativo do que o aumento devido a l; no entanto, para orbitais maiores, as duas tendências são comparáveis e não podem ser simplesmente previstas. Discutiremos métodos para lembrar a ordem observada.
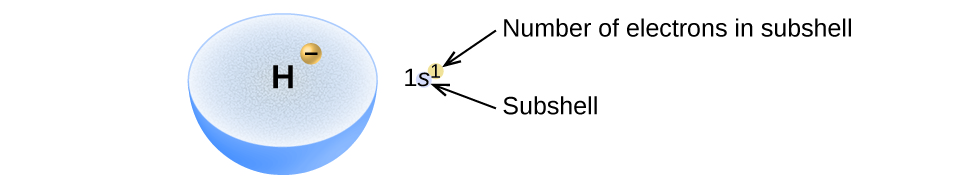
A disposição dos elétrons nos orbitais de um átomo é chamada de configuração eletrônica do átomo. Descrevemos uma configuração eletrônica com um símbolo que contém três informações (Figura\(\PageIndex{2}\)):
- O número da camada quântica principal, n,
- A letra que designa o tipo orbital (a subcamada, l) e
- Um número sobrescrito que designa o número de elétrons nessa subcamada específica.
Por exemplo, a notação 2 p 4 (leia-se “dois—p—quatro”) indica quatro elétrons em uma subcamada p (l = 1) com um número quântico principal (n) de 2. A notação 3 d 8 (leia-se “três-d—oito”) indica oito elétrons na subcamada d (ou seja, l = 2) da camada principal para a qual n = 3.
O Princípio de Aufbau
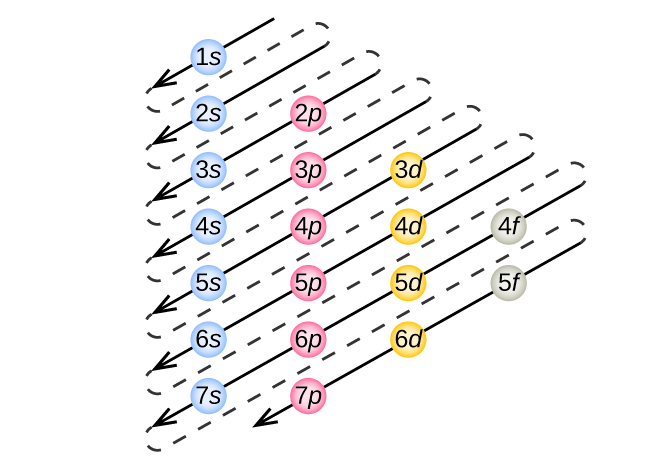
Para determinar a configuração eletrônica de qualquer átomo em particular, podemos “construir” as estruturas na ordem dos números atômicos. Começando com o hidrogênio e continuando pelos períodos da tabela periódica, adicionamos um próton por vez ao núcleo e um elétron à subcamada adequada até descrevermos as configurações eletrônicas de todos os elementos. Esse procedimento é chamado de princípio de Aufbau, da palavra alemã Aufbau (“construir”). Cada elétron adicionado ocupa a subcamada de menor energia disponível (na ordem mostrada na Figura\(\PageIndex{3}\)), sujeita às limitações impostas pelos números quânticos permitidos de acordo com o princípio de exclusão de Pauli. Os elétrons entram nas subcamadas de maior energia somente depois que as subcamadas de baixa energia são preenchidas até a capacidade máxima. A figura\(\PageIndex{3}\) ilustra a maneira tradicional de lembrar a ordem de preenchimento dos orbitais atômicos.
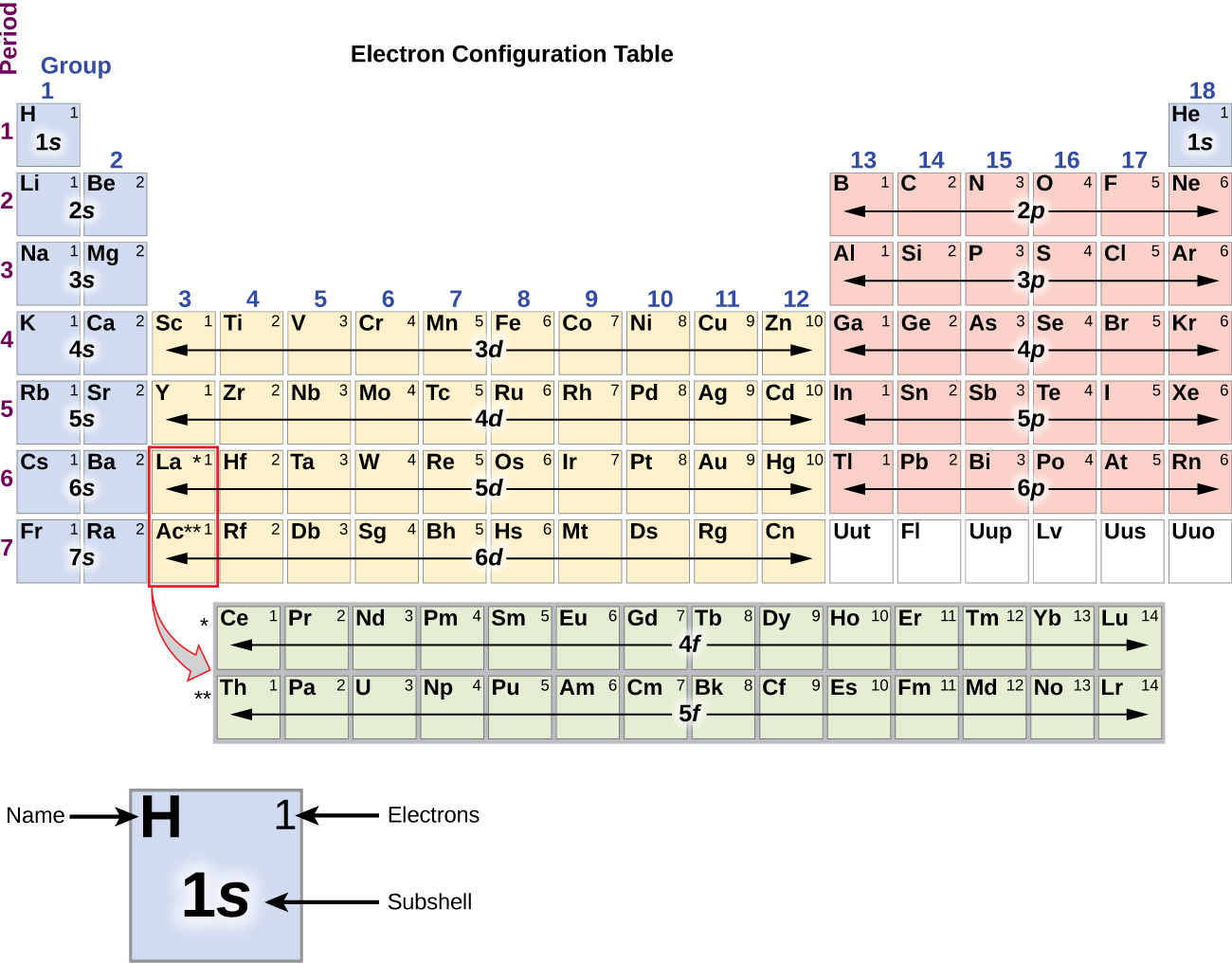
Como a disposição da tabela periódica é baseada nas configurações eletrônicas, a Figura\(\PageIndex{4}\) fornece um método alternativo para determinar a configuração eletrônica. A ordem de preenchimento simplesmente começa no hidrogênio e inclui cada subcamada à medida que você avança na ordem Z crescente. Por exemplo, depois de preencher o bloco de 3 p até Ar, vemos que o orbital será 4s (K, Ca), seguido pelos orbitais de 3 d.
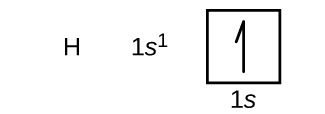
Agora construiremos a configuração eletrônica do estado fundamental e o diagrama orbital para uma seleção de átomos no primeiro e segundo períodos da tabela periódica. Os diagramas orbitais são representações pictóricas da configuração eletrônica, mostrando os orbitais individuais e o arranjo de emparelhamento de elétrons. Começamos com um único átomo de hidrogênio (número atômico 1), que consiste em um próton e um elétron. Referindo-se à Figura 1\(\PageIndex{3}\) ou 2\(\PageIndex{4}\), esperaríamos encontrar o elétron no orbital de 1 s. Por convenção, o\(m_s=+\dfrac{1}{2}\) valor geralmente é preenchido primeiro. A configuração eletrônica e o diagrama orbital são:
Após o hidrogênio está o gás nobre hélio, que tem um número atômico de 2. O átomo de hélio contém dois prótons e dois elétrons. O primeiro elétron tem os mesmos quatro números quânticos que o elétron do átomo de hidrogênio (n = 1, l = 0, m l = 0,\(m_s=+\dfrac{1}{2}\)). O segundo elétron também entra no orbital de 1 s e preenche esse orbital. O segundo elétron tem os mesmos números quânticos n, l e m l, mas deve ter o número quântico de spin oposto,\(m_s=−\dfrac{1}{2}\). Isso está de acordo com o princípio de exclusão de Pauli: dois elétrons no mesmo átomo não podem ter o mesmo conjunto de quatro números quânticos. Para diagramas orbitais, isso significa que duas setas entram em cada caixa (representando dois elétrons em cada orbital) e as setas devem apontar em direções opostas (representando spins emparelhados). A configuração eletrônica e o diagrama orbital do hélio são:
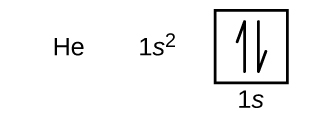
A camada n = 1 está completamente preenchida em um átomo de hélio.
O próximo átomo é o metal alcalino lítio com um número atômico de 3. Os dois primeiros elétrons no lítio preenchem o orbital de 1 s e têm os mesmos conjuntos de quatro números quânticos que os dois elétrons do hélio. O elétron restante deve ocupar o orbital da próxima energia mais baixa, o orbital de 2 s (Figura\(\PageIndex{3}\) ou\(\PageIndex{4}\)). Assim, a configuração eletrônica e o diagrama orbital do lítio são:
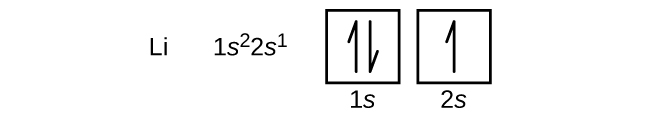
Um átomo do metal alcalino-terroso berílio, com um número atômico de 4, contém quatro prótons no núcleo e quatro elétrons ao redor do núcleo. O quarto elétron preenche o espaço restante no orbital de 2 s.
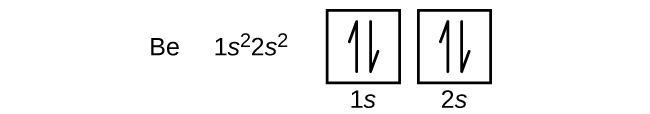
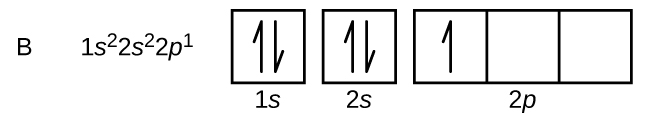
Um átomo de boro (número atômico 5) contém cinco elétrons. A camada n = 1 é preenchida com dois elétrons e três elétrons ocuparão a camada n = 2. Como qualquer subcamada s pode conter apenas dois elétrons, o quinto elétron deve ocupar o próximo nível de energia, que será um orbital de 2p. Existem três orbitais degenerados de 2 p (m l = −1, 0, +1) e o elétron pode ocupar qualquer um desses orbitais p. Ao desenhar diagramas orbitais, incluímos caixas vazias para representar quaisquer orbitais vazios na mesma subcamada que estamos preenchendo.
O carbono (número atômico 6) tem seis elétrons. Quatro deles preenchem os orbitais de 1 s e 2 s. Os dois elétrons restantes ocupam a subcamada de 2 p. Agora temos a opção de preencher um dos orbitais 2p e emparelhar os elétrons ou deixar os elétrons desemparelhados em dois orbitais p diferentes, mas degenerados. Os orbitais são preenchidos conforme descrito pela regra de Hund: a configuração de menor energia para um átomo com elétrons dentro de um conjunto de orbitais degenerados é aquela com o número máximo de elétrons desemparelhados. Assim, os dois elétrons nos orbitais de carbono 2 p têm números quânticos n, l e m s idênticos e diferem em seu número quântico m l (de acordo com o princípio de exclusão de Pauli). A configuração eletrônica e o diagrama orbital do carbono são:
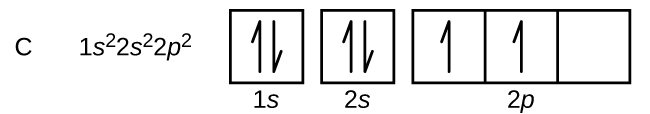
O nitrogênio (número atômico 7) preenche as subcamadas 1 s e 2 s e tem um elétron em cada um dos três orbitais de 2 p, de acordo com a regra de Hund. Esses três elétrons têm spins não pareados. O oxigênio (número atômico 8) tem um par de elétrons em qualquer um dos orbitais 2p (os elétrons têm spins opostos) e um único elétron em cada um dos outros dois. O flúor (número atômico 9) tem apenas um orbital de 2 p contendo um elétron não pareado. Todos os elétrons do néon de gás nobre (número atômico 10) estão emparelhados e todos os orbitais nas camadas n = 1 e n = 2 são preenchidos. As configurações eletrônicas e os diagramas orbitais desses quatro elementos são:
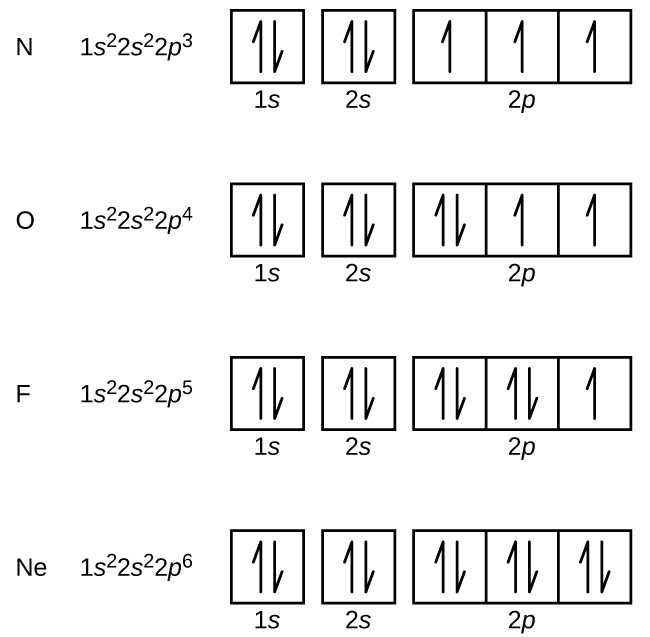
O metal alcalino de sódio (número atômico 11) tem um elétron a mais que o átomo de néon. Esse elétron deve entrar na subcamada de menor energia disponível, o orbital 3 s, dando um 1 s 2 2 2 p 6 3 s 1 configuração. Os elétrons que ocupam o (s) orbital (s) da camada mais externa (valor mais alto de n) são chamados de elétrons de valência, e aqueles que ocupam os orbitais da camada interna são chamados de elétrons centrais (Figura\ PageIndex5\ PageIndex5). Como as camadas de elétrons centrais correspondem às configurações de elétrons de gás nobre, podemos abreviar as configurações de elétrons escrevendo o gás nobre que corresponde à configuração do elétron central, junto com os elétrons de valência em um formato condensado. Para nosso exemplo de sódio, o símbolo [Ne] representa elétrons centrais (1 s 2 2 s 2 2 p 6) e nossa configuração abreviada ou condensada é [Ne] 3 s 1 .

Da mesma forma, a configuração abreviada do lítio pode ser representada como [He] 2 s 1, onde [He] representa a configuração do átomo de hélio, que é idêntica à da camada interna preenchida de lítio. Escrever as configurações dessa maneira enfatiza a semelhança das configurações de lítio e sódio. Ambos os átomos, que estão na família dos metais alcalinos, têm apenas um elétron em uma subcamada de valência, fora de um conjunto preenchido de camadas internas.
\[\ce{Li:[He]}\,2s^1\\ \ce{Na:[Ne]}\,3s^1 \nonumber \]
O metal alcalino-terroso magnésio (número atômico 12), com seus 12 elétrons em uma configuração [Ne] 3 s 2, é análogo ao berílio de seu membro da família, [He] 2 s 2. Ambos os átomos têm uma subcamada s preenchida fora de suas camadas internas preenchidas. O alumínio (número atômico 13), com 13 elétrons e a configuração eletrônica [Ne] 3 s 2 3 p 1, é análogo ao boro de seu membro familiar, [He] 2 s 2 2 p 1.
As configurações eletrônicas de silício (14 elétrons), fósforo (15 elétrons), enxofre (16 elétrons), cloro (17 elétrons) e argônio (18 elétrons) são análogas nas configurações eletrônicas de suas camadas externas às de seus membros familiares correspondentes carbono, nitrogênio, oxigênio, flúor e néon, respectivamente, exceto que o número quântico principal da camada externa dos elementos mais pesados aumentou em um para n = 3. A figura\(\PageIndex{6}\) mostra a menor configuração eletrônica de energia, ou estado fundamental, para esses elementos, bem como para átomos de cada um dos elementos conhecidos.
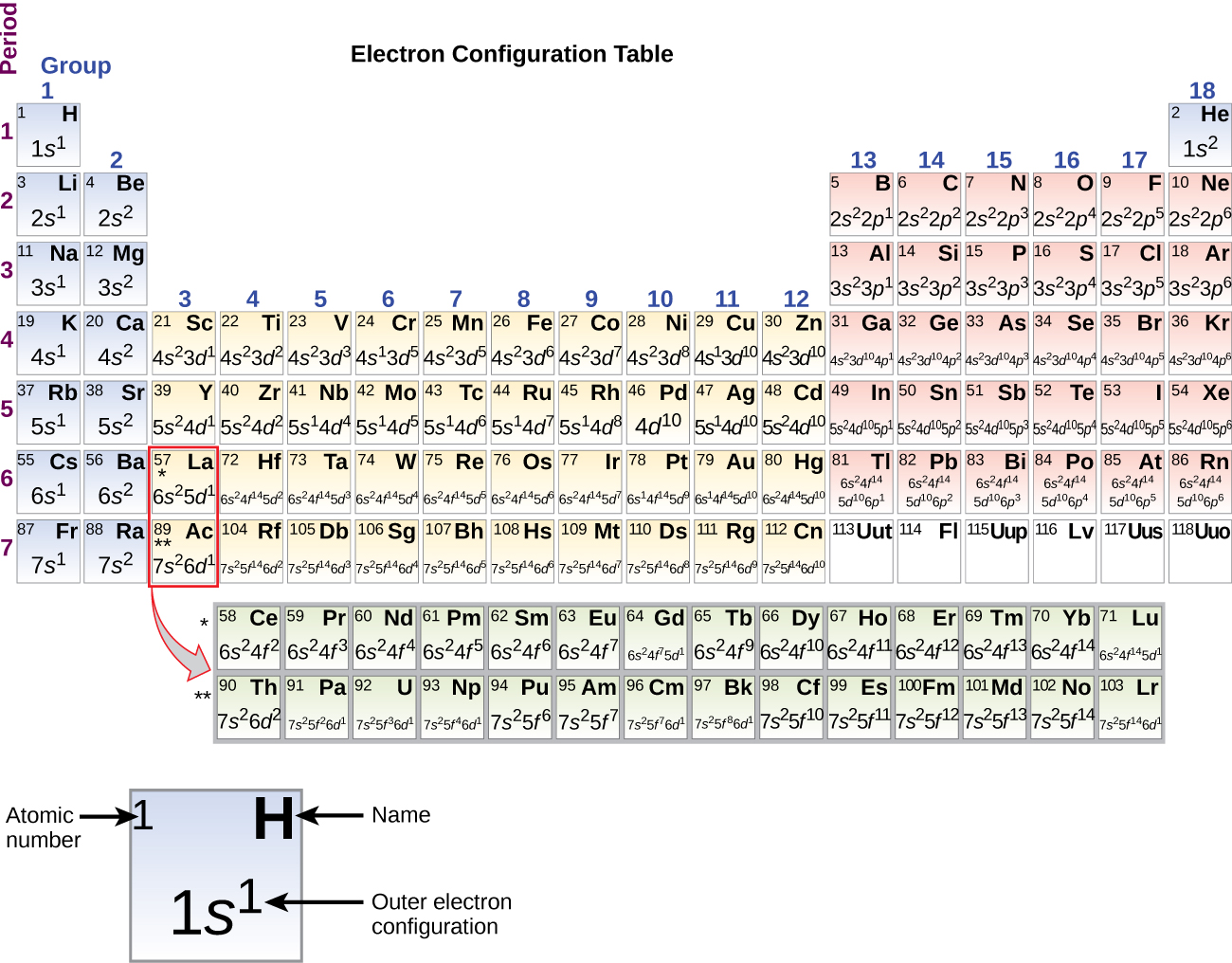
Quando chegarmos ao próximo elemento na tabela periódica, o metal alcalino potássio (número atômico 19), podemos esperar que comecemos a adicionar elétrons à subcamada 3 d. No entanto, todas as evidências químicas e físicas disponíveis indicam que o potássio é como o lítio e o sódio, e que o próximo elétron não é adicionado ao nível de 3 d, mas é, em vez disso, adicionado ao nível de 4 s (Figura\(\PageIndex{3}\) ou\(\PageIndex{4}\)). Conforme discutido anteriormente, o orbital 3D sem nós radiais tem maior energia porque é menos penetrante e mais protegido do núcleo do que o 4s, que tem três nós radiais. Assim, o potássio tem uma configuração eletrônica de [Ar] 4 s 1. Portanto, o potássio corresponde a Li e Na em sua configuração de concha de valência. O próximo elétron é adicionado para completar a subcamada 4 s e o cálcio tem uma configuração eletrônica de [Ar] 4 s 2. Isso dá ao cálcio uma configuração eletrônica da camada externa correspondente à do berílio e do magnésio.
Começando com o metal de transição escândio (número atômico 21), elétrons adicionais são adicionados sucessivamente à subcamada 3 d. Essa subcamada é preenchida até sua capacidade com 10 elétrons (lembre-se de que para l = 2 [d orbitais], existem 2 l + 1 = 5 valores de m l, o que significa que existem cinco orbitais d que têm uma capacidade combinada de 10 elétrons). A subcamada 4 p é preenchida em seguida. Observe que para três séries de elementos, escândio (Sc) através de cobre (Cu), ítrio (Y) até prata (Ag) e lutécio (Lu) até ouro (Au), um total de 10 elétrons d são adicionados sucessivamente à camada (n — 1) próxima à camada n para trazer que (n — 1) ) concha de 8 a 18 elétrons. Para duas séries, lantânio (La) através de lutécio (Lu) e actínio (Ac) através de lawrencium (Lr), 14 elétrons f (l = 3, 2 l + 1 = valores de 7 m l; assim, sete orbitais com uma capacidade combinada de 14 elétrons) são adicionados sucessivamente ao ( n — 2) concha para trazer essa camada de 18 elétrons para um total de 32 elétrons.
Qual é a configuração eletrônica e o diagrama orbital de um átomo de fósforo? Quais são os quatro números quânticos do último elétron adicionado?
Solução
O número atômico do fósforo é 15. Assim, um átomo de fósforo contém 15 elétrons. A ordem de preenchimento dos níveis de energia é 1 s, 2 s, 2 p, 3 s, 3 p, 4 s,. Os 15 elétrons do átomo de fósforo preencherão até o orbital 3p, que conterá três elétrons:
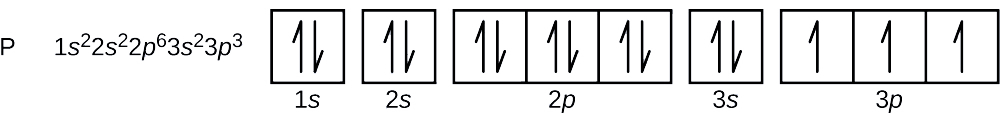
O último elétron adicionado é um elétron de 3 p. Portanto, n = 3 e, para um orbital do tipo p, l = 1. O valor m l pode ser —1, 0 ou +1. Os três orbitais p são degenerados, então qualquer um desses valores de m l está correto. Para elétrons não pareados, a convenção atribui o valor de\(+\dfrac{1}{2}\) for the spin quantum number; thus, \(m_s=+\dfrac{1}{2}\).
Identify the atoms from the electron configurations given:
- [Ar]4s23d5
- [Kr]5s24d105p6
- Answer a
-
Mn
- Answer b
-
Xe
The periodic table can be a powerful tool in predicting the electron configuration of an element. However, we do find exceptions to the order of filling of orbitals that are shown in Figure \(\PageIndex{3}\) or \(\PageIndex{4}\). For instance, the electron configurations of the transition metals chromium (Cr; atomic number 24) and copper (Cu; atomic number 29), among others, are not those we would expect. In general, such exceptions involve subshells with very similar energy, and small effects can lead to changes in the order of filling.
In the case of Cr and Cu, we find that half-filled and completely filled subshells apparently represent conditions of preferred stability. This stability is such that an electron shifts from the 4s into the 3d orbital to gain the extra stability of a half-filled 3d subshell (in Cr) or a filled 3d subshell (in Cu). Other exceptions also occur. For example, niobium (Nb, atomic number 41) is predicted to have the electron configuration [Kr]5s24d3. Experimentally, we observe that its ground-state electron configuration is actually [Kr]5s14d4. We can rationalize this observation by saying that the electron–electron repulsions experienced by pairing the electrons in the 5s orbital are larger than the gap in energy between the 5s and 4d orbitals. There is no simple method to predict the exceptions for atoms where the magnitude of the repulsions between electrons is greater than the small differences in energy between subshells.
Electron Configurations and the Periodic Table
As described earlier, the periodic table arranges atoms based on increasing atomic number so that elements with the same chemical properties recur periodically. When their electron configurations are added to the table (Figure \(\PageIndex{6}\)), we also see a periodic recurrence of similar electron configurations in the outer shells of these elements. Because they are in the outer shells of an atom, valence electrons play the most important role in chemical reactions. The outer electrons have the highest energy of the electrons in an atom and are more easily lost or shared than the core electrons. Valence electrons are also the determining factor in some physical properties of the elements.
Elements in any one group (or column) have the same number of valence electrons; the alkali metals lithium and sodium each have only one valence electron, the alkaline earth metals beryllium and magnesium each have two, and the halogens fluorine and chlorine each have seven valence electrons. The similarity in chemical properties among elements of the same group occurs because they have the same number of valence electrons. It is the loss, gain, or sharing of valence electrons that defines how elements react.
It is important to remember that the periodic table was developed on the basis of the chemical behavior of the elements, well before any idea of their atomic structure was available. Now we can understand why the periodic table has the arrangement it has—the arrangement puts elements whose atoms have the same number of valence electrons in the same group. This arrangement is emphasized in Figure \(\PageIndex{6}\), which shows in periodic-table form the electron configuration of the last subshell to be filled by the Aufbau principle. The colored sections of Figure \(\PageIndex{6}\) show the three categories of elements classified by the orbitals being filled: main group, transition, and inner transition elements. These classifications determine which orbitals are counted in the valence shell, or highest energy level orbitals of an atom.
- Main group elements (sometimes called representative elements) are those in which the last electron added enters an s or a p orbital in the outermost shell, shown in blue and red in Figure \(\PageIndex{6}\). This category includes all the nonmetallic elements, as well as many metals and the intermediate semimetallic elements. The valence electrons for main group elements are those with the highest n level. For example, gallium (Ga, atomic number 31) has the electron configuration [Ar]4s23d104p1, which contains three valence electrons (underlined). The completely filled d orbitals count as core, not valence, electrons.
- Transition elements or transition metals. These are metallic elements in which the last electron added enters a d orbital. The valence electrons (those added after the last noble gas configuration) in these elements include the ns and (n – 1) d electrons. The official IUPAC definition of transition elements specifies those with partially filled d orbitals. Thus, the elements with completely filled orbitals (Zn, Cd, Hg, as well as Cu, Ag, and Au in Figure \(\PageIndex{6}\)) are not technically transition elements. However, the term is frequently used to refer to the entire d block (colored yellow in Figure \(\PageIndex{6}\)), and we will adopt this usage in this textbook.
- Inner transition elements are metallic elements in which the last electron added occupies an f orbital. They are shown in green in Figure \(\PageIndex{6}\). The valence shells of the inner transition elements consist of the (n – 2)f, the (n – 1)d, and the ns subshells. There are two inner transition series:
- The lanthanide series: lanthanide (La) through lutetium (Lu)
- The actinide series: actinide (Ac) through lawrencium (Lr)
Lanthanum and actinium, because of their similarities to the other members of the series, are included and used to name the series, even though they are transition metals with no f electrons.
Electron Configurations of Ions
We have seen that ions are formed when atoms gain or lose electrons. A cation (positively charged ion) forms when one or more electrons are removed from a parent atom. For main group elements, the electrons that were added last are the first electrons removed. For transition metals and inner transition metals, however, electrons in the s orbital are easier to remove than the d or f electrons, and so the highest ns electrons are lost, and then the (n – 1)d or (n – 2)f electrons are removed. An anion (negatively charged ion) forms when one or more electrons are added to a parent atom. The added electrons fill in the order predicted by the Aufbau principle.
What is the electron configuration and orbital diagram of:
- Na+
- P3–
- Al2+
- Fe2+
- Sm3+
Solution
First, write out the electron configuration for each parent atom. We have chosen to show the full, unabbreviated configurations to provide more practice for students who want it, but listing the core-abbreviated electron configurations is also acceptable.
Next, determine whether an electron is gained or lost. Remember electrons are negatively charged, so ions with a positive charge have lost an electron. For main group elements, the last orbital gains or loses the electron. For transition metals, the last s orbital loses an electron before the d orbitals.
- Na: 1s22s22p63s1. Sodium cation loses one electron, so Na+: 1s22s22p63s1 = Na+: 1s22s22p6.
- P: 1s22s22p63s23p3. Phosphorus trianion gains three electrons, so P3−: 1s22s22p63s23p6.
- Al: 1s22s22p63s23p1. Aluminum dication loses two electrons Al2+: 1s22s22p63s23p1 = Al2+: 1s22s22p63s1.
- Fe: 1s22s22p63s23p64s23d6. Iron(II) loses two electrons and, since it is a transition metal, they are removed from the 4s orbital Fe2+: 1s22s22p63s23p64s23d6 = 1s22s22p63s23p63d6.
- Sm: 1s22s22p63s23p64s23d104p65s24d105p66s24f6. Samarium trication loses three electrons. The first two will be lost from the 6s orbital, and the final one is removed from the 4f orbital. Sm3+: 1s22s22p63s23p64s23d104p65s24d105p66s24f6 = 1s22s22p63s23p64s23d104p65s24d105p64f5.
- Which ion with a +2 charge has the electron configuration 1s22s22p63s23p63d104s24p64d5?
- Which ion with a +3 charge has this configuration?
- Answer a
-
Tc2+
- Answer b
-
Ru3+
Summary
The relative energy of the subshells determine the order in which atomic orbitals are filled (1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, and so on). Electron configurations and orbital diagrams can be determined by applying the Pauli exclusion principle (no two electrons can have the same set of four quantum numbers) and Hund’s rule (whenever possible, electrons retain unpaired spins in degenerate orbitals).
Electrons in the outermost orbitals, called valence electrons, are responsible for most of the chemical behavior of elements. In the periodic table, elements with analogous valence electron configurations usually occur within the same group. There are some exceptions to the predicted filling order, particularly when half-filled or completely filled orbitals can be formed. The periodic table can be divided into three categories based on the orbital in which the last electron to be added is placed: main group elements (s and p orbitals), transition elements (d orbitals), and inner transition elements (f orbitals).
Glossary
- Aufbau principle
- procedure in which the electron configuration of the elements is determined by “building” them in order of atomic numbers, adding one proton to the nucleus and one electron to the proper subshell at a time
- core electron
- electron in an atom that occupies the orbitals of the inner shells
- electron configuration
- electronic structure of an atom in its ground state given as a listing of the orbitals occupied by the electrons
- Hund’s rule
- every orbital in a subshell is singly occupied with one electron before any one orbital is doubly occupied, and all electrons in singly occupied orbitals have the same spin
- orbital diagram
- pictorial representation of the electron configuration showing each orbital as a box and each electron as an arrow
- valence electrons
- electrons in the outermost or valence shell (highest value of n) of a ground-state atom; determine how an element reacts
- valence shell
- outermost shell of electrons in a ground-state atom; for main group elements, the orbitals with the highest n level (s and p subshells) are in the valence shell, while for transition metals, the highest energy s and d subshells make up the valence shell and for inner transition elements, the highest s, d, and f subshells are included


