3.E: Estrutura eletrônica e propriedades periódicas (exercícios)
- Page ID
- 195512
6.1: Energia eletromagnética
Q6.1.1
A luz produzida por um sinal de néon vermelho é devida à emissão de luz por átomos de néon excitados. Descreva qualitativamente o espectro produzido pela passagem da luz de uma lâmpada de néon através de um prisma.
S6.1.1
O espectro consiste em linhas coloridas, das quais pelo menos uma (provavelmente a mais brilhante) é vermelha.
Q6.1.2
Uma estação de rádio FM encontrada em 103,1 no dial FM transmite a uma frequência de 1,031 × 10 8 s −1 (103,1 MHz). Qual é o comprimento de onda dessas ondas de rádio em metros?
S6.1.2
\(λ=\dfrac{c}{ν}\)
\(λ = \dfrac{2.998 \times10^{8}\: \dfrac{m}{s}}{1.031 \times10^{8}\: \dfrac{1}{s}} = 2.908\:m\)
Q6.1.3
A FM-95, uma estação de rádio FM, transmite a uma frequência de 9,51 × 10 7 s −1 (95,1 MHz). Qual é o comprimento de onda dessas ondas de rádio em metros?
6.1.3
\(λ=\dfrac{c}{ν}\)
\(λ = \dfrac{2.998 \times10^{8}\: \dfrac{m}{s}}{9.51 \times10^{7}\: \dfrac{1}{s}} = 3.15 \:m\)
Q6.1.4
Uma linha violeta brilhante ocorre a 435,8 nm no espectro de emissão do vapor de mercúrio. Que quantidade de energia, em joules, deve ser liberada por um elétron em um átomo de mercúrio para produzir um fóton dessa luz?
6.1.4
\(E= \dfrac{hc}{λ}\)
\(E= \dfrac{(2.998 \times 10^{8} \dfrac{m}{s})\: (6.6262 \times 10^{-34} Js)}{4.358 \times 10^{-7} m}\)
\(=4.56\times 10^{-19}J\)
Q6.1.5
A luz com comprimento de onda de 614,5 nm parece laranja. Qual é a energia, em joules, por fóton dessa luz laranja? Qual é a energia em eV (1 eV = 1,602 × 10 −19 J)?
S6.1.5
1.) Primeiro, converta 614,5 nm em metros
\(6.145 nm\)=\(6.145 \times10^{-7} m\)
2.) Em seguida, calcule a quantidade de energia que esse comprimento de onda de luz contém usando as equações:
\(E = hν\)e\(ν=\dfrac{c}{λ}\) que pode ser manipulado algebricamente em:\(E=\dfrac{hc}{λ}\)
- h = constante de Plancks →\(6.6262 \times10^{-34} Js\)
- c = Velocidade da luz →\(2.998\times 10^{8}\; \dfrac {m}{s}\)
- λ = comprimento de onda do fóton →\(6.145 \times10^{-7} m\)
\[= \dfrac{(6.6262\times 10^{−34}\;Js) \ (2.998\times 10^{8}\; \dfrac {m}{s}) } {6.145 \times 10^{−7}m \ } =3.233 \times 10^{-19} J\]
3.) Em seguida, converta Joules em eV:
\[=(3.233 \times 10^{−19}J) \times\dfrac{1eV}{1.602\times 10^{-19}J} \]\[=2.018 eV\]
Átomos de lítio aquecidos emitem fótons de luz com uma energia de 2,961 × 10 −19 J. Calcule a frequência e o comprimento de onda de um desses fótons. Qual é a energia total em 1 mol desses fótons? Qual é a cor da luz emitida?
6.1.6
1.) \(E = hν\)e\(ν=\dfrac{E}{h}\)
- h = constante de Plancks →\(6.6262 \times10^{-34} Js\)
Frequência:\(ν=\dfrac{ 2.961\times 10^{-19}J}{6.6262\times 10^{-34}Js}\ = 4.469\times 10^{14} Hz\)
2.) \(λ=\dfrac{c}{ν}\)
c = Velocidade da luz →\(2.998\times 10^{8}\; \dfrac {m}{s}\)
Comprimento de onda:\(λ=\dfrac{ 2.998\times 10^{8}\dfrac {m}{s}}{4.469\times 10^{14}\dfrac {1}{s}}\ = 6.709\times 10^{-7} m\) = luz vermelha
Energia total:
\(E= \dfrac{2.961 \times 10^{-19}J}{1\: photon}\times\dfrac{6.022\times 10^{23}\: photons}{1\: mole} = 1.783\times 10^{5} J \)
Q6.1.7
Um fóton de luz produzido por um laser cirúrgico tem uma energia de 3,027 × 10 −19 J. Calcule a frequência e o comprimento de onda do fóton. Qual é a energia total em 1 mol de fótons? Qual é a cor da luz emitida?
S6.1.7
₂ = 4,568 × 10 14 s; λ = 656,3 nm; Energia mol −1 = 1,823 × 10 5 J mol −1; vermelho
Q6.1.8
Quando os íons rubídio são aquecidos a uma alta temperatura, duas linhas são observadas em seu espectro de linha nos comprimentos de onda (a) 7,9 × 10 −7 m e (b) 4,2 × 10 −7 m. Quais são as frequências das duas linhas? Que cor vemos quando aquecemos um composto de rubídio?
Q6.1.9
O espectro de emissão do césio contém duas linhas cujas frequências são (a) 3,45 × 10 14 Hz e (b) 6,53 × 10 14 Hz. Quais são os comprimentos de onda e as energias por fóton das duas linhas? De que cor são as linhas?
6.1.9
(a) λ = 8,69 × 10 −7 m; E = 2,29 × 10 −19 J; (b) λ = 4,59 × 10 −7 m; E = 4,33 × 10 −19 J; A cor de (a) é vermelha; (b) é azul.
Q6.1.10
Os fótons de radiação infravermelha são responsáveis por grande parte do calor que sentimos ao segurar nossas mãos diante de um incêndio. Esses fótons também aquecerão outros objetos. Quantos fótons infravermelhos com comprimento de onda de 1,5 × 10 −6 m devem ser absorvidos pela água para aquecer uma xícara de água (175 g) de 25,0 °C a 40°
S6.1.10
1.) Primeiro, devemos usar a equação: Q = mcΔt ° para calcular a quantidade de energia em Joules (J) para aquecer 175g de H 2 O, um total de 15 ° Celsius
- m = massa em gramas (g) → 175g
- C = Calor específico de H 2 O (l) →\(\dfrac {4.184 J}{g°C}\)
- ΔT ° = Diferença na temperatura → 40 - 25 =15°
\[q = 175g\times \dfrac {4.184 J}{g°C}\times 15° C\]
q= 11.000 J
2.) Agora precisamos calcular a quantidade de energia em Joules (J) que um fóton com comprimento de onda de 1,5x10 -6 m contém. Usaremos as equações:
\(E = hν\)e\(ν=\dfrac{c}{λ}\) que pode ser manipulado algebricamente em:\(E=\dfrac{hc}{λ}\)
- h = constante de Plancks →\(6.6262 \times10^{-34} Js\)
- c = Velocidade da luz →\(2.998\times 10^{8}\; \dfrac {m}{s}\)
- λ = comprimento de onda do fóton →\(1.5 \times10^{-6} m\)
\[= \dfrac{(6.6262\times 10^{−34}\;Js) \ (2.998\times 10^{8}\; \dfrac {m}{s}) } {1.5 \times 10^{−6}m \ } =1.3 \times 10^{-19} J\]
Essa é a energia em um fóton, então agora temos que ver quantas vezes 1,3x10 -19 J se encaixa no 11.000 J do nosso primeiro cálculo:
\[= \dfrac{11,000\;J} {1.3 \times 10^{−19}\; \dfrac {J}{photon} } =8.3\times 10^{22} photons\]
\[= 8.3\times 10^{22} photons\]
Q6.1.11
Um dos aparelhos radiográficos usados no consultório do dentista emite uma radiografia de comprimento de onda de 2,090 × 10 −11 m. Qual é a energia, em joules, e a frequência desse raio-X?
6.1.11
E = 9,502 × 10 −15 J; 𝑥 = 1,434 × 10 19 s −1
Q6.1.12
Os olhos de certos répteis transmitem um único sinal visual para o cérebro quando os receptores visuais são atingidos por fótons com um comprimento de onda de 850 nm. Se for necessária uma energia total de 3,15 × 10 −14 J para disparar o sinal, qual é o número mínimo de fótons que devem atingir o receptor?
S6.1.12
1.) Primeiro, precisamos converter nanômetros em metros
850 nm = 8,5 x 10 -7 m
2. Em seguida, calcule a energia em Joules que um fóton desse comprimento de onda (λ) produz:
\[(E=\dfrac{hc}{λ}) = \dfrac{(6.6262\times 10^{−34}\;Js) \ (2.998\times 10^{8}\; \dfrac {m}{s}) } {8.5 \times 10^{−7}m \ } = 2.3 \times 10^{-19} \dfrac {J}{photon}\]
3.) Em seguida, precisamos descobrir quantos desses fótons serão necessários para direcionar o sinal visual ao cérebro:
\[ \begin{align} &= \dfrac{3.15\times 10^{-14}\;\cancel{J}} {2.3 \times 10^{−19}\; \dfrac {\cancel{J}}{photon} } \\[5pt] &=1.3\times 10^{5}\, photons \end{align}\]
Q6.1.13
Os monitores de televisão e computador em cores RGB usam tubos de raios catódicos que produzem cores misturando luz vermelha, verde e azul. Se olharmos para a tela com uma lupa, podemos ver pontos individuais se ativando e desativando à medida que as cores mudam. Usando um espectro de luz visível, determine o comprimento de onda aproximado de cada uma dessas cores. Qual é a frequência e a energia de um fóton de cada uma dessas cores?
S6.1.13
- Vermelho: 660 nm; 4,54 × 10 14 Hz; 3,01 × 10 −19 J.
- Verde: 520 nm; 5,77 × 10 14 Hz; 3,82 × 10 −19 J.
- Azul: 440 nm; 6,81 × 10 14 Hz; 4,51 × 10 −19 J.
Números um pouco diferentes também são possíveis.
Q6.1.14
Responda às seguintes perguntas sobre um laser Blu-ray:
- O laser em um aparelho de Blu-ray tem um comprimento de onda de 405 nm. Em que região do espectro eletromagnético está essa radiação? Qual é sua frequência?
- Um laser Blu-ray tem uma potência de 5 miliwatts (1 watt = 1 J s −1). Quantos fótons de luz são produzidos pelo laser em 1 hora?
- A resolução ideal de um player usando um laser (como um reprodutor de Blu-ray), que determina a proximidade com que os dados podem ser armazenados em um disco compacto, é determinada usando a seguinte fórmula: Resolução = 0,60 (λ /NA), onde λ é o comprimento de onda do laser e NA é o numérico abertura. A abertura numérica é uma medida do tamanho do ponto de luz no disco; quanto maior o NA, menor o ponto. Em um sistema Blu-ray típico, NA = 0,95. Se o laser de 405 nm for usado em um reprodutor de Blu-ray, qual é o mais próximo em que as informações podem ser armazenadas em um disco Blu-ray?
- A densidade de dados de um disco Blu-ray usando um laser de 405 nm é de 1,5 × 10 7 bits mm −2. Os discos têm um diâmetro externo de 120 mm e um orifício de 15 mm de diâmetro. Quantos bits de dados podem estar contidos no disco? Se um disco Blu-ray pode conter 9.400.000 páginas de texto, quantos bits de dados são necessários para uma página digitada? (Dica: determine a área do disco que está disponível para armazenar dados. A área dentro de um círculo é dada por A = π r 2, onde o raio r é metade do diâmetro.)
Q6.1.15
Qual é a frequência limite para o metal sódico se um fóton com frequência 6,66 × 10 14 s −1 ejeta um fóton com energia cinética de 7,74 × 10 −20 J? O efeito fotoelétrico será observado se o sódio for exposto à luz laranja?
S6.1.15
5,49 × 10 14 s −1; não
6.2: O modelo de Bohr
Q6.2.1
Por que o elétron em um átomo de hidrogênio de Bohr está ligado menos fortemente quando tem um número quântico de 3 do que quando tem um número quântico de 1?
Q6.2.2
O que significa dizer que a energia dos elétrons em um átomo é quantizada?
S6.2.2
Energia quantizada significa que os elétrons podem possuir apenas certos valores discretos de energia; valores entre esses valores quantizados não são permitidos.
Q6.2.3
Usando o modelo de Bohr, determine a energia, em joules, necessária para ionizar um átomo de hidrogênio no estado fundamental. Mostre seus cálculos.
Q6.2.4
O elétron volt (eV) é uma unidade de energia conveniente para expressar energias em escala atômica. É a quantidade de energia que um elétron ganha quando submetido a um potencial de 1 volt;\(1 \;eV = 1.602 \times 10^{-19}\; J\). Usando o modelo de Bohr, determine a energia, em elétron-volts, do fóton produzido quando um elétron em um átomo de hidrogênio se move da órbita com\(n = 5\) para a órbita com\(n = 2\). Mostre seus cálculos.
S6.2.4
\[E=E_2−E_5=2.179 \times 10^{−18} \left (\dfrac{1}{n_2^2}−\dfrac{1}{n^2_5}\right) \; J\]
\[ = 2.179 \times 10^{-18} \left (\dfrac{1}{2^2}−\dfrac{1}{5^2}\right)=4.576 \times 10^{−19}\; J\]
\[= \dfrac{4.576\times 10^{−19}\;J} {1.602 \times 10^{−19}\;J \; eV^{−1} } =2.856\; eV\]
Q6.2.5
Usando o modelo de Bohr, determine a menor energia possível para o elétron no\(He^+\) íon.
Q6.2.6
Usando o modelo de Bohr, determine a energia de um elétron\(n = 6\) em um átomo de hidrogênio.
S6.2.6
−8,716 × 10−18 M
Q6.2.7
Usando o modelo de Bohr, determine a energia de um elétron\(n = 8\) em um átomo de hidrogênio.
Q6.2.8
A que distância do núcleo em angstroms (1 angstrom =\(1 \times 10^{–10}\; \ce m\)) está o elétron em um átomo de hidrogênio se tiver uma energia de\(-8.72 \times 10^{-20}\; \ce J\)?
S6.2.8
\(−3.405 \times 10^{−20} J\)
Q6.2.9
Qual é o raio, em angstroms, do orbital de um elétron com n = 8 em um átomo de hidrogênio?
Q6.2.10
Usando o modelo de Bohr, determine a energia em joules do fóton produzido quando um elétron em um\(\ce{He^{+}}\) íon se move da órbita com n = 5 para a órbita com n = 2.
Q6.2.11
Usando o modelo de Bohr, determine a energia em joules do fóton produzido quando um elétron em um íon Li2+ se move da órbita com n = 2 para a órbita com n = 1.
S6.2.11
1,471 × 10−17 M
Q6.2.12
Considere um grande número de átomos de hidrogênio com elétrons distribuídos aleatoriamente nas órbitas n = 1, 2, 3 e 4
- Quantos comprimentos de onda diferentes de luz são emitidos por esses átomos à medida que os elétrons caem em orbitais de baixa energia?
- Calcule as energias mais baixas e mais altas da luz produzidas pelas transições descritas na parte (a).
- Calcule as frequências e comprimentos de onda da luz produzida pelas transições descritas na parte (b).
Q6.2.13
Como o modelo de Bohr e o modelo de Rutherford do átomo são semelhantes? Como eles são diferentes?
Q6.2.14
Os espectros de hidrogênio e cálcio são mostrados em [link]. O que causa as linhas nesses espectros? Por que as cores das linhas são diferentes? Sugira uma razão para a observação de que o espectro do cálcio é mais complicado do que o espectro do hidrogênio
S6.2.14
Ambos envolvem um núcleo relativamente pesado com elétrons se movendo ao redor dele, embora, estritamente falando, o modelo de Bohr funcione apenas para átomos ou íons de um elétron. De acordo com a mecânica clássica, o modelo de Rutherford prevê um “sistema solar” em miniatura com elétrons se movendo ao redor do núcleo em órbitas circulares ou elípticas confinadas a planos. Se os requisitos da teoria eletromagnética clássica de que elétrons em tais órbitas emitiriam radiação eletromagnética fossem ignorados, tais átomos seriam estáveis, com energia e momento angular constantes, mas não emitiriam nenhuma luz visível (ao contrário da observação). Se a teoria eletromagnética clássica for aplicada, o átomo de Rutherford emitiria radiação eletromagnética de frequência cada vez maior (ao contrário dos espectros discretos observados), perdendo energia até que o átomo colapsasse em um tempo absurdamente curto (ao contrário da estabilidade observada a longo prazo de átomos). O modelo de Bohr mantém a visão mecânica clássica de órbitas circulares confinadas a planos com energia e momento angular constantes, mas as restringe a valores quantizados dependentes de um único número quântico, n. Supõe-se que o elétron em órbita no modelo de Bohr não emita nenhuma radiação eletromagnética enquanto movendo-se ao redor do núcleo em suas órbitas estacionárias, mas o átomo pode emitir ou absorver radiação eletromagnética quando o elétron muda de uma órbita para outra. Por causa das órbitas quantizadas, esses “saltos quânticos” produzirão espectros discretos, de acordo com as observações.
6.3: Desenvolvimento da Teoria Quântica
Q6.3.1
Como o modelo de Bohr e o modelo de mecânica quântica do átomo de hidrogênio são semelhantes? Como eles são diferentes?
6.3.1
Ambos os modelos têm um núcleo central de carga positiva com elétrons se movendo ao redor do núcleo de acordo com o potencial eletrostático de Coulomb. O modelo de Bohr assume que os elétrons se movem em órbitas circulares que têm energias quantizadas, momento angular e raios que são especificados por um único número quântico, n = 1, 2, 3,..., mas essa quantização é uma suposição ad hoc feita por Bohr para incorporar a quantização em um descrição mecânica essencialmente clássica do átomo. Bohr também assumiu que os elétrons que orbitam o núcleo normalmente não emitem nem absorvem radiação eletromagnética, mas o fazem quando o elétron muda para uma órbita diferente. No modelo de mecânica quântica, os elétrons não se movem em órbitas precisas (tais órbitas violam o princípio da incerteza de Heisenberg) e, em vez disso, uma interpretação probabilística da posição do elétron em um determinado instante é usada, com uma função matemática chamada função de onda que pode ser usado para determinar a distribuição de probabilidade espacial do elétron. Essas funções de onda, ou orbitais, são ondas estacionárias tridimensionais que podem ser especificadas por três números quânticos que surgem naturalmente de sua matemática subjacente (sem necessidade de suposições ad hoc): o número quântico principal, n (o mesmo usado por Bohr), que especifica conchas como que orbitais com o mesmo n têm todos a mesma energia e aproximadamente a mesma extensão espacial; o número quântico do momento angular l, que é uma medida do momento angular do orbital e corresponde às formas gerais dos orbitais, além de especificar subcamadas de tal forma que orbitais com o mesmo l (e n) têm todos a mesma energia; e o número quântico de orientação m, que é uma medida do componente z do momento angular e corresponde às orientações dos orbitais. O modelo de Bohr dá a mesma expressão para a energia que a expressão da mecânica quântica e, portanto, ambos explicam adequadamente o espectro discreto do hidrogênio (um exemplo de como obter as respostas certas pelos motivos errados, algo com o qual muitos estudantes de química podem simpatizar), mas dá a resposta errada expressão para o momento angular (as órbitas de Bohr necessariamente têm momento angular diferente de zero, mas alguns orbitais quânticos [s orbitais] podem ter momento angular zero).
Q6.3.2
Quais são os valores permitidos para cada um dos quatro números quânticos: n, l, m l e m s?
Q6.3.3
Descreva as propriedades de um elétron associado a cada um dos quatro números quânticos a seguir: n, l, m l e m s.
6.3.3
n determina a faixa geral para o valor da energia e as prováveis distâncias que o elétron pode estar do núcleo. l determina a forma do orbital. m l determina a orientação dos orbitais com o mesmo valor l em relação um ao outro. m s determina o spin de um elétron.
Q6.3.4
Responda às seguintes perguntas:
- Sem usar números quânticos, descreva as diferenças entre as camadas, subcamadas e orbitais de um átomo.
- Como os números quânticos das camadas, subcamadas e orbitais de um átomo diferem?
Q6.3.5
Identifique a subcamada na qual os elétrons com os seguintes números quânticos são encontrados:
- n = 2, l = 1
- n = 4, l = 2
- n = 6, l = 0
S6.3.5
(a) 2 p; (b) 4 d; (c) 6 s
Q6.3.6
Quais das subcamadas descritas na Pergunta 5 contêm orbitais degenerados? Quantos orbitais degenerados existem em cada um?
Q6.3.7
Identifique a subcamada na qual os elétrons com os seguintes números quânticos são encontrados:
- n = 3, l = 2
- n = 1, l = 0
- n = 4, l = 3
6.3.7
(a) 3 d; (b) 1 s; (c) 4 f
Q6.3.8
Quais das subcamadas descritas na Pergunta 7 contêm orbitais degenerados? Quantos orbitais degenerados existem em cada um?
Q6.3.9
Esboce a superfície limite de um orbital a\(d_{x^2−y^2}\) e a p y. Certifique-se de mostrar e rotular os eixos.
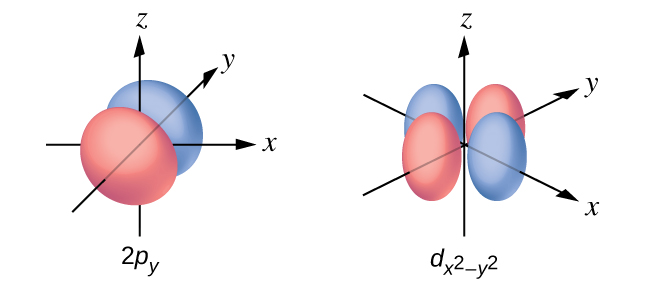
Q6.3.10
Esboce os orbitais p x e d xz. Certifique-se de mostrar e rotular as coordenadas.
Q6.3.11
Considere os orbitais mostrados aqui no esboço.
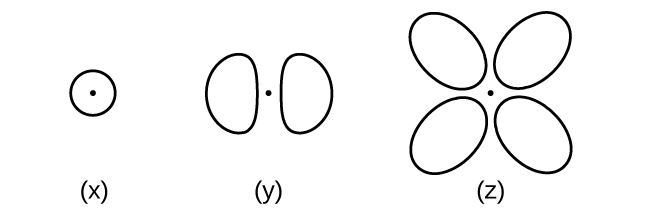
- Qual é o número máximo de elétrons contidos em um orbital do tipo (x)? Do tipo (y)? Do tipo (z)?
- Quantos orbitais do tipo (x) são encontrados em uma concha com n = 2? Quantos do tipo (y)? Quantos do tipo (z)?
- Escreva um conjunto de números quânticos para um elétron em um orbital do tipo (x) em uma camada com n = 4. De um orbital do tipo (y) em uma concha com n = 2. De um orbital do tipo (z) em uma concha com n = 3.
- Qual é o menor valor de n possível para um orbital do tipo (x)? Do tipo (y)? Do tipo (z)?
- Quais são os valores possíveis de l e m l para um orbital do tipo (x)? Do tipo (y)? Do tipo (z)?
6.3.11
(a) x. 2, y. 2, z. 2; (b) x. 1, y. 3, z. 0; (c) x. 4 0 0\(\dfrac{1}{2}\), y. 2 1 0 \(\dfrac{1}{2}\), z. 3 2 0 \(\dfrac{1}{2}\); (d) x. 1, y. 2, z. 3; (e) x. l = 0, ml = 0, y. l = 1, ml = –1, 0, or +1, z. l = 2, ml = –2, –1, 0, +1, +2
Q6.3.12
State the Heisenberg uncertainty principle. Describe briefly what the principle implies.
Q6.3.13
How many electrons could be held in the second shell of an atom if the spin quantum number ms could have three values instead of just two? (Hint: Consider the Pauli exclusion principle.)
S6.3.13
12
Q6.3.14
Which of the following equations describe particle-like behavior? Which describe wavelike behavior? Do any involve both types of behavior? Describe the reasons for your choices.
- \(c = λν\)
- \(E=\dfrac{mν^2}{2}\)
- \(r=\dfrac{n^2a_0}{Z}\)
- \(E = hν\)
- \(λ=\dfrac{h}{mν}\)
Q6.3.15
Write a set of quantum numbers for each of the electrons with an n of 4 in a Se atom.
S6.3.15
| n | l | ml | s |
|---|---|---|---|
| 4 | 0 | 0 | \(+\dfrac{1}{2}\) |
| 4 | 0 | 0 | \(−\dfrac{1}{2}\) |
| 4 | 1 | −1 | \(+\dfrac{1}{2}\) |
| 4 | 1 | 0 | \(+\dfrac{1}{2}\) |
| 4 | 1 | +1 | \(+\dfrac{1}{2}\) |
| 4 | 1 | −1 | \(−\dfrac{1}{2}\) |
6.4: Electronic Structure of Atoms (Electron Configurations)
Q6.4.1
Read the labels of several commercial products and identify monatomic ions of at least four transition elements contained in the products. Write the complete electron configurations of these cations.
Q6.4.2
Read the labels of several commercial products and identify monatomic ions of at least six main group elements contained in the products. Write the complete electron configurations of these cations and anions.
S6.4.2
For example, Na+: 1s22s22p6; Ca2+: 1s22s22p6; Sn2+: 1s22s22p63s23p63d104s24p64d105s2; F–: 1s22s22p6; O2–: 1s22s22p6; Cl–: 1s22s22p63s23p6.
Q6.4.3
Using complete subshell notation (not abbreviations, 1s22s22p6, and so forth), predict the electron configuration of each of the following atoms:
- C
- P
- V
- Sb
- Sm
S6.4.3
a.) 1s22s22p2
b.) 1s22s22p63s23p3
c.) 1s22s22p63s23p63d34s2
d.) 1s22s22p63s23p63d104s24p64d105s25p3
e.) 1s22s22p63s23p63d104s24p64d104f65s25p66s2
Q6.4.4
Using complete subshell notation (1s22s22p6, and so forth), predict the electron configuration of each of the following atoms:
- N
- Si
- Fe
- Te
- Tb
S6.4.4
- 1s22s22p3;
- 1s22s22p63s23p2;
- 1s22s22p63s23p64s23d6;
- 1s22s22p63s23p64s23d104p65s24d105p4;
- 1s22s22p63s23p64s23d104p65s24d105p66s24f9
Q6.4.5
Is 1s22s22p6 the symbol for a macroscopic property or a microscopic property of an element? Explain your answer.
Q6.4.6
What additional information do we need to answer the question “Which ion has the electron configuration 1s22s22p63s23p6”?
S6.4.6
The charge on the ion.
Q6.4.7
Draw the orbital diagram for the valence shell of each of the following atoms:
- C
- P
- V
- Sb
- Ru
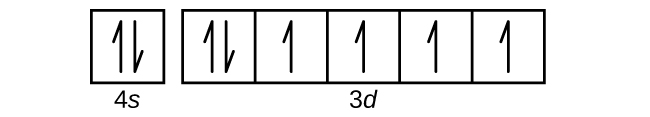
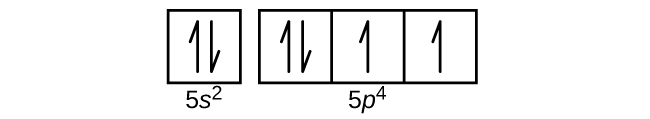
Q6.4.8
Use an orbital diagram to describe the electron configuration of the valence shell of each of the following atoms:
- N
- Si
- Fe
- Te
- Mo
S6.4.8
(a)

Q6.4.9
Usando a notação completa da subcamada (1 s 2 2 s 2 2 p 6 e assim por diante), preveja as configurações eletrônicas dos seguintes íons.
- EM 3—
- Carro 2+
- S —
- Cs 2+
- Cr 2+
- Deus 3+
Q6.4.10
Qual átomo tem a configuração eletrônica: 1 s 2 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 x 2?
S6.4.10
Zr
Q6.4.11
Qual átomo tem a configuração eletrônica: 1 s 2 2 2 p 6 3 s 2 3 p 6 3 d 7 4 s 2?
S6.4.11
Co; Cobalto
Q6.4.12
Qual íon com carga +1 tem a configuração eletrônica 1 s 2 2 2 p 6 3 s 2 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 ? Qual íon com carga de -2 tem essa configuração?
S6.4.12
Rb +, Se 2−
Q6.4.13
Qual dos seguintes átomos contém apenas três elétrons de valência: Li, B, N, F, Ne?
S6.4.13
B; Boro
Q6.4.14
Qual dos seguintes tem dois elétrons não pareados?
- Mg
- Si
- S
- Tanto Mg quanto S
- Tanto Si quanto S.
S6.4.14
Embora tanto (b) quanto (c) estejam corretos, (e) engloba ambos e é a melhor resposta.
Q6.4.15
Qual átomo seria esperado que tivesse uma subcamada de 6 p meio preenchida?
S6.4.15
Bi; Bismuto
Q6.4.16
Qual átomo seria esperado que tivesse uma subcamada de 4 s parcialmente preenchida?
S6.4.16
K
Q6.4.17
Em uma área da Austrália, o gado não prosperou apesar da presença de forragem adequada. Uma investigação mostrou que a causa é a ausência de cobalto suficiente no solo. O cobalto forma cátions em dois estados de oxidação, Co 2+ e Co 3+. Escreva a estrutura eletrônica dos dois cátions.
Q6.4.18
O tálio foi usado como veneno na história de mistério de Agatha Christie “The Pale Horse”. O tálio tem duas formas catiônicas possíveis, +1 e +3. Os compostos +1 são os mais estáveis. Escreva a estrutura eletrônica do cátion +1 do tálio.
S6.4.18
1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 4 d 10 5 s 2 5 p 6 6 s 2 4 de 14 5 x 10
Q6.4.19
Escreva as configurações eletrônicas para os seguintes átomos ou íons:
- B 3+
- O —
- Cl 3+
- Carro 2+
- Ti
Q6.4.20
O cobalto-60 e o iodo-131 são isótopos radioativos comumente usados na medicina nuclear. Quantos prótons, nêutrons e elétrons estão nos átomos desses isótopos? Escreva a configuração eletrônica completa para cada isótopo.
S6.4.20
Co tem 27 prótons, 27 elétrons e 33 nêutrons: 1 s 2 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 7.
Ele tem 53 prótons, 53 elétrons e 78 nêutrons: 1 s 2 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 4 d 10 5 s 2 5 p 5.
Q6.4.21
Escreva um conjunto de números quânticos para cada um dos elétrons com um n de 3 em um átomo de Sc.
6.5: Variações periódicas nas propriedades do elemento
Q6.5.1
Com base em suas posições na tabela periódica, preveja qual tem o menor raio atômico: Mg, Sr, Si, Cl, I.
S6.5.1
Cl
Q6.5.2
Com base em suas posições na tabela periódica, preveja qual tem o maior raio atômico: Li, Rb, N, F, I.
Q6.5.3
Com base em suas posições na tabela periódica, preveja qual tem a maior energia de primeira ionização: Mg, Ba, B, O, Te.
6.5.3
O
Q6.5.4
Com base em suas posições na tabela periódica, preveja qual tem a menor energia de primeira ionização: Li, Cs, N, F, I.
Q6.5.5
Com base em suas posições na tabela periódica, classifique os seguintes átomos em ordem crescente de energia de primeira ionização: F, Li, N, Rb
6.5.5
Rb < Li < N < F
Q6.5.6
Com base em suas posições na tabela periódica, classifique os seguintes átomos ou compostos em ordem crescente de energia de primeira ionização: Mg, O, S, Si
Q6.5.7
Átomos de qual grupo na tabela periódica têm uma configuração eletrônica de camada de valência de ns 2 np 3?
6.5.7
15 (5A)
Q6.5.8
Átomos de qual grupo na tabela periódica têm uma configuração eletrônica de camada de valência de ns 2?
Q6.5.9
Com base em suas posições na tabela periódica, liste os seguintes átomos em ordem crescente de raio: Mg, Ca, Rb, Cs.
6.5.9
Mg < Ca < Rb < Cs
Q6.5.10
Com base em suas posições na tabela periódica, liste os seguintes átomos em ordem crescente de raio: Sr, Ca, Si, Cl.
Q6.5.11
Com base em suas posições na tabela periódica, liste os seguintes íons em ordem crescente de raio: K +, Ca 2+, Al 3+, Si 4+.
6.5.11
Si 4+ < Al 3+ < Ca 2+ < K +
Q6.5.12
Liste os seguintes íons em ordem crescente de raio: Li +, Mg 2+, Br —, Te 2—.
Q6.5.13
Qual átomo e/ou íon é (são) isoeletrônico com Br +: Se 2+, Se, As —, Kr, Ga 3+, Cl —?
S6.5.13
Se, As -
Q6.5.14
Qual dos seguintes átomos e íons é (são) isoeletrônico com S 2+: Si 4+, Cl 3+, Ar, As 3+, Si, Al 3+?
Q6.5.15
Compare o número de prótons e elétrons presentes em cada um para classificar os seguintes íons em ordem crescente de raio: As 3—, Br —, K +, Mg 2+.
S6.5.15
Mg 2+ < K + < Br — < As 3—
Q6.5.16
Dos cinco elementos Al, Cl, I, Na, Rb, qual tem a reação mais exotérmica? (E representa um átomo.) Qual nome é dado à energia da reação? Dica: observe que o processo descrito não corresponde à afinidade eletrônica
\(\ce{E+}(g)+\ce{e-}⟶\ce{E}(g)\)
Q6.5.17
Of the five elements Sn, Si, Sb, O, Te, which has the most endothermic reaction? (E represents an atom.) What name is given to the energy for the reaction?
\[\ce{E}(g)⟶\ce{E+}(g)+\ce{e-}\]
S6.5.17
O, IE1
Q6.5.18
The ionic radii of the ions S2–, Cl–, and K+ are 184, 181, 138 pm respectively. Explain why these ions have different sizes even though they contain the same number of electrons.
Q6.5.19
Which main group atom would be expected to have the lowest second ionization energy?
S6.5.19
Ra
Q6.5.20
Explain why Al is a member of group 13 rather than group 3?


