2.3: Carbono
- Page ID
- 181888
Habilidades para desenvolver
- Explique por que o carbono é importante para a vida
- Descreva o papel dos grupos funcionais nas moléculas biológicas
As células são feitas de muitas moléculas complexas chamadas macromoléculas, como proteínas, ácidos nucléicos (RNA e DNA), carboidratos e lipídios. As macromoléculas são um subconjunto de moléculas orgânicas (qualquer líquido, sólido ou gás contendo carbono) que são especialmente importantes para a vida. O componente fundamental de todas essas macromoléculas é o carbono. O átomo de carbono tem propriedades únicas que lhe permitem formar ligações covalentes com até quatro átomos diferentes, tornando esse elemento versátil ideal para servir como componente estrutural básico, ou “espinha dorsal”, das macromoléculas.
Átomos de carbono individuais têm uma camada eletrônica externa incompleta. Com um número atômico de 6 (seis elétrons e seis prótons), os dois primeiros elétrons preenchem a camada interna, deixando quatro na segunda camada. Portanto, os átomos de carbono podem formar até quatro ligações covalentes com outros átomos para satisfazer a regra do octeto. A molécula de metano fornece um exemplo: tem a fórmula química CH 4. Cada um de seus quatro átomos de hidrogênio forma uma única ligação covalente com o átomo de carbono ao compartilhar um par de elétrons. Isso resulta em uma concha externa preenchida.
Hidrocarbonetos
Os hidrocarbonetos são moléculas orgânicas que consistem inteiramente de carbono e hidrogênio, como o metano (CH 4) descrito acima. Costumamos usar hidrocarbonetos em nossas vidas diárias como combustíveis, como o propano em uma churrasqueira a gás ou o butano em um isqueiro. As muitas ligações covalentes entre os átomos nos hidrocarbonetos armazenam uma grande quantidade de energia, que é liberada quando essas moléculas são queimadas (oxidadas). O metano, um excelente combustível, é a molécula de hidrocarboneto mais simples, com um átomo de carbono central ligado a quatro átomos de hidrogênio diferentes, conforme ilustrado na Figura\(\PageIndex{1}\). A geometria da molécula de metano, onde os átomos residem em três dimensões, é determinada pela forma de seus orbitais de elétrons. Os carbonos e os quatro átomos de hidrogênio formam uma forma conhecida como tetraedro, com quatro faces triangulares; por esse motivo, o metano é descrito como tendo geometria tetraédrica.
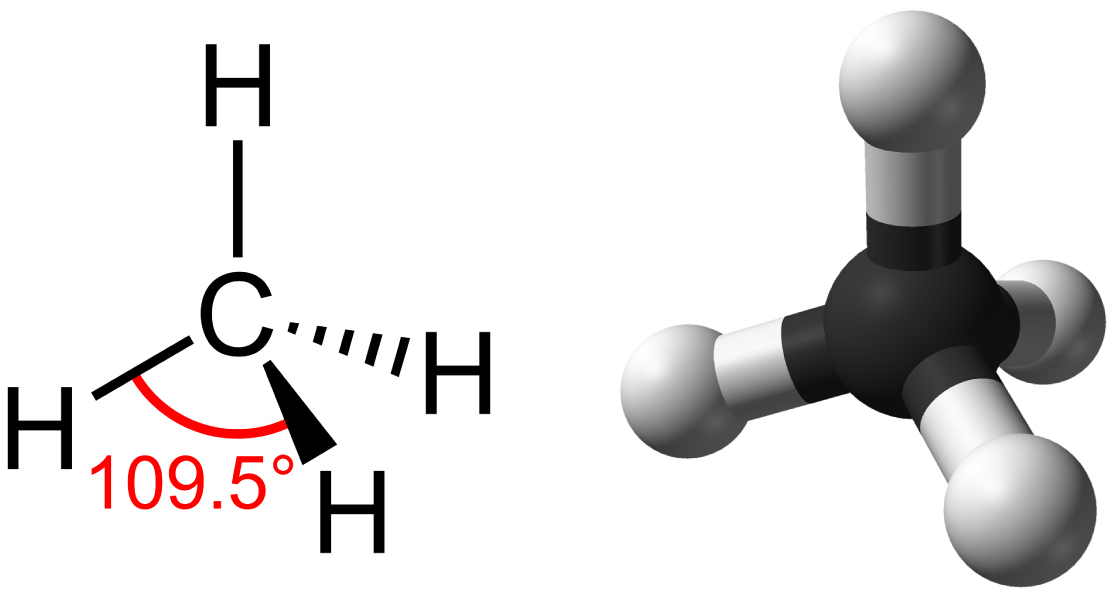
Como espinha dorsal das grandes moléculas de seres vivos, os hidrocarbonetos podem existir como cadeias lineares de carbono, anéis de carbono ou combinações de ambos. Além disso, ligações individuais de carbono a carbono podem ser ligações covalentes simples, duplas ou triplas, e cada tipo de ligação afeta a geometria da molécula de uma maneira específica. Essa forma ou conformação tridimensional das grandes moléculas da vida (macromoléculas) é fundamental para o funcionamento delas.
Cadeias de hidrocarbonetos
As cadeias de hidrocarbonetos são formadas por ligações sucessivas entre átomos de carbono e podem ser ramificadas ou não ramificadas. Além disso, a geometria geral da molécula é alterada pelas diferentes geometrias de ligações covalentes simples, duplas e triplas, ilustradas na Figura\(\PageIndex{2}\). Os hidrocarbonetos etano, eteno e etino servem como exemplos de como diferentes ligações carbono-carbono afetam a geometria da molécula. Os nomes das três moléculas começam com o prefixo “eth-”, que é o prefixo de dois hidrocarbonetos de carbono. Os sufixos “-ane”, “-ene” e “-yne” referem-se à presença de ligações carbono-carbono simples, duplas ou triplas, respectivamente. Assim, propano, propeno e propino seguem o mesmo padrão com três moléculas de carbono, butano, butano e butino para quatro moléculas de carbono, e assim por diante. Ligações duplas e triplas alteram a geometria da molécula: ligações simples permitem a rotação ao longo do eixo da ligação, enquanto ligações duplas levam a uma configuração plana e ligações triplas a uma linear. Essas geometrias têm um impacto significativo na forma que uma determinada molécula pode assumir.
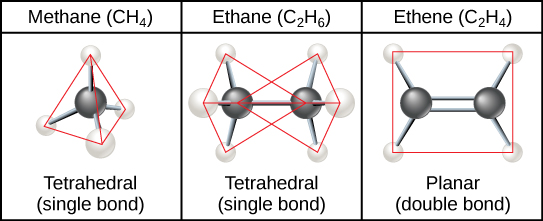
Anéis de hidrocarbonetos
Até agora, os hidrocarbonetos que discutimos foram hidrocarbonetos alifáticos, que consistem em cadeias lineares de átomos de carbono. Outro tipo de hidrocarboneto, os hidrocarbonetos aromáticos, consiste em anéis fechados de átomos de carbono. Estruturas em anel são encontradas em hidrocarbonetos, às vezes com a presença de ligações duplas, o que pode ser visto comparando a estrutura do ciclohexano com o benzeno na Figura\(\PageIndex{3}\). Exemplos de moléculas biológicas que incorporam o anel de benzeno incluem alguns aminoácidos e colesterol e seus derivados, incluindo os hormônios estrogênio e testosterona. O anel de benzeno também é encontrado no herbicida 2,4-D. O benzeno é um componente natural do petróleo bruto e foi classificado como cancerígeno. Alguns hidrocarbonetos têm porções alifáticas e aromáticas; o betacaroteno é um exemplo desse hidrocarboneto.
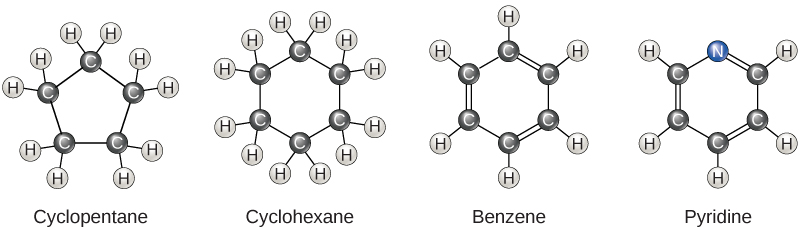
Isômeros
O posicionamento tridimensional de átomos e ligações químicas dentro de moléculas orgânicas é fundamental para entender sua química. Moléculas que compartilham a mesma fórmula química, mas diferem na localização (estrutura) de seus átomos e/ou ligações químicas, são conhecidas como isômeros. Isômeros estruturais (como butano e isobuteno mostrados na Figura\(\PageIndex{4}\) a) diferem na colocação de suas ligações covalentes: ambas as moléculas têm quatro carbonos e dez hidrogênios (C 4 H 10), mas o arranjo diferente dos átomos dentro das moléculas leva a diferenças em suas propriedades químicas. Por exemplo, devido às suas diferentes propriedades químicas, o butano é adequado para uso como combustível para isqueiros e tochas, enquanto o isobuteno é adequado para uso como refrigerante e propelente em latas de spray.
Os isômeros geométricos, por outro lado, têm posicionamentos semelhantes de suas ligações covalentes, mas diferem na forma como essas ligações são feitas aos átomos circundantes, especialmente nas ligações duplas carbono-carbono. Na molécula simples buteno (C 4 H 8), os dois grupos metil (CH 3) podem estar em ambos os lados da ligação dupla covalente central à molécula, conforme ilustrado na Figura\(\PageIndex{4}\) b. Quando os carbonos estão ligados no mesmo lado da ligação dupla, este é o cis configuração; se estiverem em lados opostos da ligação dupla, é uma configuração trans. Na configuração trans, os carbonos formam uma estrutura mais ou menos linear, enquanto os carbonos na configuração cis fazem uma curva (mudança de direção) da espinha dorsal do carbono.
Conexão artística

Qual das seguintes afirmações é falsa?
- Moléculas com as fórmulas CH 3 CH 2 COOH e C 3 H 6 O 2 podem ser isômeros estruturais.
- As moléculas devem ter uma ligação dupla para serem isômeros cis-trans.
- Para ser enantiômeros, uma molécula deve ter pelo menos três átomos ou grupos diferentes conectados a um carbono central.
- Para ser enantiômeros, uma molécula deve ter pelo menos quatro átomos ou grupos diferentes conectados a um carbono central.
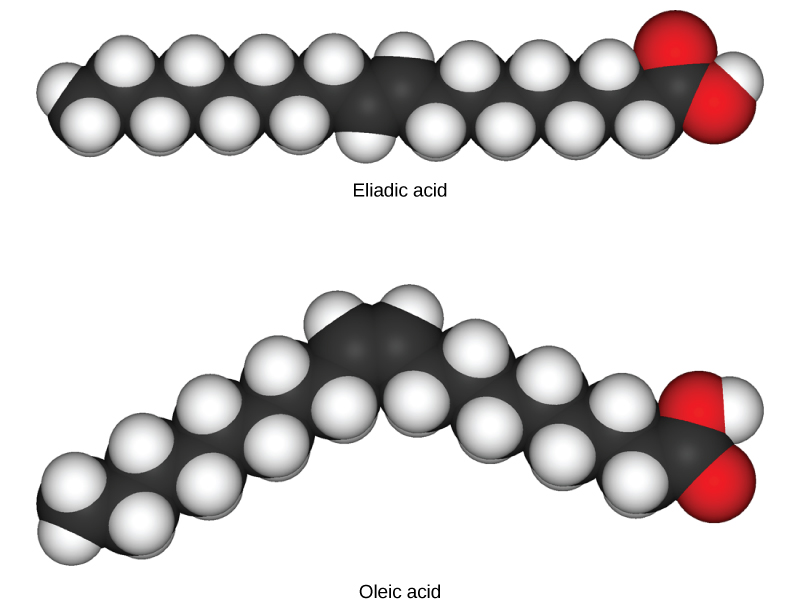
Em triglicérides (gorduras e óleos), cadeias longas de carbono conhecidas como ácidos graxos podem conter ligações duplas, que podem estar na configuração cis ou trans, ilustradas na Figura\(\PageIndex{5}\). Gorduras com pelo menos uma ligação dupla entre átomos de carbono são gorduras insaturadas. Quando algumas dessas ligações estão na configuração cis, a curvatura resultante na espinha dorsal de carbono da cadeia significa que as moléculas de triglicérides não podem se compactar firmemente e, portanto, permanecem líquidas (óleo) à temperatura ambiente. Por outro lado, os triglicérides com ligações duplas trans (popularmente chamadas de gorduras trans) têm ácidos graxos relativamente lineares que são capazes de se unir à temperatura ambiente e formar gorduras sólidas. Na dieta humana, as gorduras trans estão associadas a um risco aumentado de doenças cardiovasculares; portanto, muitos fabricantes de alimentos reduziram ou eliminaram seu uso nos últimos anos. Em contraste com as gorduras insaturadas, os triglicérides sem ligações duplas entre os átomos de carbono são chamados de gorduras saturadas, o que significa que eles contêm todos os átomos de hidrogênio disponíveis. As gorduras saturadas são sólidas à temperatura ambiente e geralmente de origem animal.
Enantiômeros
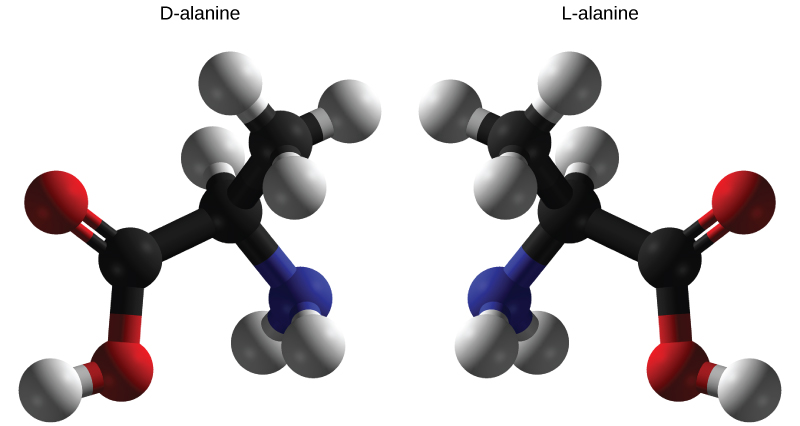
Enantiômeros são moléculas que compartilham a mesma estrutura química e ligações químicas, mas diferem no posicionamento tridimensional dos átomos, de forma que sejam imagens espelhadas. Conforme mostrado na Figura\(\PageIndex{6}\), um exemplo de aminoácido alanina, as duas estruturas não são sobrepostas. Na natureza, apenas as formas L dos aminoácidos são usadas para produzir proteínas. Algumas formas D de aminoácidos são vistas nas paredes celulares das bactérias, mas nunca em suas proteínas. Da mesma forma, a forma D da glicose é o principal produto da fotossíntese e a forma L da molécula raramente é vista na natureza.
Grupos funcionais
Grupos funcionais são grupos de átomos que ocorrem dentro das moléculas e conferem propriedades químicas específicas a essas moléculas. Eles são encontrados ao longo da “espinha dorsal de carbono” das macromoléculas. Essa espinha dorsal de carbono é formada por cadeias e/ou anéis de átomos de carbono com a substituição ocasional de um elemento como nitrogênio ou oxigênio. Moléculas com outros elementos em sua estrutura de carbono são hidrocarbonetos substituídos.
Os grupos funcionais em uma macromolécula geralmente estão ligados à estrutura do carbono em um ou vários lugares diferentes ao longo de sua estrutura em cadeia e/ou anel. Cada um dos quatro tipos de macromoléculas - proteínas, lipídios, carboidratos e ácidos nucléicos - tem seu próprio conjunto característico de grupos funcionais que contribui muito para suas diferentes propriedades químicas e sua função nos organismos vivos.
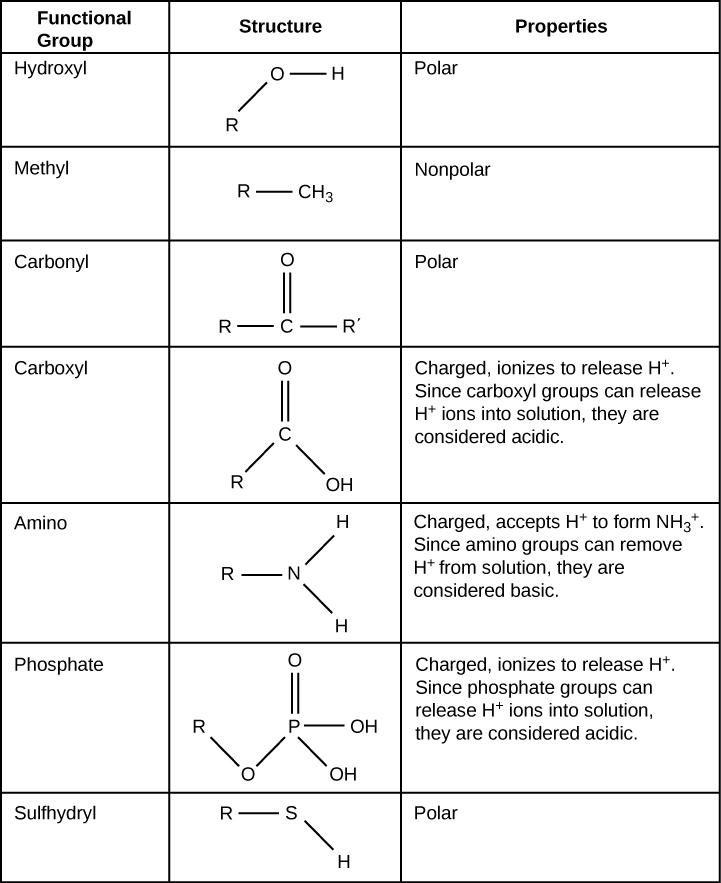
Um grupo funcional pode participar de reações químicas específicas. Alguns dos grupos funcionais importantes nas moléculas biológicas são mostrados na Figura\(\PageIndex{7}\); eles incluem: hidroxil, metil, carbonil, carboxil, amino, fosfato e sulfidril. Esses grupos desempenham um papel importante na formação de moléculas como DNA, proteínas, carboidratos e lipídios. Os grupos funcionais geralmente são classificados como hidrofóbicos ou hidrofílicos, dependendo de suas características de carga ou polaridade. Um exemplo de grupo hidrofóbico é a molécula não polar de metano. Entre os grupos funcionais hidrofílicos está o grupo carboxila encontrado nos aminoácidos, em algumas cadeias laterais de aminoácidos e nos ácidos graxos que formam triglicérides e fosfolipídios. Esse grupo carboxila ioniza para liberar íons de hidrogênio (H +) do grupo COOH, resultando no grupo COO - carregado negativamente; isso contribui para a natureza hidrofílica de qualquer molécula em que seja encontrada. Outros grupos funcionais, como o grupo carbonila, têm um átomo de oxigênio parcialmente carregado negativamente que pode formar ligações de hidrogênio com moléculas de água, novamente tornando a molécula mais hidrofílica.
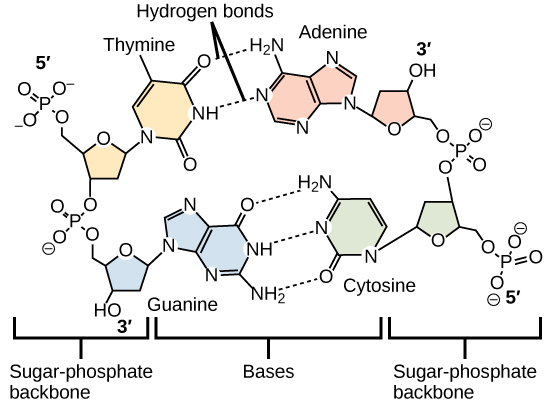
As ligações de hidrogênio entre grupos funcionais (dentro da mesma molécula ou entre moléculas diferentes) são importantes para o funcionamento de muitas macromoléculas e as ajudam a se dobrar adequadamente e manter a forma apropriada para o funcionamento. As ligações de hidrogênio também estão envolvidas em vários processos de reconhecimento, como o emparelhamento de bases complementares de DNA e a ligação de uma enzima ao seu substrato, conforme ilustrado na Figura\(\PageIndex{8}\).
Resumo
As propriedades únicas do carbono fazem dele uma parte central das moléculas biológicas. O carbono se liga ao oxigênio, hidrogênio e nitrogênio covalentemente para formar as muitas moléculas importantes para a função celular. O carbono tem quatro elétrons em sua camada mais externa e pode formar quatro ligações. O carbono e o hidrogênio podem formar cadeias ou anéis de hidrocarbonetos. Grupos funcionais são grupos de átomos que conferem propriedades específicas às cadeias ou anéis de hidrocarbonetos (ou hidrocarbonetos substituídos) que definem suas características e funções químicas gerais.
Conexões artísticas
Figura\(\PageIndex{4}\): Qual das seguintes afirmações é falsa?
- Moléculas com as fórmulas CH 3 CH 2 COOH e C 3 H 6 O 2 podem ser isômeros estruturais.
- As moléculas devem ter uma ligação dupla para serem isômeros cis - trans.
- Para ser enantiômeros, uma molécula deve ter pelo menos três átomos ou grupos diferentes conectados a um carbono central.
- Para ser enantiômeros, uma molécula deve ter pelo menos quatro átomos ou grupos diferentes conectados a um carbono central.
- Responda
-
C
Glossário
- hidrocarboneto alifático
- hidrocarboneto constituído por uma cadeia linear de átomos de carbono
- hidrocarboneto aromático
- hidrocarboneto constituído por anéis fechados de átomos de carbono
- enantiômeros
- moléculas que compartilham estrutura geral e padrões de ligação, mas diferem na forma como os átomos são colocados tridimensionalmente, de forma que sejam imagens espelhadas um do outro
- grupo funcional
- grupo de átomos que fornece ou transmite uma função específica a um esqueleto de carbono
- isômero geométrico
- isômero com padrões de ligação semelhantes que diferem na colocação de átomos ao lado de uma ligação covalente dupla
- hidrocarbonetos
- molécula que consiste apenas em carbono e hidrogênio
- isômeros
- moléculas que diferem umas das outras, embora compartilhem a mesma fórmula química
- molécula orgânica
- qualquer molécula contendo carbono (exceto dióxido de carbono)
- isômeros estruturais
- moléculas que compartilham uma fórmula química, mas diferem na colocação de suas ligações químicas
- hidrocarboneto substituído
- cadeia ou anel de hidrocarbonetos contendo um átomo de outro elemento no lugar de um dos carbonos da espinha dorsal


