2.2: Água
- Page ID
- 181887
Habilidades para desenvolver
- Descreva as propriedades da água que são essenciais para manter a vida
- Explique por que a água é um excelente solvente
- Forneça exemplos das propriedades coesas e adesivas da água
- Discuta o papel dos ácidos, bases e tampões na homeostase
Por que os cientistas passam tempo procurando água em outros planetas? Por que a água é tão importante? É porque a água é essencial para a vida como a conhecemos. A água é uma das moléculas mais abundantes e a mais crítica para a vida na Terra. Aproximadamente 60 a 70 por cento do corpo humano é composto de água. Sem ela, a vida como a conhecemos simplesmente não existiria.
A polaridade da molécula de água e sua ligação de hidrogênio resultante fazem da água uma substância única com propriedades especiais que estão intimamente ligadas aos processos da vida. A vida evoluiu originalmente em um ambiente aquoso, e a maior parte da química celular e do metabolismo de um organismo ocorre dentro do conteúdo aquoso do citoplasma da célula. As propriedades especiais da água são sua alta capacidade térmica e calor de vaporização, sua capacidade de dissolver moléculas polares, suas propriedades coesivas e adesivas e sua dissociação em íons que levam à geração de pH. Compreender essas características da água ajuda a elucidar sua importância na manutenção da vida.
Polaridade da água
Uma das propriedades importantes da água é que ela é composta por moléculas polares: o hidrogênio e o oxigênio dentro das moléculas de água (H 2 O) formam ligações polares covalentes. Embora não haja carga líquida em uma molécula de água, a polaridade da água cria uma carga levemente positiva no hidrogênio e uma carga levemente negativa no oxigênio, contribuindo para as propriedades de atração da água. As cargas da água são geradas porque o oxigênio é mais eletronegativo do que o hidrogênio, tornando mais provável que um elétron compartilhado seja encontrado próximo ao núcleo de oxigênio do que o núcleo de hidrogênio, gerando assim a carga negativa parcial próxima ao oxigênio.
Como resultado da polaridade da água, cada molécula de água atrai outras moléculas de água por causa das cargas opostas entre as moléculas de água, formando ligações de hidrogênio. A água também atrai ou é atraída por outras moléculas polares e íons. Uma substância polar que interage prontamente ou se dissolve na água é chamada de hidrofílica (hidro- = “água”; -fílica = “amorosa”). Em contraste, moléculas não polares, como óleos e gorduras, não interagem bem com a água, como mostrado na Figura,\(\PageIndex{1}\) e se separam dela em vez de se dissolverem nela, como vemos em molhos para salada contendo óleo e vinagre (uma solução de água ácida). Esses compostos não polares são chamados de hidrofóbicos (hidro- = “água”; -fóbico = “medo”).

Estados da água: gás, líquido e sólido
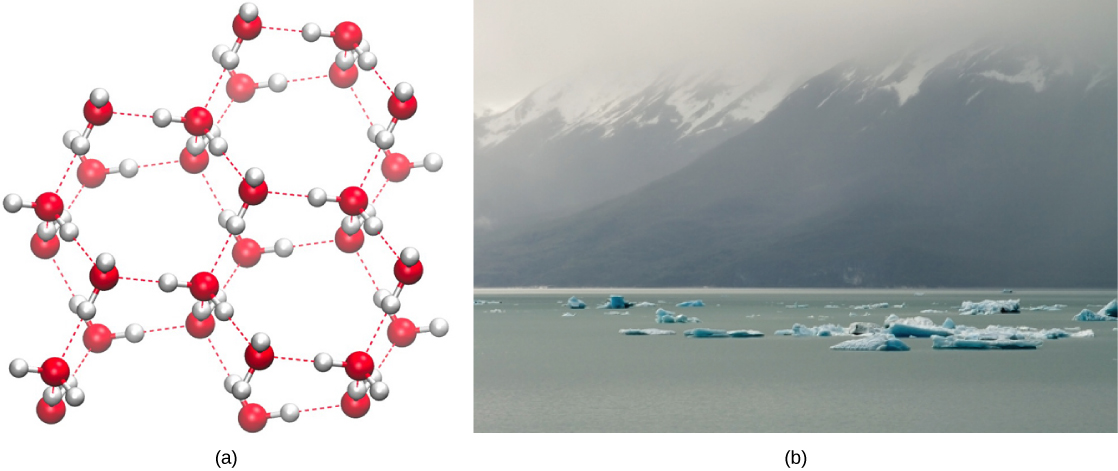
A formação de ligações de hidrogênio é uma qualidade importante da água líquida que é crucial para a vida como a conhecemos. Como as moléculas de água formam ligações de hidrogênio umas com as outras, a água assume algumas características químicas únicas em comparação com outros líquidos e, como os seres vivos têm um alto teor de água, entender essas características químicas é fundamental para entender a vida. Na água líquida, as ligações de hidrogênio são constantemente formadas e quebradas à medida que as moléculas de água deslizam umas sobre as outras. A quebra dessas ligações é causada pelo movimento (energia cinética) das moléculas de água devido ao calor contido no sistema. Quando o calor aumenta à medida que a água é fervida, a maior energia cinética das moléculas de água faz com que as ligações de hidrogênio se quebrem completamente e permite que as moléculas de água escapem para o ar como gás (vapor ou vapor de água). Por outro lado, quando a temperatura da água é reduzida e a água congela, as moléculas de água formam uma estrutura cristalina mantida pela ligação de hidrogênio (não há energia suficiente para romper as ligações de hidrogênio) que torna o gelo menos denso que a água líquida, fenômeno não visto na solidificação de outros líquidos.
A menor densidade da água em sua forma sólida se deve à forma como as ligações de hidrogênio são orientadas à medida que ela congela: as moléculas de água são afastadas mais em comparação com a água líquida. Com a maioria dos outros líquidos, a solidificação quando a temperatura cai inclui a redução da energia cinética entre as moléculas, permitindo que elas se acumulem ainda mais firmemente do que na forma líquida e dando ao sólido uma densidade maior do que o líquido.
A menor densidade do gelo, ilustrada e ilustrada na Figura\(\PageIndex{2}\), uma anomalia, faz com que ele flutue na superfície da água líquida, como em um iceberg ou nos cubos de gelo em um copo de água gelada. Em lagos e lagoas, o gelo se formará na superfície da água, criando uma barreira isolante que protege os animais e a vida vegetal da lagoa do congelamento. Sem essa camada de gelo isolante, as plantas e os animais que vivem na lagoa congelariam no bloco sólido de gelo e não poderiam sobreviver. O efeito prejudicial do congelamento nos organismos vivos é causado pela expansão do gelo em relação à água líquida. Os cristais de gelo que se formam ao congelar rompem as delicadas membranas essenciais para o funcionamento das células vivas, danificando-as irreversivelmente. As células só sobreviverão ao congelamento se a água contida nelas for temporariamente substituída por outro líquido como o glicerol.
Link para o aprendizado

Vídeo: Clique aqui para ver uma animação 3D da estrutura de uma rede de gelo. (Crédito da imagem: Jane Whitney. Imagem criada usando o software Visual Molecular Dynamics VMD. 2)
Alta capacidade calorífica da água
A alta capacidade térmica da água é uma propriedade causada pela ligação de hidrogênio entre as moléculas de água. A água tem a maior capacidade térmica específica de qualquer líquido. O calor específico é definido como a quantidade de calor que um grama de uma substância deve absorver ou perder para alterar sua temperatura em um grau Celsius. Para a água, essa quantidade é de uma caloria. Portanto, a água leva muito tempo para aquecer e muito tempo para esfriar. De fato, a capacidade térmica específica da água é cerca de cinco vezes maior que a da areia. Isso explica por que a terra esfria mais rápido que o mar. Devido à sua alta capacidade calorífica, a água é usada por animais de sangue quente para dispersar mais uniformemente o calor em seus corpos: ela age de forma semelhante ao sistema de resfriamento de um carro, transportando calor de locais quentes para locais frios, fazendo com que o corpo mantenha uma temperatura mais uniforme.
O calor da vaporização da água
A água também tem um alto calor de vaporização, a quantidade de energia necessária para transformar um grama de uma substância líquida em um gás. Uma quantidade considerável de energia térmica (586 cal) é necessária para realizar essa mudança na água. Esse processo ocorre na superfície da água. À medida que a água líquida esquenta, a ligação de hidrogênio dificulta a separação das moléculas de água líquida umas das outras, o que é necessário para que ela entre em sua fase gasosa (vapor). Como resultado, a água atua como um dissipador de calor ou reservatório de calor e requer muito mais calor para ferver do que um líquido como o etanol (álcool de grãos), cuja ligação de hidrogênio com outras moléculas de etanol é mais fraca do que a ligação de hidrogênio da água. Eventualmente, quando a água atinge seu ponto de ebulição de 100° Celsius (212° Fahrenheit), o calor é capaz de quebrar as ligações de hidrogênio entre as moléculas de água, e a energia cinética (movimento) entre as moléculas de água permite que elas escapem do líquido como um gás. Mesmo quando estão abaixo do ponto de ebulição, as moléculas individuais da água adquirem energia suficiente de outras moléculas de água para que algumas moléculas de água superficial possam escapar e se vaporizar: esse processo é conhecido como evaporação.
O fato de que as ligações de hidrogênio precisam ser quebradas para que a água evapore significa que uma quantidade substancial de energia é usada no processo. À medida que a água evapora, a energia é absorvida pelo processo, resfriando o ambiente onde a evaporação está ocorrendo. Em muitos organismos vivos, inclusive em humanos, a evaporação do suor, que é 90% de água, permite que o organismo esfrie para que a homeostase da temperatura corporal possa ser mantida.
Propriedades do solvente da água
Como a água é uma molécula polar com cargas levemente positivas e levemente negativas, íons e moléculas polares podem se dissolver facilmente nela. Portanto, a água é chamada de solvente, uma substância capaz de dissolver outras moléculas polares e compostos iônicos. As cargas associadas a essas moléculas formarão ligações de hidrogênio com a água, envolvendo a partícula com moléculas de água. Isso é conhecido como uma esfera de hidratação, ou uma casca de hidratação, conforme ilustrado na Figura
Assista a este vídeo para obter uma explicação direta sobre o pH e sua escala logarítmica.
Então, como organismos cujos corpos precisam de um pH quase neutro podem ingerir substâncias ácidas e básicas (um ser humano bebendo suco de laranja, por exemplo) e sobreviver? Os amortecedores são a chave. Os amortecedores absorvem prontamente o excesso de H + ou OH —, mantendo o pH do corpo cuidadosamente mantido na faixa estreita necessária para a sobrevivência. Manter um pH constante no sangue é fundamental para o bem-estar de uma pessoa. O tampão que mantém o pH do sangue humano envolve ácido carbônico (H 2 CO 3), íon bicarbonato (HCO 3 —) e dióxido de carbono (CO 2). Quando os íons bicarbonato se combinam com íons de hidrogênio livres e se tornam ácido carbônico, os íons de hidrogênio são removidos, moderando as mudanças de pH Da mesma forma, conforme mostrado na Figura\(\PageIndex{8}\), o excesso de ácido carbônico pode ser convertido em gás dióxido de carbono e expirado pelos pulmões. Isso evita que muitos íons livres de hidrogênio se acumulem no sangue e reduzam perigosamente o pH do sangue. Da mesma forma, se muito OH — for introduzido no sistema, o ácido carbônico se combinará com ele para criar bicarbonato, diminuindo o pH. Sem esse sistema de amortecimento, o pH do corpo flutuaria o suficiente para colocar a sobrevivência em risco.
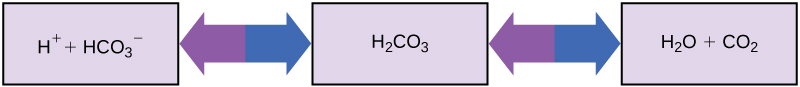
Outros exemplos de tampões são os antiácidos usados para combater o excesso de ácido estomacal. Muitos desses medicamentos vendidos sem receita médica funcionam da mesma forma que os amortecedores de sangue, geralmente com pelo menos um íon capaz de absorver hidrogênio e moderar o pH, trazendo alívio para aqueles que sofrem de “azia” após comer. As propriedades únicas da água que contribuem para essa capacidade de equilibrar o pH, bem como outras características da água, são essenciais para manter a vida na Terra.
Link para o aprendizado

Para saber mais sobre a água. Visite o Serviço Geológico de Ciência da Água dos EUA para escolas All About Water! site.
Resumo
A água tem muitas propriedades que são essenciais para manter a vida. É uma molécula polar, permitindo a formação de ligações de hidrogênio. As ligações de hidrogênio permitem que íons e outras moléculas polares se dissolvam na água. Portanto, a água é um excelente solvente. As ligações de hidrogênio entre as moléculas de água fazem com que a água tenha uma alta capacidade térmica, o que significa que é preciso muito calor adicional para elevar sua temperatura. À medida que a temperatura aumenta, as ligações de hidrogênio entre a água se quebram continuamente e se formam de novo. Isso permite que a temperatura geral permaneça estável, embora a energia seja adicionada ao sistema. A água também apresenta um alto calor de vaporização, que é fundamental para a forma como os organismos se resfriam pela evaporação do suor. As forças coesivas da água permitem a propriedade de tensão superficial, enquanto suas propriedades adesivas são vistas à medida que a água sobe dentro dos tubos capilares. O valor do pH é uma medida da concentração de íons hidrogênio em uma solução e é uma das muitas características químicas altamente reguladas em organismos vivos por meio da homeostase. Ácidos e bases podem alterar os valores de pH, mas os tampões tendem a moderar as mudanças que causam. Essas propriedades da água estão intimamente ligadas aos processos bioquímicos e físicos realizados pelos organismos vivos, e a vida seria muito diferente se essas propriedades fossem alteradas, se é que poderiam existir.
Notas de pé
- 1 W. Humphrey W., A. Dalke e K. Schulten, “VMD — Visual Molecular Dynamics”, Journal of Molecular Graphics 14 (1996): 33-38.
- 2 W. Humphrey W., A. Dalke e K. Schulten, “VMD — Visual Molecular Dynamics”, Journal of Molecular Graphics 14 (1996): 33-38.
Glossário
- ácido
- molécula que doa íons hidrogênio e aumenta a concentração de íons hidrogênio em uma solução
- adesão
- atração entre moléculas de água e outras moléculas
- base
- molécula que doa íons hidróxido ou de outra forma se liga ao excesso de íons de hidrogênio e diminui a concentração de íons de hidrogênio em uma solução
- amortecedor
- substância que impede uma mudança no pH absorvendo ou liberando íons hidrogênio ou hidróxido
- caloria
- quantidade de calor necessária para alterar a temperatura de um grama de água em um grau Celsius
- ação capilar
- ocorre porque as moléculas de água são atraídas por cargas nas superfícies internas de estruturas tubulares estreitas, como tubos de vidro, puxando as moléculas de água para as laterais dos tubos
- coesão
- forças intermoleculares entre moléculas de água causadas pela natureza polar da água; responsáveis pela tensão superficial
- dissociação
- liberação de um íon de uma molécula tal que a molécula original agora consiste em um íon e os restos carregados do original, como quando a água se dissocia em H + e OH -
- evaporação
- separação de moléculas individuais da superfície de um corpo de água, das folhas de uma planta ou da pele de um organismo
- calor de vaporização da água
- alta quantidade de energia necessária para que a água líquida se transforme em vapor de água
- hidrofílico
- descreve íons ou moléculas polares que interagem bem com outras moléculas polares, como a água
- hidrofóbico
- descreve moléculas não polares não carregadas que não interagem bem com moléculas polares, como a água
- papel tornassol
- (também, papel de pH) papel de filtro que foi tratado com um corante natural solúvel em água que muda de cor à medida que o pH do ambiente muda para que possa ser usado como indicador de pH
- Papel de pH
- veja papel tornassol
- escala de pH
- escala variando de zero a 14 que é inversamente proporcional à concentração de íons de hidrogênio em uma solução
- solvente
- substância capaz de dissolver outra substância
- capacidade térmica específica
- a quantidade de calor que um grama de uma substância deve absorver ou perder para alterar sua temperatura em um grau Celsius
- esfera de hidratação
- quando uma molécula de água polar envolve moléculas carregadas ou polares, mantendo-as dissolvidas e em solução
- tensão superficial
- tensão na superfície de um corpo de líquido que impede a separação das moléculas; criada pelas forças coesivas atraentes entre as moléculas do líquido


