2.1: Átomos, isótopos, íons e moléculas - Os blocos de construção
- Page ID
- 181902
Habilidades para desenvolver
- Defina matéria e elementos
- Descreva a inter-relação entre prótons, nêutrons e elétrons
- Compare as maneiras pelas quais os elétrons podem ser doados ou compartilhados entre átomos
- Explique as maneiras pelas quais os elementos que ocorrem naturalmente se combinam para criar moléculas, células, tecidos, sistemas orgânicos e organismos
Em seu nível mais fundamental, a vida é feita de matéria. A matéria é qualquer substância que ocupa espaço e tem massa. Elementos são formas únicas de matéria com propriedades químicas e físicas específicas que não podem ser decompostas em substâncias menores por meio de reações químicas comuns. Existem 118 elementos, mas apenas 92 ocorrem naturalmente. Os elementos restantes são sintetizados em laboratórios e são instáveis.
Cada elemento é designado por seu símbolo químico, que é uma única letra maiúscula ou, quando a primeira letra já está “tomada” por outro elemento, uma combinação de duas letras. Alguns elementos seguem o termo em inglês para o elemento, como C para carbono e Ca para cálcio. Os símbolos químicos de outros elementos derivam de seus nomes latinos; por exemplo, o símbolo do sódio é Na, referindo-se a natrium, a palavra latina para sódio.
Os quatro elementos comuns a todos os organismos vivos são oxigênio (O), carbono (C), hidrogênio (H) e nitrogênio (N). No mundo não vivo, os elementos são encontrados em proporções diferentes, e alguns elementos comuns aos organismos vivos são relativamente raros na Terra como um todo, conforme mostrado na Tabela\(\PageIndex{1}\). Por exemplo, a atmosfera é rica em nitrogênio e oxigênio, mas contém pouco carbono e hidrogênio, enquanto a crosta terrestre, embora contenha oxigênio e uma pequena quantidade de hidrogênio, tem pouco nitrogênio e carbono. Apesar de suas diferenças de abundância, todos os elementos e as reações químicas entre eles obedecem às mesmas leis químicas e físicas, independentemente de fazerem parte do mundo vivo ou não vivo.
| Elemento | Vida (Humanos) | Atmosfera | Crosta terrestre |
|---|---|---|---|
| Oxigênio (O) | 65% | 21% | 46% |
| Carbono (C) | 18% | traço | traço |
| Hidrogênio (H) | 10% | traço | 0,1% |
| Nitrogênio (N) | 3% | 78% | traço |
A estrutura do átomo
Para entender como os elementos se unem, devemos primeiro discutir o menor componente ou bloco de construção de um elemento, o átomo. Um átomo é a menor unidade de matéria que retém todas as propriedades químicas de um elemento. Por exemplo, um átomo de ouro tem todas as propriedades do ouro, pois é um metal sólido à temperatura ambiente. Uma moeda de ouro é simplesmente um grande número de átomos de ouro moldados na forma de uma moeda e contendo pequenas quantidades de outros elementos conhecidos como impurezas. Os átomos de ouro não podem ser divididos em nada menor, mantendo as propriedades do ouro.
Um átomo é composto por duas regiões: o núcleo, que está no centro do átomo e contém prótons e nêutrons, e a região mais externa do átomo que mantém seus elétrons em órbita ao redor do núcleo, conforme ilustrado na Figura\(\PageIndex{1}\). Os átomos contêm prótons, elétrons e nêutrons, entre outras partículas subatômicas. A única exceção é o hidrogênio (H), que é feito de um próton e um elétron sem nêutrons.
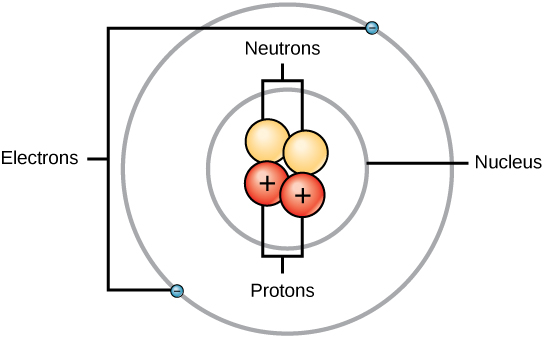
Prótons e nêutrons têm aproximadamente a mesma massa, cerca de 1,67 × 10 -24 gramas. Os cientistas definem arbitrariamente essa quantidade de massa como uma unidade de massa atômica (amu) ou um Dalton, conforme mostrado na Tabela\(\PageIndex{2}\). Embora semelhantes em massa, prótons e nêutrons diferem em sua carga elétrica. Um próton tem carga positiva, enquanto um nêutron não está carregado. Portanto, o número de nêutrons em um átomo contribui significativamente para sua massa, mas não para sua carga. Os elétrons são muito menores em massa do que os prótons, pesando apenas 9,11 × 10 -28 gramas, ou cerca de 1/1800 de uma unidade de massa atômica. Portanto, eles não contribuem muito para a massa atômica geral de um elemento. Portanto, ao considerar a massa atômica, costuma-se ignorar a massa de qualquer elétron e calcular a massa do átomo com base apenas no número de prótons e nêutrons. Embora não contribuam significativamente para a massa, os elétrons contribuem muito para a carga do átomo, pois cada elétron tem uma carga negativa igual à carga positiva de um próton. Em átomos neutros não carregados, o número de elétrons orbitando o núcleo é igual ao número de prótons dentro do núcleo. Nesses átomos, as cargas positivas e negativas se cancelam mutuamente, levando a um átomo sem carga líquida.
Considerando os tamanhos de prótons, nêutrons e elétrons, a maior parte do volume de um átomo - maior que 99 por cento - é, na verdade, espaço vazio. Com todo esse espaço vazio, pode-se perguntar por que os chamados objetos sólidos não passam simplesmente um pelo outro. A razão pela qual não o fazem é que os elétrons que cercam todos os átomos são carregados negativamente e as cargas negativas se repelem.
| Cobrança | Missa (amu) | Localização | |
|---|---|---|---|
| Próton | +1 | 1 | núcleo |
| Nêutron | 0 | 1 | núcleo |
| Elétron | —1 | 0 | orbitais |
Número atômico e massa
Os átomos de cada elemento contêm um número característico de prótons e elétrons. O número de prótons determina o número atômico de um elemento e é usado para distinguir um elemento do outro. O número de nêutrons é variável, resultando em isótopos, que são formas diferentes do mesmo átomo que variam apenas no número de nêutrons que possuem. Juntos, o número de prótons e o número de nêutrons determinam o número de massa de um elemento, conforme ilustrado na Figura\(\PageIndex{2}\). Observe que a pequena contribuição da massa dos elétrons é desconsiderada no cálculo do número de massa. Essa aproximação de massa pode ser usada para calcular facilmente quantos nêutrons um elemento tem simplesmente subtraindo o número de prótons do número de massa. Como os isótopos de um elemento terão números de massa ligeiramente diferentes, os cientistas também determinam a massa atômica, que é a média calculada do número de massa de seus isótopos naturais. Muitas vezes, o número resultante contém uma fração. Por exemplo, a massa atômica do cloro (Cl) é 35,45 porque o cloro é composto por vários isótopos, alguns (a maioria) com massa atômica 35 (17 prótons e 18 nêutrons) e alguns com massa atômica 37 (17 prótons e 20 nêutrons).
Conexão artística
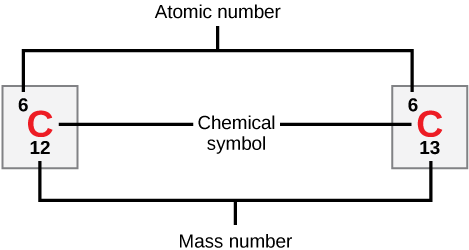
Quantos nêutrons o carbono-12 e o carbono-13 têm, respectivamente?
Isótopos
Isótopos são formas diferentes de um elemento que tem o mesmo número de prótons, mas um número diferente de nêutrons. Alguns elementos, como carbono, potássio e urânio, têm isótopos naturais. O carbono-12 contém seis prótons, seis nêutrons e seis elétrons; portanto, tem um número de massa de 12 (seis prótons e seis nêutrons). O carbono-14 contém seis prótons, oito nêutrons e seis elétrons; sua massa atômica é 14 (seis prótons e oito nêutrons). Essas duas formas alternativas de carbono são isótopos. Alguns isótopos podem emitir nêutrons, prótons e elétrons e atingir uma configuração atômica mais estável (menor nível de energia potencial); são isótopos radioativos ou radioisótopos. O decaimento radioativo (nêutrons que perdem carbono 14 para eventualmente se tornar carbono-12) descreve a perda de energia que ocorre quando o núcleo de um átomo instável libera radiação.
Conexão de evolução: Datação por carbono
O carbono está normalmente presente na atmosfera na forma de compostos gasosos como dióxido de carbono e metano. O carbono-14 (\(\ce C^{14}\)) é um radioisótopo natural criado na atmosfera a partir da atmosfera\(\ce N^{14}\) (nitrogênio) pela adição de um nêutron e pela perda de um próton devido aos raios cósmicos. Esse é um processo contínuo, então sempre\(\ce C^{14}\) há mais coisas sendo criadas. Como um organismo vivo se incorpora\(\ce C^{14}\) inicialmente como dióxido de carbono fixado no processo de fotossíntese, a quantidade relativa de\(\ce C^{14}\) em seu corpo é igual à concentração de\(\ce C^{14}\) na atmosfera. Quando um organismo morre, não está mais ingerindo\(\ce C^{14}\), então a proporção entre\(\ce C^{14}\) e\(\ce C^{12}\) diminuirá à medida que\(\ce C^{14}\) decai gradualmente\(\ce N^{14}\) até um processo chamado decaimento beta - a emissão de elétrons ou pósitrons. Essa decadência emite energia em um processo lento.
Após aproximadamente 5.730 anos, metade da concentração inicial de\(\ce C^{14}\) terá sido convertida novamente em\(\ce N^{14}\). O tempo necessário para que metade da concentração original de um isótopo volte à sua forma mais estável é chamado de meia-vida. Porque a meia-vida de\(\ce C^{14}\) é longa, é usado para datar objetos anteriormente vivos, como ossos velhos ou madeira. Comparando a razão entre a\(\ce C^{14}\) concentração encontrada em um objeto e a quantidade\(\ce C^{14}\) detectada na atmosfera, a quantidade do isótopo que ainda não se decompôs pode ser determinada. Com base nessa quantidade, a idade do material, como o mamute pigmeu mostrado na Figura\(\PageIndex{3}\), pode ser calculada com precisão se não for muito maior do que cerca de 50.000 anos. Outros elementos têm isótopos com diferentes meias-vidas. Por exemplo,\(\ce K^{40}\) (potássio-40) tem meia-vida de 1,25 bilhão de anos e\(\ce U^{235}\) (Urânio 235) tem meia-vida de cerca de 700 milhões de anos. Por meio do uso de datação radiométrica, os cientistas podem estudar a idade dos fósseis ou outros restos de organismos extintos para entender como os organismos evoluíram de espécies anteriores.

Link para o aprendizado

Vídeo: Para saber mais sobre átomos, isótopos e como diferenciar um isótopo de outro, visite este site e execute a simulação.
A tabela periódica
Os diferentes elementos são organizados e exibidos na tabela periódica. Criada pelo químico russo Dmitri Mendeleev (1834—1907) em 1869, a tabela agrupa elementos que, embora únicos, compartilham certas propriedades químicas com outros elementos. As propriedades dos elementos são responsáveis por seu estado físico à temperatura ambiente: podem ser gases, sólidos ou líquidos. Os elementos também têm reatividade química específica, a capacidade de se combinarem e se ligarem quimicamente uns aos outros.
Na tabela periódica, mostrada na Figura
Vídeo: Assista a esta animação visual para ver a disposição espacial dos orbitais p e s.
Reações químicas e moléculas
Todos os elementos são mais estáveis quando sua camada mais externa é preenchida com elétrons de acordo com a regra do octeto. Isso ocorre porque é energeticamente favorável que os átomos estejam nessa configuração e isso os torna estáveis. No entanto, como nem todos os elementos têm elétrons suficientes para preencher suas camadas mais externas, os átomos formam ligações químicas com outros átomos, obtendo assim os elétrons de que precisam para atingir uma configuração eletrônica estável. Quando dois ou mais átomos se ligam quimicamente, a estrutura química resultante é uma molécula. A molécula de água familiar, H 2 O, consiste em dois átomos de hidrogênio e um átomo de oxigênio; estes se unem para formar água, conforme ilustrado na Figura\(\PageIndex{8}\). Os átomos podem formar moléculas doando, aceitando ou compartilhando elétrons para preencher suas camadas externas.
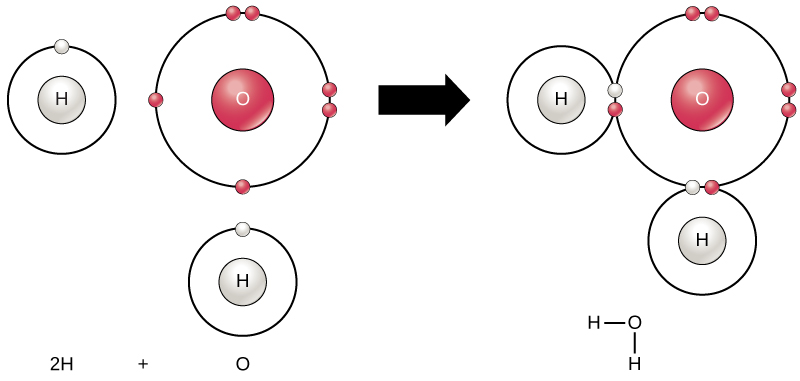
As reações químicas ocorrem quando dois ou mais átomos se unem para formar moléculas ou quando átomos ligados são separados. As substâncias usadas no início de uma reação química são chamadas de reagentes (geralmente encontradas no lado esquerdo de uma equação química), e as substâncias encontradas no final da reação são conhecidas como produtos (geralmente encontradas no lado direito de uma equação química). Normalmente, uma seta é desenhada entre os reagentes e os produtos para indicar a direção da reação química; essa direção nem sempre é uma “via de sentido único”. Para a criação da molécula de água mostrada acima, a equação química seria:
\[\ce{2H + O \rightarrow H_2O} \nonumber\]
Um exemplo de reação química simples é a quebra de moléculas de peróxido de hidrogênio, cada uma das quais consiste em dois átomos de hidrogênio ligados a dois átomos de oxigênio (H 2 O 2). O reagente peróxido de hidrogênio é decomposto em água, contendo um átomo de oxigênio ligado a dois átomos de hidrogênio (H 2 O) e oxigênio, que consiste em dois átomos de oxigênio ligados (O 2). Na equação abaixo, a reação inclui duas moléculas de peróxido de hidrogênio e duas moléculas de água. Este é um exemplo de uma equação química balanceada, em que o número de átomos de cada elemento é o mesmo em cada lado da equação. De acordo com a lei de conservação da matéria, o número de átomos antes e depois de uma reação química deve ser igual, de forma que nenhum átomo seja, em circunstâncias normais, criado ou destruído.
\[\ce{2H_2O_2\: (hydrogen\: peroxide) \rightarrow 2H_2O\: (water) + O_2\: (oxygen)} \nonumber\]
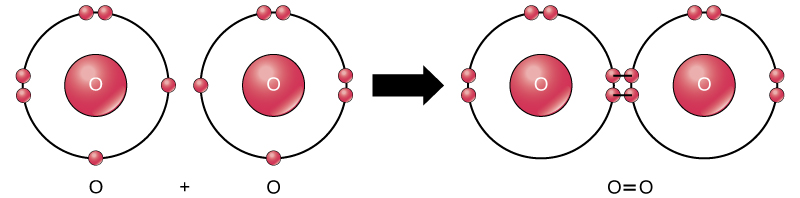
Embora todos os reagentes e produtos dessa reação sejam moléculas (cada átomo permanece ligado a pelo menos um outro átomo), nessa reação apenas o peróxido de hidrogênio e a água são representantes dos compostos: eles contêm átomos de mais de um tipo de elemento. O oxigênio molecular, por outro lado, conforme mostrado na Figura\(\PageIndex{9}\), consiste em dois átomos de oxigênio duplamente ligados e não é classificado como um composto, mas como uma molécula mononuclear.
Algumas reações químicas, como a mostrada acima, podem prosseguir em uma direção até que todos os reagentes se esgotem. As equações que descrevem essas reações contêm uma seta unidirecional e são irreversíveis. Reações reversíveis são aquelas que podem ir em qualquer direção. Em reações reversíveis, os reagentes são transformados em produtos, mas quando a concentração do produto ultrapassa um determinado limite (característico da reação específica), alguns desses produtos serão convertidos novamente em reagentes; nesse ponto, as designações de produtos e reagentes são revertidas. Essas idas e vindas continuam até que ocorra um certo equilíbrio relativo entre reagentes e produtos — um estado chamado equilíbrio. Essas situações de reações reversíveis são frequentemente indicadas por uma equação química com uma seta de duas pontas apontando para os reagentes e produtos.
Por exemplo, no sangue humano, o excesso de íons de hidrogênio (H +) se liga aos íons bicarbonato (HCO 3 -) formando um estado de equilíbrio com o ácido carbônico (H 2 CO 3). Se o ácido carbônico fosse adicionado a esse sistema, parte dele seria convertido em íons bicarbonato e hidrogênio.
\[\ce{HCO^{-}_3 + H^+ \leftrightarrow H_2CO_3} \nonumber\]
Em reações biológicas, no entanto, o equilíbrio raramente é obtido porque as concentrações dos reagentes ou produtos ou de ambos estão mudando constantemente, geralmente com um produto de uma reação sendo um reagente para outra. Voltando ao exemplo do excesso de íons de hidrogênio no sangue, a formação do ácido carbônico será a principal direção da reação. No entanto, o ácido carbônico também pode deixar o corpo como gás dióxido de carbono (via expiração) em vez de ser convertido novamente em íon bicarbonato, conduzindo assim a reação à direita pela lei química conhecida como lei de ação em massa. Essas reações são importantes para manter a homeostase do nosso sangue.
\[\ce{HCO_3^- + H^+ \leftrightarrow H_2CO_3 \leftrightarrow CO_2 + H_2O} \nonumber\]
Íons e ligações iônicas
Alguns átomos são mais estáveis quando ganham ou perdem um elétron (ou possivelmente dois) e formam íons. Isso preenche sua camada de elétrons mais externa e os torna energeticamente mais estáveis. Como o número de elétrons não é igual ao número de prótons, cada íon tem uma carga líquida. Os cátions são íons positivos que são formados pela perda de elétrons. Os íons negativos são formados pelo ganho de elétrons e são chamados de ânions. Os ânions são designados pelo nome elementar sendo alterado para terminar em “-ide”: o ânion do cloro é chamado de cloreto e o ânion do enxofre é chamado de sulfeto, por exemplo.
Esse movimento de elétrons de um elemento para outro é conhecido como transferência de elétrons. Como\(\PageIndex{10}\) ilustra a Figura, o sódio (Na) tem apenas um elétron em sua camada externa de elétrons. É preciso menos energia para o sódio doar esse elétron do que para aceitar mais sete elétrons para preencher a camada externa. Se o sódio perder um elétron, ele agora tem 11 prótons, 11 nêutrons e apenas 10 elétrons, deixando-o com uma carga geral de +1. Agora é chamado de íon sódio. O cloro (Cl) em seu estado de menor energia (chamado estado fundamental) tem sete elétrons em sua camada externa. Novamente, é mais eficiente em termos energéticos que o cloro ganhe um elétron do que perca sete. Portanto, ele tende a ganhar um elétron para criar um íon com 17 prótons, 17 nêutrons e 18 elétrons, dando a ele uma carga líquida negativa (—1). Agora é chamado de íon cloreto. Neste exemplo, o sódio doará seu único elétron para esvaziar sua camada, e o cloro aceitará esse elétron para preencher sua camada. Ambos os íons agora satisfazem a regra do octeto e têm camadas externas completas. Como o número de elétrons não é mais igual ao número de prótons, cada um agora é um íon e tem uma carga +1 (cátion sódio) ou —1 (ânion cloreto). Observe que essas transações normalmente só podem ocorrer simultaneamente: para que um átomo de sódio perca um elétron, ele deve estar na presença de um receptor adequado, como um átomo de cloro.
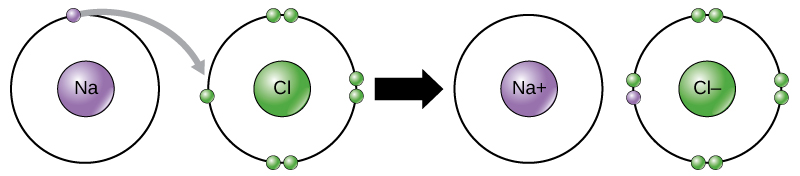
Ligações iônicas são formadas entre íons com cargas opostas. Por exemplo, íons de sódio carregados positivamente e íons cloreto carregados negativamente se unem para formar cristais de cloreto de sódio, ou sal de cozinha, criando uma molécula cristalina com carga líquida zero.
Certos sais são referidos na fisiologia como eletrólitos (incluindo sódio, potássio e cálcio), íons necessários para a condução do impulso nervoso, contrações musculares e equilíbrio hídrico. Muitas bebidas esportivas e suplementos dietéticos fornecem esses íons para substituir os perdidos do corpo devido à transpiração durante o exercício.
Ligações covalentes e outras ligações e interações
Outra forma pela qual a regra do octeto pode ser satisfeita é compartilhando elétrons entre átomos para formar ligações covalentes. Essas ligações são mais fortes e muito mais comuns do que as ligações iônicas nas moléculas dos organismos vivos. Ligações covalentes são comumente encontradas em moléculas orgânicas à base de carbono, como nosso DNA e proteínas. Ligações covalentes também são encontradas em moléculas inorgânicas como H 2 O, CO 2 e O 2. Um, dois ou três pares de elétrons podem ser compartilhados, formando ligações simples, duplas e triplas, respectivamente. Quanto mais ligações covalentes entre dois átomos, mais forte é sua conexão. Assim, as ligações triplas são as mais fortes.
A força dos diferentes níveis de ligação covalente é uma das principais razões pelas quais os organismos vivos têm dificuldade em adquirir nitrogênio para uso na construção de suas moléculas, embora o nitrogênio molecular, N 2, seja o gás mais abundante na atmosfera. O nitrogênio molecular consiste em dois átomos de nitrogênio triplamente ligados entre si e, como acontece com todas as moléculas, o compartilhamento desses três pares de elétrons entre os dois átomos de nitrogênio permite o preenchimento de suas camadas externas de elétrons, tornando a molécula mais estável do que os átomos individuais de nitrogênio. Essa forte ligação tripla dificulta que os sistemas vivos quebrem esse nitrogênio para usá-lo como constituinte de proteínas e DNA.
A formação de moléculas de água fornece um exemplo de ligação covalente. Os átomos de hidrogênio e oxigênio que se combinam para formar moléculas de água são unidos por ligações covalentes, conforme mostrado na Figura\(\PageIndex{8}\). O elétron do hidrogênio divide seu tempo entre a camada externa incompleta dos átomos de hidrogênio e a camada externa incompleta dos átomos de oxigênio. Para preencher completamente a camada externa de oxigênio, que tem seis elétrons em sua camada externa, mas que seria mais estável com oito, dois elétrons (um de cada átomo de hidrogênio) são necessários: daí a conhecida fórmula H 2 O. Os elétrons são compartilhados entre os dois elementos para preencher a camada externa de cada um, tornando os dois elementos mais estáveis.
Link para o aprendizado
Vídeo: Assista a este pequeno vídeo para ver uma animação da ligação iônica e covalente.
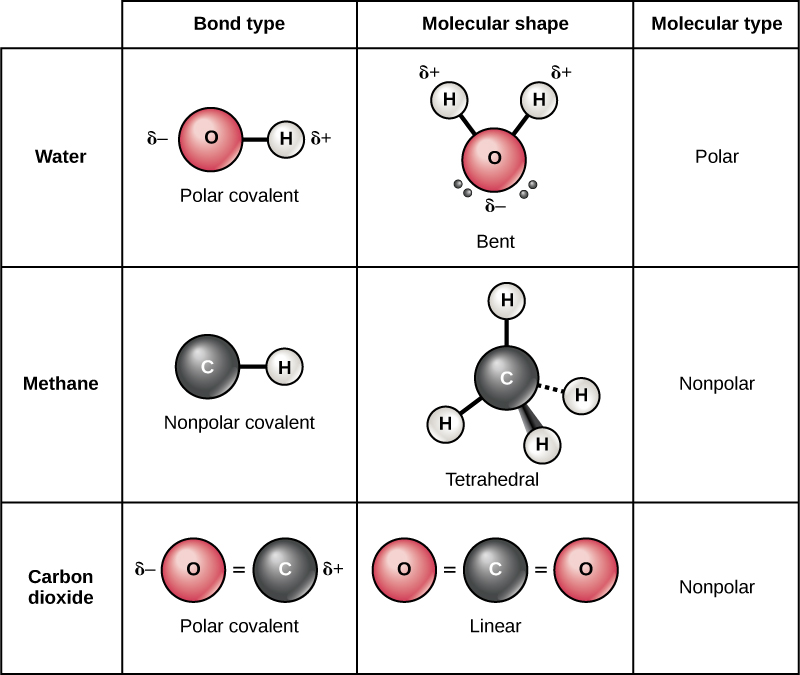
Ligações covalentes polares
Existem dois tipos de ligações covalentes: polares e não polares. Em uma ligação polar covalente, mostrada na Figura\(\PageIndex{11}\), os elétrons são compartilhados de forma desigual pelos átomos e são atraídos mais para um núcleo do que para o outro. Devido à distribuição desigual de elétrons entre os átomos de diferentes elementos, uma carga ligeiramente positiva (δ +) ou ligeiramente negativa (δ —) se desenvolve. Essa carga parcial é uma propriedade importante da água e é responsável por muitas de suas características.
A água é uma molécula polar, com os átomos de hidrogênio adquirindo uma carga positiva parcial e o oxigênio uma carga negativa parcial. Isso ocorre porque o núcleo do átomo de oxigênio é mais atraente para os elétrons dos átomos de hidrogênio do que o núcleo de hidrogênio é para os elétrons do oxigênio. Assim, o oxigênio tem uma eletronegatividade maior do que o hidrogênio e os elétrons compartilhados passam mais tempo nas proximidades do núcleo de oxigênio do que perto do núcleo dos átomos de hidrogênio, dando aos átomos de oxigênio e hidrogênio cargas ligeiramente negativas e positivas, respectivamente. Outra forma de afirmar isso é que a probabilidade de encontrar um elétron compartilhado perto de um núcleo de oxigênio é mais provável do que encontrá-lo perto de um núcleo de hidrogênio. De qualquer forma, a eletronegatividade relativa do átomo contribui para o desenvolvimento de cargas parciais sempre que um elemento é significativamente mais eletronegativo que o outro, e as cargas geradas por essas ligações polares podem então ser usadas para a formação de ligações de hidrogênio com base na atração do oposto cobranças parciais. (As ligações de hidrogênio, que são discutidas em detalhes abaixo, são ligações fracas entre átomos de hidrogênio levemente carregados positivamente e átomos levemente carregados negativamente em outras moléculas.) Como as macromoléculas geralmente têm átomos dentro delas que diferem em eletronegatividade, ligações polares geralmente estão presentes em moléculas orgânicas.
Ligações covalentes não polares
Ligações covalentes não polares se formam entre dois átomos do mesmo elemento ou entre elementos diferentes que compartilham elétrons igualmente. Por exemplo, o oxigênio molecular (O 2) não é polar porque os elétrons serão igualmente distribuídos entre os dois átomos de oxigênio.
Outro exemplo de ligação covalente não polar é o metano (CH 4), também mostrado na Figura\(\PageIndex{11}\). O carbono tem quatro elétrons em sua camada mais externa e precisa de mais quatro para preenchê-lo. Ele obtém esses quatro de quatro átomos de hidrogênio, cada átomo fornecendo um, formando uma camada externa estável de oito elétrons. Carbono e hidrogênio não têm a mesma eletronegatividade, mas são semelhantes; assim, ligações não polares se formam. Cada átomo de hidrogênio precisa de um elétron para sua camada mais externa, que é preenchida quando contém dois elétrons. Esses elementos compartilham os elétrons igualmente entre os átomos de carbono e hidrogênio, criando uma molécula covalente não polar.
Ligações de hidrogênio e interações de Van der Waals
Ligações iônicas e covalentes entre os elementos requerem energia para serem quebradas. As ligações iônicas não são tão fortes quanto as covalentes, o que determina seu comportamento nos sistemas biológicos. No entanto, nem todas as ligações são ligações iônicas ou covalentes. Ligações mais fracas também podem se formar entre as moléculas. Duas ligações fracas que ocorrem com frequência são as ligações de hidrogênio e as interações de van der Waals. Sem esses dois tipos de laços, a vida como a conhecemos não existiria. As ligações de hidrogênio fornecem muitas das propriedades críticas que sustentam a vida da água e também estabilizam as estruturas das proteínas e do DNA, o alicerce das células.
Quando ligações covalentes polares contendo hidrogênio se formam, o hidrogênio nessa ligação tem uma carga ligeiramente positiva porque o elétron do hidrogênio é puxado com mais força em direção ao outro elemento e para longe do hidrogênio. Como o hidrogênio é ligeiramente positivo, ele será atraído pelas cargas negativas vizinhas. Quando isso acontece, ocorre uma interação fraca entre o δ + do hidrogênio de uma molécula e a carga δ nos átomos mais eletronegativos de outra molécula, geralmente oxigênio ou nitrogênio, ou dentro da mesma molécula. Essa interação é chamada de ligação de hidrogênio. Esse tipo de ligação é comum e ocorre regularmente entre as moléculas de água. As ligações individuais de hidrogênio são fracas e facilmente quebradas; no entanto, elas ocorrem em grandes quantidades na água e nos polímeros orgânicos, criando uma grande força em combinação. As ligações de hidrogênio também são responsáveis por unir a dupla hélice do DNA.
Como as ligações de hidrogênio, as interações de van der Waals são atrações fracas ou interações entre moléculas. As atrações de Van der Waals podem ocorrer entre duas ou mais moléculas e dependem de pequenas flutuações nas densidades de elétrons, que nem sempre são simétricas em torno de um átomo. Para que essas atrações aconteçam, as moléculas precisam estar muito próximas umas das outras. Essas ligações - junto com as ligações iônicas, covalentes e de hidrogênio - contribuem para a estrutura tridimensional das proteínas em nossas células, necessária para seu funcionamento adequado.
Conexão de carreira: químico farmacêutico
Os químicos farmacêuticos são responsáveis pelo desenvolvimento de novos medicamentos e pela tentativa de determinar o modo de ação dos medicamentos antigos e novos. Eles estão envolvidos em todas as etapas do processo de desenvolvimento de medicamentos. Os medicamentos podem ser encontrados no ambiente natural ou podem ser sintetizados em laboratório. Em muitos casos, os medicamentos potenciais encontrados na natureza são alterados quimicamente em laboratório para torná-los mais seguros e eficazes, e às vezes as versões sintéticas dos medicamentos substituem a versão encontrada na natureza.
Após a descoberta ou síntese inicial de um medicamento, o químico então desenvolve o medicamento, talvez alterando-o quimicamente, testando-o para ver se o medicamento é tóxico e, em seguida, projetando métodos para uma produção eficiente em larga escala. Em seguida, inicia-se o processo de aprovação do medicamento para uso humano. Nos Estados Unidos, a aprovação de medicamentos é feita pela Food and Drug Administration (FDA) e envolve uma série de experimentos em grande escala usando seres humanos para garantir que o medicamento não seja prejudicial e trate eficazmente a condição que visa tratar. Esse processo geralmente leva vários anos e requer a participação de médicos e cientistas, além de químicos, para concluir os testes e obter aprovação.
Um exemplo de medicamento que foi originalmente descoberto em um organismo vivo é o Paclitaxel (Taxol), um medicamento anticâncer usado para tratar o câncer de mama. Esta droga foi descoberta na casca do teixo do Pacífico. Outro exemplo é a aspirina, originalmente isolada da casca do salgueiro. Encontrar medicamentos geralmente significa testar centenas de amostras de plantas, fungos e outras formas de vida para ver se algum composto biologicamente ativo é encontrado dentro delas. Às vezes, a medicina tradicional pode dar à medicina moderna pistas sobre onde um composto ativo pode ser encontrado. Por exemplo, o uso da casca do salgueiro para fazer remédios é conhecido há milhares de anos, remontando ao antigo Egito. No entanto, foi somente no final do século XIX que a molécula de aspirina, conhecida como ácido acetilsalicílico, foi purificada e comercializada para uso humano.
Ocasionalmente, descobriu-se que medicamentos desenvolvidos para um uso têm efeitos imprevistos que permitem que esses medicamentos sejam usados de outras formas não relacionadas. Por exemplo, o medicamento minoxidil (Rogaine) foi originalmente desenvolvido para tratar a hipertensão. Quando testado em humanos, percebeu-se que indivíduos que tomavam o medicamento criavam novos cabelos. Eventualmente, o medicamento foi comercializado para homens e mulheres com calvície para restaurar o cabelo perdido.
A carreira do farmacêutico químico pode envolver trabalho de detetive, experimentação e desenvolvimento de medicamentos, tudo com o objetivo de tornar os seres humanos mais saudáveis.
Resumo
Matéria é qualquer coisa que ocupe espaço e tenha massa. É feito de elementos. Todos os 92 elementos que ocorrem naturalmente têm qualidades únicas que permitem que eles se combinem de várias maneiras para criar moléculas, que por sua vez se combinam para formar células, tecidos, sistemas orgânicos e organismos. Os átomos, que consistem em prótons, nêutrons e elétrons, são as menores unidades de um elemento que retêm todas as propriedades desse elemento. Os elétrons podem ser transferidos, compartilhados ou causar disparidades de carga entre os átomos para criar ligações, incluindo ligações iônicas, covalentes e de hidrogênio, bem como interações de van der Waals.
Conexões artísticas
Figura\(\PageIndex{2}\): Quantos nêutrons o carbono-12 e o carbono-13 têm, respectivamente?
- Resposta
-
O carbono-12 tem seis nêutrons. O carbono-13 tem sete nêutrons.
Figura\(\PageIndex{6}\): Um átomo pode dar, receber ou compartilhar elétrons com outro átomo para obter uma camada de valência completa, a configuração eletrônica mais estável. Observando essa figura, quantos elétrons os elementos do grupo 1 precisam perder para alcançar uma configuração eletrônica estável? Quantos elétrons os elementos dos grupos 14 e 17 precisam ganhar para alcançar uma configuração estável?
- Resposta
-
Os elementos do grupo 1 precisam perder um elétron para obter uma configuração eletrônica estável. Os elementos dos grupos 14 e 17 precisam ganhar quatro e um elétrons, respectivamente, para obter uma configuração estável.
Glossário
- ânion
- íon negativo que é formado por um átomo ganhando um ou mais elétrons
- átomo
- a menor unidade de matéria que retém todas as propriedades químicas de um elemento
- massa atômica
- média calculada do número de massa dos isótopos de um elemento
- número atômico
- número total de prótons em um átomo
- equação química balanceada
- declaração de uma reação química com o número de cada tipo de átomo equalizado tanto para os produtos quanto para os reagentes
- catião
- íon positivo que é formado por um átomo que perde um ou mais elétrons
- ligação química
- interação entre dois ou mais átomos iguais ou diferentes que resulta na formação de moléculas
- reação química
- processo que leva ao rearranjo de átomos em moléculas
- reatividade química
- a capacidade de combinar e se unir quimicamente uns aos outros
- composto
- substância composta por moléculas que consistem em átomos de pelo menos dois elementos diferentes
- ligação covalente
- tipo de ligação forte formada entre dois elementos iguais ou diferentes; formas quando elétrons são compartilhados entre átomos
- eletrólito
- íon necessário para a condução do impulso nervoso, contrações musculares e equilíbrio hídrico
- elétron
- partícula subatômica carregada negativamente que reside fora do núcleo no orbital de elétrons; carece de massa funcional e tem uma carga negativa de —1 unidade
- configuração eletrônica
- arranjo de elétrons na camada de elétrons de um átomo (por exemplo, 1s 2 2s 2 2p 6)
- orbital eletrônico
- como os elétrons são distribuídos espacialmente ao redor do núcleo; a área onde um elétron tem maior probabilidade de ser encontrado
- transferência de elétrons
- movimento de elétrons de um elemento para outro; importante na criação de ligações iônicas
- eletronegatividade
- capacidade de alguns elementos de atrair elétrons (geralmente de átomos de hidrogênio), adquirindo cargas negativas parciais nas moléculas e criando cargas positivas parciais nos átomos de hidrogênio
- elemento
- uma das 118 substâncias únicas que não podem ser decompostas em substâncias menores; cada elemento tem propriedades únicas e um número específico de prótons
- equilíbrio
- estado estacionário do reagente relativo e concentração do produto em reações químicas reversíveis em um sistema fechado
- ligação de hidrogênio
- ligação fraca entre átomos de hidrogênio levemente carregados positivamente e átomos levemente carregados negativamente em outras moléculas
- gás inerte
- (também, gás nobre) elemento com camada externa de elétrons preenchida que não reage com outros átomos
- íon
- átomo ou grupo químico que não contém números iguais de prótons e elétrons
- ligação iônica
- ligação química que se forma entre íons com cargas opostas (cátions e ânions)
- reação química irreversível
- reação química em que os reagentes procedem unidirecionalmente para formar produtos
- isótopo
- uma ou mais formas de um elemento que têm números diferentes de nêutrons
- lei de ação em massa
- lei química afirmando que a taxa de uma reação é proporcional à concentração das substâncias que reagem
- número de massa
- número total de prótons e nêutrons em um átomo
- importam
- qualquer coisa que tenha massa e ocupe espaço
- molécula
- dois ou mais átomos ligados quimicamente
- nêutron
- partícula não carregada que reside no núcleo de um átomo; tem uma massa de um amu
- gás nobre
- veja gás inerte
- ligação covalente não polar
- tipo de ligação covalente que se forma entre os átomos quando os elétrons são compartilhados igualmente entre eles
- núcleo
- núcleo de um átomo; contém prótons e nêutrons
- regra do octeto
- regra de que os átomos são mais estáveis quando mantêm oito elétrons em suas camadas mais externas
- orbital
- região ao redor do núcleo; contém elétrons
- tabela periódica
- organograma de elementos indicando o número atômico e a massa atômica de cada elemento; fornece informações importantes sobre as propriedades dos elementos
- ligação covalente polar
- tipo de ligação covalente que se forma como resultado do compartilhamento desigual de elétrons, resultando na criação de regiões carregadas levemente positivas e levemente negativas da molécula
- produto
- molécula encontrada no lado direito de uma equação química
- próton
- partícula carregada positivamente que reside no núcleo de um átomo; tem uma massa de um amu e uma carga de +1
- radioisótopo
- isótopo que emite radiação composta por partículas subatômicas para formar elementos mais estáveis
- reagente
- molécula encontrada no lado esquerdo de uma equação química
- reação química reversível
- reação química que funciona bidirecionalmente, onde os produtos podem se transformar em reagentes se sua concentração for grande o suficiente
- concha de valência
- camada mais externa de um átomo
- interação de van der Waals
- interação muito fraca entre moléculas devido a cargas temporárias que atraem átomos muito próximos


