5.5: Formação de linhas espectrais
- Page ID
- 183550
Objetivos de
Ao final desta seção, você poderá:
- Explicar como os espectros da linha de emissão e os espectros da linha de absorção
- Descreva o que são os íons e como eles são formados
- Explique como as linhas espectrais e os níveis de ionização em um gás podem nos ajudar a determinar sua temperatura
Podemos usar o modelo do átomo de Bohr para entender como as linhas espectrais são formadas. O conceito de níveis de energia para as órbitas de elétrons em um átomo leva naturalmente a uma explicação de por que os átomos absorvem ou emitem apenas energias específicas ou comprimentos de onda de luz.
O espectro do hidrogênio
Vejamos o átomo de hidrogênio da perspectiva do modelo de Bohr. Suponha que um feixe de luz branca (que consiste em fótons de todos os comprimentos de onda visíveis) brilhe através de um gás de hidrogênio atômico. Um fóton de comprimento de onda de 656 nanômetros tem a energia certa para elevar um elétron em um átomo de hidrogênio da segunda para a terceira órbita. Assim, como todos os fótons de diferentes energias (ou comprimentos de onda ou cores) fluem pelos átomos de hidrogênio, fótons com esse comprimento de onda específico podem ser absorvidos pelos átomos cujos elétrons estão orbitando no segundo nível. Quando forem absorvidos, os elétrons do segundo nível passarão para o terceiro nível, e vários fótons desse comprimento de onda e energia estarão ausentes no fluxo geral de luz branca.
Outros fótons terão as energias certas para elevar elétrons da segunda para a quarta órbita, ou da primeira para a quinta órbita, e assim por diante. Somente fótons com essas energias exatas podem ser absorvidos. Todos os outros fótons passarão pelos átomos intocados. Assim, os átomos de hidrogênio absorvem a luz em apenas certos comprimentos de onda e produzem linhas escuras nesses comprimentos de onda no espectro que vemos.
Suponha que tenhamos um recipiente de gás hidrogênio através do qual toda uma série de fótons está passando, permitindo que muitos elétrons subam para níveis mais altos. Quando desligamos a fonte de luz, esses elétrons “caem” de órbitas maiores para pequenas e emitem fótons de luz, mas, novamente, apenas a luz dessas energias ou comprimentos de onda que correspondem à diferença de energia entre as órbitas permitidas. As mudanças orbitais dos elétrons de hidrogênio que dão origem a algumas linhas espectrais são mostradas na Figura\(\PageIndex{1}\).
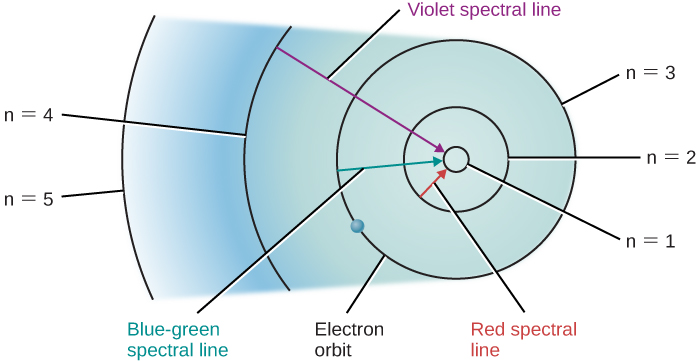
Imagens semelhantes podem ser desenhadas para outros átomos além do hidrogênio. No entanto, como esses outros átomos normalmente têm mais de um elétron cada, as órbitas de seus elétrons são muito mais complicadas e os espectros também são mais complexos. Para nossos propósitos, a principal conclusão é esta: cada tipo de átomo tem seu próprio padrão único de órbitas de elétrons, e não há dois conjuntos de órbitas exatamente iguais. Isso significa que cada tipo de átomo mostra seu próprio conjunto exclusivo de linhas espectrais, produzidas por elétrons se movendo entre seu conjunto exclusivo de órbitas.
Astrônomos e físicos trabalharam duro para aprender as linhas que acompanham cada elemento estudando a forma como os átomos absorvem e emitem luz em laboratórios aqui na Terra. Em seguida, eles podem usar esse conhecimento para identificar os elementos nos corpos celestes. Dessa forma, agora conhecemos a composição química não de qualquer estrela, mas até mesmo de galáxias de estrelas tão distantes que sua luz começou a chegar até nós muito antes mesmo da formação da Terra.
Níveis de energia e excitação
O modelo de Bohr do átomo de hidrogênio foi um grande avanço em nossa compreensão do átomo. No entanto, sabemos hoje que os átomos não podem ser representados por uma imagem tão simples. Por exemplo, o conceito de órbitas de elétrons bem definidas não está realmente correto; no entanto, no nível desse curso introdutório, a noção de que apenas certas energias discretas são permitidas para um átomo é muito útil. Os níveis de energia que estamos discutindo podem ser considerados como representando certas distâncias médias das possíveis órbitas do elétron em relação ao núcleo atômico.
Normalmente, um átomo está no estado de menor energia possível, seu estado fundamental. No modelo de Bohr do átomo de hidrogênio, o estado fundamental corresponde ao elétron estar na órbita mais interna. Um átomo pode absorver energia, o que a eleva a um nível de energia mais alto (correspondendo, na imagem simples de Bohr, ao movimento de um elétron para uma órbita maior) - isso é chamado de excitação. Diz-se então que o átomo está em um estado excitado. Geralmente, um átomo permanece excitado por pouco tempo. Depois de um curto intervalo, normalmente cerca de um centésimo milionésimo de segundo, ele volta espontaneamente ao estado fundamental, com a emissão simultânea de luz. O átomo pode retornar ao seu estado mais baixo em um salto, ou pode fazer a transição em etapas de dois ou mais saltos, parando em níveis intermediários na descida. A cada salto, ele emite um fóton do comprimento de onda que corresponde à diferença de energia entre os níveis no início e no final desse salto.
Um diagrama do nível de energia para um átomo de hidrogênio e várias transições atômicas possíveis são mostrados na Figura\(\PageIndex{2}\). Quando medimos as energias envolvidas à medida que o átomo salta entre os níveis, descobrimos que as transições de ou para o estado fundamental, chamadas de série Lyman de linhas, resultam na emissão ou absorção de fótons ultravioleta. Mas as transições de ou para o primeiro estado excitado (marcado como n = 2 na parte (a) da Figura\(\PageIndex{2}\)), chamadas de série Balmer, produzem emissão ou absorção na luz visível. Na verdade, foi para explicar essa série de Balmer que Bohr sugeriu pela primeira vez seu modelo do átomo.
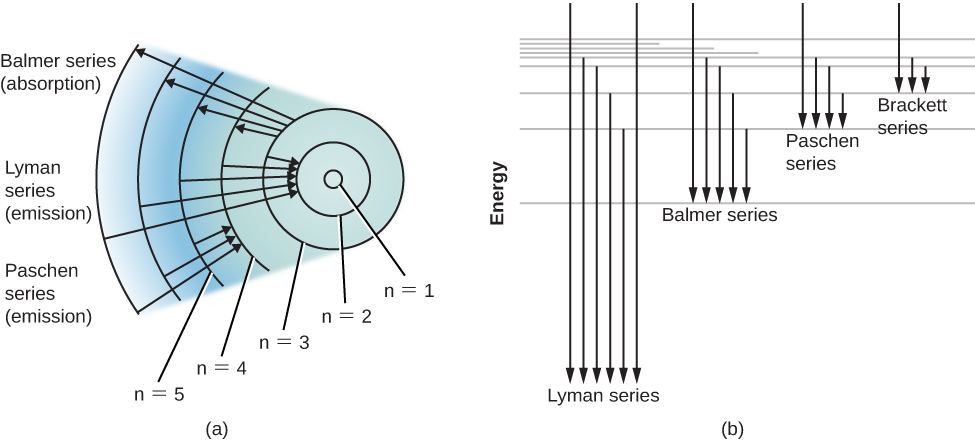
Átomos que absorveram fótons específicos de um feixe de luz branca que passa e, portanto, ficam excitados geralmente se desexcitam e emitem essa luz novamente em um tempo muito curto. Você pode se perguntar, então, por que linhas espectrais escuras são produzidas. Em outras palavras, por que essa luz reemitida não “preenche” rapidamente as linhas de absorção mais escuras?
Imagine um feixe de luz branca vindo em sua direção através de um gás mais frio. Parte da luz reemitida é, na verdade, devolvida ao feixe de luz branca que você vê, mas isso preenche as linhas de absorção apenas em uma pequena extensão. A razão é que os átomos do gás reemitem luz em todas as direções, e apenas uma pequena fração da luz reemitida está na direção do feixe original (em sua direção). Em uma estrela, grande parte da luz reemitida na verdade vai em direções que levam de volta à estrela, o que faz com que os observadores fora da estrela não sejam nada bons.
A figura\(\PageIndex{3}\) resume os diferentes tipos de espectros que discutimos. Uma lâmpada incandescente produz um espectro contínuo. Quando esse espectro contínuo é visto através de uma nuvem de gás mais fina, um espectro de linha de absorção pode ser visto sobreposto ao espectro contínuo. Se olharmos apenas para uma nuvem de átomos de gás excitados (sem nenhuma fonte contínua vista por trás dela), veremos que os átomos excitados emitem um espectro de linha de emissão.
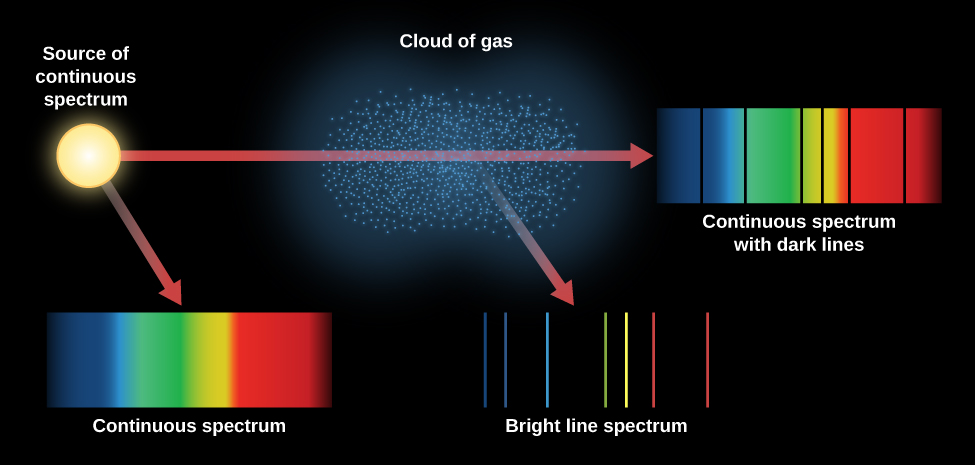
Os átomos em um gás quente estão se movendo em altas velocidades e colidindo continuamente uns com os outros e com quaisquer elétrons soltos. Eles podem ser excitados (elétrons se movendo para um nível mais alto) e desexcitados (elétrons se movendo para um nível mais baixo) por essas colisões, bem como absorvendo e emitindo luz. A velocidade dos átomos em um gás depende da temperatura. Quando a temperatura é mais alta, também aumentam a velocidade e a energia das colisões. Quanto mais quente o gás, portanto, maior a probabilidade de os elétrons ocuparem as órbitas mais externas, que correspondem aos maiores níveis de energia. Isso significa que o nível em que os elétrons iniciam seus saltos ascendentes em um gás pode servir como um indicador de quão quente esse gás está. Dessa forma, as linhas de absorção em um espectro fornecem aos astrônomos informações sobre a temperatura das regiões de origem das linhas.
Use essa simulação para brincar com um átomo de hidrogênio e ver o que acontece quando os elétrons se movem para níveis mais altos e, em seguida, emitem fótons à medida que vão para um nível mais baixo.
Ionização
Descrevemos como certas quantidades discretas de energia podem ser absorvidas por um átomo, elevando-o a um estado excitado e movendo um de seus elétrons para mais longe de seu núcleo. Se energia suficiente for absorvida, o elétron pode ser completamente removido do átomo — isso é chamado de ionização. Diz-se então que o átomo está ionizado. A quantidade mínima de energia necessária para remover um elétron de um átomo em seu estado fundamental é chamada de energia de ionização.
Quantidades ainda maiores de energia devem ser absorvidas pelo átomo agora ionizado (chamado de íon) para remover um elétron adicional mais profundo na estrutura do átomo. Energias sucessivamente maiores são necessárias para remover o terceiro, quarto, quinto - e assim por diante - elétrons do átomo. Se houver energia suficiente disponível, um átomo pode ficar completamente ionizado, perdendo todos os seus elétrons. Um átomo de hidrogênio, com apenas um elétron a perder, pode ser ionizado apenas uma vez; um átomo de hélio pode ser ionizado duas vezes; e um átomo de oxigênio até oito vezes. Quando examinamos regiões do cosmos onde há uma grande quantidade de radiação energética, como os bairros onde estrelas quentes jovens se formaram recentemente, vemos muita ionização acontecendo.
Um átomo que se tornou ionizado positivamente perdeu uma carga negativa - o elétron ausente - e, portanto, fica com uma carga positiva líquida. Portanto, exerce uma forte atração em qualquer elétron livre. Eventualmente, um ou mais elétrons serão capturados e o átomo se tornará neutro (ou ionizado em um grau a menos) novamente. Durante o processo de captura de elétrons, o átomo emite um ou mais fótons. Quais fótons são emitidos depende se o elétron é capturado de uma só vez até o nível de energia mais baixo do átomo ou para em um ou mais níveis intermediários em seu caminho para o nível mais baixo disponível.
Assim como a excitação de um átomo pode resultar de uma colisão com outro átomo, íon ou elétron (as colisões com elétrons geralmente são as mais importantes), o mesmo acontece com a ionização. A taxa na qual essas ionizações colisionais ocorrem depende das velocidades dos átomos e, portanto, da temperatura do gás — quanto mais quente o gás, mais átomos serão ionizados.
A taxa na qual íons e elétrons se recombinam também depende de suas velocidades relativas, ou seja, da temperatura. Além disso, depende da densidade do gás: quanto maior a densidade, maior a chance de recaptura, porque os diferentes tipos de partículas estão mais aglomerados. A partir do conhecimento da temperatura e densidade de um gás, é possível calcular a fração de átomos que foram ionizados uma, duas vezes e assim por diante. No Sol, por exemplo, descobrimos que a maioria dos átomos de hidrogênio e hélio em sua atmosfera são neutros, enquanto a maioria dos átomos de cálcio, assim como muitos outros átomos mais pesados, são ionizados uma vez.
Os níveis de energia de um átomo ionizado são totalmente diferentes dos do mesmo átomo quando ele é neutro. Cada vez que um elétron é removido do átomo, os níveis de energia do íon e, portanto, os comprimentos de onda das linhas espectrais que ele pode produzir mudam. Isso ajuda os astrônomos a diferenciar os íons de um determinado elemento. O hidrogênio ionizado, sem elétron, não pode produzir linhas de absorção.
Conceitos principais e resumo
Quando os elétrons passam de um nível de energia mais alto para um mais baixo, os fótons são emitidos e uma linha de emissão pode ser vista no espectro. As linhas de absorção são vistas quando os elétrons absorvem fótons e se movem para níveis mais altos de energia. Como cada átomo tem seu próprio conjunto característico de níveis de energia, cada um está associado a um padrão único de linhas espectrais. Isso permite que os astrônomos determinem quais elementos estão presentes nas estrelas e nas nuvens de gás e poeira entre as estrelas. Um átomo em seu nível de energia mais baixo está no estado fundamental. Se um elétron estiver em uma órbita diferente da menos energética possível, diz-se que o átomo está excitado. Se um átomo perdeu um ou mais elétrons, ele é chamado de íon e é considerado ionizado. Os espectros de íons diferentes parecem diferentes e podem informar os astrônomos sobre as temperaturas das fontes que eles estão observando.
Glossário
- excitação
- o processo de dar a um átomo ou íon uma quantidade de energia maior do que ele tem em seu estado de menor energia (fundamental)
- estado fundamental
- o estado de energia mais baixo de um átomo
- íon
- um átomo que se tornou eletricamente carregado pela adição ou perda de um ou mais elétrons
- ionização
- o processo pelo qual um átomo ganha ou perde elétrons


