5.4: A estrutura do átomo
- Page ID
- 183537
objetivos de aprendizagem
Ao final desta seção, você poderá:
- Descreva a estrutura dos átomos e os componentes dos núcleos
- Explicar o comportamento dos elétrons dentro dos átomos e como os elétrons interagem com a luz para se mover entre os níveis de energia
A ideia de que a matéria é composta por partículas minúsculas chamadas átomos tem pelo menos 25 séculos. No entanto, demorou até o século XX para que os cientistas inventassem instrumentos que lhes permitissem sondar dentro de um átomo e descobrirem que ele não é, como se pensava, duro e indivisível. Em vez disso, o átomo é uma estrutura complexa composta por partículas ainda menores.
Sondando o átomo
A primeira dessas partículas menores foi descoberta pelo físico britânico James (J. J.) Thomson em 1897. Chamada de elétron, essa partícula tem carga negativa. (É o fluxo dessas partículas que produz correntes de eletricidade, seja nos raios ou nos fios que levam à sua lâmpada.) Como um átomo em seu estado normal é eletricamente neutro, cada elétron em um átomo deve ser balanceado pela mesma quantidade de carga positiva.
A próxima etapa foi determinar onde no átomo as cargas positivas e negativas estão localizadas. Em 1911, o físico britânico Ernest Rutherford desenvolveu um experimento que forneceu parte da resposta a essa pergunta. Ele bombardeou um pedaço extremamente fino de folha de ouro, com apenas cerca de 400 átomos de espessura, com um feixe de partículas alfa (Figura\(\PageIndex{1}\)). Partículas alfa (partículas α) são átomos de hélio que perderam seus elétrons e, portanto, são carregados positivamente. A maioria dessas partículas passou pela folha de ouro como se ela e os átomos nela fossem quase um espaço vazio. Cerca de 1 em 8000 das partículas alfa, no entanto, inverteu completamente a direção e saltou para trás da folha. Rutherford escreveu: “Foi o evento mais incrível que já aconteceu comigo na minha vida. Foi quase tão incrível como se você tivesse disparado um projétil de 15 polegadas em um pedaço de lenço de papel e ele voltasse e batesse em você.”
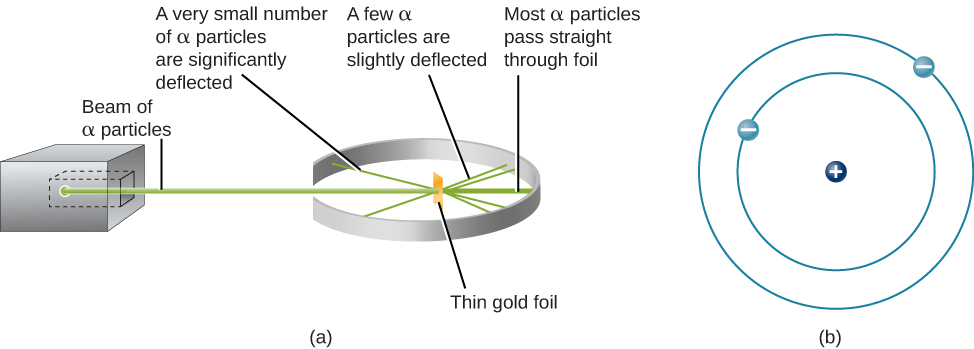
A única maneira de explicar as partículas que inverteram a direção quando atingiram a folha de ouro era supor que quase toda a massa, assim como toda a carga positiva em cada átomo de ouro individual, está concentrada em um pequeno centro ou núcleo. Quando uma partícula alfa de carga positiva atinge um núcleo, ela inverte a direção, assim como uma bola branca inverte a direção quando atinge outra bola de bilhar. O modelo de Rutherford colocou o outro tipo de carga — os elétrons negativos — em órbita ao redor desse núcleo.
O modelo de Rutherford exigia que os elétrons estivessem em movimento. Cargas positivas e negativas se atraem, então elétrons estacionários cairiam no núcleo positivo. Além disso, como os elétrons e o núcleo são extremamente pequenos, a maior parte do átomo está vazia, e é por isso que quase todas as partículas de Rutherford conseguiram passar direto pela folha de ouro sem colidir com nada. O modelo de Rutherford foi uma explicação muito bem-sucedida dos experimentos que ele conduziu, embora eventualmente os cientistas descobrissem que até mesmo o próprio núcleo tem estrutura.
O Núcleo Atômico
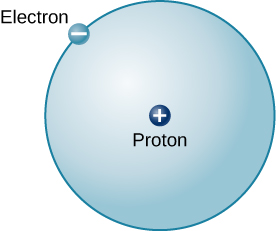
O átomo mais simples possível (e o mais comum no Sol e nas estrelas) é o hidrogênio. O núcleo do hidrogênio comum contém um único próton. Movendo-se em torno desse próton há um único elétron. A massa de um elétron é quase 2000 vezes menor que a massa de um próton; o elétron carrega uma quantidade de carga exatamente igual à do próton, mas em sinal oposto (Figura\(\PageIndex{2}\)). Cargas opostas se atraem, então é uma força eletromagnética que mantém o próton e o elétron juntos, assim como a gravidade é a força que mantém os planetas em órbita ao redor do Sol.
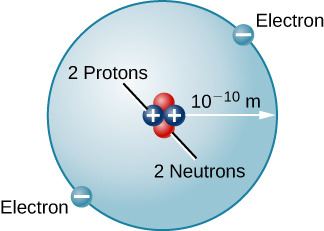
Existem muitos outros tipos de átomos na natureza. O hélio, por exemplo, é o segundo elemento mais abundante no Sol. O hélio tem dois prótons em seu núcleo em vez do único próton que caracteriza o hidrogênio. Além disso, o núcleo de hélio contém dois nêutrons, partículas com massa comparável à do próton, mas sem carga elétrica. Movendo-se em torno desse núcleo estão dois elétrons, então a carga líquida total do átomo de hélio também é zero (Figura\(\PageIndex{3}\)).
A partir dessa descrição de hidrogênio e hélio, talvez você tenha adivinhado o padrão para construir todos os elementos (diferentes tipos de átomos) que encontramos no universo. O tipo de elemento é determinado pelo número de prótons no núcleo do átomo. Por exemplo, qualquer átomo com seis prótons é o elemento carbono, com oito prótons é oxigênio, com 26 é ferro e com 92 é urânio. Na Terra, um átomo típico tem o mesmo número de elétrons que os prótons, e esses elétrons seguem padrões orbitais complexos ao redor do núcleo. No fundo das estrelas, no entanto, é tão quente que os elétrons se soltam do núcleo e (como veremos) levam vidas separadas, mas produtivas.
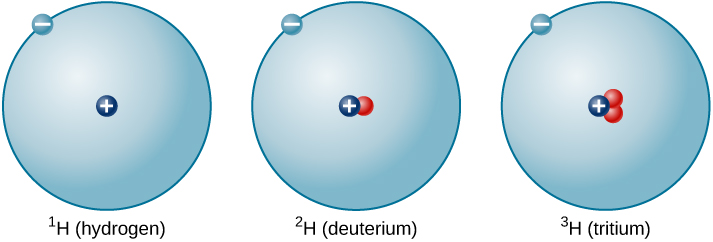
A proporção de nêutrons para prótons aumenta à medida que o número de prótons aumenta, mas cada elemento é único. O número de nêutrons não é necessariamente o mesmo para todos os átomos de um determinado elemento. Por exemplo, a maioria dos átomos de hidrogênio não contém nêutrons. Existem, no entanto, átomos de hidrogênio que contêm um próton e um nêutron, e outros que contêm um próton e dois nêutrons. Os vários tipos de núcleos de hidrogênio com diferentes números de nêutrons são chamados de isótopos de hidrogênio (Figura\(\PageIndex{4}\)), e todos os outros elementos também têm isótopos. Você pode pensar nos isótopos como irmãos no mesmo elemento “família” — intimamente relacionados, mas com características e comportamentos diferentes.
Para explorar a estrutura dos átomos, acesse o site PhET Build an Atom, onde você pode adicionar prótons, nêutrons ou elétrons a um modelo e o nome do elemento que você criou aparecerá. Você também pode ver a carga líquida, o número de massa, se é estável ou instável e se é um íon ou um átomo neutro.
O átomo de Bohr
O modelo de Rutherford para átomos tem um problema sério. A teoria da radiação eletromagnética de Maxwell diz que quando os elétrons mudam a velocidade ou a direção do movimento, eles devem emitir energia. Os elétrons em órbita mudam constantemente sua direção de movimento, então eles devem emitir um fluxo constante de energia. Aplicando a teoria de Maxwell ao modelo de Rutherford, todos os elétrons devem entrar em espiral no núcleo do átomo à medida que perdem energia, e esse colapso deve acontecer muito rapidamente, em cerca de 10 a 16 segundos.
Foi o físico dinamarquês Niels Bohr (1885-1962) que resolveu o mistério de como os elétrons permanecem em órbita. Ele estava tentando desenvolver um modelo do átomo que também explicasse certas regularidades observadas no espectro do hidrogênio. Ele sugeriu que o espectro do hidrogênio pode ser entendido se assumirmos que órbitas de apenas certos tamanhos são possíveis para o elétron. Bohr ainda assumiu que, enquanto o elétron se mover em apenas uma dessas órbitas permitidas, ele não irradia energia: sua energia mudaria somente se ele se movesse de uma órbita para outra.
Essa sugestão, nas palavras do historiador da ciência Abraham Pais, foi “uma das hipóteses mais audaciosas já introduzidas na física”. Se algo equivalente estivesse em ação no mundo cotidiano, você poderia descobrir que, ao caminhar depois da aula de astronomia, a natureza permitia que você caminhasse dois passos por minuto, cinco passos por minuto e 12 passos por minuto, mas sem velocidades intermediárias. Não importa como você tentasse mover as pernas, somente certas velocidades de caminhada seriam permitidas. Para tornar as coisas mais bizarras, não seria necessário nenhum esforço para andar em qualquer uma das velocidades permitidas, mas seria difícil mudar de uma velocidade para outra. Felizmente, essas regras não se aplicam ao nível do comportamento humano. Mas no nível microscópico do átomo, experimento após experimento confirmou a validade da estranha ideia de Bohr. As sugestões de Bohr se tornaram uma das bases do novo (e muito mais sofisticado) modelo do mundo subatômico chamado mecânica quântica.
No modelo de Bohr, se o elétron se move de uma órbita para outra mais perto do núcleo atômico, ele deve liberar alguma energia na forma de radiação eletromagnética. Se o elétron passar de uma órbita interna para outra mais distante do núcleo, no entanto, ele requer alguma energia adicional. Uma forma de obter a energia necessária é absorver a radiação eletromagnética que pode estar passando pelo átomo de uma fonte externa.
Uma característica fundamental do modelo de Bohr é que cada uma das órbitas eletrônicas permitidas em torno de um determinado átomo tem um certo valor de energia; portanto, podemos pensar em cada órbita como um nível de energia. Mover-se de uma órbita para outra (que terá seu próprio valor específico de energia) requer uma mudança na energia do elétron — uma mudança determinada pela diferença entre os dois valores de energia. Se o elétron for para um nível mais baixo, a diferença de energia será emitida; se o elétron for para um nível mais alto, a diferença de energia deve ser obtida de outro lugar. Cada salto (ou transição) para um nível diferente tem uma mudança de energia fixa e definida associada a ele.
Uma analogia grosseira para essa situação pode ser a vida em uma torre de apartamentos de luxo, onde o aluguel é determinado pela qualidade da vista. Esse edifício tem certos níveis ou andares numerados e definidos nos quais os apartamentos estão localizados. Ninguém pode morar no andar 5.37 ou 22.5. Além disso, o aluguel aumenta à medida que você sobe para andares mais altos. Se você quiser trocar um apartamento no vigésimo andar por um no segundo andar, não deverá tanto aluguel. No entanto, se você quiser passar do terceiro andar para o vigésimo quinto andar, seu aluguel aumentará. Em um átomo, também, o lugar “mais barato” para um elétron viver é o nível mais baixo possível, e a energia é necessária para se mover para um nível mais alto.
Aqui temos uma das situações em que é mais fácil pensar na radiação eletromagnética como partículas (fótons) do que como ondas. À medida que os elétrons se movem de um nível para outro, eles emitem ou absorvem pequenos pacotes de energia. Quando um elétron se move para um nível mais alto, ele absorve um fóton com a energia certa (desde que haja um disponível). Quando ele se move para um nível mais baixo, ele emite um fóton com a quantidade exata de energia de que não precisa mais em sua “situação de vida de menor custo”.
As perspectivas de fótons e ondas devem ser equivalentes: luz é luz, não importa como olhamos para ela. Assim, cada fóton carrega uma certa quantidade de energia que é proporcional à frequência (\(f\)) da onda que ele representa. O valor de sua energia (\(E\)) é dado pela fórmula
\[E=hf \nonumber\]
onde a constante de proporcionalidade,\(h\), é chamada de constante de Planck.
A constante tem o nome de Max Planck, o físico alemão que foi um dos criadores da teoria quântica (Figura\(\PageIndex{5}\)). Se unidades métricas forem usadas (ou seja, se a energia for medida em joules e a frequência em hertz), a constante de Planck terá o valor de\(h = 6.626 \times 10^{–34}\) joule-segundos (J-s). Fótons de energia mais alta correspondem a ondas de frequência mais alta (que têm um comprimento de onda menor); fótons de baixa energia são ondas de menor frequência.

Para dar um exemplo específico, considere um átomo de cálcio dentro da atmosfera do Sol, no qual um elétron salta de um nível mais baixo para um nível mais alto. Para fazer isso, ele precisa de cerca de 5 × 10 —19 joules de energia, que ele pode obter convenientemente absorvendo um fóton passageiro dessa energia vindo das profundezas do Sol. Esse fóton é equivalente a uma onda de luz cuja frequência é de cerca de 7,5 × 10 14 hertz e cujo comprimento de onda é de cerca de 3,9 × 10 —7 metros (393 nanômetros), na parte violeta profunda do espectro de luz visível. Embora possa parecer estranho no início deixar de imaginar a luz como um fóton (ou pacote de energia) para imaginá-la como uma onda, essa mudança se tornou uma segunda natureza para os astrônomos e pode ser uma ferramenta útil para fazer cálculos sobre espectros.
Exemplo\(\PageIndex{1}\): A energia de um fóton
Agora que sabemos como calcular o comprimento de onda e a frequência de um fóton, podemos usar essas informações, junto com a constante de Planck, para determinar a quantidade de energia que cada fóton carrega. Quanta energia tem um fóton vermelho de comprimento de onda de 630 nm?
Solução
Primeiro, como aprendemos anteriormente, podemos encontrar a frequência do fóton:
\[f= \frac{c}{ \lambda} = \frac{3 \times 10^8 \text{ m/s}}{630 \times 10^{–9} \text{ m}} = 4.8 \times 10^{14} \text{ Hz} \nonumber\]
Em seguida, podemos usar a constante de Planck para determinar a energia (lembre-se de que um Hz é o mesmo que 1/s):
\[E=hf= \left( 6.626 \times 10^{–34} \text{ J-s} \right) \left( 4.8 \times 10^{14} (1/\text{s}) \right)=3.2 \times 10^{–19} \text{ J} \nonumber\]
Exercício\(\PageIndex{1}\)
Qual é a energia de um fóton amarelo com uma frequência de 5,5 × 10 14 Hz?
- Resposta
-
\[E=hf= \left(6.626 \times10^{–34} \right) \left(5.5 \times 10^{14} \right) = 3.6 \times 10^{–19} \text{ J} \nonumber\]
Conceitos principais e resumo
Os átomos consistem em um núcleo contendo um ou mais prótons carregados positivamente. Todos os átomos, exceto o hidrogênio, também podem conter um ou mais nêutrons no núcleo. Eletrões carregados negativamente orbitam o núcleo. O número de prótons define um elemento (o hidrogênio tem um próton, o hélio tem dois e assim por diante) do átomo. Núcleos com o mesmo número de prótons, mas números diferentes de nêutrons, são isótopos diferentes do mesmo elemento. No modelo de Bohr do átomo, os elétrons em órbitas permitidas (ou níveis de energia) não emitem nenhuma radiação eletromagnética. Mas quando os elétrons vão dos níveis mais baixos para os mais altos, eles devem absorver um fóton com a energia certa e, quando vão dos níveis mais altos para os mais baixos, emitem um fóton com a energia certa. A energia de um fóton está conectada à frequência da onda eletromagnética que ele representa pela fórmula de Planck,\(E=hf\).
Glossário
- nível de energia
- um determinado nível, ou quantidade, de energia possuída por um átomo ou íon acima da energia que ele possui em seu estado menos energético; também usado para se referir aos estados de energia que um elétron pode ter em um átomo
- isótopo
- qualquer uma das duas ou mais formas do mesmo elemento cujos átomos têm o mesmo número de prótons, mas diferentes números de nêutrons
- núcleo (de um átomo)
- a grande parte de um átomo, composta principalmente por prótons e nêutrons, e sobre a qual os elétrons giram


