14.2: Fluidos, densidade e pressão (Parte 1)
- Page ID
- 185621
- Declare as diferentes fases da matéria
- Descreva as características das fases da matéria no nível molecular ou atômico
- Faça a distinção entre materiais compressíveis e incompressíveis
- Defina a densidade e suas unidades SI relacionadas
- Compare e contraste as densidades de várias substâncias
- Defina a pressão e suas unidades SI relacionadas
- Explicar a relação entre pressão e força
- Calcule a força dada, pressão e área
A matéria geralmente existe como um sólido, líquido ou gás; esses estados são conhecidos como as três fases comuns da matéria. Examinaremos cada uma dessas fases em detalhes nesta seção.
Características dos sólidos
Os sólidos são rígidos e têm formas específicas e volumes definidos. Os átomos ou moléculas em um sólido estão próximos uns dos outros e há uma força significativa entre essas moléculas. Os sólidos assumirão uma forma determinada pela natureza dessas forças entre as moléculas. Embora os sólidos verdadeiros não sejam incompressíveis, no entanto, é necessária uma grande força para mudar a forma de um sólido. Em alguns casos, a força entre as moléculas pode fazer com que as moléculas se organizem em uma rede, conforme mostrado na Figura\(\PageIndex{1}\). A estrutura dessa rede tridimensional é representada como moléculas conectadas por ligações rígidas (modeladas como molas rígidas), que permitem liberdade limitada de movimento. Mesmo uma grande força produz apenas pequenos deslocamentos nos átomos ou moléculas da rede, e o sólido mantém sua forma. Os sólidos também resistem às forças de cisalhamento. (As forças de cisalhamento são forças aplicadas tangencialmente a uma superfície, conforme descrito em Equilíbrio estático e elasticidade.)
Características dos fluidos
Líquidos e gases são considerados fluidos porque cedem às forças de cisalhamento, enquanto os sólidos resistem a elas. Como os sólidos, as moléculas em um líquido estão ligadas às moléculas vizinhas, mas possuem muito menos dessas ligações. As moléculas em um líquido não estão presas no lugar e podem se mover uma em relação à outra. A distância entre as moléculas é semelhante às distâncias em um sólido e, portanto, os líquidos têm volumes definidos, mas a forma de um líquido muda, dependendo da forma de seu recipiente. Os gases não estão ligados aos átomos vizinhos e podem ter grandes separações entre as moléculas. Os gases não têm formas específicas nem volumes definidos, pois suas moléculas se movem para encher o recipiente em que são mantidos (Figura\(\PageIndex{1}\)).
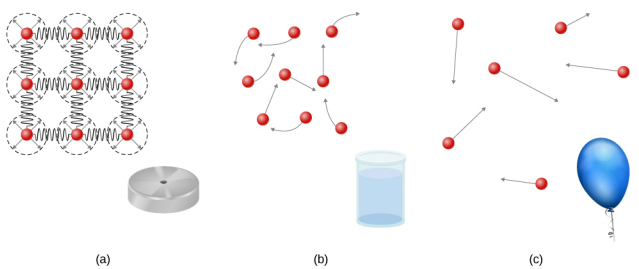
Os líquidos se deformam facilmente quando estressados e não voltam à sua forma original depois que a força é removida. Isso ocorre porque os átomos ou moléculas em um líquido podem deslizar livremente e mudar de vizinhança. Ou seja, os líquidos fluem (então são um tipo de fluido), com as moléculas mantidas unidas por atração mútua. Quando um líquido é colocado em um recipiente sem tampa, ele permanece no recipiente. Como os átomos estão bem compactados, líquidos, como sólidos, resistem à compressão; uma força extremamente grande é necessária para alterar o volume de um líquido.
Em contraste, os átomos nos gases são separados por grandes distâncias e as forças entre os átomos em um gás são, portanto, muito fracas, exceto quando os átomos colidem uns com os outros. Isso torna os gases relativamente fáceis de comprimir e permite que eles fluam (o que os torna fluidos). Quando colocados em um recipiente aberto, os gases, diferentemente dos líquidos, escaparão.
Neste capítulo, geralmente nos referimos a gases e líquidos simplesmente como fluidos, fazendo uma distinção entre eles somente quando se comportam de maneira diferente. Existe outra fase da matéria, o plasma, que existe em temperaturas muito altas. Em altas temperaturas, as moléculas podem se desassociar em átomos e os átomos se desassociam em elétrons (com cargas negativas) e prótons (com cargas positivas), formando um plasma. O plasma não será discutido em profundidade neste capítulo porque o plasma tem propriedades muito diferentes das outras três fases comuns da matéria, discutidas neste capítulo, devido às fortes forças elétricas entre as cargas.
Densidade
Suponha que um bloco de latão e um bloco de madeira tenham exatamente a mesma massa. Se os dois blocos caírem em um tanque de água, por que a madeira flutua e a pia de latão (Figura\(\PageIndex{2}\))? Isso ocorre porque o latão tem uma densidade maior que a água, enquanto a madeira tem uma densidade menor que a água.

A densidade é uma característica importante das substâncias. É crucial, por exemplo, para determinar se um objeto afunda ou flutua em um fluido.
A densidade média de uma substância ou objeto é definida como sua massa por unidade de volume,
\[\rho = \frac{m}{V} \label{14.1}\]
onde a letra grega\(\rho\) (rho) é o símbolo da densidade, m é a massa e V é o volume.
A unidade de densidade SI é kg/m 3. A Tabela 14.1 lista alguns valores representativos. A unidade de densidade cgs é o grama por centímetro cúbico, g/cm 3, onde
\[1\; g/cm^{3} = 1000\; kg/m^{3} \ldotp\]
O sistema métrico foi originalmente concebido para que a água tivesse uma densidade de 1 g/cm 3, equivalente a 103 kg/m 3. Assim, a unidade básica de massa, o quilograma, foi inicialmente concebida para ser a massa de 1000 mL de água, que tem um volume de 1000 cm 3.
Tabela 14.1 - Densidades de algumas substâncias comuns
| Sólidos | (0,0° C) | Líquidos | (0,0° C) | Gases | (0,0 °C, 101,3 kPa) |
|---|---|---|---|---|---|
| Substância | \(\rho\)(kg/m 3) | Substância | \(\rho\)(kg/m 3) | Substância | \(\rho\)(kg/m 3) |
| Alumínio | 2,70 x 10 3 | Benzeno | 8,79 x 10 2 | Ar | 1,29 x 10 0 |
| Osso | 1,90 x 10 3 | Sangue | 1,05 x 10 3 | Dióxido de carbono | 1,98 x 10 0 |
| Latão | 8,44 x 10 3 | Álcool etílico | 8,06 x 10 2 | Monóxido de carbono | 1,25 x 10 0 |
| Betão | 2,40 x 10 3 | Gasolina | 6,80 x 10 2 | Hélio | 1,80 x 10 -1 |
| Cobre | 8,92 x 10 3 | Glicerina | 1,26 x 10 3 | Hidrogênio | 9,00 x 10 -2 |
| Cortiça | 2,40 x 10 2 | Mercúrio | 1,36 x 10 4 | Metano | 7,20 x 10 -2 |
| Crosta terrestre | 3,30 x 10 3 | Azeite | 9,20 x 10 2 | Azoto | 1,25 x 10 0 |
| Vidro | 2,60 x 10 3 | Óxido nitroso | 1,98 x 10 0 | ||
| Granito | 2,70 x 10 3 | Oxigênio | 1,43 x 10 0 | ||
| Ferro | 7,86 x 10 3 | ||||
| Liderar | 1,13 x 10 4 | ||||
| Carvalho | 7,10 x 10 2 | ||||
| Pinheiro | 3,73 x 10 2 | ||||
| Platina | 2,14 x 10 4 | ||||
| Poliestireno | 1,00 x 10 2 | ||||
| Tungstênio | 1,93 x 10 4 | ||||
| Urânio | 1,87 x 10 3 |
Como você pode ver ao examinar a Tabela 14.1, a densidade de um objeto pode ajudar a identificar sua composição. A densidade do ouro, por exemplo, é cerca de 2,5 vezes a densidade do ferro, que é cerca de 2,5 vezes a densidade do alumínio. A densidade também revela algo sobre a fase da matéria e sua subestrutura. Observe que as densidades de líquidos e sólidos são aproximadamente comparáveis, consistentes com o fato de que seus átomos estão em contato próximo. As densidades dos gases são muito menores do que as dos líquidos e sólidos, porque os átomos dos gases são separados por grandes quantidades de espaço vazio. Os gases são exibidos para uma temperatura padrão de 0,0° C e uma pressão padrão de 101,3 kPa, e há uma forte dependência das densidades da temperatura e da pressão. As densidades dos sólidos e líquidos exibidos são fornecidas para a temperatura padrão de 0,0 °C e as densidades dos sólidos e líquidos dependem da temperatura. A densidade de sólidos e líquidos normalmente aumenta com a diminuição da temperatura.
A Tabela 14.2 mostra a densidade da água em várias fases e temperaturas. A densidade da água aumenta com a diminuição da temperatura, atingindo um máximo a 4,0 °C, e depois diminui à medida que a temperatura cai abaixo de 4,0 °C. Esse comportamento da densidade da água explica por que o gelo se forma no topo de um corpo de água.
Tabela 14.2 - Densidades da água
| Substância | \(\rho\)(kg/m 3) |
|---|---|
| Gelo (0 °C) | \ (\ rho\) (kg/m3)” style="text-align:center;” class="lt-phys-4055">9,17 x 10 2 |
| Água (0 °C) | \ (\ rho\) (kg/m3)” style="text-align:center;” class="lt-phys-4055">9,998 x 10 2 |
| Água (4 °C) | \ (\ rho\) (kg/m3)” style="text-align:center;” class="lt-phys-4055">1.000 x 10 3 |
| Água (20 °C) | \ (\ rho\) (kg/m3)” style="text-align:center;” class="lt-phys-4055">9,982 x 10 2 |
| Água (100 °C) | \ (\ rho\) (kg/m3)” style="text-align:center;” class="lt-phys-4055">9,584 x 10 2 |
| Vapor (100 °C, 101,3 kPa) | \ (\ rho\) (kg/m3)” style="text-align:center;” class="lt-phys-4055">1,670 x 10 2 |
| Água do mar (0°C) | \ (\ rho\) (kg/m3)” style="text-align:center;” class="lt-phys-4055">1.030 x 10 3 |
A densidade de uma substância não é necessariamente constante em todo o volume de uma substância. Se a densidade for constante em toda a substância, diz-se que a substância é uma substância homogênea. Uma barra de ferro sólido é um exemplo de substância homogênea. A densidade é constante por toda parte e a densidade de qualquer amostra da substância é a mesma que sua densidade média. Se a densidade de uma substância não fosse constante, diz-se que a substância é uma substância heterogênea. Um pedaço de queijo suíço é um exemplo de material heterogêneo que contém tanto o queijo sólido quanto os vazios cheios de gás. A densidade em um local específico dentro de um material heterogêneo é chamada de densidade local e é dada em função da localização,\(\rho\) =\(\rho\) (x, y, z) (Figura\(\PageIndex{3}\)).
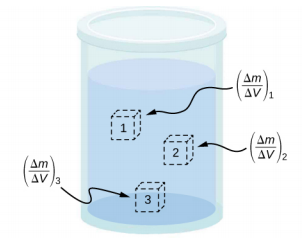
A densidade local pode ser obtida por um processo limitador, baseado na densidade média de um pequeno volume ao redor do ponto em questão, considerando o limite em que o tamanho do volume se aproxima de zero,
\[\rho = \lim_{\Delta V \rightarrow 0} \frac{\Delta m}{\Delta V} \label{14.2}\]
onde\(\rho\) está a densidade, m é a massa e V é o volume.
Como os gases são livres para se expandir e contrair, as densidades dos gases variam consideravelmente com a temperatura, enquanto as densidades dos líquidos variam pouco com a temperatura. Portanto, as densidades dos líquidos são frequentemente tratadas como constantes, com a densidade igual à densidade média.
A densidade é uma propriedade dimensional; portanto, ao comparar as densidades de duas substâncias, as unidades devem ser levadas em consideração. Por esse motivo, uma quantidade adimensional mais conveniente chamada gravidade específica é frequentemente usada para comparar densidades. A gravidade específica é definida como a razão entre a densidade do material e a densidade da água a 4,0 °C e uma atmosfera de pressão, que é de 1000 kg/m 3:
\[Specific\; gravity = \frac{Density\; of\; material}{Density\; of\; water} \ldotp\]
A comparação usa água porque a densidade da água é de 1 g/cm 3, que foi originalmente usada para definir o quilograma. A gravidade específica, sendo adimensional, fornece uma comparação rápida entre os materiais sem ter que se preocupar com a unidade de densidade. Por exemplo, a densidade do alumínio é 2,7 em g/cm 3 (2700 em kg/m 3), mas sua gravidade específica é 2,7, independentemente da unidade de densidade. A gravidade específica é uma quantidade particularmente útil em relação à flutuabilidade, que discutiremos mais adiante neste capítulo.
Pressão
Sem dúvida, você já ouviu a palavra “pressão” usada em relação ao sangue (pressão alta ou baixa) e em relação ao clima (sistemas climáticos de alta e baixa pressão). Esses são apenas dois dos muitos exemplos de pressão em fluidos. (Lembre-se de que introduzimos a ideia de pressão em equilíbrio estático e elasticidade, no contexto de tensão e deformação em massa.)
A pressão (p) é definida como a força normal F por unidade de área A sobre a qual a força é aplicada, ou
\[p = \frac{F}{A} \ldotp \label{14.3}\]
Para definir a pressão em um ponto específico, a pressão é definida como a força dF exercida por um fluido sobre um elemento infinitesimal da área dA contendo o ponto, resultando em p =\(\frac{dF}{dA}\).
Uma determinada força pode ter um efeito significativamente diferente, dependendo da área sobre a qual a força é exercida. Por exemplo, uma força aplicada a uma área de 1 mm 2 tem uma pressão 100 vezes maior que a mesma força aplicada a uma área de 1 cm 2. É por isso que uma agulha afiada é capaz de perfurar a pele quando uma pequena força é exercida, mas aplicar a mesma força com um dedo não perfura a pele (Figura\(\PageIndex{4}\)).
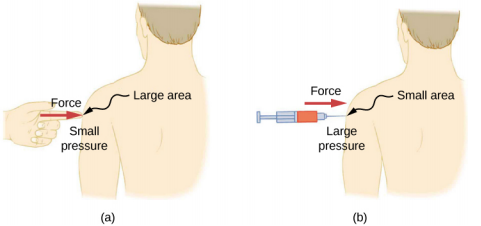
Observe que, embora a força seja um vetor, a pressão é um escalar. A pressão é uma grandeza escalar porque é definida como proporcional à magnitude da força atuando perpendicularmente à área da superfície. A unidade SI para pressão é o pascal (Pa), em homenagem ao matemático e físico francês Blaise Pascal (1623—1662), onde
\[1\; Pa = 1\; N/m^{2} \ldotp\]
Várias outras unidades são usadas para pressão, que discutiremos mais adiante no capítulo.


